京尼平苷酸对大鼠缺血性脑损伤神经保护作用*
黄嘉驹,严 莉,欧阳昌汉**
(1.湖北科技学院药学院,湖北 咸宁 437100;2.武汉市中心医院药学部)
京尼平苷酸对大鼠缺血性脑损伤神经保护作用*
黄嘉驹1,2,严 莉1,欧阳昌汉1**
(1.湖北科技学院药学院,湖北 咸宁 437100;2.武汉市中心医院药学部)
目的 观察口服京尼平苷酸对缺血性脑损伤大鼠的保护作用。方法 SD大鼠随机分成四组,假手术组、脑缺血模型组、京尼平苷酸组和安理申对照组,每组10只。采用Morris水迷宫实验评价大鼠学习记忆能力;HE染色观察大鼠海马CA1区、皮质内锥体层、扣带回皮质层和皮质外颗粒层的神经元数量的变化。结果 水迷宫结果显示假手术组和脑缺血模型组大鼠平均逃避潜伏期分别为(31.81±9.51)s、(87.21±12.18)s;京尼平苷酸组大鼠平均逃避潜伏期为(45.48±15.04)s比脑缺血模型组明显缩短(P<0.01)。HE染色结果脑缺血模型组相对于假手术组各脑区神经元总数显著降低,变性神经元数和变性率显著增加(P<0.01)。京尼平苷酸组与脑缺血模型组相比较,CA1区、扣带回区、外颗粒层及内锥体层4个脑区的神经元总数均显著增加,变性神经元数及变性率均显著降低(P<0.01)。京尼平苷酸组与安理申对照组比较,除在CA1区神经元总数方面前者高于后者(P<0.01)以外,其余各脑区指标的差异均无差异(P>0.05)。结论 京尼平苷酸可以改善大鼠缺血性脑损伤,能减少缺血性脑损伤大鼠大脑皮质和海马神经元的缺血性坏死。
京尼平苷酸;慢性脑缺血;大脑皮质;神经保护
缺血性脑损伤极大地危害人们的身心健康。近年来,对急性脑缺血损伤机制和预防治疗的研究不断增多,而对慢性脑缺血的研究相对较少。由于原发疾病导致的慢性脑缺血,早期并不表现出明显的脑损伤症状,没有引起人们对慢性脑缺血足够的重视,也没有采取相应的预防措施和很好的治疗手段。随着经济社会的发展和医疗卫生条件的改善,人口老龄化现象越来越严重,慢性脑缺血问题逐渐引起大家的广泛关注。近年研究发现,常用中药栀子主要有效成分环烯醚萜苷类具有多重药理功能,具备良好的临床应用前景,受到广泛关注[1]。京尼平苷酸也称栀子苷酸,是栀子果实的主要药效成份之一。本文通过建立慢性脑缺血实验动物模型,考察京尼平苷酸对脑缺血性损伤的神经保护作用,为临床药物开发提供依据。
1 材料与方法
1.1 动物与分组 取60只健康SPF级、雄性、体重(240±20)g的SD(Sprague-Dawley)大鼠[由武汉大学实验动物中心提供,动物质量合格证号:SCXK(鄂),2008-0004]。实验动物自由饮水、进食,正常昼夜节律,室温控制在25℃。在实验前通过Morris水迷宫实验,对动物进行筛选。挑选逃避潜伏期大约在120s范围内大鼠为实验对象,弃用有视力障碍、灵活性太差或逃避潜伏期过低(<40s)的大鼠。随机数字表法将实验动物共分成四组:假手术组、慢性脑缺血模型组、京尼平苷酸组、安理申对照组。除假手术组外,其它各组大鼠均采用双侧颈总动脉(CCA)永久性结扎法(2-VO法)造模。假手术组大鼠只分离双侧颈总动脉,但不结扎剪断动脉。剔除因手术意外死亡的大鼠后,每实验组各10只大鼠。
1.2 实验材料 京尼平苷酸(含量96.2%,批号:syz090911,四川双子叶生物科技有限公司);肝素钠(Solarbio 试剂公司);盐酸多奈哌齐[卫材(中国)药业有限公司,批号:091028A];显微照相仪(OLYMOUS,BX-41);Morris水迷宫(湖北科技学院医药研究院平台提供);Morris图象采集分析器(中国医科院药物研究所);Motic Image Advanced 3.2图像软件(德国麦克奥迪公司)。
1.3 慢性脑缺血模型制作 根据文献[2-3]采用双侧颈总动脉(CCA)永久性结扎制作慢性脑缺血损伤模型(2-VO模型)。大鼠术前禁食12h、禁水4h。用10%水合氯醛腹腔注射麻醉(350mg/kg)。待麻醉充分后,取仰卧位固定,颈前部稍微剪除毛发、常规消毒后,沿颈前部正中切开、分离肌肉,钝性分离出双侧CCA(注意避免损伤与之伴行的迷走神经),在近颈总动脉末端处套上两根0号丝线,间隔5mm左右,分别结扎双侧CCA后,从中间剪断CCA,要确保已阻断动脉血流,然后逐层缝合切口,消毒,待醒。假手术组除了不结扎剪断CCA外,其它步骤同上。术后肌注青霉素0.2万U/d,连续3d。
1.4 给药方式 假手术组和脑缺血模型组灌胃等体积生理盐水;京尼平苷酸组给药剂量50mg/(kg·d);安理申(盐酸多奈派齐)对照组给药剂量1.75 mg/(kg·d)。手术过程中若出现死亡则补足数量。大鼠用药剂量和人用药剂量换算按体表面积计算,每组1次/d,连续给药28d。
1.5 Morris水迷宫学习记忆行为测试
1.5.1 Morris水迷宫构造[4]Morris水迷宫由圆形水池和全自动摄像记录系统两部分组成。不锈钢水池直径150cm、池深60cm,实验时水深约40cm,池壁和池底用涂料涂成全黑色。水池分为四个象限,在其中一象限中放一平台,平台涂成黑色,平台低于水面约1.5cm,动物可爬上平台站立休息。每次实验时将大鼠面向池壁放入水池中,依次从4个象限中挑选一个作为入水点,通过摄录机记录大鼠游泳轨迹,历时6d,分别进行定位航行实验和空间探索实验,并通过Morris图象处理软件对数据进行采集、分析。
1.5.2 行为学测试过程[5]
(1)定位航行实验(Place navigation) 实验前,水池中先不安放平台,逐一将各组大鼠放入水池中,自由游泳2~4min,先熟悉水池及周边环境。实验第1~4d为训练时间,具体训练方法为:每天测试4次,上午下午各2次,每次2min。需要注意每次实验时必须在第Ⅰ、Ⅱ、Ⅲ、Ⅳ象限边缘的固定位置,分别将大鼠面向池壁放入池中,记录大鼠从入水到找到平台并爬上平台所用时间,也就是逃避潜伏期(platform locating latency,PLL)。最大逃避潜伏期为120s,如果大鼠在120s时间内还不能找到平台,可由实验助手助其登上平台,并让其在平台站立30s。实验第5d,首先选取靠平台最远象限为入水点,然后依次按序进行下一入水点进行测试。记录上下午共16个入水点的逃避潜伏期时间,并取平均值作为测试的平均逃避潜伏期值。
(2)空间探索实验(Spatial probe test) 在定位航行实验之后,撤除平台,选择离平台最远象限为入水点,摄录大鼠在水池中120 s内的游泳轨迹。由水迷宫配套的摄像软件记录120s内游泳总距离、各象限内的游泳距离及穿越平台次数,统计各组大鼠在平台象限内游泳时间/总时间(%),以此作为评价大鼠记忆能力的指标,并将各组大鼠的游泳轨迹作为评价记忆能力的参考。
1.6 脑组织形态学实验 大鼠Morris水迷宫所有实验结束后,腹腔注射10%水合氯醛(0.35mL/0.1kg)麻醉,左心室依次灌注0.9%生理盐水和4%多聚甲醛。灌注结束,迅速开颅小心取出脑组织,分离颅骨时要小心,注意保护硬脑膜不受损伤。4℃下固定过夜后,取胼胝体与穹窿交界处向下与视交叉后缘连线,自此向后切2mm,脱水,包埋,装片,行HE染色。在成像系统辅助下,每张切片随机选取10个视野,在400倍视野下记录该视野下神经元总个数和变性神经元个数,并观察神经元细胞形态,计数统计。
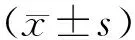
2 结 果
2.1 定位航行实验结果 定位航行测试结果显示,与假手术组相比较,脑缺血模型组大鼠学习成绩(平均逃避潜伏期)较差(P<0.01),提示双侧颈总动脉结扎缺血4周可导致大鼠学习能力的下降,说明永久性结扎大鼠双侧颈总动脉法制备慢性低灌注脑缺血损伤实验动物模型的方法建立成功。安理申对照组、京尼平苷酸组大鼠的学习能力均优于模型组,其中安理申对照组与脑缺血模型组相比较,具有显著性差异(P<0.05),而京尼平苷酸组与脑缺血模型组的差异更为显著(P<0.01),见表1。上述结果表明京尼平苷酸可以显著改善慢性低灌注脑缺血损伤大鼠的学习能力,提示京尼平苷酸对大鼠缺血性脑损伤具有神经保护作用。
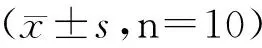
表1 各组大鼠定位航行实验结果
与脑缺血模型组比较,*P<0.05、**P<0.01
2.2 空间探索实验结果
2.2.1 空间探索实验结果 与假手术组比较,脑缺血模型组大鼠的记忆成绩(平台象限时间/总时间)较差(P<0.01),与脑缺血模型组相比,给药的两组大鼠的记忆成绩均优于脑缺血模型组(P<0.01),其中京尼平苷酸组记忆成绩更好,见表2。以上结果表明京尼平苷酸可以明显改善慢性低灌注脑缺血大鼠的记忆能力,也提示京尼平苷酸对大鼠缺血性脑损伤具有神经保护作用。
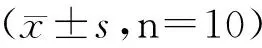
表2 各组大鼠空间探索实验结果
与脑缺血模型组比较,**P<0.01
2.2.2 空间探索实验大鼠游泳轨迹 撤除平台后各组大鼠游泳路径如图1(封二)所示,对比分析各组四个象限内大鼠游泳轨迹,假手术组游泳轨迹多在原平台所在象限内;脑缺血模型组游泳轨迹沿池壁运动较多,在所设定的四个象限滞留时间相似;京尼平苷酸组大鼠运动轨迹主要集中在原平台所在象限内,显现良好的记忆改善趋势;安理申对照组虽然在原平台象限的时间没有较明显的改善,但是沿池壁运动较少,显示出较明显的探索特性。
2.3 HE染色结果
2.3.1 各组大鼠海马和皮质区组织病理形态学变化 镜下观察可见,假手术组大鼠各脑区神经元形态正常、排列齐整规则,细胞核边缘清楚,染色均匀,核仁清晰,细胞周围间隙小或无间隙,海马锥体细胞排列较密、层次清楚,核固缩深染、空泡变性等变性细胞很少。而脑缺血模型组大鼠大脑皮质和海马神经元变性严重,变性神经元胞核边界不清、核仁肿胀或消失、核固缩浓染、空泡变性多、树突呈螺旋状变形、细胞间隙增大;海马锥体细胞水肿密度降低,呈无序排列,有少量核固缩深染细胞,细胞间隙变大。京尼平苷酸组、安理申对照组大鼠各脑区的神经元变性情况均好于脑缺血模型组,见图2(封二)。
2.3.2 各组大鼠海马和皮质区神经元统计结果(见表3~6)。
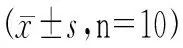
表3 各组大鼠海马CA1区神经元变性情况统计
与假手术组比较,**P<0.01;与脑缺血模型组比较,##P<0.01
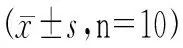
表4 各组大鼠皮质扣带回区神经元变性情况统计
与假手术组比较,**P<0.01;与脑缺血模型组比较,##P<0.01
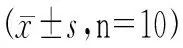
表5 各组大鼠皮质内锥体层神经元变性情况统计
与假手术组比较,**P<0.01;与脑缺血模型组比较,##P<0.01
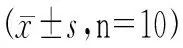
表6 各组大鼠皮质外颗粒层神经元变性情况统计
与假手术组比较,*P<0.05、**P<0.01;与脑缺血模型组比较,##P<0.01
3 讨 论
本实验用2-VO方法制作慢性脑缺血模型,阻断大鼠双侧颈总动脉血流,整个脑组织仅靠椎基底动脉供血造成脑部持续性低灌注脑缺血状态。一般认为2-VO在3周后即进入慢性脑缺血期[6]。本次Morris迷宫实验结果中,平台跨越次数反应了实验动物的学习能力情况,空间探索实验反应了实验动物学习能力情况,由结果可知,口服京尼平苷酸能够改善由慢性低灌注引起的学习记忆能力损伤。安理申是可逆性乙酰胆碱酯酶抑制剂,可用于治疗中毒阿尔兹海默病。从Morris水迷宫结果可以看到,安理申对照组平台跨越次数,比脑缺血模型组少,显示其未能改善实验大鼠的学习能力。
海马是一个卷绕折叠的皮质结构,由几个相关皮质区构成[7],依据细胞形态,不同皮质区发育差异以及各种纤维通路的不同,分成CA1、CA2、CA3、CA4四个扇形区。Naudi等[8]发现各脑区的神经元易损性按递减的排列顺序是CA1>CA3。其中CA1区与人类学习记忆关系最为密切,具有对缺血的选择易损伤性[9]。大脑皮质可分为旧皮质和新皮质,旧皮质占据整个大脑皮质的10%,新皮质占大脑皮质的90%,本文所指大脑皮质主要是指新皮质,一般由外向内均可分为六层结构即分子层、外颗粒层、外锥体细胞层、内颗粒层、内锥体细胞层、多形层。有研究表明[10],对缺血敏感性高低依次为:神经细胞、星形胶质细胞、少突胶质细胞、内皮细胞。本文前期实验结果显示大脑皮质各层中对缺血性损伤敏感的部位除了皮质外颗粒层和皮质内锥体层以外,可能还有一个很重要的部位就是扣带回皮质层。所以选择了皮质外颗粒层、皮质内锥体层以及扣带回皮质层三个部位研究探索京尼平苷酸对大鼠脑缺血损伤的保护作用机制。
结果显示,京尼平苷酸可显著降低模型大鼠海马CA1区、皮质扣带回、皮质外颗粒层、皮质内椎体层的神经元丢失情况,改善神经元变性。以上结果表明,京尼平苷酸对慢性脑缺血引起的神经损伤具有较好的神经保护作用。但是对于京尼平苷酸保护神经元的具体作用机制,有待深入研究。
[1]张君,程笑,杨欢,等.山奈酚对慢性脑缺血大鼠学习记忆能力的影响及机制探讨[J].中国药理学通报,2017,33(1):39
[2]TIAN X S,GUO X J,RUAN Z,et al.Long-term vision and non-vision dominant behavioral deficits in the 2-VO rats are accompanied by time and regional glial activation in the white matter[J].PLoS One,2014,9(6):e101120
[3]ANISIMOVA A V,KOLESNIKOVA T I,IUTSKOVA E V,et al.Neuroprotective treatment of chronic cerebrovascular insufficiency[J].Zh Nevrol Psikhiatr Im S S Korsakova,2014,114(7):30
[4]MORRIS R.Developments of a water-maze procedure for studying spatial learning in the rat[J].J Neurosci Methods,1984,11(1):47
[5]赵苗,柯婷梅,欧阳昌汉.姜黄素对阿尔茨海默病模型小鼠记忆获得和巩固障碍的影响[J].湖北科技学院学报(医学版),2016,30(5):372
[6]TANAKA K,WADA N,OGAWA N.Chronic cerebral hypoperfusion induces transient reversible monoaminergic changes in the rat brain[J].Neurochem Res,2000,25(2):313
[7]KOWALSKI J,GAN J,JONAS P,et al.Intrinsic membrane properties determine hippocampal differential firing pattern in vivo in anesthetized rats[J].Hippocampus,2016,26(5):668
[8]NAUDI A,CABRE R,Dominguez-Gonzalez M,et al.Region-specific vulnerability to lipid peroxidation and evidence of neuronal mechanisms for polyunsaturated fatty acid biosynthesis in the healthy adult human central nervous system[J].Biochim Biophys Acta,2017,1862(5):485
[9]马婧怡,张万鑫,陈虹,等.改良方法制备的血管性痴呆模型大鼠的学习记忆能力表现[J].中国药理学与毒理学杂志,2014,28(3):421
[10]MAIR G,BOYD E V,CHAPPELL F M,et al.Sensitivity and specificity of the hyperdense artery sign for arterial obstruction in acute ischemic stroke[J].Stroke,2015,46(1):102
Study of Neuroprotection of Geniposidic Acid on Ischemic Brain Injury of Rat
HUANG Jia-ju,YAN Li,OUYANG Chang-han
(SchoolofPharmacy,HubeiUniversityofScienceandTechnology,XianningHubei437100,China)
Objective To study the protective effect of oral administration of geniposidic acid on ischemic brain injury in rats. Methods A total of 40 SD rats were randomly divided into one of four groups in equal numbers (n = 10): sham operation group,cerebral ischemia model group,geniposidic acid group and Anli Shen group.Morris water maze test was used to evaluate the learning and memory ability of rats.HE staining was used to observe the changes of neuronal cells in hippocampal CA1 region,cortical pyramidal layer,cingulate cortex and extracorporeal granule layer.Results Morris water maze showed that the mean escape latency was (31.81±9.51)s in sham operation group and(87.21±12.18)s in model group.The mean escape latency of the geniposidic acid group was (45.48±15.04)s and significantly shorter than that of the model group(P<0.01).The total number of neurons in the brain of the HE staining model was significantly decreased,and the number of degenerated neurons and degeneration rate was increased significantly(P<0.01).Compared with the model group,the geniposidic acid group number of neurons in the CA1 region,the cingulate zone,the outer granular layer and the inner cone layer significantly increased,and the number of deformed neurons and degeneration rate were decreased significantly(P<0.01).There was no significant difference between the other groups(P> 0.05).Conclusion Geniposidic acid can improve ischemic brain injury in rats and reduce ischemic necrosis of cerebral cortex and hippocampal neurons in rats with ischemic brain injury.
Geniposidic acid;Chronic cerebral ischemia;Cerebral cortex;Neuroprotection
湖北省卫计委面上项目(WJ2017M248);国家级创新训练项目(201410927002)
R-332
A
2095-4646(2017)02-0093-05
10.16751/j.cnki.2095-4646.2017.02.0095
2016-12-03)
**通讯作者,E-mail:176788542@qq.com

