卡波氏肉瘤相关疱疹病毒感染神经元细胞SH-SY5Y的特点研究
曹冬冬 ,李英 ,张慧 ,谭晓华 ,杨磊 ,潘泽民 ,李冬妹 *
(1新疆地方与民族高发病教育部重点实验室/石河子大学医学院生物化学教研室,新疆 石河子 832002;2新疆维吾尔自治区人民医院临床医学研究中心,新疆 乌鲁木齐 830001;3杭州师范大学医学院,浙江 杭州 310036)
卡波氏肉瘤相关疱疹病毒(KSHV),又名人类8型疱疹病毒 (human herpesvirus 8,HHV8),是由Chang 等[1]首次在卡波氏肉瘤(Kaposi Sarcoma,KS)组织中提取发现的。KSHV属于γ-疱疹病毒,基因组全长大约140.5kb[2],是一种DNA病毒,含90个开放阅读框(open reading frame,ORF),病毒特有基因被命名为K1~K15,其它则用ORF表示[3-4]。目前报道KSHV主要感染的细胞为上皮细胞、内皮细胞、B细胞以及巨噬细胞[5-6]。
该病毒感染引起的疾病主要包括卡波氏肉瘤(Kaposi’ssarcoma,KS)、 原 发 性 渗 出 性 淋 巴 瘤(primary exudative lymphoma,PEL)与多中心 Castleman’s病(Multicenter Castleman’s Disease,MCD)[1]。KSHV 感染具有鲜明的地区与民族特点[7],在我国,新疆是高感染区,其感染所引发的经典型KS也主要见于新疆的维吾尔族与哈萨克族人[8]。
随着研究的深入,近年来发现KSHV所在的疱疹病毒家族存在嗜神经倾向[9],其感染可导致神经系统病理性改变[9-10],人类4型疱疹病毒(human herpesvirus 4,HHV4)感染伴发艾滋病(AIDS)患者会继发中枢神经系统性淋巴瘤,而在KSHV感染伴发中枢神经系统性疾病患者的脑脊髓液中检测到该病毒[11]。
AIDS患者易感KSHV,KSHV感染引发的卡波氏肉瘤是AIDS患者最常并发的肿瘤和死亡原因[1,12],且患者常出现记忆丧失、智力减退和行为改变等神经系统症状[13-14]。KSHV是否可以直接感染神经元细胞而造成其功能障碍需要进一步研究。本研究旨在研究和验证KSHV病毒是否可以直接感染神经元细胞,同时检测KSHV病毒相关基因的表达和对细胞增殖的影响。
1 材料与方法
1.1 材料
主要试剂:DMEM培养液、RPMI 1640培养液、0.25%胰酶-EDTA购自美国Gibco公司,四季清胎牛血清购自北京麦瑞博公司,青链霉素、1%triton-X-100购自 Solarbio公司,PBS购自上海生工公司,Ratanti-HHV8[LN35]抗体购自美国Abcam公司(抗LANA),山羊抗鼠IgG、DAPI购自美国生命技术公司,Trizol购自德国Qiagen公司,SuperScript III逆转录试剂盒购自Invitrogen公司。
1.2 方法
1.2.1 细胞培养
SH-SY5Y细胞采用含10%FBS和1%青链霉素的DMEM培养基培养,BCBL-1细胞、BJAB细胞为悬浮细胞,采用含10%FBS和1%青链霉素的RPMI 1640培养基培养,BC3细胞采用含20%FBS和1%青链霉素的RPMI 1640培养基培养,均常规培养在含5%CO2的37℃恒温箱中。
1.2.2 诱导提取KSHV
提取BCBL-1细胞中的KSHV,用20ng/mL TPA刺激BCBL-1细胞72 h后,收集细胞液至离心管中,800 r/min,离心10 min。用不含TPA的完全培养基培养24 h,收集细胞于离心管中,在液氮与60℃水浴锅中多次冻融细胞,促使细胞膜破裂,释放病毒于上清液中,收集病毒上清液,16000 r/min,离心1 h,获得的病毒液冻存在-80℃冰箱备用。
1.2.3 SH-SY5Y细胞感染
按照KSHV∶DMEM培养基=1∶5比例配制病毒滤液。将配置的病毒滤液加入到SH-SY5Y细胞液中,在含5%CO2的37℃恒温箱中常规培养。将KSHV感染的SH-SY5Y细胞命名为SH-KSHVBCBL1。KSHV感染细胞48 h后,显微观察细胞并拍照,以未感染的细胞做对照。
1.2.4 RT-PCR
严格按照Trizol提取RNA的方法进行操作,提取KSHV感染和未感染的SH-SY5Y细胞及BC3中提取总RNA,按照Super Script III逆转录试剂盒操作步骤将RNA进行逆转录,采用PCR技术扩增病毒裂解态的基因ORF26和潜伏态的LANA基因,BC3细胞作为阳性对照,β-actin作为内对照,ORF26、LANA以及β-actin的引物序列见表1。RT-PCR的反应条件为95 ℃,5 min;95 ℃,30 s,56 ℃,30 s,72 ℃,30 s,共计35个循环,然后72℃延伸10 min。扩增产物用1.5% 的琼脂糖凝胶电泳鉴定。
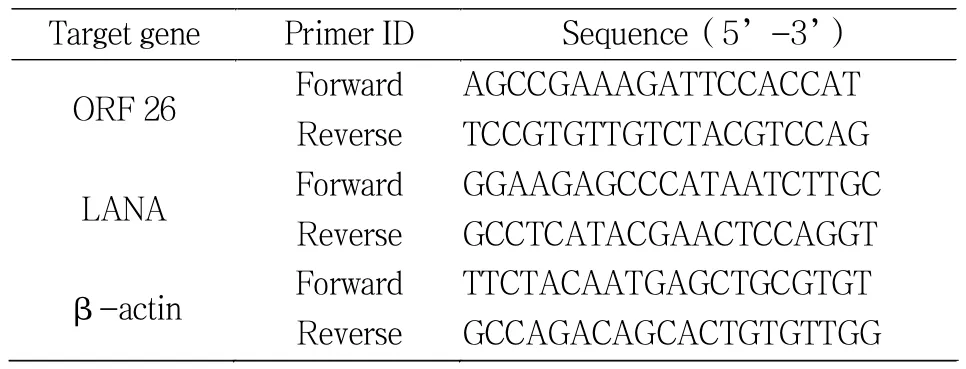
表1 引物序列Tab.1 Primer sequence
1.2.5 间接免疫荧光(IFA)检测 LANA蛋白的表达
分别取 2×104个 BC3、BJAB、SH-SY5Y 和感染KSHV后的SH-SY5Y细胞,使用4%的多聚甲醛固定细胞30 min,用1%triton-X-100破膜,接种在干净的载玻片上使其干燥。一抗使用Rat anti-HHV8[LN35](抗LANA,1∶25)滴加在固定细胞的载玻片上,4℃孵育过夜。第二天用吸水纸吸去一抗,1×PBS清洗细胞3 min×5次,二抗使用山羊抗鼠IgG(Alexa Fluor 594,1∶200),DAPI(1∶400),37 ℃孵育2 h。弃去二抗,PBS清洗细胞3 min×3次,用吸水纸吸取多余的PBS,封片,在激光共聚焦显微镜下观察细胞并拍照。
1.2.6 细胞计数
消化KSHV感染与未感染的SH-SY5Y细胞,每种细胞分别同时接种于4个60 mm培养皿,每皿3×105个细胞,于接种后 1、3、5、7 d消化计数细胞,每次消化一皿细胞,去除细胞上清液,用PBS轻轻洗涤细胞,胰酶消化细胞3 min,利用台盼蓝染色,于Vi-CELL XR细胞计数仪计数并记录细胞数,本实验重复3次。
1.2.7 统计学方法
采用SPSS 17.0统计软件对增殖数据进行处理,采用配对样本的t检验,其中P<0.05为有统计学意义。
2 结果
2.1 镜下观察KSHV感染与未感染的SH-SY5Y细胞形态
感染KSHV 48 h后,采用倒置显微镜观察KSHV感染与未感染SH-SY5Y的细胞形态(200×),未感染的SH-SY5Y细胞呈梭形,表现为聚团生长,感染KSHV后,细胞变大,形态变圆,倾向于分散生长(图1)。

图1 KSHV感染SH-SY5Y细胞形态改变情况(200×)Fig.1 Morphological changes in SH-SY5Y cells infected by KSHV(200×)
2.2 KSHV感染的SH-SY5Y细胞中ORF26与LANA的mRNA表达检测
为了验证KSHV感染是否成功,同时检测KSHV裂解态基因ORF26与潜伏态基因LANA的mRNA表达水平,我们从KSHV感染的SH-SY5Y细胞中提取了总RNA,以未感染的细胞为对照,以含有KSHV病毒的BC3细胞为阳性对照,采用RT-PCR扩增ORF26和LANA。结果显示,KSHV感染后的SH-SY5Y细胞中存在裂解态的ORF26基因的表达,同时也存在潜伏态的LANA基因的表达。这也证实了KSHV可以直接感染SH-SY5Y细胞(图2)。
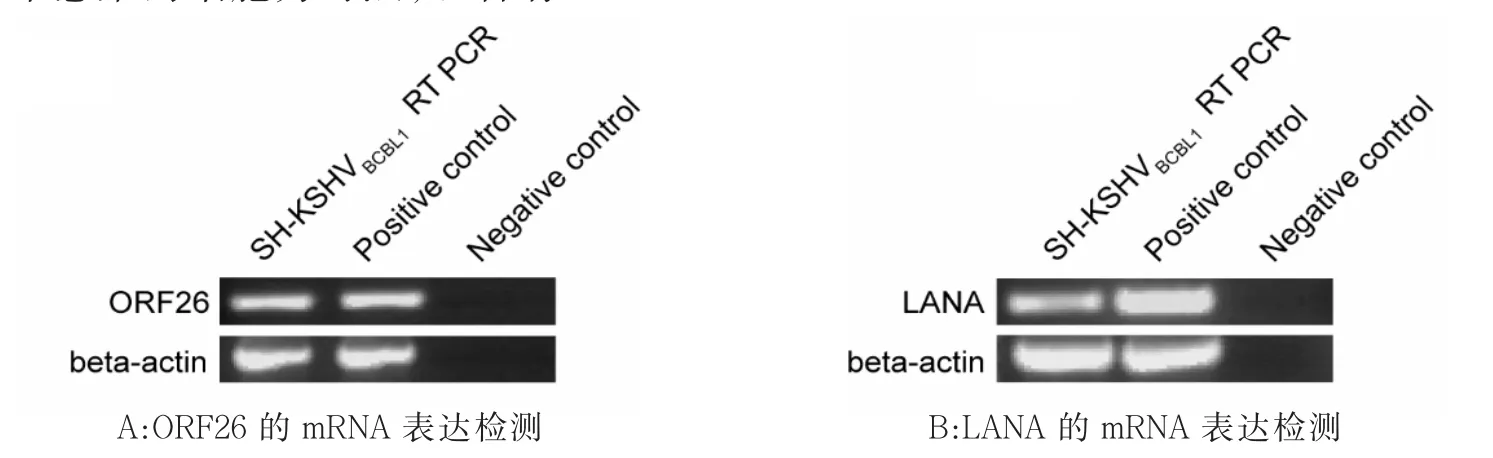
图2 RT-PCR检测ORF26和LANA mRNA的表达水平Fig.2 The expression levels of ORF26 and LANA mRNA by RT-PCR
2.3 采用IFA检测SH-KSHVBCBL1细胞中LANA蛋白的表达
为了从蛋白质水平进一步证明KSHV感染的成功以及分析LANA蛋白的表达情况,我们采用了IFA技术检测了SH-KSHVBCBL1中的LANA蛋白水平。BC3细胞自身带有KSHV,我们以BC3为阳性对照,以无KSHV的BJAB细胞为阴性对照,同时检测LANA蛋白的表达,以不加LANA一抗而只加二抗的细胞排除因二抗造成的阳性信号。采用激光共聚焦显微镜在各细胞中检测 Alexa fluor 594,红色为阳性信号。结果显示BC3细胞可见明显的LANA基因表达,BJAB细胞未出现LANA基因的表达(图3A)。SH-KSHVBCBL1细胞中有LANA基因的表达,未感染KSHV的SH-SY5Y细胞无LANA基因的表达,只加二抗的细胞均未见阳性信号,这些结果证实了KSHV可以感染SH-SY5Y细胞,并可表达LANA蛋白(图 3B)。
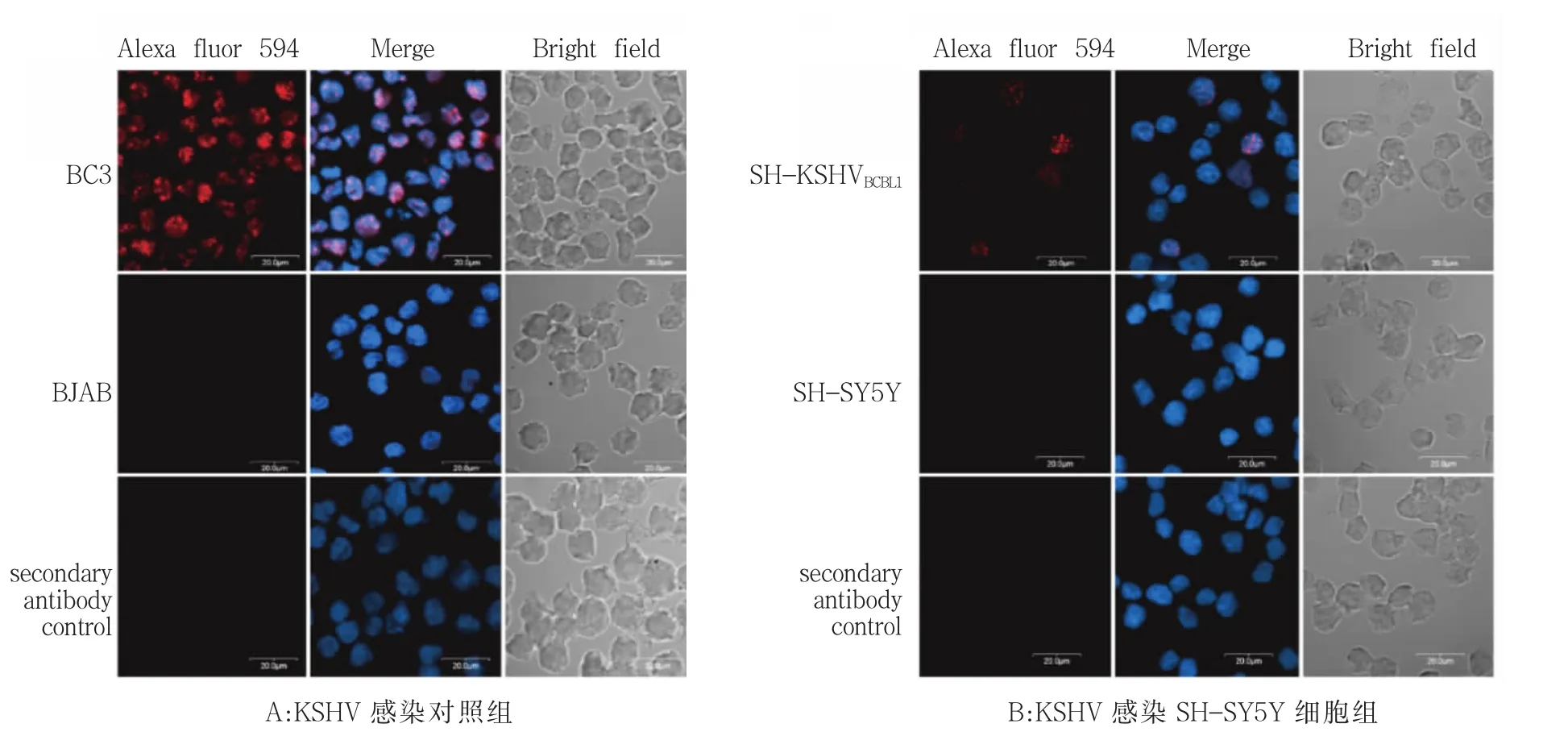
图3 IFA检测LANA蛋白的表达水平Fig.3 IFA detected the level of LANA protein expression
2.4 KSHV感染对SH-SY5Y细胞增殖能力的影响
接种相同的SH-SY5Y细胞数目,在感染KSHV后的1、3、5、7 d分别计数细胞,结果如图1所示。
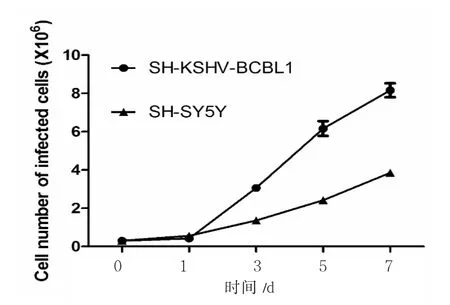
图4 感染与未感染KSHV的神经元细胞SH-SY5Y不同时间点的细胞计数Fig.4 The cell count at different time points in the infected and uninfected KSHV neuron cell SH-SY5Y
由图4可知:在培养1天后,两种细胞数目差别不大,但在培养3天后,感染KSHV的SH-SY5Y细胞数目明显高于未感染组细胞(P<0.05,差异有统计学意义),说明感染KSHV感染促进了细胞的增殖(图4)。
3 讨论
新疆是我国KSHV的高感染区[7],新疆的卡波氏肉瘤患者KSHV的感染率高达91.67%[15],正常人群的感染率为25.9%[12],大量研究表明,KSHV感染细胞后导致细胞因子合成和分泌增加,促进细胞增殖分化。血管内皮细胞增生可导致卡波氏肉瘤,B细胞增生可引发淋巴细胞瘤,上皮细胞增生发展为鳞状上皮细胞癌[16]。
KSHV感染细胞后主要以两种方式存在,即持续的潜伏感染(潜伏态)和短暂的裂解感染(裂解态)。潜伏态的病毒为了逃避宿主细胞免疫应答,保护病毒的持续存活,基因组以共价环状形式游离于细胞染色体之外,仅表达有限的蛋白;而裂解态的病毒基因组演变为线性DNA,便于病毒大量而快速的复制[17]。KSHV潜伏态与裂解态的作用不同,编码与表达不同的致病蛋白。KSHV潜伏态编码的致病蛋白主要为ORF73编码的潜伏相关核抗原(LANA);裂解态编码的致病蛋白包括 ORFK1、ORFK2编码的白介素-6(vIL-6)、ORF26编码的小衣壳蛋白、ORF74编码的病毒G蛋白偶联受体(vGPCR)和ORF16表达的疱疹病毒家族的BCL-2(vBCL-2)等。其中,ORF26、ORF75可作为 KSHV 检测的诊断依据[18]。在体内,大多数细胞都处于潜伏态,只有约1%-5%的原发性渗出性淋巴瘤细胞和5%-10%的多中心Castleman’s病细胞中KSHV会自发的进入裂解态[16,19]。而在体外,KSHV感染成功的细胞中,KSHV均保持了潜伏态感染,但在特殊的环境和生理因素下,如缺氧、炎症性细胞因子和TPA等因素的刺激下,潜伏态病毒可进入裂解复制期[20-21]。
目前发现的KSHV主要感染的细胞为B淋巴细胞和内皮细胞,随着疱疹病毒家族成员表现出的嗜神经倾向,有研究者开始关注KSHV与中枢神经系统感染的关系,Volpi A[22]利用PCR技术检测到KSHV血清阳性患者的脑组织样本中存在KSHV感染,BrinkNS等[23]在伴随有艾滋病病人的脑脊髓中扩增到KSHV的DNA。这些研究都是PCR技术,PCR技术无法区分病毒感染的是脑组织中的血管内皮细胞或免疫细胞造成PCR结果阳性,还是病毒感染的是脑细胞本身,并未直接证明KSHV对神经元细胞的感染,也未进行其感染的功能研究。
我们的研究是为了确定KSHV能够感染神经元细胞并表达病毒基因。ORF26为KSHV晚期裂解基因,基因序列相对保守,促进病毒的裂解复制并感染新的细胞,这可能与细胞增殖能力变强有关。LANA基因能够与ORF50编码KSHV分子开关的立早蛋白RTA(Replication and Transcription Activator,RTA)竞争性结合Norch信号通路的转录抑制子RBP-Jκ蛋白上的结合位点来抑制RTA的自我活化,最终使得RTA不能有效的激活裂解态基因的表达从而持续保持病毒的潜伏态,形成中枢神经系统KSHV储存池而造成神经元细胞持续感染,引发其功能障碍。
本研究利用免疫荧光检测LANA蛋白和PCR扩增ORF26与LANA结果表明KSHV成功感染了神经元细胞SH-SY5Y并表达病毒基因,这些为进一步阐明KSHV感染伴发神经系统疾病提供新的思路,也为进一步研究KSHV感染在神经系统型疾病进展中的作用提供理论依据。
参考文献;
[1] Chang Y,Cesarman E,Pessin MS,et al.Identification of herpesviruslike DNA sequences in AIDS-associated Kaposi's sarcoma[J].Science,1994,266(5192):1865-1869.
[2] Russo J J,Bohenzky R A,Chien M C,et al.Nucleotide sequ ence of the Kaposi sarcoma-associated herpesvirus(HHV8)[J].Proc Natl Acad Sci USA,1996,93(25):14862-14867.
[3] Bhatt A P,Damania B.AKTivation of PI3K/AKT/mTOR signaling pathway by KSHV[J].Fromtiers in Immunology,2012,3:401.
[4] Boshoff C,Weiss R.AIDS-related malignancies[J].Nat Rev Cancer,2002,2(5):373-382.
[5] Mesri E A,Cesarman E,Boshoff C.Kaposi's sarcoma and its associated herpesvirus[J].NatRev Cancer,2010,10(10):707-719.
[6] Dittmer D P,Damania B.Kaposi sarcoma-associated herpes virus:immunobiology,oncogenesis,and therapy[J].J Clin Invest,2016,126(9):3165-3175.
[7] Ouyang X,Zeng Y,Fu B,et al.Genotypic analysis of Kaposi's sarcoma-associated herpesvirus from patients with Kaposi's sarcoma in Xinjiang,China[J].Viruses,2014,6(12):4800-4810.
[8] Zhang D,Pu X,Wu W,et al.Genotypic analysis on the ORF-K1 gene of human herpesvirus 8 from patients with Kaposi's sarcoma in Xinjiang,China[J].J Genet Genomics,2008,35(11):657-663.
[9] Jha H C,Mehta D,Lu J,et al.Gammaherpesvirus infection of human neuronal cells[J].MBio,2015,6(6):1815-1844.
[10] Ludlow M,Kortekaas J,Herden C,et al.Neurotropic virus infections as the cause of immediate and delayed neuropathology[J].Acta Neuropathol,2016,131(2):159-184.
[11]Jha H C,Lu J,Verma S C,et al.Kaposi’s Sarcoma associated herpesvirus genome programming during the early stages of primary infection of peripheral blood mononuclear cells[J].MBio,2014,5(6):2214-2261.
[12]Wang H,Liu J,Dilimulati,et al.Seroprevalence and risk factors of Kaposi's sarcoma-associated herpesvirus infection among the general Uygur population from south and north region of Xinjiang,China[J].Virol J,2011,8:539.
[13]McIntosh R C,Rosselli M,Uddin L Q,et al.Neuropathological sequelae of humanImmunodeficiency virus and apathy:a review of neuropsychological and neuroimaging studies[J].Neuroscience and Biobehavioral Reviews,2015,55:147-164.
[14] Singer E J,Thames A D.Neurobehavioral manifestations of human immunodeficiency Virus/AIDS:Diagnosis and treatment[J].Neurologic Clinics,2016,34(1):33-53.
[15] 李冬妹,杨磊,谭晓华,等.新疆经典型 Kaposi肉瘤 29例血清 HHV-8 DNA的套式PCR检测[J].中国皮肤性病学杂志,2005,19(6):329-330.Li D M,Yang L,Tan X H,et al.Detection of HHV-8 DNA in serum of 29 Xinjiang classic Kaposi sarcoma by PCR[J].The Chinese Journal of Dermatovenereology,2005,19(6)329-330.
[16] Giffin L,Damania B.KSHV:pathways to tumorigenesis and persistent infection[J].Advances in Vinus Research,2014,88:111-159.
[17] Juillard F,Tan M,Li S,et al.Kaposi's sarcoma herpesvirus genome persistence[J].Frontiers in Microbidogy,2016,7:1149.
[18] 马春雷,普雄明.人类疱疹病毒8型ORF75亚型的研究进展[J].中国麻风皮肤病杂志,2008,24(12):976-978.Ma C L,Pu X M.Research progress of human herpesvirus 8 ORF75 subtype[J].China Journal of Leprosy and Skin Diseases,2008,24(12):976-978.
[19]Semeere A S,Busakhala N,Martin J N.Impact of antiretroviral therapy on the incidence of Kaposi'ssarcoma in resource-rich and resource-limited settings[J].Curr Opin Oncol,2012,24(5):522-530.
[20]Ye F,Gao S J.A novel role of hydrogen peroxide in Kaposi sarcoma-associatedherpesvirus reactivation[J].Cell Cycle,2011,10(19):3237-3238.
[21] Purushothaman P,Uppal T,Verma S C.Molecular biology of KSHV lytic reactivation[J].Viruses,2015,7(1):116-153.
[22]Volpi A.Epstein-Barr virus and human herpesvirus type 8 infections of the central nervoussystem[J].Herpes,2004,11(2):120-127.
[23] Brink N S,Sharvell Y,Howard M R,et al.Detection of epstein-Barr virus and Kaposi'ssarcoma-associated herpesvirus DNA in CSF from persons infected with HIV who had neurological disease[J].Journal of Neurology Neurosurgery and Psychiatry,1998,65(2):191-195.

