壳聚糖碱性氨基酸衍生物的合成及抑菌活性研究
黄 勇, 刘 松, 秦玉坤, 邢荣娥, 李克成, 于华华, 岳 洋, 李 俨, 李鹏程
壳聚糖碱性氨基酸衍生物的合成及抑菌活性研究
黄 勇1, 2, 刘 松1, 秦玉坤1, 邢荣娥1, 李克成1, 于华华1, 岳 洋1, 2, 李 俨1, 2, 李鹏程1
(1. 中国科学院海洋研究所, 山东青岛 266071; 2. 中国科学院大学, 北京 100049)
利用接枝反应, 采用碱性氨基酸修饰壳聚糖, 制备壳聚糖赖氨酸衍生物、壳聚糖精氨酸衍生物、壳聚糖组氨酸衍生物。通过红外(FT-IR)、核磁(1H-NMR)、元素分析(EA)对其进行表征, 并研究了不同壳聚糖氨基酸衍生物的抑菌活性。结果表明, 壳聚糖赖氨酸衍生物、壳聚糖精氨酸衍生物、壳聚糖组氨酸衍生物、壳聚糖对金黄色葡萄球菌的最低抑菌浓度(MIC)分别为320、160、320、640 μg/mL, 对大肠杆菌的最低抑菌浓度(MIC)分别为320、320、320、640 μg/mL, 三种壳聚糖氨基酸衍生物的抑菌活性均明显高于未修饰壳聚糖。通过引入碱性氨基酸增加壳聚糖的正电荷有利于提高其抑菌活性。
壳聚糖; 碱性氨基酸; 衍生物; 抑菌活性
壳聚糖是甲壳素部分或完全脱乙酰基后的产物, 是自然界中唯一的天然碱性多糖, 具有使用安全、良好的生物相容性、生物降解性和理化性质相对稳定等优点, 同时具有降血脂、絮凝、止血、抗菌等多种生物活性[1]。壳聚糖具有的活泼羟基和氨基, 可以进行多种化学改性, 以改善其溶解性、增强抗菌活性等, 因此在抗菌剂的研究与应用方面具有良好的前景。目前, 虽然壳聚糖及其衍生物的抗菌机理尚没有明确的结论, 但研究者提出了多种可能的壳聚糖抗菌作用机理, 这些机理都与壳聚糖的氨基或正电荷有关[2]。归结起来主要有以下三种: 首先最认同的抗菌机理是带正电荷的壳聚糖与带负电荷的细菌细胞表面的相互作用, 通过影响细菌代谢而达到抑菌效果[3-5]; 第二个可能的抗菌机理是壳聚糖穿透细胞壁和细胞膜进入细菌细胞内部, 与DNA结合阻止了DNA的转录[6]; 第三个可能的抗菌机理是壳聚糖及其衍生物与金属离子螯合, 抑制微量元素的摄取以及与细菌生长所必需的营养物质结合, 从而达到抑菌效果[7]。
氨基酸作为生物功能大分子的基本组成单位, 是构成动物营养所需蛋白质的基本物质。而赖氨酸、精氨酸、组氨酸因其侧链分别带氨基、胍基和咪唑基(碱性基团), 使其成为带正电荷的碱性氨基酸[8]。本文利用活性基团拼接原理, 通过接枝反应, 将这三类碱性氨基酸接枝到壳聚糖上, 理论上可以增加壳聚糖上正电荷, 从而提高其抑菌活性。
1 实验部分
1.1 主要药品与试剂
壳聚糖(CS, 相对分子质量1300 KDa, 脱乙酰度85.6%), 购于青岛云宙生物科技有限公司; 赖氨酸(Lys)、精氨酸(Arg)、组氨酸(His), 吗啉乙磺酸(MES), 购于国药试剂集团有限公司; 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDCl)、N-羟基琥珀酰亚胺(NHS), 购于阿拉丁试剂有限公司, 透析袋(MEMBRA-CEL, 截留分子质量为3500 Da)购于济南邦达医药公司。
1.2 主要仪器与设备
78-1型磁力加热搅拌器, 常州国华电器有限公司; PHS-3C型pH计, 上海雷磁公司; TU-1810型紫外可见分光光度计, 北京普析通用仪器有限责任公司; iMark酶标仪, 美国美国BIO-RAD公司; FD-1型冷冻干燥机, 北京德天佑实验仪器有限公司; SARTORIUS 精密分析天平, 德国 SARTORIUS 公司; 博讯立式蒸汽压力灭菌器, 上海博讯实业有限公司; 红外光谱仪(Nicolet Magna-Avatar 360), Nicolet Magna公司; 核磁共振光谱仪(JNM-ECP600 NMR spectrometer), 日本JEOL公司; 元素分析仪(Vario EL-Ⅲ elemental analyzer), 德国元素分析系统公司。
1.3 壳聚糖氨基酸衍生物的合成
参照前期已报道的制备方法并进行适当改进[9]。称取0.5 g壳聚糖溶于50 mL0.10 mol/L MES缓冲溶液中(pH=5.5), 待壳聚糖完全溶解, 加入壳聚糖单元物质的量3倍的EDCl作缩合剂、壳聚糖单元物质的量3倍的NHS作偶联剂, 搅拌均匀, 加入壳聚糖单元物质的量2倍的氨基酸(赖氨酸、精氨酸、组氨酸), 磁力搅拌, 室温反应24 h。反应结束后, 于去离子水中透析3 d, 真空冷冻干燥得样品CS-L(壳聚糖赖氨酸衍生物), CS-A(壳聚糖精氨酸衍生物), CS-H(壳聚糖组氨酸衍生物)。壳聚糖氨基酸衍生物的合成路线如图1所示。
1.4 抑菌实验
细菌最小抑菌浓度(MIC)采用微量肉汤稀释法测定[10]。具体步骤如下:
(1) 用接种环挑取37℃过夜培养的MH琼脂培养皿上的单菌落于无菌的0.85%生理盐水中, 校准为0.5麦氏比浊标准, 约含菌数1×108CFU/mL, 然后用MHB培养基稀释100倍, 即得到约含菌数1×106CFU/mL的菌液, 备用。
(2) 将待测样品用0.5%乙酸配制成浓度为5 120 μg/mL储备液。取无菌的96孔板, 每个孔中加入100 μL含菌数1×106CFU/mL的菌悬液, 在A孔中加入100 μL待测样品储备液, 混匀, 从A孔吸取100 μL加入B孔, 混匀, 再从B孔吸取100 μL至C孔, 依次类推, G孔吸取100 μL弃去, H孔不加样品, 只含100 μL菌悬液。此时各孔药物浓度依次为: 2 560、1 280、640、320、160、80、40 μg/mL。以只加100μL菌悬液不加待测样品作对照。用酶标仪620 nm波长下测定初始吸光度值, 将96孔板于37℃细菌培养箱培养18~24 h后再用酶标仪620 nm波长下测定吸光度值, 两次测得的吸光度差δ值代表细菌的生长情况。所测样品对细菌的抑制率按下式计算:
抑制率=(δ0–δx)/δ0×100%
其中,δ0为只含菌悬液的空白对照培养前后吸光度差值,δx为所测样品培养前后吸光度差值。
2 结果与分析
2.1 红外光谱(FT-IR)测定
壳聚糖(CS)和三类氨基酸修饰壳聚糖(CS-L, CS-A, CS-H)的红外光谱如图2所示, 从图中可以看出, 反应后在1 640 cm–1和1 540 cm–1附近出现明显的吸收峰, 经分析可知, 1 640 cm–1和1 540 cm–1附近分别是仲酰胺的酰胺Ⅰ代吸收峰和酰胺Ⅱ代的N-H变形振动吸收峰, 而原壳聚糖上1589cm–1的氨基(N-H)谱带被新生成的酰胺Ⅱ谱带所掩盖, 这说明反应后产物中有酰胺键生成[11]。证明三种氨基酸通过α-羧基与壳聚糖上氨基发生反应, 生成酰胺键, 氨基酸修饰壳聚糖成功。
2.2 核磁共振谱图(1H-NMR)测定
图3为壳聚糖(CS)和三类氨基酸修饰壳聚糖(CS-L, CS-A, CS-H)的1H-NMR谱图, 在CS谱图上, 1.80×10–6处为壳聚糖上未脱乙酰基团质子吸收峰, 2.93×10–6处为C2上质子的吸收峰, 4.65×10–6处为C1上质子的吸收峰, 3.47×10–6~3.66×10–6为C3、C4、C5、C6上质子的重叠吸收峰[12]。经氨基酸修饰的壳聚糖的1H-NMR 除了保持原来的吸收峰外, CS-L的谱图在1.25×10–6, 1.54×10–6, 1.71×10–6, 2.52×10–6处出现的吸收峰分别对应C9, C10, C8, C11上质子; CS-A的谱图在1.47×10–6, 1.62×10–6, 2.52×10–6出现的吸收峰分别对应C9, C8, C10上的质子; CS-H的谱图在2.92×10–6处出现的吸收峰对应C8上的质子, 在7.00×10–6和8.14×10–6处出现的吸收峰分别对应组氨酸咪唑环上C10和C9的质子吸收峰[13]。CS-L, CS-A, CS-H的C7位上质子吸收峰出现在3.40×10–6~ 3.80×10–6, 与壳聚糖骨架上质子出峰位置接近, 可能被壳聚糖骨架上质子吸收峰所掩盖, 由此可以判定壳聚糖主链中成功引入氨基酸分子, 壳聚糖碱性氨基酸衍生物制备成功。
2.3 元素分析
壳聚糖与三类壳聚糖氨基酸衍生物元素分析结果如表1所示。根据C/N比值计算得出壳聚糖脱乙酰度及氨基酸对壳聚糖的取代度, 根据元素分析计算得到的结果表明, 在本实验条件下制得的三类壳聚糖氨基酸衍生物具有相似的取代度, 由于氨基酸分子的引入, N元素含量增加, C/N降低。
2.4 抑菌实验
壳聚糖及三类壳聚糖氨基酸衍生物对金黄色葡萄球菌的抑菌效果如表2所示。CS对金黄色葡萄球菌的最低抑菌浓度(MIC)为640 μg/mL, 三类壳聚糖氨基酸衍生物的抑菌活性均高于壳聚糖原料, 其中CS-A抑菌活性最高, 对金黄色葡萄球菌的MIC为160 μg/mL, CS-L、CS-H对金黄色葡萄球菌的抑菌活性相当, 其MIC为320 μg/mL。
壳聚糖及三类壳聚糖氨基酸衍生物对大肠杆菌的抑菌效果如表3所示, CS对大肠杆菌的最低抑菌浓度(MIC)为640 μg/mL, 三类壳聚糖氨基酸衍生物的抑菌活性相当, 均高于壳聚糖原料, 其对大肠杆菌的最低抑菌浓度(MIC)为320 μg/mL。
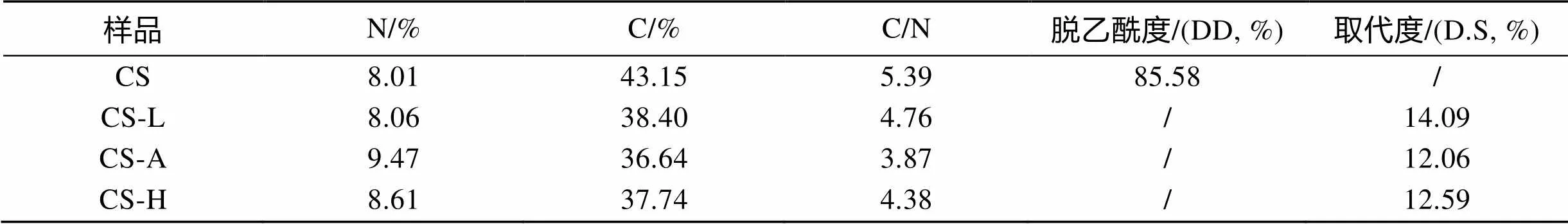
表1 壳聚糖及赖氨酸、精氨酸、组氨酸修饰壳聚糖元素分析
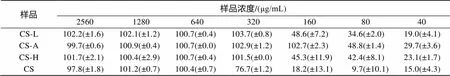
表2 壳聚糖及赖氨酸、精氨酸、组氨酸修饰壳聚糖对金黄色葡萄球菌的抑菌率(%)

表3 壳聚糖及赖氨酸、精氨酸、组氨酸修饰壳聚糖对大肠杆菌的抑菌率(%)
3 讨论
利用赖氨酸、精氨酸、组氨酸三类带正电荷的碱性氨基酸修饰壳聚糖, 通过红外(FTIR)、核磁(1H-NMR)、元素分析(EA)进行结构鉴定、表征, 结果表明三类壳聚糖氨基酸衍生物制备成功。对大肠杆菌和金黄色葡萄球菌的抑菌活性的研究结果表明, 三类壳聚糖氨基酸衍生物均能有效提高壳聚糖的抑菌活性。其中, 壳聚糖赖氨酸衍生物、壳聚糖组氨酸衍生物对金黄色葡萄球菌的抑菌活性相当, 均高于壳聚糖但低于壳聚糖精氨酸衍生物。三类壳聚糖氨基酸衍生物对大肠杆菌的抑菌活性均高于壳聚糖。其原因可能是壳聚糖接枝碱性氨基酸后, 增加了其氨基正电荷, 使其抑菌活性有不同程度的提高。
壳聚糖精氨酸衍生物含有胍基基团, 而胍基化合物常用作农业杀菌剂和消毒剂及工业生物杀伤剂中的抗微生物剂等。这是由于胍基化合物中的胍基团是有效的活性基团, 可以与生物体中的基团或元素相互作用, 破坏其正常的物质和能量代谢[14]; 同时, 精氨酸侧链胍基基团是具有生物活性最强的有机碱之一[15], 其pKa=12.48, 而赖氨酸侧链氨基pKa= 10.53, 组氨酸侧链咪唑基pKa=6.00[8], 就其酸碱性质而言, 精氨酸碱性最强, 携带正电荷的能力也最强, 因而赋予壳聚糖精氨酸衍生物更高的抑菌活性。
[1] 程沁园, 张家骊, 夏文水. 壳聚糖的脱乙酰度、分子质量和性状对其体外促凝血活性的影响[J]. 海洋科学, 2012, 36(6): 59-63. Chen Qinyuan, Zhang Jiali, Xia Wenshui. The effects of degrees of deacetylation, molecular weights and states of chitosans on procoagulant activities in vitro[J]. Marine Sciences, 2012, 36(6): 59-63.
[2] 李明春, 许涛, 辛梅华. 壳聚糖及其衍生物的抗菌活性研究进展[J]. 化工进展, 2011, 30(1): 203-209. Li Mingchun, Xu Tao, Xin Meihua.Research progress of antibacterial activity of chitosan and its derivatives[J]. Chemical Industry and Engineering Progress, 2011, 30(1): 203-209.
[3] Guo Z. Xing R, Liu S, et al. Properties of Schiff bases of chitosan, N-substituted chitosan and quaternized chitosan[J]. Carbohydrate Research, 2007, 342(10): 1329-1332.
[4] Meng X, Xing R, Liu S, et al. Molecular weight and pH effects of aminoethyl modified chitosan on antibacterial activity in vitro[J]. Carbohydrate Polymers, 2011, 83(1): 144-150.
[5] Jae-young Je, Se-kwon kim. Chitosan derivatives killed bacteria by disrupting the outer and inner membrane[J]. Journal of Agricultural and Food Chemistry, 2006, 54(18): 6629-6633.
[6] 郑连英, 朱江峰, 孙昆山. 壳聚糖的抗菌性能研究[J]. 材料科学与工程, 2000, 18(2): 22-24. Zheng Lianying, Zhu Jiangfeng, Sun Kunshan. Antibacterial activity of chitosan[J]. Materials Science and Engineering, 2000, 18(2): 22-24.
[7] Roller S, Covill N.The antifungal properties of chitosan in laboratory media and apple juice[J]. International Journal of Food Microbiology, 1999, 47(1-2): 67-77.
[8] 王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 北京: 高等教育出版社, 2002: 123-127. Wang Jingyan, Zhu Shenggeng, Xu Changfa. Biochemistry[M]. Beijing: The Higher Education Press, 2002: 123-127.
[9] Xiao B, Wan Y, Zhao M, et al. Preparation and characterization of antimicrobial chitosan-N-arginine with different degrees of substitution[J]. Carbohydr. Polymers, 2011, 83(1): 144-150.
[10] Casey J, O'Cleirigh C, Walsh P, et al. Development of a robust microtiter plate-based assay method for assessment of bioactivity[J]. Journal of microbiological methods, 2004, 58(3): 327-334.
[11] 李双艳, 郝丽娟, 常津, 等. 赖氨酸修饰壳聚糖磁性超微载体的制备和表征[J].高分子通报, 2007, 5(7): 32-40. LI Shuangyan, Hao Lijuan, Chang Jin, et al. Preparation and characterization of lysine chemically modified chitosan magnetic microspheres[J]. Polymer Bulletin, 2007, 5(7): 32-40.
[12] 王爱琴. 甲壳素化学[M]. 北京: 科学出版社, 2008: 62-66. Wang Aiqin. Chitin Chemistry[M]. Beijing: The Science Press, 2008: 62-66.
[13] 陈彰旭, 辛梅华, 李明春. 组氨酸改性壳聚糖多孔支架的制备与表征[J]. 高分子材料科学与工程, 2013, 29(9): 152-155. Chen Zhangxu, Xin Meihua, Li Mingchun. Preparation and characterization of histidine graftedchitosanporousscaffolds[J]. Polymer Materials Science and Engineering, 2013, 29(9): 152-155.
[14] 张佩英, 岳葆珍. 生物有机化学[M]. 北京: 北京医科大学和中国协和医科大学联合出版社, 1992. 17-19.Zhang Peiying, Yue Baozhen. Bioorganic chemistry [M]. Beijing: The United Press of Beijing Medical University and Peking Union Medical College , 1992. 17-19.
[15] 赵声贵, 钟宏. 胍基化合物的制备方法及其应用[J].精细化工中间体, 2006, 36 (3): 7-10. Zhao Shenggui, Zhong Hong.Synthesis and application of guanidine compounds[J].Fine Chemical Intermediates, 2006, 36 (3): 7-10.
Synthesis and antibacterial activities of basic amino acid- modified chitosan derivatives
HUANG Yong1, 2, LIU Song1, QIN Yu-kun1, XING Rong-e1, LI Ke-cheng1, YU Hua-hua1, YUE Yang1, 2, LI Yan1, 2, LI Peng-cheng1
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
In this study, three basic amino acids were used to modify chitosan to improve its antibacterial activity. Lysine-modified chitosan, arginine-modified chitosan, and histidine-modified chitosan were synthesized, and their structures were characterized using Fourier-transform infrared, magnetic resonance spectra (1H-NMR), and elemental analysis. The results showed that the amino acids were successfully grafted onto chitosan. The antibacterial activities of these derivatives againstandwere investigated. The MIC of lysine-modified chitosan, arginine-modified chitosan, and histidine-modified chitosan onwas 320, 160, 320, and 640 μg/mL, respectively, and the MIC onwas 320, 320, 320, and 640 μg/mL, respectively. All three basic amino acid-modified chitosan derivatives exhibited better antibacterial activity than chitosan.
Chitosan; basic amino acids; derivatives; antibacterial activity
Q503
A
1000-3096(2017)01-0024-06
10.11759/hykx20160408001
2016-04-08;
2016-06-26
中国科学院STS计划项目(KFJ-SW-STS-143); 国家海洋公益性项目(201305016-2、201405038-2); NSFC-山东联合资助项目(U1406402-5)
黄勇(1990-), 山东潍坊人, 硕士研究生, 研究方向: 海洋活性物质, 电话: 0532-82898780, E-mail: huangyongno1@163.com; 刘松, 通信作者, 研究方向: 海洋活性物质, 电话: 0532-82898780, E-mail: sliu@qdio.ac.cn
Apr. 8, 2016
[CAS STS Program, No.KFJ-SW-STS-143; The Public Science and Technology Research Funds Projects of Ocean, No.201305016-2, No.201405038-2; NSFC-Shandong Union project, No. U1406402-5]
(本文编辑: 康亦兼)

