山东荣成天鹅湖海草场大型底栖贝类时空分布研究
刘建影, 李文涛, 覃乐政, 张秀梅
山东荣成天鹅湖海草场大型底栖贝类时空分布研究
刘建影, 李文涛, 覃乐政, 张秀梅
(中国海洋大学水产学院, 山东青岛266003)
为了了解天鹅湖不同微生境条件下底栖贝类的群落结构及时空分布特征, 于2013年12月至2014年11月, 对天鹅湖矮大叶藻区、空白区、大叶藻区边缘及其内部的底栖贝类和环境特征进行了调查。共发现15种大型底栖贝类, 隶属14科15属; 贝类种类组成、分布密度、生物量以及物种多样性指数在4种生境中差异显著, 但均无明显的季节变化。空白区域中贝类总密度和单位面积生物量最高, 大叶藻区内部最低, 但矮大叶藻区和大叶藻区内部多样性指数较高。大叶藻区内部的贝类以腹足类锈凹螺、日本月华螺、刺绣翼螺等刮食者为主, 而双壳贝类则更倾向于选择无海草覆盖的空白区或者海草较为稀疏的草场边缘。综合分析表明, 天鹅湖底栖贝类的分布和多样性受底质特征和海草覆盖影响最为显著, 同时与水深密切相关。
底栖大型贝类; 海草; 微生境; 时空变化
海草是生活在海洋中的沉水单子叶高等植物, 广泛分布于热带、亚热带和温带沿岸海域的潮间带和浅潮下带, 并能够形成较大面积的海草场。海草场与珊瑚礁和红树林并称为三大典型海洋生态系统, 具有极其重要的生态服务功能, 它能为鱼类、贝类、甲壳类等多种海洋生物提供栖息、觅食和育幼场所[1-2]。海草场中的大型底栖动物群落及其与海草的关系一直以来是国际上海洋生态学的研究热点[3-4]。一方面, 海草能够净化水质、减缓水流、稳定底质, 为底栖生物提供了良好的生活环境, 被称为“生态系统工程师”[5-8]。另一方面, 大型底栖贝类是海草场复杂食物网中不可或缺的组成部分, 在海草场生态系统的能量流动和物质循环中扮演着重要的角色, 且其摄食和潜沙等扰动活动将会直接或间接的对海草产生一定的影响[9]。因此, 底栖贝类的多样性和群落的稳定性对于维持海草场生态系统功能的完整性有着至关重要的作用[10]。
国外对于海草生态系的研究较为全面和丰富, 而国内则起步较晚并相对集中在大叶藻种群生理生态学方面。对其他生物群落的研究多见于浮游生物、鱼类和甲壳类以及附着、底栖藻类[11-13], 关于海草场中大型底栖贝类的研究则相对较少。目前仅有张景平[10]探究了广西合浦不同类型海草床中大型底栖动物的差异性, 赵永强等[14]比较和分析了不同互花米草密度生境中大型底栖动物的群落格局。而荣成天鹅湖作为山东半岛分布最广的连续海草场, 却至今未见对其中大型底栖贝类群落时空分布特征及与环境因子关系的报道。
因此, 本实验根据海草覆盖情况, 在天鹅湖选择了矮大叶藻区、大叶藻草场内部、大叶藻草场边缘及空白区4种微生境, 对其中贝类群落的多样性现状和分布特征进行了较为全面的研究, 旨在了解天鹅湖海草场中贝类群落的种类组成和多样性现状, 分析不同类型微生境中底栖贝类的分布规律并探明影响贝类分布的关键环境因子, 以期为天鹅湖贝类资源开发、物种多样性保护提供一定的科学依据, 为受损大叶藻草场生态系统与生境修复提供一定的理论基础和本底资料。
1 材料与方法
1.1 实验地点
实验地点位于山东半岛东部沿海的天鹅湖(37°21′N, 122°34′E), 是荣成湾内由于泥沙淤积形成的一个天然纳潮泻湖。湖内地势平坦, 平均水深1 m 左右, 平行于海岸线分布有大叶藻和矮大叶藻, 其中大叶藻为优势种, 分布于潮间带和潮下带的大部分区域, 形成大面积海草场。潮间带较浅区域为大叶藻与矮大叶藻混生区, 以矮大叶藻为主, 而大叶藻和矮大叶藻区域之间有一个无海草覆盖的带状空白区域。不同的植被覆盖状况, 造就了不同的微生境。为了探明贝类群落的组成及其在各种微生境中的分布特征, 本实验将实验海区根据海草分布情况划分为4个断面: 潮间带矮大叶藻区(AC)、潮间带空白区(KB)、大叶藻区边缘(CB)、大叶藻区内部(CN), 如图1所示。
1.2 环境因子
天鹅湖表层水温采用HOBO采集器进行监测, 水体盐度用盐度计进行逐月测量, 各个断面水深用直尺测量并换算成平均大潮低潮面下的水深。在各取样点附近用PVC管取底泥, 用筛析法进行粒径分析, 并用烧失量法测定沉积物有机质含量(OC)。
1.3 样品采集与处理
于2013年12月到2014年11月进行逐月采样。其中12月(冬)、3月(春)、6月(夏)、9月(秋), 为季度采样, 每个断面取平行样8个, 其他月份则取3个。每个断面内各个平行样的间距在10~20 m。
使用25 cm×25 cm样方进行取样, 掘取取样框内所有泥沙(包含地上和地下海草组织)进行淘洗, 取样厚度为18 cm。样品过孔径0.5 mm网筛, 仔细将海草和底栖动物挑出放入做好样方标记的塑料密封袋内, 用放有冰袋的保温箱保存, 带回实验室进行测量分析。采用目测法估计样方内海草的盖度。
将贝类用75%酒精进行固定, 并进行分类鉴定。统计各样方中各物种的种类和数量, 称量其湿重并测定其壳长等形态学指标。测定各样方中海草密度、株高, 后将海草地上组织放入做好标记的牛皮纸信封中, 在60℃下烘干至恒重并称重(精确至0.0001 g)。
1.4 数据处理
贝类群落生物多样性用Shannon-Wiener多样性指数(¢) 以及Margalef种类丰富度指数()表示:
¢−∑ (n/)lg(n/)
=(–1)/ ln ()
群落的物种均匀度用Pielou指数(¢)表示:
¢¢/ log2
用群落的优势度()确定贝类群落优势种(以≥0.02为优势种), 计算公式为:
= (n/) f
式中,为总物种数,为所有种类总生物量,P为种类的数量占总个体数的比例,n为种的数量,为所有种类总个体数, 出现率f是种出现的样方数占总样方数的百分比。
运用PRIMER 6.1软件对大型底栖贝类群落结构进行多变量统计分析。对底栖贝类原始丰度进行平方根转化和标准化后, 在Bray-Curtis相似性测定的基础上, 对底栖贝类群落进行聚类分析(Cluster Analysis)及非度量多维标度(nMDS)分析, 用ANOSIM对群落结构进行差异显著性检验并运用SIMPER 分析找出造成群落差异的主要贡献物种。非度量多维标度(nMDS)坐标轴用应力(Stress)表示, 当应力值在0.2以下, 表明矩阵表示了相对真实的结构。
运用Canoco 4.5对物种分布与环境因子之间的相关关系进行分析, 采用除趋势对应分析(DCA)和主成分分析(PCA)进行分类和排序。运用SPSS 19.0进行单因素方差分析(one-way ANOVA), 显著性水平为0.05; 结果用平均值 ± 标准误差表示, 使用SigmaPlot 12.0、PRIMER 6.1和Canoco 4.5进行分析和绘图。
2 结果与分析
2.1 环境因子
实验期间海水表层温度呈现明显的季节变化, 年平均温度为13.9℃, 最高温度出现在9月, 为30.5℃, 最低温度出现在1月, 为–1.9℃(图2)。全年盐度平均值为32.6。由于各断面距离较近, 其温度和盐度均采用一个数值。低潮时, 矮大叶藻区(AC)、空白区(KB)和大叶藻区边缘(CB)都露出水面, 而草场内部区域则完全没于水中。各断面沉积质特征各不相同, 有机质含量(OC)为0.74%~2.76%(表1): 其中大叶藻区内部(CN)有机质含量最高为2.76%, 显著高于其他3个断面, 无植被覆盖的空白区(KB)仅为0.74%, 显著低于其他断面(< 0.05)。4个区域底质均为砂质, KB区底质粒径最粗, 平均粒径为0.23 mm, 粉砂和黏土的含量仅为2.41%, 而CN区平均粒径值为0.19 mm且其粉砂和黏土的含量为11.87%, 这表明大叶藻区内部底质粒径更细。
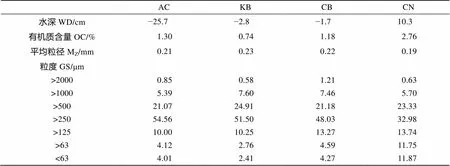
表1 天鹅湖不同断面水深、有机质含量、平均粒径和粒度分布
2.2 海草植株密度与生物量
海草的生长在各断面(KB除外)均表现出明显的季节变化, 其生物量在春、夏季高于秋、冬季, 而大叶藻的植株密度除了在矮大叶藻和大叶藻混生的AC呈现总体降低的趋势外, 在CB和CN也表现为春、夏季高于秋、冬季。海草单位面积生物量在3个断面间差异显著(<0.05, 图3a), 表现为大叶藻区内部(CN)>边缘(CB)>矮大叶藻区(AC), 分别为142.52、80.38、48.60 g/m2。CN、CB区生物量在6月份分别达到最大值(392.89 ± 68.20)g/m2和(175.02 ± 47.99)g/m2, 而AC区域则在7月份达到最大值为(132.79 ± 35.94)g/m2。CN区大叶藻植株总密度要显著大于其他两个区域(< 0.05, 图3b), 且在5月底达到最大值为(864.00 ± 103.50)株/m2。矮大叶藻仅存在于AC区, 其植株密度在2月份最小, 为(213.33 ± 62.53)株/m2, 在9月份达到最大值, 为(1658.67 ± 365.64)株/m2, 年平均值为(853.11 ± 168.77)株/m2。
2.3 贝类组成与分布的时空变化
2.3.1 贝类组成与分布
从2013年12月到2014年11月, 共采集224个样方, 总计4039个贝类个体, 隶属于14科15属15种。作者将冬(12、1、2月)、春(3、4、5月)、夏(6、7、8月)和秋(9、10、11月)4个季度, 每个季度3个月份采集到的贝类样本合并, 对其种类、密度、生物量以及多样性进行分析。大叶藻区边缘(CB)贝类种类最多(14), 其中冬、春、夏和秋四季分别发现9、11、12和10种, 优势种由菲律宾蛤仔()、异白樱蛤()、秀丽织纹螺()、日本月华螺()组成(表2)。矮大叶藻区(AC)种类最少(10种),其中在冬、春、夏和秋四季分别发现8、7、9和9种, 其优势种为菲律宾蛤仔、异白樱蛤、秀丽织纹螺、砂海螂()。空白区(KB)发现13种贝类, 冬、春、夏和秋四季分别发现10、11、7和5种, 优势种主要由菲律宾蛤仔、异白樱蛤、秀丽织纹螺、纵带滩栖螺()组成。大叶藻区内部(CN)发现11种贝类, 冬、春、夏和秋四季分别发现8、7、5和8种, 优势种为异白樱蛤、日本月华螺、锈凹螺()。各个断面种类数及优势种的组成全年保持稳定, 没有表现出明显的季节变化规律(表2)。
4个断面贝类的总密度与总生物量均无显著的季节差异(> 0.05), 但每个季度不同断面间均差异显著(< 0.05, 图4)。4个断面的总密度与总生物量在全年都呈现出相同的规律, 即空白区域最高, 草场内部最低, 且空白区域显著大于草场内部(< 0.05)。四个季度贝类总密度最高值出现在冬季空白区域为(692.22 ± 109.08)个/m2, 最低值则出现在春季草场内部为(63.82 ± 15.86)个/m2; 贝类总生物量最高值则出现在夏季的空白区域为(1837.85 ± 300.33)g/m2, 最低值出现在秋季的草场内部为(81.52 ± 11.66)g/m2。草场边缘贝类密度与生物量均略大于矮大叶藻草场, 但两者之间差异不显著(> 0.05)。
各个物种的密度与生物量全年都保持相对稳定的状态, 未表现出显著的时间变化, 但各物种的空间分布在不同的断面表现出一定的差异。菲律宾蛤仔为天鹅湖的优势贝类, 其全年平均密度与生物量表现为: KB>CB>AC>CN, 且差异均显著(0.05), 空白区域密度为(235.74 ± 26.04)个/m2, 生物量高达(1281.91 ± 133.71)g/m2, 而草场内部很少出现, 其年平均密度仅为(4.88 ± 1.80)个/m2。异白樱蛤分布较为均匀, 但其他3个断面的密度和生物量仍显著大于草场内部(< 0.05)。砂海螂大量出现在矮大叶藻草场区, 基本不出现在草场内部。秀丽织纹螺和滩栖螺在空白区域最为丰富, 但与矮大叶藻区和草场边缘区差异不显著(> 0.05), 在草场内部分布很少。锈凹螺更多分布在水较深的草场边缘和草场内部, 矮大叶藻区出现较少。日本月华螺在有海草存在的区域更加丰富, 草场边缘和内部区域显著大于空白区域(< 0.05)。

表2 不同季节和断面贝类的优势度
注: “−”表示优势度为0; 0.00表示优势度<0.01
2.3.2 贝类物种多样性
3种多样性指数在季节间差异均不显著(> 0.05), 并且无一致的变化规律, 表明贝类多样性全年保持相对稳定(表3)。种类丰富度指数()在断面间呈现出一定的差异, 其平均值在草场内部较高, 矮大叶藻区域最低, 但差异不显著(= 0.198)。而多样性指数(¢)与均匀度指数(¢)在断面间差异显著(< 0.05), 全年都呈现为草场内部和矮大叶藻区域显著高于空白区域和草场边缘区域。多样性指数(¢)最高值出现在夏季草场内部(1.42), 最低值则出现在夏季空白区域(0.46); 均匀度指数(¢)最高值也出现在夏季草场内部(0.78), 最低值出现在夏季空白区域(0.22)。
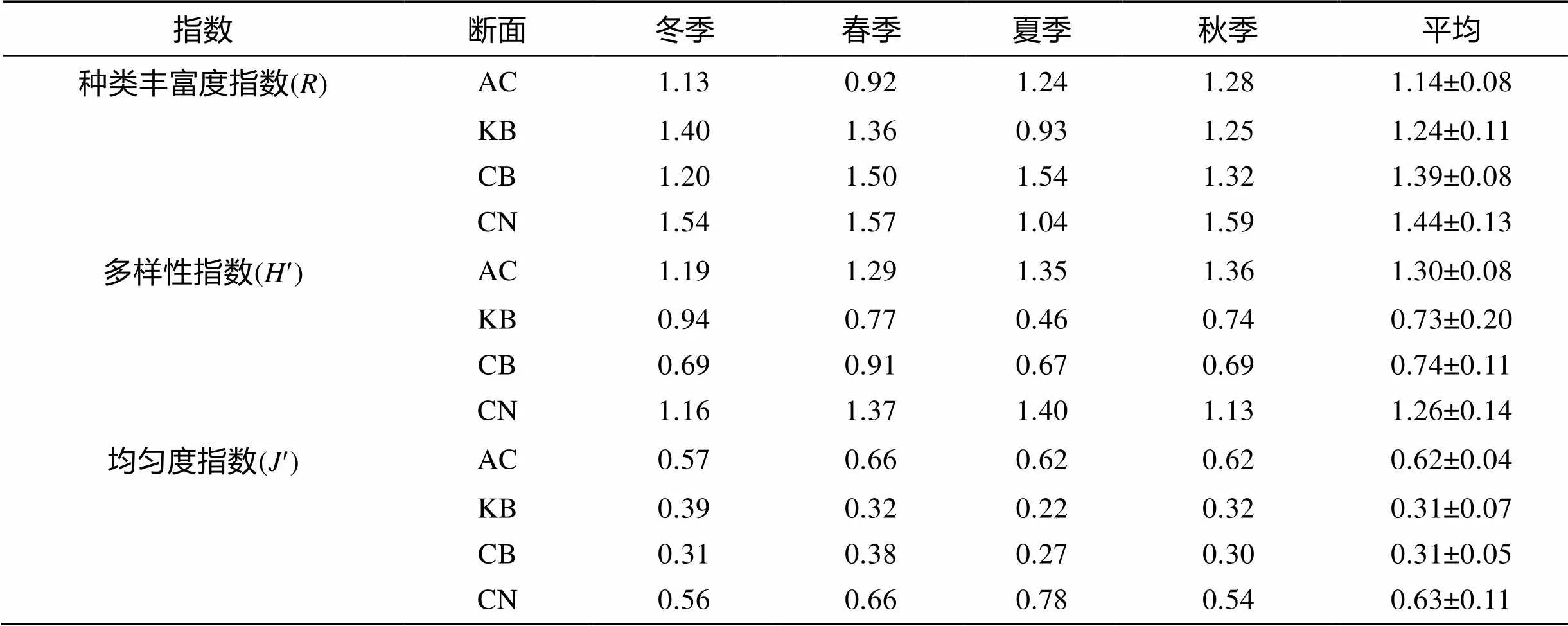
表3 贝类群落物种多样性指数
2.3.3 贝类群落结构特征分析
以Bray-Curtis相似性系数为基础进行的聚类分析显示, 各个断面的大型底栖贝类群落结构具有一定的稳定性, 在37.75%相似性水平上, 可将4个断面上的贝类分为两大聚类组, 在CN断面的12次监测中采集的贝类群落结构最为相似, 独立成为一组, 而在KB、CB、AC断面在12个月份采集的贝类的相似性水平达60%, 成为另一组(图5)。
nMDS结果与聚类分析显示, 在40% 相似性水平上可分为3组, CN单独一组, 这与聚类结果一致, 另外两个分组表明AC和KB贝类群落分离, 但CB同AC、KB均有交叉(Stress=0.15, 图6)。相似性分析(ANOSIM)显示, CN与AC、CB、KB贝类群落组成差异显著(1=0.744,2=0.769,3=0.945;<0.001), AC与KB两群落分离但有部分重叠(=0.779;<0.001),而CB与AC、KB基本上是不分离的(=0.404,=0.528;<0.001), 这均与聚类分析和nMDS分析结果一致。
1~12代表每个断面全年12个月份
1~12 represents the 12 months of the year
1~12代表每个断面全年12个月份
1~12 represents the 12 months of the year

AC,beds; ● KB, bare area; ■ CB, edge ofL. beds; ◆ CN, interior ofL. beds
SIMPER分析显示, 各个断面内12个月份相似性均在50%以上, 这表明各个断面贝类组成在月份间变化不大, 这与前面的季度分析结果一致。各个断面组内典型种与优势度计算结果一致。AC和CN之间的差异中, 菲律宾蛤仔、秀丽织纹螺、纵带滩栖螺、砂海螂这4种贝类的贡献度达65.01%; KB与CN、AC与KB的差异主要是由菲律宾蛤仔、秀丽织纹螺、纵带滩栖螺、日本月华螺这4种贝类造成的, 其贡献度之和分别为72.64%和74.57%; CB与CN的分歧种包括菲律宾蛤仔、异白樱蛤、秀丽织纹螺和日本月华螺, 这4种贝类的贡献度之和达到了72.11%(表4)。
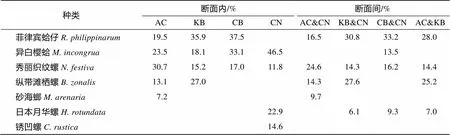
表4 天鹅湖贝类典型种断面内相似性贡献率和断面间分歧贡献率
2.4 贝类群落与环境因子的关系
对天鹅湖底栖贝类与环境因子关系的分析显示, 第一(水平)、第二(垂直)排序轴对物种的解释量分别为64.4%和24.6%(图7)。环境变量海草总生物量(TB)、底质有机质含量(OC)与第一轴正相关, 底质粒径(GS)与第一轴负相关, 其相关系数值分别为0.9666、0.9607、−0.9363。表明从左到右, 海草总生物量逐渐增加、底泥质地呈细化趋势、有机质含量升高, 腹足类日本月华螺、钝角口螺、锈凹螺和布尔小笔螺与TB、OC具有较好的正相关性。而菲律宾蛤仔、异白樱蛤、秀丽织纹螺、纵带滩栖螺则与底质粒径具有较好的正相关性。
JD为矮大叶藻密度, GS为平均粒径, OC为有机质含量, TB为海草总生物量, MD为大叶藻植株密度, WD为水深; ■ 代表断面, 1为矮大叶藻区, 2为空白区, 3为大叶藻区边缘, 4为大叶藻区内部
JD,density; GS, mean grain size; OC, organic content; TB, total biomass of seagrass; MD,L. density; WD, water depth; ■, study transects; 1,area; 2, bare area; 3, edge ofL. beds; 4, interior ofL. beds
3 讨论
3.1 天鹅湖海草场底栖贝类的分布特征
本研究在天鹅湖海草场中共发现贝类15种, 比刘炳舰[15]在对天鹅湖大叶藻资源调查中发现的贝类(共发现13种)多出2种, 而刘静[16]对天鹅湖大叶藻间小型腹足类的研究中只发现双壳类6种、腹足类28种(这其中包括多种小型腹足类), 这些差异可能来源于不同的样品采集方法。其中菲律宾蛤仔、异白樱蛤、秀丽织纹螺、纵带滩栖螺、日本月华螺、锈凹螺为天鹅湖的主要优势贝类。本次调查发现贝类的种类组成及多样性没有表现出明显的时间变化规律, Stein Fredriksen对挪威海草场的研究中也发现底内动物没有明显的季节变化[17], 这与本实验结果一致。这可能是由于海草为多年生形成了相对复杂的地下根茎结构, 为贝类营造了相对稳定的栖息环境。此外, 贝类活动均较为迟缓、活动范围有限, 因而贝类没有表现出季节差异。
一般来说, 海草场中的贝类主要分4大类: 以附生藻类(epiphytes)为食的刮食性贝类(grazer)、底内和底上滤食性贝类(filter-feeder)、底上以碎屑为食的沉积食性贝类(deposit-feeder)及底上肉食性贝类(carnivore), 此外还包括以大叶藻叶片为食的小部分贝类[18]。天鹅湖采集到的贝类中, 锈凹螺、日本月华螺、刺绣翼螺及布尔小笔螺等腹足类属于刮食者, 双壳类菲律宾蛤仔、异白樱蛤、砂海螂等属于底内滤食者, 而纵带滩栖螺、秀丽织纹螺则属于底上碎屑食性的贝类。
对贝类种类、优势种、密度与生物量、多样性及多元统计结果的综合分析表明, 4种类型微生境中贝类群落结构与丰富度存在显著差异。大叶藻草场内部种类丰富度指数和均匀度指数最高, 空白区域的多样性指数最低。造成这种现象的原因可能是草场内部生境结构相对更加复杂, 各种贝类的分布较为均匀, 没有出现特别突出的优势种类。有研究表明, 个别优势种数量过多反而会降低群落多样性[18], 而本实验中草场边缘和空白区域大量菲律宾蛤仔的存在可能是导致两者多样性和均匀度指数降低的原因。
草场内部贝类的总密度和生物量最低, 主要由锈凹螺、日本月华螺及秀丽织纹螺等腹足类组成, 菲律宾蛤仔数量极少。而空白区域贝类总密度和生物量分别为草场内部区的3.27和5.63倍, 分布有大量的菲律宾蛤仔、异白樱蛤、秀丽织纹螺和纵带滩栖螺。其他的研究中也有类似的发现: Sfriso和Bologna 的研究表明浅海海草场中底上附着贝类同海草之间存在正相关关系[19-20]; Stein在对挪威大叶藻海草场中有草和无草覆盖的区域底内动物的对比中, 发现裸露砂质底中的贝类也要比海草场中丰富的多[17]; Webster[21]在对海草场中植株密度影响大型底栖生物分布的研究中, 也发现双壳贝类以及一些大型管栖类生物仅出现在植株密度小的地方。海草场内部海草较为密集, 大叶藻宽阔的叶片一方面能够为刮食性螺类提供栖息的环境, 另一方面还能为其提供充足的附生生物资源作为食物, 复杂的栖息环境还有利于其躲避敌害, 因而草场内部的贝类以底上腹足类刮食者为主。此外, 虽然海草能够减缓水流, 沉降悬浮物质, 为生物提供稳定的底质环境, 但是大叶藻复杂的根茎能够形成致密的网络结构起到了加固底质的作用, 这十分不利于双壳贝类及大型管栖类的潜沙和掘穴活动。而无海草覆盖的空白区域及海草稀疏的草场边缘相比致密的草场内部栖息环境, 其砂质粒径粗、空隙大, 能够减少贝类下潜的阻力, 因而更加适合贝类活动。还有文献指出, 双壳贝类的摄食方式为被动摄食, 而海草根茎结构使得底质碎屑再悬浮程度减弱, 同时茂盛的叶片减缓了水流, 这样就会对贝类的摄食起到阻碍作用[22], 这可能是海草场内部双壳贝类分布较少的另外一个原因。
草场边缘的种类最为丰富且其贝类密度也要显著高于草场内部, 这与Bologna对海草场中底栖生物的研究一致: 草场边缘位置腹足类和一些双壳类都更为丰富和多样[23-24]。草场的边缘部分是过渡地带, 同时具有海草和裸露砂质的生境特征, 因此能够兼具两种生境中的生物种类[25]。这也解释了草场边缘同空白区域贝类群落会出现重叠的现象, 但也有可能是与实验尺度较小, 两断面的距离太小有关。草场边缘贝类群落组成与矮大叶藻区相似, 但其贝类的总密度和生物量要略大于后者, 这可能是由边缘区存在较多菲律宾蛤仔造成的。而后者矮大叶藻虽植株纤细矮小, 但其叶片更加密集, 能够形成致密的冠层, 不利于菲律宾蛤仔的潜沙和移动。此外, 底表碎屑食性腹足类秀丽织纹螺、纵带滩栖螺在矮大叶藻区和空白区数量丰富, 而在大叶藻草场边缘和内部区则分布很少, 这可能是因为这两种螺类更加倾向于选择潮间带浅水区域。
3.2 天鹅湖海草场底栖贝类的影响因素
本研究根据植被的覆盖划分的4个断面具有不同的环境特征, 代表了海草场中4个典型的微生境(microhabitats)。有研究指出, 贝类在栖息空间上均具有选择最佳生境的倾向, 其选择性与海区地理位置、底部沉积类型、波浪扰动、饵料食物丰富程度及季节更替等因素密切相关[22]。综合不同生境贝类分布特征分析及PCA贝类与环境因子关系的分析, 作者推测天鹅湖贝类的分布和多样性特征受底质特征和海草覆盖影响最为显著, 同时与水深密切相关。这与其他学者的研究结果具有一致性。大量对海草与底栖生物之间关系的研究表明, 海草是底栖生物分布和多样性的重要决定因素[26]。李宝泉[27]在对胶州湾底栖软体动物与环境因子的关系的研究中发现, 底质是底栖动物, 尤其是埋栖性软体动物的主要生存场所, 而在不同的底质中栖息的软体动物种类、生物量和栖息密度都有较大差异。腹足类锈凹螺、日本月华螺、刺绣翼螺等刮食者主要分布于能够为其提供栖息环境以及丰富食物的海草密集区。而双壳贝类则更倾向于选择无海草覆盖或者海草稀疏、且底质粒径较粗的空白及草场边缘区。秀丽织纹螺、纵带滩栖螺大量分布在浅水潮间带区域, 在深水区分布较少。
近年来受贝类采集、地笼网作业、游人踩踏等人为活动的影响, 天鹅湖海草床生态系统受到了严重的破坏, 该区域的底栖生物也面临过渡捕捞和生境破坏的双重威胁。因此我们建议对天鹅湖海草床实施更加严格的保护, 划定专门的菲律宾蛤仔采集区和游人活动区, 有序并限量控制资源生物的采集和捕捞, 这将有利于维持和恢复底栖动物的数量和物种多样性, 保持天鹅湖海草场生态功能的稳定。
[1] Hemminga M A, Duarte C M. Seagrass ecology[M]. Cambridge University Press, 2000.
[2] Newell S Y. Multiyear patterns of fungal biomass dynamics and productivity within naturally decaying smooth cordgrass shoots[J]. Limnology and Oceanography, 2001, 46(3): 573-583.
[3] Mills V S, Berkenbusch K. Seagrass () patch size and spatial location influence infaunal macroinvertebrate assemblages[J]. Estuarine, Coastal and Shelf Science, 2009, 81(1): 123-129.
[4] De Troch M, Gurdebeke S, Fiers F, et al. Zonation and structuring factors of meiofauna communities in a tropical seagrass bed (Gazi Bay, Kenya)[J]. Journal of Sea Research, 2001, 45(1): 45-61.
[5] Gacia E, ranata T, Duarte C. An approach to measurement of particle flux and sediment retention within seagrass () meadows[J]. Aquatic Botany, 1999, 65(1): 255-268.
[6] Fonseca M. Sediment stabilization by Halophila decipiens in comparison to other seagrasses[J]. Estuarine, Coastal and Shelf Science, 1989, 29(5): 501-507.
[7] Newell R I, Koch E W. Modeling seagrass density and distribution in response to changes in turbidity stemming from bivalve filtration and seagrass sediment stabilization[J]. Estuaries, 2004, 27(5): 793-806.
[8] Bruno J F, Stachowicz J J, Bertness M D. Inclusion of facilitation into ecological theory[J]. Trends in Ecology & Evolution, 2003, 18(3): 119-125.
[9] Williams S L, Heck Jr K L. Seagrass community ecology[J]. Marine community ecology, 2001: 317-337.
[10] 张景平, 黄小平, 江志坚. 广西合浦不同类型海草床中大型底栖动物的差异性研究[C]//杭州: 国际遥感大会(ICRS)论文集, 2010. Zhang Jingping, Huang Xiaoping, Jiang Zhijian. Differences of benthic macrofauna community among three types of seagrass beds in Hepu Guangxi, South China[C]// Hangzhou: International Conference on Remote Sensing (ICRS)conference proceedings, 2010.
[11] 张才学, 孙省利, 陈春亮, 等. 流沙湾海草床海域浮游动物的群落结构和季节变化[J]. 海洋与湖沼, 2013, 44(05) : 1386-1394. Zhang Caixue, Sun Shengli, Chen Chunliang, et al. Community composition and seasonal changes of the zooplankton in the seaweed-field area of the Liusha Bay[J]. Oceanologia Et Limnologia Sinica, 2013, 44(05): 1386-1394.
[12] Xu Q, Guo D, Zhang P, et al. Seasonal variation in species composition and abundance of demersal fish and invertebrates in a Seagrass Natural Reserve on the eastern coast of the Shandong Peninsula, China[J]. Chinese Journal of Oceanology and Limnology, 2015: 1-12.
[13] 聂猛. 山东半岛典型海域大叶藻(L.)草场藻类群落结构的初步研究[D]. 青岛: 中国海洋大学, 2014. Nie Meng. Preliminary study on the structure of epiphytic and benthic algal community in the eelgrass () meadows of the typical coastal area of Shandong Peninsula[D]. Qingdao: Ocean University of China, 2014.
[14] 赵永强, 曾江宁, 陈全震, 等. 不同互花米草(Loisel)密度生境中大型底栖动物群落格局[J]. 自然资源学报, 2009, 24(4): 630-639. Zhao Yongqiang, Zeng Jiangning, Chen Quanzhen, et al. Community pattern of Macrozoobenthos in distinct habitats with different densities ofLoisel[J]. Journal of Natural Resources, 2009, 24(4): 630-639.
[15] 刘炳舰. 山东典型海湾大叶藻资源调查与生态恢复的基础研究[D]. 青岛: 中国科学院海洋研究所, 2012. Liu Bingjian. Foundational studies on resource investigation and ecological restoration of eelgrass in typical bays in Shandong[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2012.
[16] 刘静. 山东省荣成天鹅湖大叶藻间小型腹足类生物调查及分子学研究[D]. 青岛: 青岛大学, 2013. Liu Jing. Investigation and molecular research of small gastropods amongL. in the Swan Lake, Rongcheng, Shandong[D]. Qingdao: Qiingdao University, 2013.
[17] Fredriksen S, De Backer A, Boström C, et al. Infauna fromL. meadows in Norway. Differences in vegetated and unvegetated areas[J]. Marine biology research, 2010, 6(2): 189-200.
[18] Rueda J L, Salas C. Molluscs associated with a subtidalL. bed in southern Spain: Linking seasonal changes of fauna and environmental variables[J]. Estuarine, Coastal and Shelf Science, 2008, 79(1): 157-167.
[19] Sfriso A, Birkemeyer T, Ghetti P. Benthic macrofauna changes in areas of Venice lagoon populated by seagrasses or seaweeds[J]. Marine Environmental Research, 2001, 52(4): 323-349.
[20] Bologna P A. Assessing within habitat variability in plant demography, faunal density, and secondary production in an eelgrass (L.) bed[J]. Journal of experimental marine biology and ecology, 2006, 329(1): 122-134.
[21] Webster P, Rowden A, Attrill M. Effect of shoot density on the infaunal macro-invertebrate community within aL. Seagrass Bed[J]. Estuarine, Coastal and Shelf Science, 1998, 47(3): 351-357.
[22] 柯盛, 申玉春, 谢恩义, 等. 雷州半岛流沙湾潮间带底栖贝类多样性[J]. 生物多样性, 2013, 21(05): 547- 553. Ke Sheng, Shen Yuchun, Xie Enyi, et al. Biodiversity of the benthic shellfish in the intertidal zone of the Liusha Bay, Leizhou Peninsula [J]. Biodiversity Science, 2013, 21 (05): 547-553.
[23] Bologna P A, Heck K L. Impact of habitat edges on density and secondary production of seagrass-associated fauna[J]. Estuaries, 2002, 25(5): 1033-1044.
[24] Bologna P A, Heck K L. Impacts of seagrass habitat architecture on bivalve settlement[J]. Estuaries, 2000, 23(4): 449-457.
[25] Harris L D. Edge effects and conservation of biotic diversity[J]. Conservation Biology, 1988: 330-332.
[26] Honkoop P J, Berghuis E M, Holthuijsen S, et al. Molluscan assemblages of seagrass-covered and bare intertidal flats on the Banc d'Arguin, Mauritania, in relation to characteristics of sediment and organic matter[J]. Journal of Sea Research, 2008, 60(4): 255-263.
[27] 李宝泉, 李新正, 于海燕, 等. 胶州湾底栖软体动物与环境因子的关系[J]. 海洋与湖沼, 2005, 36(3): 193-198. Li Baoquan, Li Xinzheng, Yu Haiyan, et al. Macrobenthic mollusca fauna and its relations to environmental factors in Jiaozhou Bay[J]. Oceanologia Et Limnologia Sinica, 2005, 36(3): 193-198.
Spatio-temporal variations in benthic and macrobenthic molluscs in Swan Lake, Shandong, China
LIU Jian-ying, LI Wen-tao, QIN Le-zheng, ZHANG Xiu-mei
(College of Fisheries, Ocean University of China, Qingdao 266003, China)
To understand the community structure as well as the spatial and temporal distribution of macrobenthic molluscs at different microhabitats in Swan Lake, we investigated the molluscan community and environmental factors at four types of microhabitats (beds, bare area, edge ofLbeds, and interior ofLbeds) from December 2013 to November 2014. Fifteen molluscan species belonging to 14 families and 15 genera were recorded. The species composition, abundance, biomass, and biodiversity of molluscan communities exhibited significant differences among the transects but no clear difference among the seasons. The maximum abundance and biomass of molluscs were found in the bare area, whereas the minimum was found in the interior ofLbeds. The species diversity index of molluscs was higher in thebeds and internalbeds than in the other two transects. The dominant molluscs in the internalLbeds were gastropod grazers, such as,andHowever, bivalve molluscs were more likely to choose the bare area without vegetation or the edge ofLbeds with sparse seagrass. Comprehensive analysis revealed that the community structure and distribution of molluscs were closely related to seagrass, sediment characteristics, and water depth.
benthic macromolluscs; seagrass; microhabitats; spatio-temporal variations
Q958.15
A
1000-3096(2017)01-0113-10
10.11759/hykx20151022001
2016-05-15;
2016-08-12
国家自然科学基金项目(41576112); 国家科技支撑计划项目(2015BAD13B05)
刘建影(1990-), 女, 山东东营人, 硕士研究生, 主要从事资源增殖研究, 电话: 15684737660, E-mail: yingliu0707@163.com; 李文涛, 通信作者, 主要从事海草生理生态学研究, 电话: 13153221194, E-mail: liwentaoxy@hotmail.com
May 15, 2016
[Project Supported by the National Natural Science Foundation of the China, No.41576112; the National Science and Technology Support Program, No.2015BAD13B05]
(本文编辑: 梁德海)

