混合大孔树脂纯化海芦笋总黄酮工艺的研究
段筱杉, 张朝辉, 应 锐, 赵腾飞, 侯 虎, 赵 雪
混合大孔树脂纯化海芦笋总黄酮工艺的研究
段筱杉, 张朝辉, 应 锐, 赵腾飞, 侯 虎, 赵 雪
(中国海洋大学食品科学与工程学院, 山东青岛266003)
以黄酮的吸附率、解吸率和回收率作为主要评价指标, 对海芦笋(Torr)总黄酮的纯化工艺进行了研究。结果表明, 在5种大孔树脂中选取D101型、HPD600型两种树脂混合用于纯化, 最佳混合比例为3︰2。混合树脂对海芦笋黄酮的最佳纯化工艺参数为: 黄酮浓度为0.5 g/L时, pH为5的上样液以1.0 mL/min的上样流速进行吸附, 上样量最大为27BV。待吸附完全, 用4BV蒸馏水冲洗混合树脂柱后, 用8BV60%的乙醇溶液进行洗脱, 洗脱流速0.5 mL/min。采用该工艺纯化后, 海芦笋黄酮的纯度提高至45.91%±0.44%, 黄酮回收率为86.74%±0.46%, D101、HPD600混合树脂对海芦笋黄酮纯化效果良好, 可用于海芦笋总黄酮的纯化。
海芦笋(Torr); 黄酮; 混合树脂; 纯化
海芦笋(Torr)别名海蓬子、盐角草等, 是藜科(Chenopodiaeea)盐角草属(),茎高度肉质化, 有梗无叶的一年生真盐生植物, 其主要生长于海滩、盐沼、盐碱地。盐角草属植物在全世界范围存在30多个品种, 其中以欧洲海蓬子(L.)和北美海蓬子(Torr)、L.等研究最多。北美海蓬子于1999年引进到我国, 目前在江苏、浙江、福建等东南沿海地区都有较为广泛的栽培[1-3]。海芦笋不仅具有耐盐度高(5% NaCl)的优良生物学特性, 而且具有丰富的活性物质, 黄酮类、多糖、有机酸和三萜皂苷类为海芦笋的主要有效成分, 营养价值较高[4]。2004年Park等[5]在L.中鉴定出了异鼠李素3-O-β-D葡萄糖苷、槲皮素3-O-β-D葡萄糖苷, 为海芦笋中黄酮类化合物的研究提供了重要基础。
黄酮化合物又称类黄酮、黄酮体、黄碱素, 在植物的次生代谢过程中产生, 黄酮类化合物的基本结构是以2-苯基色原酮为母核, 多以苷的形式或游离态广泛存在于植物中[6]。黄酮类化合物不仅种类繁多结构复杂, 而且具有强而广的生物活性, 它在植物的抗菌防病等方面发挥着重要作用, 是茶[7]及银杏[8]、葛根[9]等植物的重要活性成分。黄酮类物质除了能够抑制和清除自由基, 是有效的抗氧化剂、自由基清除剂[10]外, 研究表明, 黄岑甙、芦丁对紫外线具有一定吸收作用[11], 杜仲叶黄酮被证明有良好的降血脂作用[12], 互花米草总黄酮被证明是一种免疫活性物质且可起到降血脂、降血糖的作用[13-14], 因此, 黄酮类化合物在医药、化妆品、食品等多个领域开发前景良好。目前国内对海芦笋黄酮的提取方法如回流法[15]、温浸法[16]、微波辅助提取法[17-18]已经有较为广泛的研究, 而在海芦笋黄酮纯化方面的相关报道较少, 徐青等[17]将AB-8与D101型树脂进行比较后, 选取AB-8型树脂对海芦笋黄酮的纯化工艺进行了研究, 树脂的选择范围较小。因此, 进一步研究并优化海芦笋总黄酮的纯化工艺对于海芦笋总黄酮的开发应用具有重要意义。
大孔吸附树脂是一类由人工合成的、具有多孔性的、有机高分子聚合物的吸附剂, 大孔树脂所具有的网状空穴结构产生分子筛作用, 以及它的极性基团所产生的吸附性, 使不同的化合物根据吸附力及分子质量大小可以在大孔树脂上经某种溶剂的洗脱实现分离纯化。近年来, 大孔吸附树脂因其稳定性良好, 比表面积大, 吸附、解吸迅速且条件温和, 吸附容量大再生方便, 可重复使用等优点[20-21], 广泛用于黄酮、皂甙等天然产物的分离纯化。本文将海芦笋黄酮粗提物作为纯化对象, 在5种不同类型的大孔树脂中, 通过静态吸附与解吸实验选取最适合海芦笋黄酮纯化用的大孔树脂, 并通过动态吸附及解吸实验研究了海芦笋总黄酮的大孔树脂纯化工艺条件, 为进一步开发利用海芦笋提供依据。
1 材料与方法
1.1 材料与试剂
海芦笋购于盐城绿苑盐土农业科技有限公司, 将海芦笋清净烘干后, 将海芦笋粉碎制成干粉备用。
芦丁标准品由南京替斯艾么中药研究所提供; 无水乙醇, HCl, NaNO2, Al(NO3)3, NaOH等均为国产分析纯; D101由Sigma公司生产, HPD600大孔吸附树脂由深蓝科技有限公司生产, DM130, D101-1, AB-8 大孔吸附树脂由安徽三星树脂科技有限公司生产。
1.2 仪器与设备
HY-881-2型电热鼓风干燥箱, 苏州市豪悦电热设备制造厂; UV-2100型紫外可见分光光度计, 尤尼柯(上海)仪器有限公司; 低温高速离心机, Sigma公司; SHA-B 恒温振荡器, 江苏常州国华电器有限公司; pH计, 上海精密科学仪器有限公司; AL204 电子天平, 梅特勒托利多(上海)有限责任公司; 蠕动泵, 保定兰格恒流泵有限公司; 真空冷冻干燥机, 北京思达兴业仪器有限公司; BSZ-100 自动部分收集器, 上海青浦泸西仪器制造厂。
1.3 实验方法
1.3.1 海芦笋总黄酮溶液的制备
准确称取适量海芦笋干粉, 以65%的乙醇溶液为提取溶剂, 按照1︰60(g/mL)的料液比, 于35℃提取2次, 每次3.5 h, 以7 000 r/min的转速离心后, 取上清液, 旋转蒸发除尽溶液中的乙醇后, 冷冻干燥, 备用。
1.3.2 海芦笋中黄酮含量的测定
1.3.2.1 标准曲线的绘制[22]
将10.00 mg芦丁标准品以95%乙醇溶液充分溶解, 室温下定容至50 mL, 摇匀, 即得浓度为0.2 g/L。采用NaNO2-Al(NO3)3-NaOH比色法在510 nm波长下测定不同浓度的芦丁标准品溶液的, 以浓度(g/L)为横坐标绘制标准曲线, OD值为纵坐标, 得到回归方程和相关系数为:
=6.177 4+0.001,2=0.999 7 (1)
1.3.2.2 样品溶液中黄酮浓度的测定
准确移取适量样品溶液置于10 mL比色管内, 以标准曲线的测定方法显色后, 测定OD值, 带入回归方程计算样品溶液中黄酮的质量浓度。
1.3.2.3 样品纯度的测定
准确称取适量冻干样品(精确至0.1 mg), 配制成溶液后, 取一定量溶液按照标准曲线的测定方法显色并测定吸光值, 计算样品中的黄酮含量, 并按照式(2)计算冻干样品中总黄酮的纯度。
纯度(%)=/×100 (2)
式中:为液体中黄酮的质量浓度(g/L);为液体的体积(mL);为称取的冻干样品的质量(mg)。
1.3.3 大孔树脂的预处理[21]
分别将AB-8型、D101型、D101-1型、DM130型、HPD600型5种大孔吸附树脂置于无水乙醇溶液中浸泡至充分溶胀后湿法装柱, 经2BV的95%乙醇溶液淋洗后, 用蒸馏水将其淋洗直至没有醇味, 之后用2BV的5%HCl溶液淋洗树脂, 用蒸馏水冲洗至中性, 再用2BV的5%NaoH溶液淋洗, 蒸馏水冲洗至中性, 待用。
1.3.4 大孔树脂的筛选
取等量且经预处理好的5种大孔树脂置于锥形瓶中, 移取等体积的已知黄酮含量的海芦笋黄酮溶液, 于恒温(25℃)下吸附饱和后取出, 移取等量上层样液测定其中的黄酮浓度。将剩余样液滤去后用蒸馏水充分洗涤去除残留样液后过滤, 参考文献[22]以乙醇溶液作为洗脱剂, 分别加入等体积90%乙醇溶液, 25℃恒温水浴振荡解吸, 24 h后测定洗脱液中的黄酮浓度, 并计算5种大孔树脂对海芦笋黄酮的吸附率和解吸率, 计算公式如下:
吸附量(mg/g)=(0-1)1(3)
吸附率(%)=(01)0×100 (4)
解吸量(mg/g)=22/M (5)
解吸率(%)=22/(0–1)1×100 (6)
公式(3)至(6)中,0为上样溶液初始质量浓度(g/L);1为吸附饱和后上层样液的黄酮浓度(g/L);2为洗脱液黄酮浓度(g/L);1为上样溶液体积(mL);2为洗脱液体积(mL);为大孔树脂质量(g)。
1.3.5 大孔树脂混合比例的确定
根据上述筛选实验结果将树脂按不同质量比例均匀混合后, 分别取等量树脂置于具塞锥形瓶中, 同1.3.3相同处理后, 分别计算不同混合比例的树脂对海芦笋黄酮的吸附率、解吸率及黄酮回收率。
黄酮回收率(%)=22/01×100 (7)
式中,0为上样溶液初始黄酮浓度(g/L);2为洗脱液黄酮浓度(g/L);1为上样溶液体积(mL);2为洗脱液体积(mL)。
1.3.6 混合大孔树脂吸附及解吸条件的研究[23-27]
对最佳比例的混合大孔树脂纯化海芦笋黄酮的工艺条件进行研究, 通过静态吸附实验, 考察上样液的不同pH(3、4、5、6、7)、黄酮质量浓度(0.5、1.0、1.5、2.0、2.5 g/L)对混合大孔树脂黄酮吸附率的影响。将混合树脂湿法装柱(直径1.1 cm, 柱高20 cm), 径高比1︰8, 确保没有气泡后动态上样, 考察不同上样流速(0.5、1.0、1.5、2.0 mL/min)对动态吸附率的影响, 确定动态吸附的最大上样体积。取等体积、黄酮浓度相同的上样溶液以一定上样流速动态吸附后, 用一定体积蒸馏水动态冲洗残留液后, 考察不同浓度洗脱剂(50%、60%、70%、80%、90%乙醇)、洗脱流速(0.5、1、1.5、2 mL/min)对动态解吸率的影响, 确定最大洗脱体积。
1.4 验证实验
按最佳上样及洗脱条件对海芦笋总黄酮进行纯化, 按上述公式分别计算纯化后海芦笋黄酮的回收率以及干品中黄酮的纯度。
1.5 数据统计分析
本实验所有数据均以平均值±标准差表示, 每组试验重复 3次, 采用SPSS软件对实验结果进行方差分析。
2 结果与分析
2.1 5种大孔树脂的静态吸附与解吸实验结果
AB-8型、D101型、D101-1型、DM130型、HPD600型5种大孔树脂对海芦笋总黄酮的吸附与解吸结果如表1所示。

表1 5种大孔树脂对海芦笋总黄酮的静态吸附与解吸结果
注: 与HPD600相比, 吸附率*<0.05、**<0.01, 吸附量◇<0.05、◇◇<0.01; 与D101相比, 解吸率#<0.05、##<0.01, 解吸量△<0.05、△△<0.01。
在上样溶液黄酮含量相同、树脂用量相同的情况下, 由于这5种大孔树脂的比表面积、平均孔径、极性不同, 对海芦笋总黄酮的吸附与解吸能力也不同。由表1可见, 5种树脂对海芦笋黄酮的吸附能力顺序为: HPD600>AB-8>D101>D101-1>DM130, 其中HPD600型大孔树脂对海芦笋黄酮的吸附效果最佳(26.48 mg/g±0.34 mg/g), 显著高于D101-1、DM130,<0.01, 但与AB-8、D101相比没有显著差异,>0.05。这可能是因为海芦笋总黄酮具有一定极性, 根据大孔树脂的吸附特性, 极性、弱极性树脂对其具有较好的吸附效果, 而以上5种树脂中, AB-8型树脂作为弱极性树脂, HPD600型树脂为极性树脂, 这两种树脂对海芦笋黄酮的吸附率较其他几种高。5种树脂对黄酮的解吸性能顺序为: D101>HPD600> DM130>D101-1>AB-8, 其中D101型大孔树脂的黄酮解吸率显著高于其余四种大孔树脂(<0.01), 达98.70%±1.00%, 可能是因为D101型大孔树脂的比表面积和孔径的疏水性比其他树脂更强, 因此, 吸附在表面海芦笋黄酮解吸更容易[28]。由实验结果可知, 5种树脂中, D101型大孔树脂与HPD600型大孔树脂的黄酮回收量最大, 最适于海芦笋黄酮的纯化, 因此, 将这两种树脂按一定质量比例混合对海芦笋黄酮进行吸附与解吸。
2.2 不同混合比例的树脂的静态吸附与解吸实验结果
由表2可以得知, 将D101型树脂与HPD600型树脂按照不同质量比例混合后, 对海芦笋黄酮的吸附效率顺序为: 3︰2>1︰1>2︰3>0︰1>1︰0, 解吸效率排序为: 3︰2>2︰3>1︰1>1︰0>0︰1。因此, 当D101︰HPD600=3︰2时, 对海芦笋黄酮的吸附率、解吸率最高, 分别为92.13%±0.29%, 99.38%±0.50%, 同时对海芦笋黄酮的回收率也最高, 达91.36%±0.75%。由此可知, 当质量比例为D101︰HPD600=3︰2时最适合用于海芦笋总黄酮的分离纯化。

表2 不同混合比例树脂对海芦笋总黄酮的静态吸附与解吸结果
注: 与3︰2相比, 吸附率*<0.05、**<0.01, 解吸率#<0.05、##<0.01, 回收率△<0.05、△△<0.01。
2.3 不同因素对混合树脂纯化海芦笋总黄酮的影响
2.3.1 上样液pH对混合树脂静态吸附率的影响
将等体积、相同黄酮含量的上样溶液调节pH分别为3、4、5、6、7后, 加入1.0 g混合好的树脂, 其黄酮吸附效果如图1所示。实验结果表明, pH值对吸附率的的影响较大, 当pH=5时, 黄酮吸附率最大, 且与其他pH组差异显著(<0.01), 这可能由于黄酮类化合物是多羟基酚类, 为弱酸性, 当酸性条件时呈分子状态, 更容易以氢键形式与树脂结合。当pH>5时, 随着pH升高, 黄酮酚羟基上的H易解离成酸根离子, 不易与树脂结合, 吸附率降低。当pH<5时, 随pH降低, 黄酮易形成烊盐, 不利于大孔树脂的吸附[29]。
2.3.2 上样液黄酮浓度对混合树脂静态吸附率的影响
分别配制等体积上样液, 黄酮质量浓度为0.5、1.0、1.5、2.0、2.5 g/L, 将pH调至5, 加入等量混合树脂, 其静态吸附结果图2所示, 当上样液黄酮浓度在0.5~1.0 g/L时, 树脂对海芦笋黄酮的吸附率最高, 随着黄酮浓度升高, 由于上样液质量浓度过高, 杂质造成大孔树脂表面堵塞, 使树脂的黄酮吸附率呈现下降趋势[23]。由方差分析可知, 浓度为0.5 g/L和1.0 g/L时, 吸附率差异不显著, 因此参考黄酮回收率作为选择指标, 当上样液黄酮浓度为0.5 g/L时, 黄酮的回收率最高(<0.05), 由此可见, 上样液浓度以0.5 g/L最为适宜。
2.3.3 上样流速对混合树脂动态吸附率的影响
上样流速对混合树脂动态吸附效率的影响如图3所示。取等量的pH=5、黄酮浓度相同的上样液分别以0.5、1、1.5、2 mL/min动态上样, 计算吸附率。实验结果表明, 随着上样液流速增大, 混合树脂对海芦笋黄酮的动态吸附率降低。因为, 在较慢的流速下, 上样液与黄酮能够更加充分的接触、吸附, 吸附率就高, 反之, 流速升高, 溶液中的黄酮尚未被吸附就被冲走, 吸附率下降[28]。因此当流速为0.5 mL/min时, 吸附效果最佳(<0.05), 但同时, 由于流速较慢, 纯化周期随之延长, 因此选择1 mL/min作为最适上样流速, 在不影响吸附率的前提下缩短了纯化时间。
2.3.4 最大上样量的确定
取一定体积的海芦笋总黄酮溶液(黄酮浓度0.5 g/L),以1 mL/min的上样流速动态上样(树脂约6.5 g), 每8 mL(1BV)为一份进行收集, 共31份, 收集结束后, 比色法测定每份收集液中的黄酮质量浓度, 以此绘制黄酮泄露曲线, 实验结果如图4所示。
上样液体积在5~44 mL时, 流出液黄酮浓度增大较快, 当上样溶液体积在45~170 mL时, 流出液的黄酮浓度增加缓慢, 上样液体积在170~218 mL时, 流出液黄酮浓度基本不变, 当上样量大于218 mL后, 流出液中黄酮浓度开始迅速增加, 不适合继续上样[30]。由此可知, 当上样量为218 mL(27BV)时, 混合树脂对海芦笋黄酮的吸附量趋近饱和, 因此27BV为最大上样体积, 此时树脂吸附量为16.8 mg/g。
2.3.5 洗脱剂浓度对混合树脂动态解吸率的影响
黄酮类化合物易溶于甲醇、乙醇溶液等低级醇溶液中, 在选择洗脱剂时, 考虑到在乙醇溶液中的黄酮溶解度较大, 易于从树脂上将其洗脱下来, 且可回收、毒性低[31],因此按上述实验确定的吸附条件,取适量且相同的上样液分别动态上样后, 以4BV蒸馏水动态冲洗树脂间残留液后, 将等体积的50%、60%、70%、80%、90%的乙醇溶液作为洗脱剂以相同的流速对树脂进行洗脱, 实验结果见图5。
由图5可知, 当洗脱剂浓度为60%时, 黄酮的解吸率最高, 与其余洗脱剂浓度条件相比, 差异较为显著(<0.05)。当浓度大于60%时, 随着浓度增大, 解吸率降低, 这可能是因为60%的乙醇溶液的极性与海芦笋黄酮更接近, 根据相似相溶原理, 海芦笋黄酮在60%的乙醇溶液中溶解度较高, 以其作为洗脱剂能够最大程度的将吸附在大孔树脂表面的黄酮洗脱下来[32]。而且更高浓度的洗脱剂浪费溶剂, 增大成本。因此采用60%的乙醇溶液作为洗脱剂。
2.3.6 洗脱流速对混合树脂动态解吸率的影响
按照上述确定的最优吸附条件分别动态上样后, 用4BV蒸馏水以2 mL/min的流速冲洗上样残留液, 收集所有流出液以计算树脂的吸附量。取等体积的、60%的乙醇溶液, 以0.5、1、1.5、2 mL/min的流速分别对吸附后的树脂进行洗脱, 收集洗脱液, 测定黄酮浓度, 计算其解吸率。
如图6所示, 随着洗脱流速的升高, 树脂的解吸率逐渐下降。这可能是因为, 在较慢的流速下, 树脂与洗脱剂有更加充分的接触, 树脂上吸附的黄酮能够更多的溶解到洗脱剂中, 因此以0.5 mL/min作为洗脱流速。
另外, 由图6可知, 混合大孔树脂对海芦笋黄酮的解吸率明显高于AB-8型大孔树脂对海芦笋黄酮的纯化工艺中的最大解吸率(85.25%), 因此混合大孔树脂比AB-8更适于纯化海芦笋黄酮[17]。
2.3.7 最佳洗脱体积的确定
以最大的上样量按照上述的最佳吸附条件上样, 使得树脂吸附饱和后, 再以1 mL/min的洗脱流速, 用一定量60%的乙醇溶液进行洗脱, 对洗脱液每1BV收集为一段, 总共21BV, 测定每段收集液中黄酮的浓度, 以此绘制动态解吸曲线, 结果见图7。
以60%乙醇进行洗脱, 图7中峰形集中, 无拖尾, 当洗脱剂的用量为3BV时, 洗脱液中的黄酮浓度达到最高点, 之后, 随着洗脱剂用量增加, 黄酮浓度降低, 当用量为8BV时, 树脂上的黄酮基本被洗脱下来, 洗脱液中黄酮浓度趋近于0, 继续增加洗脱剂用量, 黄酮浓度不再变化, 浪费洗脱剂。因此, 选择8BV作为最佳洗脱体积[32]。
2.4 验证实验结果
取黄酮浓度为0.5 g/L、pH=5的上样液50 mL, 根据上述所得的最佳吸附体条件样后, 以2 mL/min的流速用4BV的蒸馏水冲洗树脂。再按照得到的最佳解吸条件进行洗脱。纯化结束后, 测定洗脱液中黄酮含量, 计算回收率, 制得黄酮干品后, 计算黄酮纯度, 结果见表3。结果表明, 经混合大孔树脂纯化后海芦笋总黄酮的纯度提高较大, 由10.13%±0.72%增至45.91%±0.44%, 黄酮回收率较高, 说明混合树脂适于海芦笋黄酮的分离纯化, 因此, 可利用此方法对海芦笋黄酮进行两次纯化, 进一步用于研究海芦笋的生理活性以及实际应用。
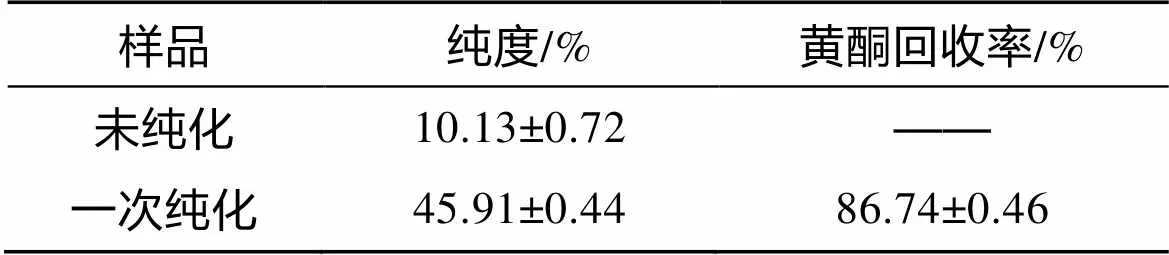
表3 纯化后样品的黄酮回收率与纯度
3 结论
1) 本实验研究了海芦笋总黄酮的大孔树脂纯化工艺, 通过静态实验在5种黄酮纯化常用树脂中挑选出两种——HPD600型、D101型大孔树脂混合后用于纯化。
2) 最佳纯化条件为: 将D101、HPD600按照质量比为3︰2进行混合后, 湿法装柱, 对海芦笋黄酮进行动态纯化, 在上样液黄酮质量浓度0.5 g/L, pH值为5, 上样流速为1.0 mL/min的条件下进行吸附, 上样量最大为27BV。吸附完全后, 以4BV蒸馏水按2 mL/min的流速冲洗残留液, 之后以0.5 mL/min的流速, 用60%的乙醇溶液进行洗脱, 最佳洗脱体积为8BV。
3) 纯化后样品中总黄酮的含量由10.13%± 0.72%增至45.91%±0.44%, 提高了3倍, 黄酮回收率为86.74%±0.46%。此法简便可行, 成本较低, 且工艺重复性良好, 适用于实际生产, 且与已有的海芦笋黄酮AB-8型大孔树脂纯化工艺相比, 黄酮解吸率、回收率更高。
[1] 张晶晶. 海蓬子水溶性成分分离及体外抗氧化能力的研究[D]. 南京: 南京农业大学, 2011. Zhang Jingjing. Water-soluble constituents and in vitro antioxidative ability of[D]. Nanjing: Nanjing Agricultural University, 2011.
[2] 王楠. 海蓬子标准组分制备及其物质基础研究[D]. 青岛: 中国海洋大学, 2014. Wang Nan. The preparation of the standard components and the studyof the meterial base of the Salicornia bigelovii Torr.[D]. Qingdao: Ocean University of China, 2014.
[3] 衣华鹏, 张鹏宴, 毕继胜, 等. 莱州湾东岸海水入侵对生态环境的影响[J]. 海洋科学, 2010, 34(1): 29-34. Yi Huapeng, Zhang Pengyan, Bi Jisheng, et al. The influence of seawater intrusion on ecological environment in the eastern coast of Laizhou Bay[J]. Marine Sciences, 2010, 34(1): 29-34.
[4] 管福琴, 单宇, 赵友谊, 等. 海蓬子属植物药理活性及其作用机制研究进展[J]. 中国药理学通报, 2013, 9: 1188-1191. Guan Fuqin, Shan Yu, Zhao Youyi, et al. Research development on pharmacological activities and mechanism of Salicornia plants[J]. Chinese Pharmacological Bulletin, 2013, 9: 1188-1191.
[5] Park S H, Kim K S. Isolation and Identification of Antioxidant Flavonoids from Salicornia herbacea L[J]. Journal of the Korean Society for Applied Biological Chemistry, 2004, 124(5): 1029-1036.
[6] Morimoto M, Tanimoto K, Nakano S, et al. Insect antifeedant activity of flavones and chromones against Spodoptera litura[J]. Journal of agricultural and food chemistry, 2003, 51(2): 389-393.
[7] 吕娜, 张伟臻, 陈林龙, 等. 安吉白茶黄酮抗氧化活性的体外实验研究[J]. 毒理学杂志, 2014, 28(5): 389-392. Lü Na, Zhang Weizhen, Chen Linlong, et al. Antioxidant activityexperimental study of Anji white tea flavonoids in vitro[J]. Journal of Toxicology, 2014, 28(5): 389-392.
[8] Nishida S, Satoh H. Comparative vasodilating actions among terpenoids and flavonoids contained in Ginkgo biloba extract[J]. Clinica Chimica Acta, 2004, 339(1): 129-133.
[9] 张喜梅, 李琳, 陈玲, 等. 葛根总黄酮提取工艺研究[J]. 现代食品科技, 2008, 24(1): 42-45. Zhang Ximei, Li Lin, Chen Ling, et al.Study on the extaction of total flavones fromOhwi[J]. Modern Food Science and Technology, 2008, 24(1): 42-45.
[10] 乌兰格日乐, 白海泉, 翁慧. 黄酮的抗氧化活性研究进展[J]. 内蒙古民族大学学报(自然科学版), 2008, 23(3): 277-280.Wulangerile1, Bai Haiquan , Weng Hui. Research progresses for antioxidation of Flavones[J]. Journal of Inner Mongolia University for Nationalities, 2008, 23(3): 277-280.
[11] 何西利, 傅清, 赵桂兰, 等. 芦丁—黄芩苷防硒霜的研制及性能评价[J]. 西北药学杂志, 1998, 13(6): 257-258. He Xili, Fu Qing, Zhao Guilan, et al. Evaluation and preparation of rutin-baicalei-7-glucuromide protective cream for sunburn[J]. Northwest Pharmaceutical Journal, 1998, 13(6): 257-258.
[12] 刘静, 濮智颖, 李爱玲, 等. 杜仲叶黄酮降血脂及抗氧化作用的研究[J]. 安徽农业科学, 2010(11): 5631- 5632.Liu Jing, Pu Zhiying, Li Ailing, et al. Study on the reducing blood lipid and antioxidition effects of flavonoids from Eucommia ulmiodes Oliver Leaves[J]. Journal of Anhui Agricultural Sciences, 2010(11): 5631-5632.
[13] 胡芝华, 钦佩, 蔡鸣, 等. 互花米草总黄酮降血脂作用研究[J]. 海洋科学, 1998, 22(2): 16-18. Hu Zhihu, Qin Pei, Cai Ming, et al. Effect of total flavonoids of spartina alterniflora on serum lipids in vivo[J]. Marine Sciences, 1998, (22)2: 16-18.
[14] 蔡鸣, 钦佩, 张康宣, 等. 互花米草总黄酮(TFS)与生物矿质液(BML)对小鼠血糖的影响[J]. 海洋科学, 1996, 20(4): 12-13. Cai Ming, Qin Pei, Zhang Kangxuan, et al. Effect of TFS and BMLon blood glucose in mice[J]. Marine Sciences, 1996, 20(4): 12-13.
[15] 孙庆庆, 商丽娟, 扶庆权, 等. 响应曲面法优化海蓬子茎叶总黄酮的提取工艺研究[J]. 食品工业科技, 2012, 33(10): 276-279.Sun Qingqing, Shang Lijuan, Fu Qingquan, et al. Optimization of total flavonoids extraction fromSalicornia Bigelovii torr by response surface methodology[J]. Science and Technology of Food Industry, 2012, 33(10): 276-279.
[16] 顾婕, 杨莉萍, 赵微加, 等. 海蓬子总黄酮提取工艺优化研究[J]. 时珍国医国药, 2009, 20(9): 2274-2275.Gu Jie, Yang Liping, Zhao Weijia, et al. Optimization of total flavonoids extraction fromSalicornia Bigelovii torr[J]. Lishizhen Medicine and Materia Medica Research, 2009, 20(9): 2274-2275.
[17] 俞稼, 徐青, 辛建美, 等. 微波辅助萃取海芦笋中总黄酮工艺的研究[J]. 中国生化药物杂志, 2011, 32(2): 122-125.Yu Jia, Xu Qing, Xin Jianmei, et al. Study on the extaction of total flavonoids from Sea Asparagus usingmicrowave-assisted extraction process[J]. Chinese Journal of Biochemical Pharmaceutics, 2011, 32(2): 122-125.
[18] 扶庆权, 周峰, 华春, 等. 微波辅助提取海蓬子总黄酮工艺的响应曲面法优化[J]. 南京师大学报: 自然科学版, 2013, 36(2): 96-103.Fu Qingquan, Zhou Feng, Hua Chun, et al.Microwave- assisted extractionof total flavonoids from Salicornia Bigelovii Torr. optimized by response surface methodology[J]. Journal of Nanjing Normal University (Natural Science Edition), 2013, 36(2): 96-103.
[19] 徐青, 卢莹莹, 辛建美, 等. 大孔树脂吸附分离海芦笋中黄酮类化合物工艺[J]. 食品科学, 2011, 32(2): 115-119.Xu Qing, Lu Yingying, Xin Jianmei, et al. Macroporous resin adsorption for the separation of Sea Asparagus flavonoids[J]. Food Science, 2011, 32(2): 115-119.
[20] 刘爱敬, 廖争争, 郭琳, 等. 大孔树脂纯化黄秋葵黄酮及其体外抗氢化活性研究[J]. 食品工业科技, 2015, 36(16): 284-288.Liu Aijing, Liao Zhengzheng, Guo Lin, et al. Purification technology of flavone from Abelmoschus esculentus (L.)Moench with macroporous resins and research of the antioxidant ability invitro[J]. Science and Technology of Food Industry, 2015, 36(16): 284-288.
[21] 孙京沙, 张朝辉. 大叶藻总黄酮的大孔树脂纯化工艺[J]. 食品科学, 2014, 14: 5-10.Sun Jingsha, Zhang Zhaohui. Purification of flavonoids fromL. by macroporous resin adsorption [J]. Food Science, 2014, 14: 5-10.
[22] 国家药典委员会.中国药典[M]. (2010版). 北京: 中国医药科技出版社, 2010: 120-121. National pharmacopoeia committee. The Chinese pharmacopoeia[M]. (2010 edition). Beijing: China Medical Science and Technology Press, 2010: 120-121.
[23] 杨喆, 万山, 张乔会, 等. 大孔树脂纯化山杏核壳总黄酮的工艺优化[J]. 食品科学, 2015, 10: 38-42. Yang Zhe, Wan Shan, Zhang Qiaohui, et al. Purification of total flavonoids from shells of Wild Apricot with macroreticular resin[J]. Food Science, 2015, 10: 38-42.
[24] 杨乐, 王洪新, 秦晓娟. 大孔树脂纯化笋壳中的黄酮物质[J]. 食品与生物技术学报, 2011, 30(2): 218-220.Yang Le, Wang Hongxin, Qin Xiaojuan. Purification of flavonoids from bamboo shellby macroprous absorbent resins[J]. Journal of Food Science and Biotechnology, 2011, 30(2): 218-220.
[25] 冯建华, 牛建峰, 黄爱优, 等. 基于R-藻红蛋白及硫酸多糖提取的次等紫菜综合利用技术[J]. 海洋科学, 2015, 39(12): 77-85. Feng Jianhua, Niu Jianfeng, Huang Aiyou, et al. Comprehensive extraction of R-Phycoerythrin and sulfated polysaccharide from Pyropia yezoensis (Bangiales, Rhodophyta)[J]. Marine Sciences, 2015, 39(12): 77-85.
[26] 何彦峰, 杨仁明, 胡娜, 等. 大孔吸附树脂纯化枸杞总黄酮的研究[J]. 食品工业科技, 2012, 33(18): 274- 278.He Yanfeng, Yang Renming, Hu Na, et al. Separation and purification of total flavonoids in Lycium barbarum L.from Qaidam Basin by macroporousresin[J]. Science and Technology of Food Industry, 2012, 33(18): 274- 278.
[27] 刘安军, 刘慧慧, 郭丹霄, 等. 大孔吸附树脂分离纯化枸杞叶总黄酮的研究[J]. 现代食品科技, 2012, 28(3): 292-296.Liu Anjun, Liu Huihui, Guo Danxiao, et al. Separation and purification of total flavones from Lycium barbarum Leaves by macroreticular resin[J]. Modern Food Science and Technology, 2012, 28(3): 292-296.
[28] 郑韵英, 韦藤幼. 大孔吸附树脂纯化荔枝壳总黄酮的工艺研究[J]. 食品工业科技, 2015, 36(18): 271-275.Zheng Yunying, Wei Tengyou. Purification technology research of total flavonoids in litchi pericarp by macroporous resin[J]. Science and Technology of Food Industry, 2015, 36(18): 271-275.
[29] 刘志祥, 曾超珍, 张玥. AB-8大孔树脂分离纯化枸骨叶总黄酮的工艺研究[J]. 食品科学, 2010(12): 76-79.Liu Zhixiang, Zeng Chaozhen, Zhang Yue. Using AB-8 macroporous resin for the separation and purification of total flavonoids fromFolium Ilicis Cornutae[J]. Food Science, 2010(12): 76-79.
[30] 汪璇, 张建新, 孙长江, 等. 大孔吸附树脂分离黄粉虫黄酮及其抗氧化活性研究[J]. 中国食品学报, 2014(1): 87-94.Wang Xuan, Zhang Jianxin, Sun Changjiang, et al. Macroporous adsorption resin for purification of total flavonoidsfrom Tenebrio Molitor and their antioxidant activity in vitro[J]. Journal of Chinese Institute of Food Science and Technology, 2014(1): 87-94.
[31] 李淑珍, 李进, 杨志江, 等. 大孔树脂分离纯化黑果枸杞总黄酮的研究[J]. 食品科学, 2009, 1: 19-24.Li Shuzhen, Li Jin, Yang Zhijiang, et al. Study on Separation and Purifiecation of total flavonoids fromMurr. with macroreticular resin[J]. Food Science, 2009, 1: 19-24.
[32] 叶春, 阚建全, 谭书明, 等. 鱼腥草叶总黄酮的提取分离[J]. 农业工程学报, 2008, 24(10): 227-232.Ye Chun, Kan Jianquan, Tan Shuming, et al. Extraction and separation of flavonoids from Houttuynia cordata Thunb. leaves[J]. Transactions of the CSAE, 2008, 2008, 24(10): 227-232.
Purification of total flavonoids fromTorrusingmixed macroporous resin
DUAN Xiao-shan, ZHANG Zhao-hui, YING Rui, ZHAO Teng-fei, HOU Hu, ZHAO Xue
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Westudied the purification technology of total flavonoids fromTorrusing adsorption, desorption, and recovery rates of flavonoids as the evaluationindices.D101 and HPD600 were selected from five types ofmacroporous resin for purification and were mixed in a ratio of 3︰2forpurification. We showed that the optimal purification conditions includeflavonoids concentration of sample (0.5 mg/mL), pH value (5), the flow rate (1 mL/min), and the maximum sample volume(27BV). After completeadsorption, themacroporousresin column was washed with 4BV distilled water with a flow rate of 2mL/min and eluted with 8BV60% alcohol and a flow rate of 0.5mL/min. We found that the purity of the sample increased to 45.91%±0.44% after purification, with a recovery rate of 86.74%±0.46%.Thus, the mixed resin improves purification outcome, and thistechnology can also be applied tothe purification oftotal flavonoids fromTorr
Torr; total flavonoids; mixed resin; purification
TS201.1
A
1000-3096(2017)01-0030-09
10.11759/hykx20160331001
2016-03-31;
2016-06-30
国家自然科学基金(31272705)
段筱杉(1992-), 女, 山东青岛人, 研究生, 研究方向: 海洋活性物质, 电话: 18766216072, E-mail: xiaoshanishare@163.com; 张朝辉(1968-), 通信作者, 男, 山东威海人, 副教授, 研究方向: 水产化学、海洋生物活性成分及水产品加工, E-mail: zhangzhh@ouc.edu.cn.
Mar. 31, 2016
[National Natural Science Foundation of China, No.31272705]
(本文编辑: 康亦兼)

