曲马多术后自控镇痛对胃癌患者静脉血Th细胞分化的影响
程旭东,唐华东,邵浙明,陈 义
(浙江新安国际医院麻醉科,浙江嘉兴 314001)
·经验交流·
曲马多术后自控镇痛对胃癌患者静脉血Th细胞分化的影响
程旭东,唐华东,邵浙明,陈 义
(浙江新安国际医院麻醉科,浙江嘉兴 314001)
[摘要] 目的 探讨曲马多术后自控镇痛对胃癌患者静脉血辅助性T淋巴细胞(Th)分化的影响。方法 将166例胃癌患者分为观察组(85例)和对照组(81例),两组术后均行患者自控静脉镇痛(PCIA),观察组所用药物为曲马多,对照组使用芬太尼。采用视觉模拟评分法(VAS)和舒适度评分(BCS)评价术后PCIA的效果。采用流式细胞仪检测外周血单个核细胞(PBMCs)中Th1、Th2细胞。结果 两组患者术后12、48 h的VAS评分均比术后4 h时明显下降(P<0.05);两组患者术后48 h的BCS评分均明显升高(P<0.05);两组患者同期VAS、BCS评分比较,差异均无统计学意义(P>0.05)。两组患者术后的Th1细胞百分率、Th1/Th2比术毕时均明显下降(P<0.05);两组术后的Th2细胞百分率比术毕时明显升高(P<0.05);两组患者术后4、48 h的Th1、Th2细胞百分率及Th1/Th2比较,差异均有统计学意义(P<0.05)。观察组不良反应发生率为7.06%(6/85),对照组为8.64%(7/81),两组比较差异无统计学意义(χ2=0.144,P>0.05)。结论 胃癌患者术后采用曲马多PCIA的镇痛效果明显,可促进Th细胞分化平衡,改善患者的免疫抑制状态。
曲马多;镇痛,患者控制;胃肿瘤;疼痛,手术后;T淋巴细胞,辅助诱导
大量临床研究表明,胃癌患者会出现不同程度的免疫机能低下[1-2]。长期处于免疫机能低下状态可引起恶性肿瘤的进展与转移,对胃癌术后患者的康复不利。在胃癌围术期尤其是术后出现的免疫功能低下往往与手术创伤、术后疼痛、肿瘤扩散及转移、术后感染等因素有关联[3-4]。而术后使用的麻醉药物也可对患者的机体免疫功能产生影响,例如,芬太尼即有一定的免疫抑制作用[5]。曲马多是一种新型的镇痛药物,其安全性较高,可用于多种疾病的术后患者自控镇痛[6],曲马多仍有一定的免疫抑制作用,但其对辅助性T淋巴细胞(T helper lymphocyte,Th)的作用尚未完全明晰。为了了解曲马多术后自控镇痛对胃癌患者静脉血Th细胞分化的影响,为该疾病的术后镇痛选择合适的麻醉药物,本文分析166例胃癌术后患者的临床资料,现报道如下。
1 资料与方法
1.1 一般资料 选取2012年1月至2016年6月本院收治的胃癌患者166例,男87例,女79例;年龄34~79岁,平均 (61.5±8.4)岁。所有患者均符合美国国家综合癌症网络(NCCN)制订的胃癌诊断标准,美国麻醉医师协会(ASA)分级均为Ⅰ级,术前3 d内未应用芬太尼、曲马多与糖皮质激素药物,未输血,所有病例均在全身静脉麻醉下行择期胃癌根治术。排除标准:自身免疫性疾病、肝肾功能不全、2型糖尿病、其他部位肿瘤、严重全身性感染等疾病。所有患者均知情同意,本研究经医院医学伦理委员会通过。将166例患者分为观察组85例和对照组81例,两组患者性别、年龄、体质量指数、手术时间等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 麻醉方法 患者入室后常规静脉输液扩容,静脉给予盐酸戊奎醚1.00 mg。麻醉诱导给予咪达唑仑1.00 mg,罗库溴铵1.00 mg/kg,丙泊酚2.00 mg/kg和芬太尼4.00 μg/kg。麻醉维持阶段全凭静脉麻醉,用微量泵持续给予丙泊酚4.00~5.00 mg·kg-1·h-1,瑞芬太尼0.15~2.00 μg·kg-1·min-1,罗库溴铵0.50 mg·kg-1·h-1。术中监测心率、有创血压、呼气末CO2浓度与血氧饱和度。术毕以电子镇痛泵行患者自控静脉镇痛(PCIA),其中,观察组给予盐酸曲马多注射液(2 mL:50.00 mg,浙江医药股份有限公司新昌制药厂),静脉注射负荷剂量为2.00 mg/kg,连接电子镇痛泵,锁定时间15 min,背景输注量20.00 mg/h,患者自控镇痛剂量20.00 mg;对照组给予芬太尼注射液(10 mL:0.50 mg,江苏恩华制药有限公司),静脉注射负荷剂量0.20 μg/kg,锁定时间15 min,背景输注0.40 μg·kg-1·h-1,患者自控镇痛剂量5.00 μg。两组患者均术后48 h停用PCIA。
1.2.2 镇痛效果评价 评价两组患者术后PCIA的效果采用视觉模拟评分法(VAS)和舒适度评分(BCS)。VAS评分分值为0~10分,分值越高表示疼痛程度越高;0分为无痛感;1~3分为镇痛良好;>3~5分为镇痛效果基本满意;>5~9分为镇痛效果差;>9~10分为剧痛。BCS评分越高表示疼痛程度越低;0分为持续疼痛;1分为安静时无痛,咳嗽或深呼吸时疼痛严重;>1~2分为平卧安静时无痛,咳嗽或深呼吸时轻微疼痛;>2~3分为深呼吸时亦无痛;>3~4分为咳嗽时亦无痛。
1.2.3 检验方法 在麻醉前、术毕时、术后48 h采集外周静脉血,肝素抗凝后立即送检。在抗凝血样品中加入三色单克隆抗体,避光放置30 min后加入溶血素,离心稀释,采用淋巴细胞分离液(等渗溶液)密度梯度离心法分离出外周血单个核细胞(PBMCs),采用流式细胞仪(美国Becton Dickinson公司)检测PBMCs中Th1、Th2细胞。将CD4+CCR5+作为Th1细胞标识物,将CD4+CCR3+作为Th2细胞标识物。统计2.0×104个淋巴细胞中的Th1与Th2细胞的百分比及Th1与Th2细胞数量的比值(Th1/Th2)。

2 结 果
2.1 两组患者镇痛效果比较 与术后4 h时比较,两组患者术后12、48 h的VAS评分均明显下降,差异均有统计学意义(t=2.292、3.013、1.863、2.891,P<0.05);两组患者术后48 h
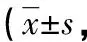
表1 两组患者术后VAS、BCS评分比较分)
a:P<0.05,与本组术后4 h比较。

表2 两组患者Th1、Th2细胞百分率和
a:P<0.05,与同组术毕时比较;b:P<0.05,与对照组同期比较。
的BCS评分明显升高,差异均有统计学意义(t=3.691、2.842,P<0.05),术后12 h的BCS评分差异无统计学意义(t=0.155、0.785,P>0.05);在PCIA期间,两组患者同期VAS、BCS评分比较,差异均无统计学意义(P>0.05),见表1。
2.2 两组患者Th1、Th2细胞百分率和Th1/Th2比较 术毕时,两组患者Th1、Th2细胞百分率、Th1/Th2比较,差异无统计学意义(t=1.901、1.344、1.604,P>0.05)。与术毕时比较,两组患者术后4、48 h的Th1细胞百分率、Th1/Th2比明显下降,差异均有统计学意义(t=13.755、25.416、6.991、11.215、27.513、38.382、11.558、18.221,P<0.05);两组患者术后的Th2细胞百分率比术毕时明显升高,差异均有统计学意义(t=9.267、13.287,P<0.05);两组患者术后4、48 h的Th1、Th2细胞百分率、Th1/Th2比较,差异均有统计学意义(t=5.458、11.088、11.606、10.120、15.249、21.121,P<0.05),见表2。
2.3 两组患者不良反应比较 两组患者在PCIA期间出现的药物不良反应,均通过对症治疗后症状缓解或消失,无病例出现过度镇静和呼吸抑制,无中断用药。观察组出现恶心2例,嗜睡2例,皮肤瘙痒2例,不良反应发生率7.06%(6/85);对照组出现恶心1例,呕吐1例,嗜睡2例,皮肤瘙痒3例,不良反应发生率8.64%(7/81);观察组不良反应发生率低于对照组,但差异无统计学意义(χ2=0.144,P>0.05)。
3 讨 论
胃癌作为一种临床常见的恶性肿瘤,其发病、进展、转移等阶段都伴随着机体免疫状态的改变,在抗肿瘤的免疫效应过程中,Th与自然杀伤细胞(NK)的细胞免疫发挥主要的免疫作用。胃癌患者的机体免疫机能比健康人群低,研究表明胃癌患者的CD3+、CD4+、CD4+/CD8+水平均明显低于健康人,CD8+水平明显高于健康人[7]。在胃癌的围术期会出现一定的免疫抑制效应,这引起研究者的广泛关注[8]。其中,胃癌术后产生的疼痛和手术造成的创伤相同,均是复杂的机体应激反应,其主要原因在于胃癌术后疼痛会激活中枢神经系统的下丘脑-垂体-肾上腺轴与交感神经系统,从而抑制机体的免疫状态。研究发现术后疼痛可抑制体内Th的增殖速率,并明显降低NK的免疫活性,还会增加术后感染的发生机会,促进恶性肿瘤的进展与转移[9-11]。
由于胃癌术后的疼痛可造成患者机体的免疫抑制状态,则术后应用适宜的镇痛药物可减轻疼痛应激所致的免疫抑制。在胃癌术后采用芬太尼与曲马多PCIA,均能有效减轻术后疼痛,但两组胃癌患者之间的VAS、BCS评分比较,差异均无统计学意义(P>0.05)。因此,可以排除术后疼痛程度差异对患者免疫机能和Th细胞分化的影响。
Th细胞各个亚型对保持机体免疫平衡的有十分重要,Th1、Th2细胞均由前体细胞Th0细胞分化而来,Th1、Th2细胞之间的交叉调节发挥着主要作用[12]。Th1细胞可分泌白细胞介素(IL)-2、干扰素-γ(IFN-γ)及肿瘤坏死因子-β等,介导细胞毒与局部炎症相关的免疫应答,并辅助抗体的生成,主要参与细胞免疫过程与迟发型超敏性炎症。Th2细胞可分泌IL-4、IL-5、IL-6及IL-10等,刺激B淋巴细胞增殖,产生免疫球蛋白G与免疫球蛋白E,主要参与体液免疫。健康人群的Th1/Th2比值约为1∶2。恶性肿瘤患者的机体处于免疫逃逸状态,其细胞免疫与体液免疫状态严重失衡,因而Th1/Th2比例失衡[13-14]。Th细胞亚型的检测较为困难,很难精确测定,传统方法通常采用IL-2与IFN-γ水平代表Th1细胞,采用IL-4与IL-10水平代表Th2细胞,但方法的灵敏性不高,存在一定的局限性。近年来发展的三色流式细胞技术可在单个细胞的水平上测试胞内细胞因子水平,并可同时测试多种细胞内因子,该方法灵敏性高、特异性强[15]。Th0细胞分化过程中会特异性表达CCR3、CCR5趋化因子受体,其中,Th1细胞表面高表达CCR5,而Th2细胞表面则高表达CCR3,因此可以采用细胞的CCR5、CCR3分别代表Th1、Th2细胞,这种新型细胞标志物的检测方法比传统方法更有特异性和准确性。
本研究通过分离新鲜外周静脉血中的PBMCs,再荧光标记,采用流式细胞仪检测CD4+CCR5+与CD4+CCR3+细胞的百分率,即可获知Th1与Th2细胞的百分率,这种检测方法通过新的细胞因子分析出麻醉镇痛药曲马多、芬太尼对胃癌术后患者T细胞亚群分化的影响。结果可见,术毕时患者的Th1、Th2细胞百分率差异无统计学意义(P>0.05),因而排除麻醉方法对研究结果的误差。术后PCIA后,患者的Th0细胞向Th2分化更多,而向Th1细胞分化更少,这使得Th1/Th2比值趋于正常,Th1、Th2细胞的分化趋于平衡。同时,与芬太尼相比,采用曲马多术后PCIA时Th0细胞向Th2细胞分化更占优势,Th1、Th2细胞的分化更为平衡。这是由于Th0细胞的分化过程受到细胞因子的调控,曲马多介导的Th0细胞向Th2细胞分化的机制和细胞趋化因子CCR3水平的增多有密切的联系。因此,胃癌术后采用曲马多PCIA可有效缓解患者疼痛,还可改善患者的免疫抑制状态,促进Th细胞分化平衡,维持机体细胞免疫和体液免疫的平衡。
[1]Chen F,Fang B,Li P,et al.Physico-chemical stability of butorphanol-tramadol and butorphanol-fentanyl patient-controlled analgesia infusion solutions over 168 hours[J].Pharmazie,2014,69(8):585-588.
[2]Choi YY,Park JS,Park SY,et al.Can intravenous patient-controlled analgesia be omitted in patients undergoing laparoscopic surgery for colorectal cancer?[J].Ann Surg Treatment Res,2015,88(2):86-91.
[3]付葵,夏建国.曲马多与吗啡对胃癌手术患者术后镇痛效果及免疫功能的影响[J].重庆医学,2015,44(17):2428-2430.
[4]Demirel I,Ozer AB,Atilgan R,et al.Comparison of patient-controlled analgesia versus continuous infusion of tramadol in post-cesarean section pain management[J].J Obstet Gynaecol Res,2014,40(2):392-398.
[5]裴圣林,阮林,潘灵辉,等.氯诺昔康与曲马多对肝癌术后自控镇痛的临床疗效及安全性评价[J].中国临床药理学杂志,2015,31(10):799-801.
[6]维拉.姜莉莉,宣斐.曲马多和吗啡术后镇痛对胃癌手术患者免疫功能的影响[J].临床麻醉学杂志,2011,27(10):979-981.
[7]Paech MJ,Mcdonnell NJ,Sinha A,et al.A randomised controlled trial of parecoxib,celecoxib and paracetamol as adjuncts to patient-controlled epidural analgesia after caesarean delivery[J].Anaesth Intensive Care,2014,42(1):15-22.
[8]谷新荣,王灿琴,王忠云,等.氯诺昔康联合曲马多对胃癌根治术患者术后血浆细胞因子的影响[J].临床麻醉学杂志,2014,30(10):1033-1035.
[9]Sun HL,Dong YC,Wang CQ,et al.Effects of postoperative analgesia with the combination of tramadol and lornoxicam on serum inflammatory cytokines in patients with gastric cancer[J].Int J Clin Pharmacol Ther,2014,52(12):1023-1029.
[10]Ma W,Wang K,Du J,et al.Multi-dose parecoxib provides an immunoprotective effect by balancing T helper 1(Th1),Th2,Th17 and regulatory T cytokines following laparoscopy in patients with cervical cancer[J].Mol Med Rep,2015,11(4):2999-3008.
[11]胡灼军,郭翠,单东海,等.曲马多、吗啡术后自控镇痛对食管癌患者细胞免疫功能的影响[J].现代生物医学进展,2015,15(34):6731-6733.
[12]Ntritsou V,Mavrommatis C,Kostoglou CA,et al.Effect of perioperative electroacupuncture as an adjunctive therapy on postoperative analgesia with tramadol and ketamine in prostatectomy:a randomised sham-controlled single-blind trial[J].Acupunct Med,2014,32(3):215-222.
[13]金原野.曲马多术后镇痛对乳癌根治术患者T淋巴细胞亚群、NK细胞的影响[J].中国医师杂志,2012,14(6):854-856.
[14]Bu X,Li M,Zhao Y.et al genetically engineered Newcastle disease virus expressing human interferon-λ1 induces apoptosis in gastric adenocarcinoma cells and modulates the Th1/Th2 immune response[J].Oncol Rep,2016,36(3):1393-1402.
[15]Lavu H,Potluri V.Proinflammatory T-helper 17 cells and interleukin 17 in gastric cancer[J].J Surg Res,2013,185(2):516-517.
程旭东(1972-),副主任医师,本科,主要从事临床麻醉研究。
10.3969/j.issn.1671-8348.2017.09.039
R614.2
B
1671-8348(2017)09-1272-03
2016-08-11
2016-11-09)

