脱脂南极磷虾粉对圆斑星鲽幼鱼体组成和消化性能的影响
郑建明, 严俊丽, 陈四清, 常青, 王贞杰, 赵捷杰, 刘长琳, 胡建成
脱脂南极磷虾粉对圆斑星鲽幼鱼体组成和消化性能的影响
郑建明1, 2, 严俊丽1, 2, 陈四清1, 常青1, 王贞杰1, 2, 赵捷杰1, 2, 刘长琳1, 胡建成1
(1. 中国水产科学研究院 黄海水产研究所, 山东 青岛 266071; 2. 上海海洋大学 水产与生命学院, 上海 201306)
为探讨脱脂南极磷虾()粉对圆斑星鲽()幼鱼体组成和消化性能的影响。作者以鱼粉和脱脂磷虾粉为蛋白源、鱼油为脂肪源, 用脱脂磷虾粉蛋白替代0%、10%、20%、30%、40%、50%和100%的鱼粉蛋白, 设计7种等蛋白(50%)、等脂肪(8%)的实验饲料(分别表示为F0、F10、F20、F30、F40、F50和F100)。每组设3个重复, 每个重复20尾鱼, 初始体质量为(68.13±0.20)g, 经过8周的饲养实验。结果表明: F100组的肝体比和脏体比显著低于其他各组(<0.05), F20~F30组的肥满度显著高于F40组(<0.05); F100组全鱼的水分和灰分显著高于其他各组(<0.05), F10组和F100组全鱼的粗蛋白显著高于其他各组(<0.05), F30组和F50组全鱼的粗脂肪显著高于其他各组(<0.05), F100组全鱼的粗脂肪显著低于其他各组(<0.05)。F10、F20和F50组肌肉的水分显著高于F100组(<0.05), F20组和F30组肌肉的粗脂肪显著高于其他各组(<0.05), 各替代组肌肉的粗蛋白、灰分无组间差异(>0.05); 胃蛋白酶活性组间无差异(>0.05), F0和F20的胃脂肪酶活性显著低于F30组(<0.05), F30组的胃淀粉酶活性显著高于其他各组(<0.05), F30和F100组的肠脂肪酶活性显著低于其他各组(<0.05), F0组的肠淀粉酶活性显著高于其他各组(<0.05); 脱脂南极磷虾粉替代组的皱襞高度呈现先升高后降低的趋势, F30组的皱襞高度显著高于其他组(<0.05), 替代组和对照组的黏膜厚度和绒毛长度没有显著性差异(>0.05)。综合来看, 脱脂南极磷虾粉10%~50%的替代比例对圆斑星鲽幼鱼的形态指标、体组成、消化酶活性和肠道形态指标有较好的效果。
圆斑星鲽(); 脱脂磷虾粉; 体组成; 消化酶
圆斑星鲽()隶属于鲽形目(Pleuronectiformes)、鲽科(Pleuronectidae)、星鲽属(), 主要分布于日本和韩国北部沿海及中国的黄渤海附近[1]。其肉色白嫩、口味鲜美、内脏团小及出肉率高[2], 再加上自然资源少, 市场价格高, 疾病少, 是具有广阔前景的海水养殖种类[3]。目前对圆斑星鲽的研究主要集中在生物学特性、胚胎发育和仔鱼发育等方面[4-7]。南极磷虾()属于节肢动物门(Arthropoda)、软甲纲(Malacostraca)、磷虾目(Euphausiacea), 通常是指南极大磷虾[8]。据最新估计, 南极磷虾的生物量为6.5×108~10.0×108t, 且营养丰富, 氨基酸平衡, 富含不饱和脂肪酸, 因此具有极高的应用研究价值[9]。南极磷虾的主要产品是全脂南极磷虾粉和磷虾油, 全脂磷虾粉在大菱鲆()、大西洋庸鲽()、星斑川鲽()和圆斑星鲽等鲆鲽鱼中已有相关报道, 研究显示南极磷虾粉可以部分替代鱼粉[10-13]。
目前鱼粉短缺的问题已成为水产养殖研究的热点, 而脱脂磷虾粉是南极磷虾提取磷虾油后的副产品, 价格低廉且含有丰富的蛋白质。因此本实验研究了脱脂磷虾粉替代鱼粉对圆斑星鲽幼鱼形态指标、体组成、消化酶活性和肠道形态结构的影响。
1 材料与方法
1.1 实验饲料
以鱼粉和脱脂南极磷虾粉为蛋白源, 鱼油为脂肪源配制成7组等蛋白等脂肪的颗粒饲料。用脱脂南极磷虾粉蛋白分别替代10%、20%、30%、40%、50%和100%的鱼粉蛋白, 并记为F0、F10、F20、F30、F40、F50和F100。实验饲料配方见表1。饲料原料经过粉碎, 80目过筛后配料, 混合均匀后加30%的水, 再一次混合, 用制粒机制成粒径为3 mm的颗粒饲料, 55℃烘10~12 h, 于–20℃保存备用。
1.2 饲养管理
实验于烟台开发区天源水产有限公司进行。实验鱼选用体格健壮、规格一致和初始体质量为(60.13± 0.20)g的幼鱼。420尾圆斑星鲽幼鱼随机放养到21个330 L的圆柱形塑料桶中, 每桶20尾。实验前, 用F0组饲料饲养一周, 使实验鱼逐步适应配合饲料。实验期间, 采用自然水温流水养殖, 水温为14~16℃, 盐度为33, 溶氧量为(5~6)mg/L, 流速是(2~3)L/min。实验持续8周, 从2016年8月6日~10月8日, 每天09: 00投喂1次, 饱食投喂, 投喂0.5 h后使用虹吸管吸取残饵, 烘干称质量, 每天记录摄食量, 如有死鱼, 记录并称质量。
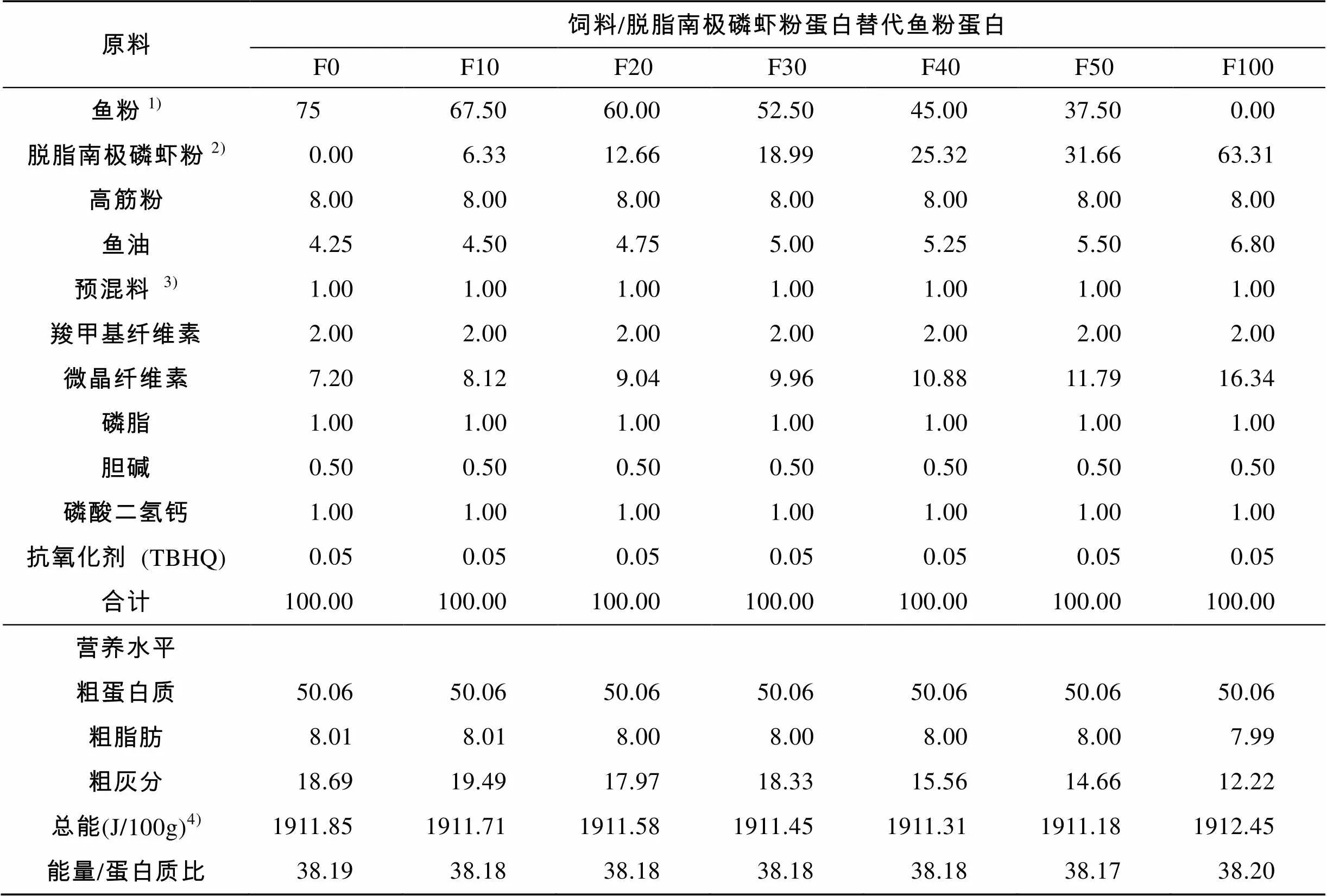
表1 实验饲料组成及营养水平(干物质基础, %)
1). 鱼粉: 粗蛋白 65%, 粗脂肪 5%; 2). 脱脂南极磷虾粉: 粗蛋白 77%, 粗脂肪 2%; 3). 预混料为每千克饲料提供: VA 375 000 IU, VD375 000 IU, VE 3 000 mg, VK3900 mg, VB1600 mg, VB2600 mg, VB6600 mg, VB123.7 mg, D-泛酸2 400 mg, 烟酸4 500 mg, 叶酸 folic acid 185 mg, D-生物素7.5 mg, 肌醇3 000 mg, VC 10 500 mg, Zn 1 750 mg, Mn 1 050 mg, Cu 410 mg, Fe 1 150 mg, Co 60 mg, I 50 mg, Se 15 mg; 4). 总能为计算值, 其余为实测值
1.3 样品收集与分析
实验结束时, 采样前将实验鱼饥饿24 h后, 每桶随机取3尾鱼测其体质量、体长, 用于计算肥满度。解剖分离内脏团和肝脏并称质量, 用于计算肝体比和脏体比。分离胃、肠, 测胃蛋白酶等消化酶。接着取其背肌, 肌肉于–20℃冰箱保存, 用于测肌肉组成。每个桶随机抽取2尾鱼于–20℃冰箱中保存, 用于测定全鱼体成分。最后每桶再取2尾鱼, 取其中肠, 用于肠道的组织切片。
肠道组织切片的制备: 参照张正等[14]的研究, 取肠道中肠, 用Davidesdous液固定24 h后, 置于70%乙醇中保存。经过乙醇脱水, 石蜡包埋后, 用LEICA RM2235型切片机连续切片, 切片厚度为6 μm, HE染色, Nikon ECLIPSE E800光学显微镜下对制作好的组织切片进行显微观察, 进行拍照并测量肠道皱襞高度、黏膜厚度及绒毛长度。
每组选取2个肠道组织切片, 进行肠微绒毛(肠道上皮细胞表面伸出的细长指状突起)长度、黏膜(肠道内壁的黏膜层)厚度和皱襞(黏膜和黏膜下层向腔面形成的突起)高度的测量, 观察肠道发育情况。
全鱼、肌肉及饲料样品105℃烘干后, 采用凯氏定氮法测得粗蛋白含量(VELP, UDK-142 automatic distillation unit, Italy); 采用索氏抽提法(石油醚为抽提液)测得粗脂肪含量(FOSS 脂肪测定仪SOXTEC- 2050 Sweden); 将样品在马弗炉(550℃)中灼烧6 h测得粗灰分含量。胃蛋白酶、AMS和LPS等消化酶活性的测定均采用南京建成生物工程研究所提供的试剂盒。相关的计算公式如下:
肥满度(%)=(体质量/体长3)×100;
脏体比(%)=(内脏质量/实验末鱼体质量)×100;
肝体比(%)=(肝脏质量/实验末鱼体质量)×100
1.4 数据统计
实验数据采用Excel 2010和SPSS 17.0软件进行统计分析, 数据差异显著时采用Duncan, s 进行多重比较, 显著水平为<0.05, 数据以平均值±标准误表示(M±SE)。
2 结果
2.1 脱脂南极磷虾粉对圆斑星鲽形态指标的影响
由表2可知, F0~F50组的肝体比和脏体比无显著性差异(>0.05), F100组的肝体比和脏体比显著低于其他各组(<0.05)。F20~F30组的肥满度显著高于F40组(<0.05), 与其他各组无显著性差异(>0.05)。
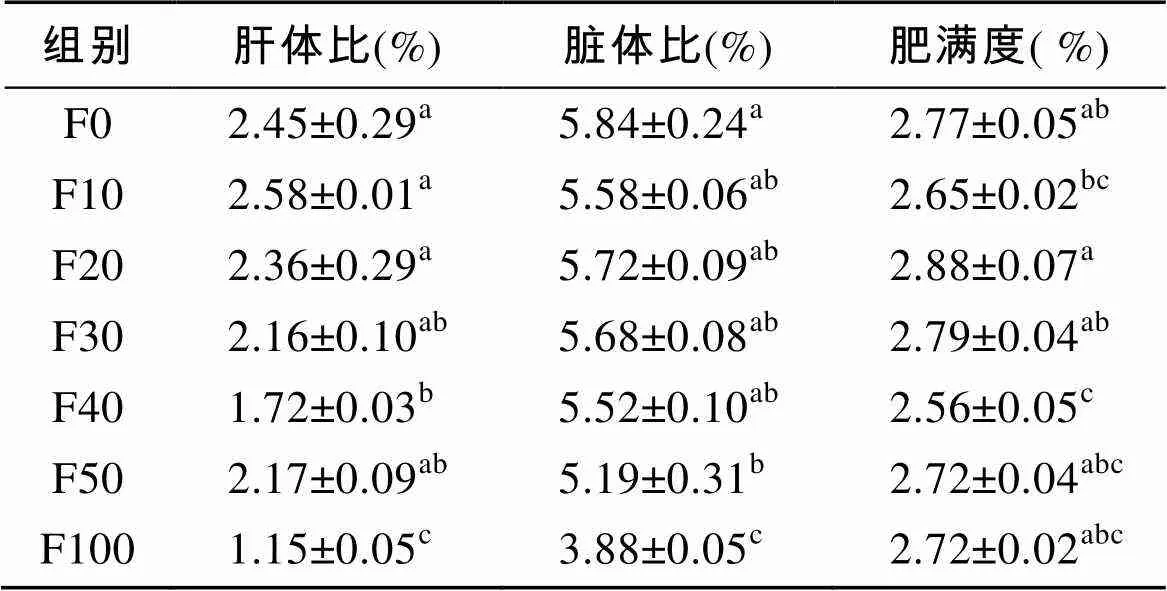
表2 脱脂南极磷虾粉对圆斑星鲽形态指标的影响
注: 同列无字母或数据肩标相同字母表示差异不显著(>0.05), 不同小写字母表示差异显著(<0.05), 下表同
2.2 脱脂南极磷虾粉对圆斑星鲽全鱼和肌肉营养组成的影响
由表3可知, F100组全鱼的水分显著高于其他各组(<0.05)。F10组和F100组全鱼的粗蛋白质显著高于其他各组(<0.05)。F30组和F50组全鱼的粗脂肪显著高于其他各组(<0.05), F100组全鱼的粗脂肪显著低于其他各组(<0.05)。实验各组的灰分都存在组间差异(<0.05), 但是F100组最高。由表4可知, F10、F20和F50组的水分显著高于F100组(<0.05)。F20组和F30组肌肉的粗脂肪显著高于其他各组(<0.05)。各替代组的粗蛋白质、粗灰分无组间差异(>0.05)。
2.3 脱脂南极磷虾粉对圆斑星鲽消化酶活力的影响
由表5可知, 胃蛋白酶活性组间无差异(> 0.05)。F0和F20的胃脂肪酶活性显著低于F30组(<0.05)。F30组的胃淀粉酶活性显著高于其他各组(<0.05)。F30和F100组的肠脂肪酶活性显著低于其他各组(<0.05)。F0组的肠淀粉酶活性显著高于其他各组(<0.05)。
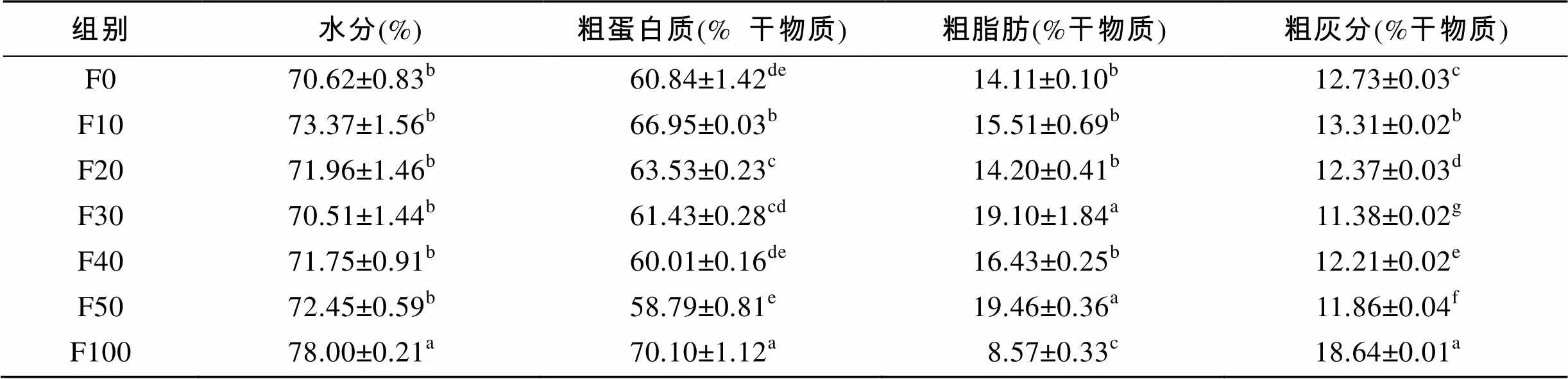
表3 脱脂南极磷虾粉对圆斑星鲽全鱼营养组成的影响
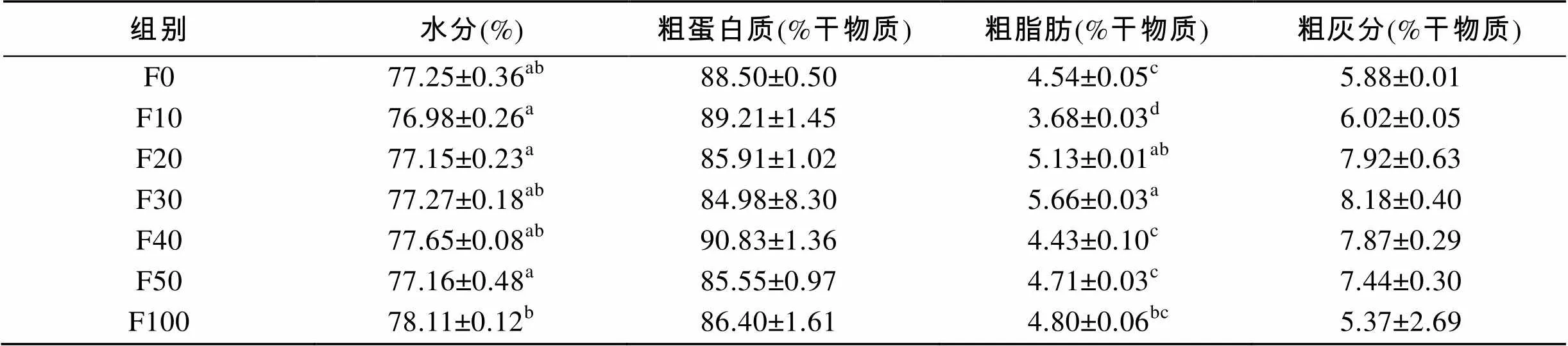
表4 脱脂南极磷虾粉对圆斑星鲽肌肉营养组成的影响

表5 脱脂南极磷虾粉对圆斑星鲽幼鱼消化酶活性的影响
2.4 脱脂南极磷虾粉对圆斑星鲽肠道结构的影响
由表6可知, 皱襞高度呈现先升高后降低的趋势, F30组的皱襞高度显著高于其他组(< 0.05)。替代组和对照组F0的黏膜厚度和绒毛长度没有显著性差异(>0.05)。
表6 脱脂南极磷虾粉对圆斑星鲽肠道显微结构指标的影响
观察圆斑星鲽中肠的组织切片发现, 肠道组织结构分为: 黏膜层、黏膜下层、肌层和浆膜, 黏膜凸起形成皱襞。F0组和F30组的皱襞密度高, 而F100组的皱襞排列疏松, 脱脂南极磷虾粉适量替代饲料中鱼粉能够促进圆斑星鲽幼鱼中肠的发育, 过高替代则显著损伤中肠组织结构(图1)。
3 讨论
3.1 脱脂南极磷虾粉对圆斑星鲽形态指标的影响
饲料蛋白来源和质量对鱼类形态发育非常重要, 肝体指数和肥满度是描述鱼体营养状况的形态指标。在本实验中, 10%~50%的脱脂磷虾粉替代组, 其脏体比、肝体比无显著性差异, 但是随着脱脂南极磷虾粉替代比例增加, 其呈降低趋势。吕云云等[15]在用发酵豆粕替代鱼粉饲养圆斑星鲽的实验中, 随饲料中发酵豆粕水平的升高, 脏体比和肝体比呈降低的趋势, 本实验结果与其研究结果一致, 表明合适比例的动植物蛋白源替代鱼粉对圆斑星鲽的肝脏发育影响不显著。魏佳丽等[12]在用酶解磷虾粉替代鱼粉投喂珍珠龙胆石斑鱼(♀× ♂)的实验中, 替代组的肝体比、脏体比和对照组无显著性差异, 同时宋文新等[16]发现发酵豆粕替代鱼粉水平对黑鲷幼鱼的肝体指数没有显著影响, 本实验与以上研究结果不一致, 可能与鱼类的种类、大小及生活习性有关。在实验中, 100%替代组的肝体比和脏体比显著低于其他各组, 可能的原因是: 在养殖投喂过程中发现F100组的摄食量最低; 脱脂南极磷虾粉中高比例的几丁质影响了圆斑星鲽对其的消化; 饲料中过多的纤维素影响圆斑星鲽的吸收利用, 目前在饲料中添加超过10%的纤维素会降低鱼类和对虾的生长已见相关报道[17-19], 由于以上原因可能造成圆斑星鲽不断消耗肝脏中的能量物质, 最终使100%替代组的肝体比和脏体比显著低于其他各组。在本实验中, 脱脂南极磷虾粉替代组的肥满度和对照组F0无显著性差异, 说明脱脂南极磷虾粉替代鱼粉蛋白对圆斑星鲽的体型没有显著影响, 与宋文新[16]、魏佳丽[12]的研究结果相同, 原因可能是磷虾粉作为一种优质蛋白源, 其氨基酸组成和比例和鱼粉相似, 且易被圆斑星鲽等鲆鲽鱼类吸收[20]。
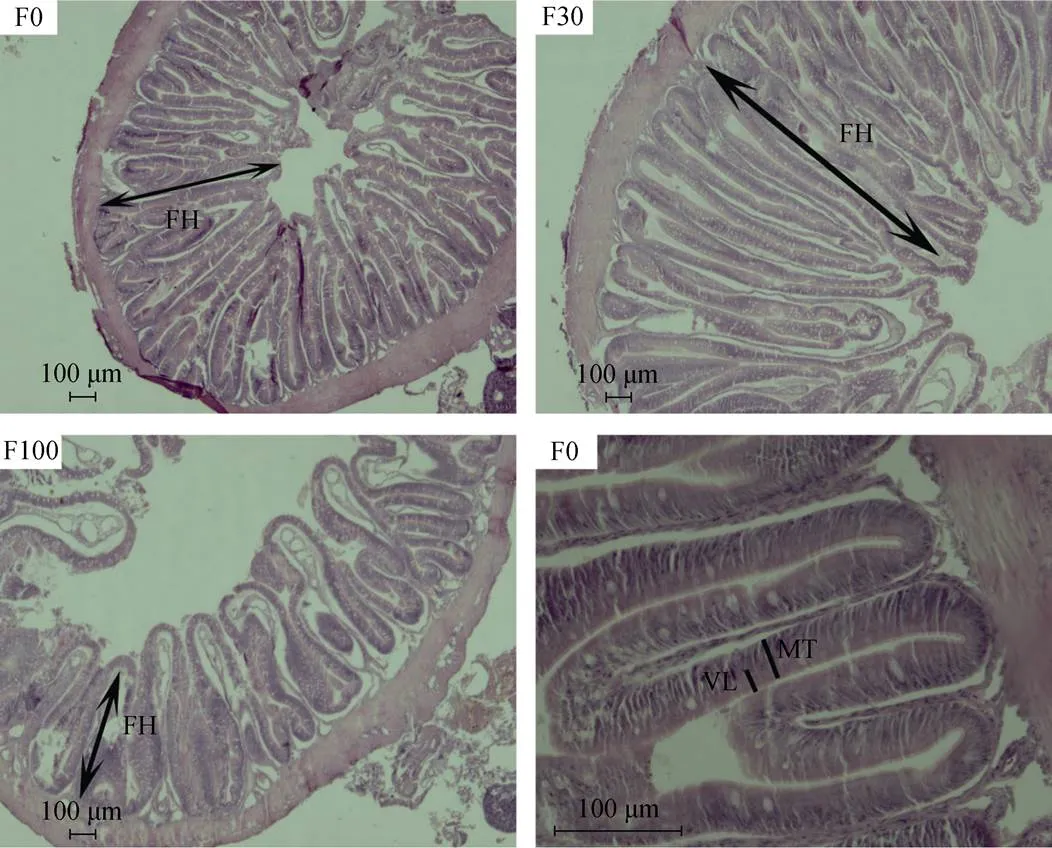
图1饲料中脱脂南极磷虾粉对圆斑星鲽肠道形态的影响(中肠)
FH. 皱襞高度; MT. 黏膜厚度; VL. 绒毛长度
FH. fold height; MT. mucosal thickness; VL. villus length
3.2 脱脂南极磷虾粉对圆斑星鲽全鱼和肌肉营养组成的影响
脱脂南极磷虾粉替代组全鱼的水分F100组显著高于其他组, 且F10和F20组全鱼的粗蛋白质显著高于对照组F0。脱脂南极磷虾粉替代组肌肉的水分、粗蛋白质和粗灰分和对照组F0无显著性差异, 说明脱脂南极磷虾粉作为蛋白源可以被较好的吸收利用。魏佳丽等[12]用酶解磷虾粉替代鱼粉饲喂珍珠龙胆石斑鱼(×), 酶解磷虾粉替代组全鱼的水分、粗蛋白质和对照组F0无显著性差异。Yoshitomi等[21]在饲料中添加南极磷虾粉饲养黄尾魳(), 南极磷虾粉替代组肌肉的粗蛋白质和对照组无显著性差异。同时在虹鳟()[22-23]的投喂实验上也有同样的效果。本实验与以上研究结果一致, 可能的原因是全脂南极磷虾、脱脂南极磷虾粉的氨基酸组成和鱼粉相似且能被圆斑星鲽幼鱼很好的摄取和吸收[20]。实验中F30组、F50组全鱼的粗脂肪和F20组、F30组肌肉的粗脂肪均显著高于F0组, 而100%添加组全鱼的粗脂肪则显著低于F0组。魏佳丽等[12]在酶解磷虾粉替代鱼粉投喂珍珠龙胆石斑鱼的实验中, 替代组全鱼和肌肉的粗脂肪和对照组无显著性差异, 原因可能是: 与鱼的种类有关; 酶解磷虾粉产生的小肽可能阻碍鱼体吸收脂肪, 并促进脂质的代谢[24]。而作者的实验结果则可能是脱脂磷虾粉作为提取磷虾油后的副产物, 由于提取磷虾油工艺不同, 仍然含有由高不饱和脂肪酸构成的磷脂成分[25], 适当比例的脱脂南极磷虾粉替代组的饲料投喂圆斑星鲽, 增强了鱼体内脂蛋白的合成和转运, 并最终导致体脂在鱼体组织中沉积, 这一点在关于龙虾()[26]的研究中得到了证实。而高比例的脱脂磷虾粉替代组由于含有高比例的几丁质, 进而对鱼体的脂肪沉积起抑制作用[27]。
3.3 脱脂南极磷虾粉对圆斑星鲽消化酶活力的影响

3.4 脱脂南极磷虾粉对圆斑星鲽肠道结构的影响
肠道皱襞和肠绒毛是鱼类消化吸收的主要场所, 皱襞高度越高, 越有利于营养物质的吸收[31]。在本实验中, 皱襞高度随脱脂磷虾粉添加水平的升高呈现先升高后降低的趋势, 而吕云云等[15]在发酵豆粕替代鱼粉投喂圆斑星鲽的实验中, 皱襞高度随着饲料中发酵豆粕的增加呈现递减的趋势, 趋势相反。可能的原因是脱脂南极磷虾粉和发酵豆粕相比其氨基酸更平衡, 营养价值更高[20]。说明合适比例的脱脂南极磷虾粉的替代有利于鱼体对营养物质的消化吸收, 但是过高比例的替代会显著影响鱼体的消化吸收。黏膜厚度是肠道发育的重要判断指标[32]。在本实验中, 黏膜厚度和绒毛长度无组间差异, 表明脱脂南极磷虾粉的添加不影响鱼体的肠道发育。
4 小结
根据对形态指标、体组成、消化酶和肠道结构指标的影响, 10%~50%的脱脂南极磷虾粉添加比例对圆斑星鲽无不利影响。
[1] 叶建生, 王兴强, 马甡, 等. 圆斑星鲽的生物学特性及其研究进展[J]. 农业经济与管理, 2006, 6: 5-7.
Ye Jiansheng, Wang Xingqiang, Ma Shen, et al. Studies on biological and advances of[J]. Progress in Fishery Sciences, 2006, 6: 5-7.
[2] 王远红, 陈四清, 吕志华, 等. 圆斑星鲽鱼的营养成分分析[J]. 营养学报, 2006, 28(3): 271-272.
Wang Yuanhong, Chen Siqing, Lv Zhihua, et al. Analysis of the nutritional components ofT.[J]. Acta Nutrimenta Sinica, 2006, 28(3): 271-272.
[3] 苗淑彦, 张利民, 王际英, 等. 圆斑星鲽的生物学特性及养殖技术[J]. 水产科技情报, 2009, 36(3): 137-139.
Miao Shuyan, Zhang Limin, Wang Jiying, et al. The biological characteristics and breeding techniques ofT.[J]. Fisheries Science & Technology Information, 2009, 36(3): 137-139.
[4] 陈四清, 马爱军, 姜开莲, 等. 圆斑星鲽()生物学特性研究[J]. 渔业信息与战略, 2002, 17(10): 25-27.
Chen Siqing, Ma Aijun, Jiang Kailian, et al. A study on biological characteristics of spotted Halibut,[J]. Modern Fisheries Information, 2002, 17(10): 25-27.
[5] 王开顺, 张志峰, 康庆浩, 等. 圆斑星鲽胚胎及仔鱼发育的观察[J]. 中国水产科学, 2003, 10(6): 451-456.
Wang Kaishun, Zhang Zhifeng, Kang Qinghao, et al. Embryonic and larval development in[J]. Journal of Fishery Sciences of China, 2003, 10(6): 451-456.
[6] Aritaki M, Suzuki S, Watanabe K.Morphological development and growth of laboratory-reared barfin flounder[J]. Nippon Suisan Gakkaishi, 2000, 66(3): 446-453.
[7] Cho K C, Kim J H, Go C S, et al.A study on seedling production of the spotted flounder,[J]. Bull Natl Fisheries Res Dev Agency, 1995, 50: 41-57.
[8] 楼乔明, 王玉明, 刘小芳, 等. 南极磷虾脂肪酸组成及多不饱和脂肪酸质谱特征分析[J]. 中国水产科学, 2011, 18(4): 929-935.
Lou Qiaoming, Wang Yuming, Liu Xiaofang, et al. Analysis of fatty acid composition and mass spectrometry characteri-zation of polyunsaturated fatty acids in[J]. Journal of Fishery Sciences of China , 2011, 18(4): 929-935.
[9] 常青, 秦帮勇, 孔繁华, 等. 南极磷虾在水产饲料中的应用[J]. 动物营养学报, 2013, 25(2): 256-262.
Chang Qing, Qin Bangyong, Kong Fanhua, et al. Application of antarctic krill in aquatic feed[J]. Chinese Journal of Animal Nutrition, 2013, 25(2): 256-262.
[10] 孔凡华, 梁萌青, 吴立新, 等. 南极磷虾粉对大菱鲆生长、非特异性免疫及氟残留的影响[J]. 渔业科学进展, 2012, 33(1): 54-60.
Kong Fanhua, Liang Mengqing, Wu Lixin, et al. Effect of different level of Antarctic krill meal on growth, non-specific immunity and fluoride retention in diets of turbot[J]. Progress in Fishery Sciences, 2012, 33(1): 54-60.
[11] Tibbetts S M, Olsen R E, Lall S P.Effects of partial or total replacement of fish meal with freeze-dried krill () on growth and nutrient utilization of juvenile Atlantic cod () and Atlantic halibut () fed the same practical diets[J]. Aquaculture Nutrition, 2011, 17(3): 287-303.
[12] 魏佳丽. 磷虾粉替代鱼粉在星斑川鲽()和珍珠龙胆石斑鱼(♀×♂)幼鱼饲料中的应用研究[D]. 上海: 上海海洋大学, 2015.
Wei Jiali. Application effects of krill meal in feeds for juvenile starry flounder()and pearl gentian grouper (♀× ♂) [D]. Shanghai: Shanghai Ocean University, 2015.
[13] 严俊丽, 陈四清, 常青, 等. 南极磷虾粉替代鱼粉对圆斑星鲽()幼鱼生长性能、血清和肝脏生化指标及血清非特异性免疫指标的影响[J]. 动物营养学报, 2016, 28(11): 3503-3510.
Yan Junli, Chen Siqing, Chang Qing, et al. Effects of dietary antarctic krill meal on the growth, blood biochemical parameters and non-specific immunity of juvenile spotted halibut () [J]. Chinese Journal of Animal Nutrition, 2016, 28(11): 3503-3510.
[14] 张正. 养殖半滑舌鳎常见疾病的病理学观察与感染微生态分析[D]. 青岛: 中国海洋大学, 2012.
Zhang Zheng. Study on histopathology and infectious microecology of common diseases in cultured half-smooth tongue sole ()[D]. Qingdao: Ocean University of China, 2012.
[15] 吕云云, 常青, 陈四清, 等. 发酵豆粕对圆斑星鲽生长及消化能力的影响[J]. 水生生物学报, 2016, 40(1): 10-18.
Lv Yunyun, Chang Qing, Chen Siqing, et al. The dffects of dietary fermented soybean meal on the growth and digestive ability of spotted halibut,[J]. Acta Hydrobiologica Sinica, 2016, 40(1): 10-18.
[16] 宋文新. 黑鲷幼鱼饲料中发酵豆粕部分替代鱼粉的研究[D]. 杭州: 浙江大学, 2009.
Song Wenxin. Partial replacement of fish meal by fermented soybean meal in diets for juvenile black sea bream,[D]. Hangzhou: Zhejiang University, 2009.
[17] Hilton J W, Atkinson J L, Slinger S J. Effect of increased dietary fiber on the growth of rainbow trout[J]. Canadian Journal of Fisheries & Aquatic Sciences, 2011, 40(1): 81-85.
[18] Shiau S Y, Yu H L, Hwa S, et al. The influence of carboxymethylcellulose on growth, digestion, gastric emptying time and body composition of tilapia[J]. Aquaculture, 1988, 70(4): 345-354.
[19] Dioundick O B, Stom D I. Effects of dietary α-cellulose levels on the juvenile tilapia,(peters)[J]. Aquaculture, 1990, 91(3-4): 311-315.
[20] 严俊丽, 陈四清, 常青, 等. 南极磷虾粉作为鲽形目鱼饲料蛋白源的营养价值评价[J]. 渔业科学进展, 2016, 37(5): 74-82.
Yan Junli, Chen Siqing, Chang Qing, et al. Evaluation of nutrition of Antarctic krill meal as dietary protein source for flatfishes[J]. Progress in Fishery Sciences, 2016, 37(5): 74-82.
[21] Yoshitomi B, Nagano I. Effect of dietary fluoride derived from Antarctic krill () meal on growth of yellowtail ()[J]. Chemosphere, 2012, 86(9): 891-897.
[22] Yoshitomi B, Aoki M, Oshima S.Effect of total replacement of dietary fish meal by low fluoride krill () meal on growth performance of rainbow trout () in fresh water[J]. Aquaculture, 2007, 266(1-4): 219-225.
[23] Yoshitomi B, Aoki M, Oshima S, et al. Evaluation of krill () meal as a partial replacement for fish meal in rainbow trout () diets[J]. Aquaculture, 2006, 261(1): 440-446.
[24] Drevon C A. Fatty acids and expression of adipokines[J]. Biochimica Et Biophysica Acta, 2005, 1740(2): 287-292.
[25] 田晓清, 杨桥, 邵盛男, 等. 南极磷虾脂溶性成分的研究进展[J]. 海洋渔业, 2011, 33(4): 462-466.
Tian Xiaoqing, Yang Qiao, Shao Shengnan, et al. The research progress of ester-soluble constituents of Antarctic krill[J]. Marine Fisheries, 2011, 33(4): 462-466.
[26] D’Abramo L R, Baum N A, Bordner C E, et al. Diet- dependent cholesterol transport in the American lobster[J]. Journal of Experimental Marine Biology & Ecology, 1985, 87(1): 83-96.
[27] 王际英, 蒋锦坤, 张利民, 等. 壳聚糖对星斑川鲽幼鱼生长、脂肪含量及抗氧化能力的影响[J]. 中国农学通报, 2013, 29(8): 64-70.
Wang Jiying, Jiang Jinkun, Zhang Limin, et al. Effects of dietary chitosan on growth, lipid deposition and antioxidant capacity of juvenile starry flounder ()[J]. Chinese Agricultural Science Bulletin, 2013, 29(8): 64-70.
[28] 梅琳, 周慧慧, 麦康森, 等. 蛹肽蛋白替代鱼粉对大菱鲆(L.)幼鱼生长、饲料利用、消化代谢酶及免疫性能的影响[J]. 渔业科学进展, 2015(3): 85-92.
Mei Lin, Zhou Huihui, Mai Kangsen, et al. Effects of dietary substitution of fishmeal by fermented silkworm pupae on the growth, feed intake, digestion and immunity of juvenile turbot (L.)[J]. Progress in Fishery Sciences, 2015(3): 85-92.
[29] Lundstedt L M, Melo J F, Moraes G. Digestive enzymes and metabolic profile of(:) in response to diet composition[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2004, 137(3): 331-339.
[30] Lcde A, Lundstedt L M, Moraes G.Digestive enzyme responses of tambaqui () fed on different levels of protein and lipid[J]. Aquaculture Nutrition, 2007, 12(6): 443-450.
[31] 王宝维, 王姣, 葛文华, 等. 维生素B1对5~15周龄鹅营养物质利用率、肠道形态及微生物菌群的影响[J]. 动物营养学报, 2014, 26(6): 1444-1452.
Wang Baowei, Wang Jiao, Ge Wenhua, et al. Effects of Vitamin B1 on nutrient digestibilityiIntestinal morphology and microbial flora of geese aged from 5 to 15 weeks[J]. Chinese Journal of Animal Nutrition, 2014, 26(6): 1444- 1452.
[32] Uda K, Tsujikawa T, Fujiyama Y, et al. Rapid absorption of luminal polyamines in a rat small intestine ex vivo model[J]. Journal of Gastroenterology & Hepatology, 2003, 18(5): 554-559.
Effects of dietary skimmed krill meal on the body composition and digestive ability of juvenile spotted halibut ()
ZHENG Jian-ming1, 2, YAN Jun-li1, 2, CHEN Si-qing1, CHANG Qing1, WANG Zhen-jie1, 2, ZHAO Jie-jie1, 2, LIU Chang-lin1, HU Jian-cheng1
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 2. College of Fishery and Life Sciences, Shanghai Ocean University, Shanghai 201306, China)
While both fishmeal and skimmed krill meal (SKM) are considered the main source of protein, fish oil has been used as a source of lipid. This study aims to determine the optimum level of SKM (in replacement of the fishmeal) in the diet for spotted halibut (). We conducted an 8-week experiment in which the seven isocaloric and isonitrogenous diets contained 0%, 10%, 20%, 30%, 40%, 50%, and 100% SKM. We provided each diet randomly to a triplicate of 15 fish (60.13 g±0.20 g) per tank in the indoor culture system. The results revealed that the viscerosomatic index and hepatosomatic index of other groups were higher than those in the F100 group (< 0.05). The condition factor of F20-F30 groups was higher than that in the F40 group (< 0.05). In addition, the whole-body moisture and ASH of the F100 group were higher than those of other groups (< 0.05); the whole-body crude protein of the F10 and F100 groups was higher than that in other groups (< 0.05); and the whole-body crude fatty of the F30 and F50 groups was higher than that in other groups (< 0.05). Furthermore, the muscle moisture of the F10, F20, and F50 groups was higher than that of the F100 group (< 0.05); the muscle crude protein and ASH of the F10-F100 groups were similar to those of the F0 group (> 0.05); and the muscle crude fat of the F20-F30 groups was higher than that in other groups (< 0.05). We observed no significant difference in the pepsin of juvenile spotted halibut among groups (> 0.05). While the stomach lipase of the F0 and F20 groups were lower than that of the F30 group (< 0.05), the stomach amylase of the F30 group was higher than that of other groups (< 0.05). Although the intestinal amylase of the F0 group was significantly higher than that of other groups (< 0.05), the intestinal lipase of the F30 and F100 groups was lower than that of other groups (< 0.05). Finally, the fold height of the F30 group was significantly higher than that of other groups (< 0.05); however, the mucosal thickness and villus length of juvenile spotted halibut exhibited no significant difference among groups (> 0.05). This study suggests that 10%-50% of SKM levels exert similar effects on the body composition and digestive ability of juvenile spotted halibut.
spotted flounder; skimmed krill meal; body composition; digestive enzyme
(本文编辑: 谭雪静)
[Yellow Sea Fisheries Research Institute of Chinese Academy of Fishery Sciences, No.20603022016005; Tianjin Agricultural Science and Technology Achievement Transformation and Extension Project, No.201604100]
May 25, 2017
郑建明(1990-), 男, 河北张家口人, 硕士研究生, 主要从事鱼类营养与饲料研究, 电话: 13061330720 E-mail: 615709961@ qq.com; 常青,通信作者, 研究员, E-mail: changqing@ysfri.ac.cn
S96
A
1000-3096(2017)12-0038-08
10.11759//hykx 20170525003
2017-05-25;
2017-09-07
中国水产科学研究院黄海水产研究所基本科研业务(20603022016005); 天津市农业科技成果转化与推广项目(201604100)

