藻胆体的结构与能量传递功能
王肖肖, 秦 松, 杨 革, 李文军
藻胆体的结构与能量传递功能
王肖肖1, 2, 秦 松1, 杨 革2, 李文军1
(1. 中国科学院 烟台海岸带研究所, 山东 烟台 264003; 2. 曲阜师范大学 生命科学学院, 山东 曲阜 273165)
藻胆体是红、蓝藻特有的捕光色素蛋白复合体, 由水溶性的藻胆蛋白和连接多肽组成, 在光合作用中能够吸收和传递能量。藻胆体作为水溶性蛋白复合物, 位于类囊体膜基质侧, 平均分子质量可达到10 Mu。藻胆体可以吸收不同波长的光能, 并且能将能量以95%以上的效率传递到光反应中心。由于具有吸收波长范围宽和环境友好等特点, 藻胆体在光合作用理论和实际应用等方面都有较大研究意义。本文主要对藻胆体的结构与能量传递研究进展进行了综述。
藻胆体; 藻胆蛋白; 结构; 能量传递
1 藻胆体的结构与组成
20世纪60年代, Gantt和Conti等[1-3]在研究紫球藻(一种单细胞红藻)叶绿体的超微结构时, 发现在类囊体膜侧规则的排列着一些小颗粒, 他们将此颗粒命名为藻胆体(Phycobilisome, PBS)。用戊二醛将藻胆体固定后, 通过电镜进行观察, 结果表明藻胆体颗粒的直径约为30~40 nm, 颗粒间的距离大小约为40~50 nm, 形状类似于“盘状”。随后, 相关研究人员在蓝藻中也观察到了藻胆体[4-6]。经过多年研究, 现在已经确定藻胆体是存在于红藻和蓝藻中的捕光色素蛋白复合体, 由85%~90%的藻胆蛋白和15%~ 10%的连接多肽组成[7]。藻胆体分子质量为7×103~ 15×103Mu, 其形状和大小与藻的种类密切相关[8]。藻胆体可以吸收波长为460~670 nm的可见光, 并将其所吸收的光能以95%以上的效率传递给类囊体膜上的光反应中心[9]。
藻胆体的形状主要有半圆盘形、半椭球形、维管束形和块状(表1)。
半圆盘形藻胆体是最常见的一种类型, 主要存在于部分蓝藻和一些单细胞红藻中。这种类型的藻胆体一般是由“核心复合物”和“杆状复合物”两部分组成。“核心复合物”一般由3个圆柱体组成, 每个圆柱体长约12 nm, 直径约为11 nm。在核心复合物的外周沿同一平面有六根“杆状复合物”呈辐射形排列, 每根“杆状复合物”由2~6个盘状物垛叠而成, 每个盘状物厚约6 nm, 直径约11~12 nm。根据核心排列模式和核、杆数量的不同, 又分为“二核六杆”[10]、“三核六杆”[11-12]、“五核八杆”[13]等类型(图1)。
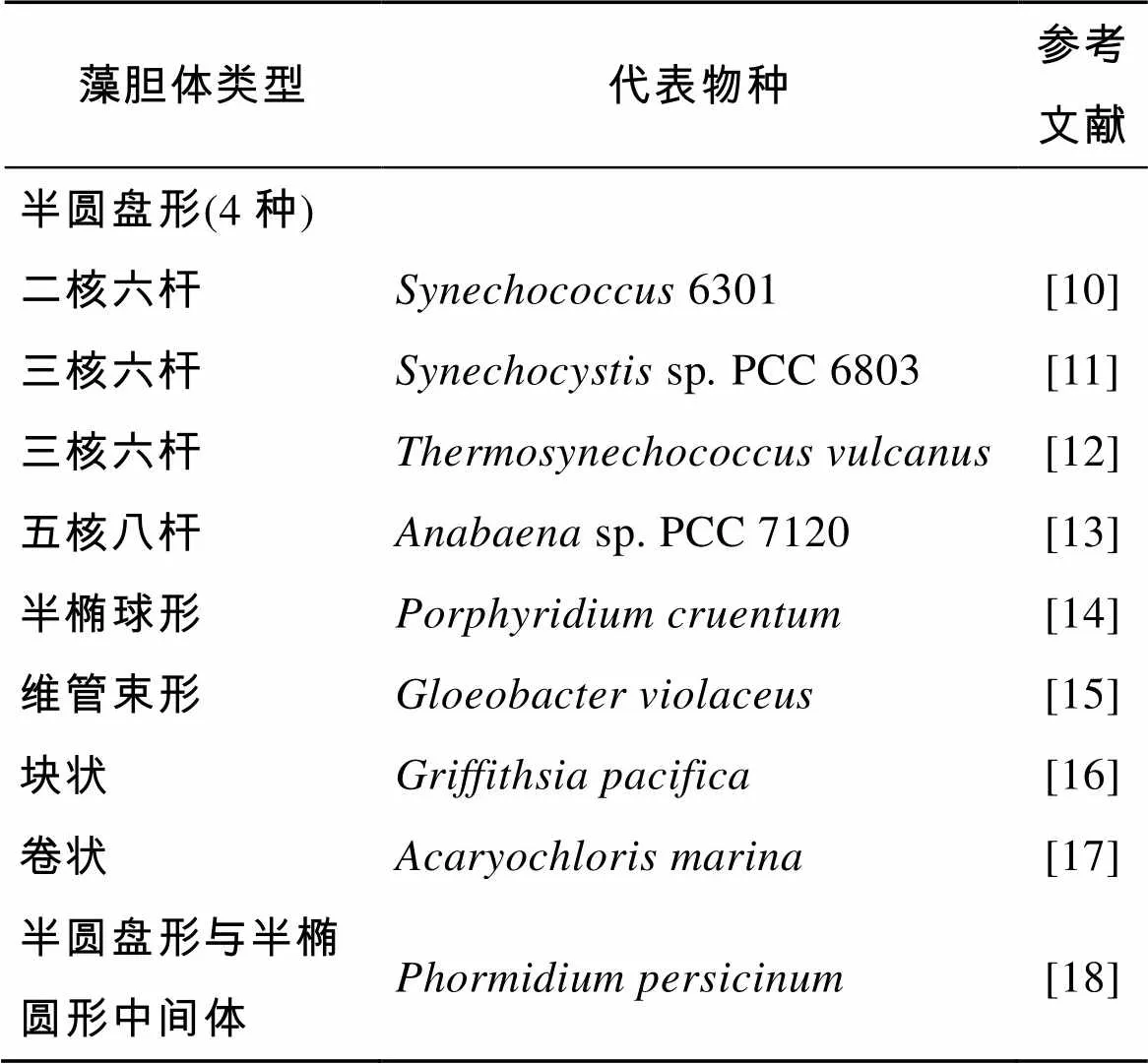
表1 藻胆体类型
半椭球形藻胆体存在于一些高等蓝藻和部分红藻中。这种类型的藻胆体首先在紫球藻中被发现, 相关的研究也比较为深入。紫球藻藻胆体的大小约为47 nm×32 nm×32 nm, 与半圆盘结构相似, 也是由“核心复合物”和“杆状复合物”两部分组成, 但杆状复合物有10~12根, 并且排列呈半椭球形(图2)[14]。
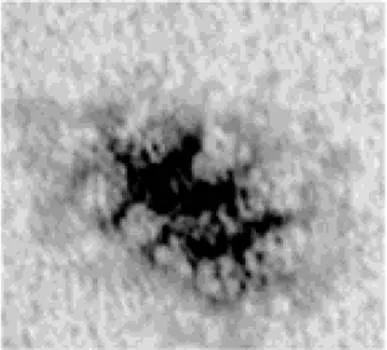
图1 半圆盘形藻胆体的电镜照片
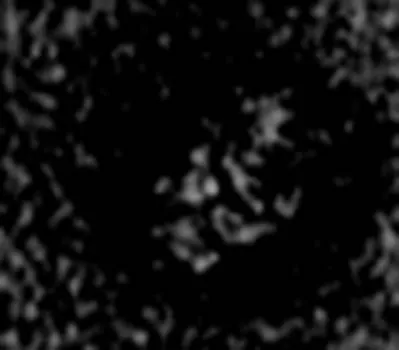
图2 半椭球形藻胆体的电镜照片
维管束形藻胆体, 目前仅在蓝藻中被发现。这种类型的藻胆体一般由六根杆状物组成, 其直径为10~12 nm, 长度为50~70 nm, 形状类似于倒三角的束状。维管束形藻胆体的基底有一个圆盘状结构, 能够与膜的内表面结合(图3)[15]。
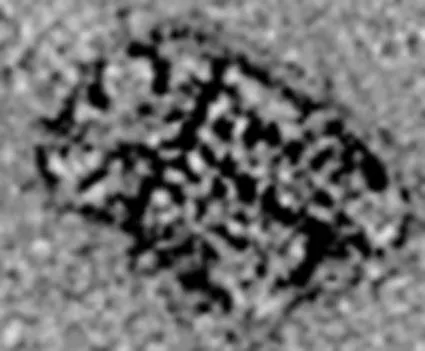
图3 维管束形藻胆体的电镜照片
块状(双圆筒状), 目前仅在红藻中被发现。其大小为63 nm×45 nm×39nm(图4)[16]。此外, Marquardt等[17]在中发现了卷状藻胆体; Wehrmeyer等[18]在中发现了一种介于半圆盘形和半椭圆形之间状态的藻胆体。
藻胆体由水溶性的藻胆蛋白和连接多肽组成。根据吸收光谱的不同, 藻胆蛋白通常分为: 别藻蓝蛋白(Allophycocyanin, APC)、藻蓝蛋白(Phycocyanin, PC)、藻红蛋白(Phycoerythrin, PE)和藻红蓝蛋白(Phycoerythrocyanin, PEC)。藻胆蛋白含有α、β、γ 3种类型的亚基, 其中α和β亚基含有160~180个氨基酸序列, 分子大小约为15~20 u, 二者之间具有很高的同源性。在部分藻红蛋白中还存在一种分子量约为30 ku的γ亚基, 由于γ亚基不具有三重对称, 并且可能位于藻红蛋白空间结构的中央空洞中[19]。因此很难根据X-晶体衍射法确定它在与α和β亚基的相对位置和结合位点。藻胆蛋白的基本结构单位为(αβ)单体, 每个(αβ)单体共价结合2~5个线性四吡咯发色团-藻胆素(Phycobilin)[20-21]。藻胆素通过硫醚键与亚基中的半胱氨酸(Cys)共价相连。(αβ)单体进一步自组装形成(αβ)3结构。(αβ)3为盘状结构, 直径约为11 nm, 厚度约为3 nm, 中央存在直径为1.5~5 nm的孔穴。(αβ)6是由(αβ)3通过“面对面”堆积而形成。藻胆蛋白在溶液中稳定存在的状态一般为(αβ)3或(αβ)6。

图4 块状藻胆体的电镜照片
2 藻胆体的能量传递功能
目前, 光合作用中的能量传递理论有3种, 分别为“Föster共振能量传递机制”(Förster resonance energy transfer, FRET)、“激子耦合机制”(Exciton coupling)以及“相干态传能机制”。
“Förster能量传递机制”是指在色素系统中, 受光激发的色素分子能够引起高能电子的振动, 从而使附近的一个分子的某个电子振动, 发生电子激发能量的传递。此时第一个分子中被激发的电子便停止振动, 而第二个分子中的电子则变为激发态, 第二个分子又能以同样的方式激发下一个分子。这是一种依靠电子振动在分子间传递能量的方式[22-23]。
在这种能量传递过程中, 影响能量传递效率的因素包括: (1)供体和受体色基间的距离, 当供体和受体色基间的相对距离大于2 nm时, 传递速率与分子间距离的六次方(R6)成反比; (2)供体和受体之间的几何关系; (3)供体和受体之间吸收峰和发射峰的重叠情况。如果作为能量供体的藻胆蛋白的荧光发射峰与受体藻胆蛋白的最大吸收峰存在较大重叠, 则能量能够以无辐射的形式传递下去[24]。当两个色基间的距离较短时, 承担能量传递的藻胆素色基可以被简化成偶极矩, 能量在偶极的发色团上离域[25]。目前这个机制不仅可以解释各种叶绿素之间的激发态能量传递过程, 也可用来解释整个藻胆体的能量传递过程[26-27]。对供体藻胆素分子进行激发, 可观察到受体藻胆素分子的荧光发射, 在整个能量转移过程中, 能量供体的藻胆素和能量受体的藻胆素之间相互耦合作用较弱, 不涉及光子的发射和重新吸收。任彦亮以蓝藻藻胆体中的藻蓝蛋白为研究对象, 运用含时密度泛函理论(TDDFT), 结合极化连续介质模型, 对三个藻蓝胆素分子(α84、β84、β155)的CD光谱和紫外吸收光谱进行研究, 推测了藻蓝蛋白中能量从β155和α84向β84传递的分子机制[28]。目前根据晶体学数据可以大致推算出杆内、核内、杆与杆之间、核与杆之间色基的距离, 再根据色基的距离进一步推测出藻胆体内部的能量传递机制。
当藻胆蛋白能量供体和能量受体中的藻胆素伴之间的距离进进一步缩小时, 藻胆素之间相互作用将超越Förster能量传递模型的极限, 藻胆素之间的耦合不可以再被忽略, 能量供体的藻胆素和能量受体的藻胆素之间出现激子耦合机制, 能量传递需要采用“激子耦合机制”进行解释。“激子耦合机制”是指色素分子受到光激发后, 高能电子在返回原来轨道时发出激子, 发出的激子再去激发相邻的同种色素分子, 即把激发能传递给相邻的色素分子, 激发的电子可以相同的方式再发出激子, 并被另一色素分子吸收[29]。影响激子耦合能量传递的因素有: (1)光能的传递仅适用于同种色素分子; (2)分子间的距离小于2 nm; (3)传递速率与分子间距离(R3)成反比。与Föster机制能量单向传递不同, 激子耦合机制可以进行双向的传递能量[12]。
1926年Schrodinger发现相干态现象, 相干态是量子谐振子达到的一种特殊的量子状态。21世纪初, Fleming团队利用二维超快电子光谱, 在77K条件下揭示了绿硫细菌FMO量子相干态传能的机制, 并且观测到了长达660 fs的量子相干过程, 提出了“相干态传能机制”[30]。这种能量传递途径具有时间瞬时性和能量的空间离域性。“相干态传能机制”在绿硫细菌光合天线系统的高效传能过程中得到很好的应用, 同时这也引发了学术界对其传能机制的持续探索。隐藻是光合浮游类单细胞藻类, 根据光谱特性的不同, 隐藻有8种不同的藻胆蛋白, 分别为PE545、PE555、PE566、PC612、PC630、PC645、PC569 (或PC570)、PC577[31]。2007年, Enge等[32-33]在常温条件下在绿色硫细菌中发现了300 fs的相干过程, 随后在紫色细菌的LH2复合体中也发现了相干现象。2010年, Scholes等[34]在室温下观察到隐藻PE545的中存在130 fs的相干能量传递。
作为捕光色素蛋白复合体, 藻胆体内部的能量在传递的效率在95%以上[27]。PE、PC、APC和叶绿素的吸收光谱和荧光发射光谱之间依次具有较强的荧光发射和吸收重叠。大量的研究表明, 能量在藻胆体内部严格按照吸收能量的强弱, 从高到底的顺序进行传递。能量在光合作用系统内的传递顺序为PE→PC→APC→叶绿素[7, 35-37]。光能经过藻胆素吸收以后, 首先在藻胆蛋白亚基内部和亚基之间传递, 然后在不同的藻胆蛋白之间传递, 最终传递给位于类囊体膜上的光反应中心, 藻胆体中能量传递全部时间在120~150 ps(图5)。
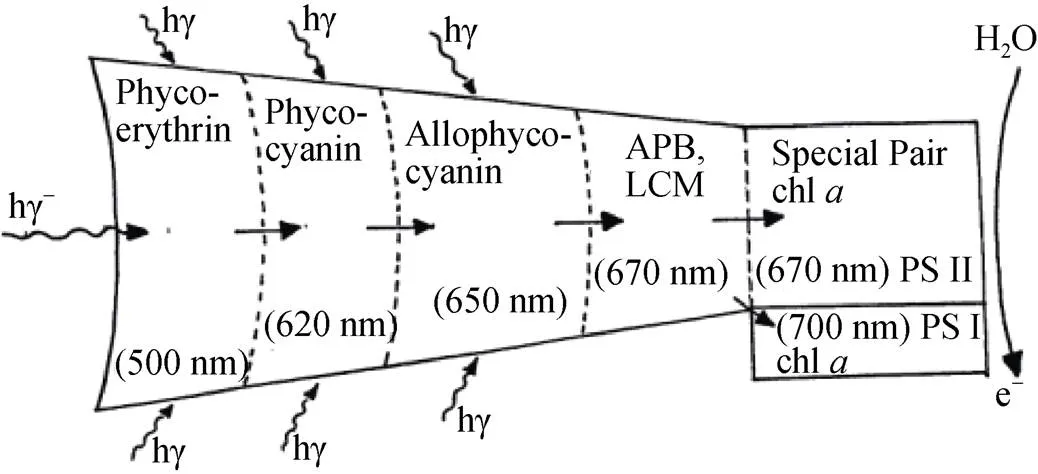
图5 能量在藻胆体内的传递[7]
研究藻胆体内能量传递的方法中, 较为常用的有: (1)构建藻胆体某些组分缺失的突变体; (2)通过共价交联来构建能量传递模型; (3)利用X-射线晶体结构分析技术和超快时间分辨光谱技术研究能量传递的过程; (4)运用LB膜技术, 经过人为的排列和组合, 组装有序的藻胆蛋白分子。
2007年, 董春霞等[38]通过构建apcD缺失突变体、apcF缺失突变体和apcD-apcF双缺失突变体, 对sp. PCC7120的光能传递和状态调节进行了研究。1996年, 王广策等[39-40]构建了3种共价的藻胆蛋白能量传递模型, 分别是螺旋藻的PC-APC共价交联体, 多管藻R-PE和螺旋藻C-PC的共价交联体, 以及多管藻R-PE和螺旋藻APC的交联体。王广策希望以共价交联代替连接多肽, 通过比较交联体和天然藻胆体的差异, 研究连接多肽和γ亚基在藻胆蛋白高效传能中的作用。实验结果表明, 共价交联后, 不同藻胆蛋白之间虽然能进行能量传递, 但效率明显低于天然的藻胆体。虽然APC的吸收峰为650 nm, 供体R-PE的荧光发射峰在580 nm, 二者没有光谱重叠, 但R-PE和APC供价交联后, 二者之间也存在着能量传递, 效率约为57%。这种传能机制可能是激子传递, 因为交联后分子之间的距离小于2 nm。虽然螺旋藻PC的荧光发射光谱和APC的吸收光谱重叠, 但是将螺旋藻的PC和APC溶液混合后, 二者之间不能发生能量传递。当螺旋藻PC和APC共价交联后, 则可以发生能量传递, 由于共价连接后二者之间的距离更近, 所以实验结果表明色基之间的距离对于能量传递效率具有很大的影响[25]。近年来, 超快时间分辨光谱技术研究也被应用于研究藻胆体内能量的传递过程[41-48]。此外, 利用LB膜技术可以模拟藻胆体的组装, 通过对不同藻胆蛋白进行人为的排列, 组装的复合物可以更为方便的研究能量传递的过程[49-50]。
目前已经报道了大量藻胆蛋白的高分辨率晶体结构, 这不仅为藻胆体装配过程提供了线索, 同时也为研究能量传递提供了依据。虽然藻胆体的能量传递功能与其本身的结构密切相关, 但是其结构却因为培养件的不同而呈现多样化, 例如“杆状复合物”的长度可以随光照、温度、CO2和氮源等培养条件的不同而变化, 因此关于“杆状复合物”能量传递的机制研究较多。藻胆体的“杆状复合物”, 通常由3~5个同种藻胆蛋白垛叠在一起。关于能量在“杆状复合物”中的传递途径, 目前有两种模型。一种是“限制动力学”模型(Diffusion-limited kinetic model)[27]。该模型认为能量在(αβ)3形成的圆盘结构之间的传递是限速步骤, 能量的传递时间与杆的长度成正比; 另一种模型是“陷阱限制”模型(Trap-limcited model)[51]。该模型认为, 能量可以在“杆状复合物”内自由传递, 藻红蛋白与藻蓝蛋白交界处的能量传递是限速步骤。由于蓝藻藻胆体通常不含有藻红蛋白, 其限速步骤由藻蓝蛋白与别藻蓝蛋白交界处的“陷阱”代替。
通过电子显微镜观察, 发现在藻胆体内, 不同的藻胆蛋白间存在5种常见的组装方式(图6)[52]。PC和APC的组装方式主要是“back to side”。PE和PC六聚体之间的组装方式主要是“back to back”。当以“back to back”方式组装的PE和PC六聚体是R-PE和R-PC时, R-PE和R-PC六对色基间的距离均小于40 Å, 能量从R-PE传递到R-PC的途径可能是: PEβ84→PCα84 (35 Å), PEβ84→PCβ84(27 Å), PEα84→PCβ84(35 Å), PEα84→PCα84(32 Å), PEβ50→PCβ84(35 Å)。PEβ50和PCβ84色基间的相对距离并不利于能量的传递, 所以PEβ50→PCβ84常作为辅助途径[52]。以“back to back”方式组装的过程中, PEβ155、PEα140α和PCβ155通常不参与能量传递[43]。R-PE 1.9 Å分辨率的晶体结构显示, PEα140和PCβ155色基之间的距离约3.4 Å, 推测PE和PC间存在“parallel side to side”组装方式, 使能量能够有效地从PEα140传递给PCβ155。
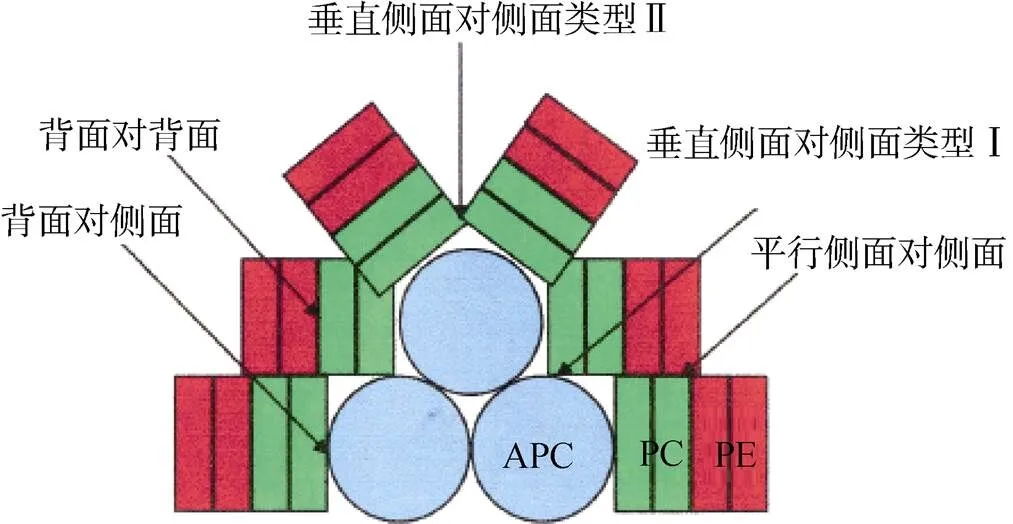
图6 藻胆蛋白的组装类型
3 结语
自20世纪以来, 研究人员对藻胆体和藻胆蛋白进行了大量的研究, 获得了很多高分辨率的藻胆蛋白晶体结构。相对于光合作用的其他蛋白结构, 藻胆蛋白构成的藻胆体具有更为复杂的结构和更为灵活的组装方式, 在2017年之前仅有两种蓝藻完整藻胆体结构被解析, 分别是陆生发菜藻胆体(分辨率为2.8 nm)和鱼腥藻sp.藻胆体(分辨率为2.1 nm)。此外, 由于缺乏连接蛋白的结构信息, 所以目前关于完整藻胆体组装过程的报道也较少。
在过去的10年中, 关于藻胆体内部和藻胆蛋白之间的能量传递过程的研究进展也较为缓慢。一方面, 由于藻胆蛋白的空间结构是柔性的, 藻胆蛋白的色基构象也处于动态变化中, 色基与所处的微环境之间存在着错综复杂的相互作用, 计算机无法模拟出复杂的动态变化过程; 另一方面, 藻胆体内通常含有几百个色基, 能量传递的途径复杂, 并且传递形式多样。
2017年10月, 隋森芳团队攻克了藻胆体在制样时稳定性差、具有优势取向等难题, 首次报道了完整红藻藻胆体的近原子分辨率的三维结构, 为揭示藻胆体的组装过程和光能传递过程提供了基础。随着研究的深入, 未来若能将物理科学和生命科学相交叉, 充分运用圆二色光谱技术、瞬态光谱实验研究技术、冷冻电镜单颗粒三维重构技术、STM操纵、局域电场的共振增强调控等技术, 对藻胆体的结构以及能量传递过程进行更为深入细致的研究, 有希望在光合作用领域取得更多的突破性成果。
[1] Gantt E, Conti S F. The ultrastructure of[J]. Journal of Cell Biology, 1965, 26(2): 365- 381.
[2] Gantt E, Conti S F. Granules associated with the chloroplast lamellae of[J]. Journal of Cell Biology, 1966a, 29(3): 423-434.
[3] Gantt E, Conti S F. Phycobiliprotein localization in algae[J]. Brookhaven Symposia in Biology, 1966b, 19(19): 393- 405.
[4] Edwards M R, Gantt E. Phycobilisomes of the thermophilic blue-green alga[J]. Journal of Cell Biology, 1971, 50(3): 896-898.
[5] Gantt E, Conti S F. Ultrastructure of blue-green algae[J]. Journal of Bacteriology, 1969, 97(3): 1486-1488.
[6] Wildman R B, Bowen C C. Phycobilisomes in blue- green algae[J]. Journal of Bacteriology, 1974, l117: 866- 881.
[7] Sidler W A. Phycobilisome and Phycobiliprotein Structures[M]. The Molecular Biology of Cyanobacteria. Springer: Springer Netherlands Press, 1994, 139-216.
[8] Glazer A N. Phycobilisome a macromolecular complex optimized for light energy transfer[J]. Bba Reviews on Bioenergetics, 1984, 768(1): 29-51.
[9] Glazer A N. Light guides directional energy transfer in a photosynthetic antenna[J]. Journal of Biological Chemistry, 1989, 264(1): 1-4.
[10] Yamanaka G, Glazer A N. Dynamic aspects of phycobilisome structure—phycobilisome turnover during nitrogen starvation insp.[J]. Archives of Microbiology, 1980, 124: 39-47.
[11] Elmorjani K, Thomas J C, Sebban P. Phycobilisomes of wild type and pigment mutants of the cyanobacteriumPCC 6803[J]. Archives of Microbiology, 1986, 146(2): 186-191.
[12] 林瀚智. 藻胆体结构多样性研究及黄海绿潮早期形成过程分析[D]. 北京: 中国科学院大学, 2012.
Lin Hanzhi. Structural Diversity Research of Phycobilisome and Analysis on Early Development of Green Tide in Yellow Sea[D]. Beijing: University of Chinese Academy of Sciences, 2012.
[13] Glauser M, Bryant D A, Frank G, et al. Phycobilisome structure in the cyanobacteriaandsp. PCC 7120[J]. European Journal of Biochemistry, 1992, 205(3): 907-915.
[14] Gantt E, Lipschul C A. Phycobilisomes of. 1. Isolation[J]. Journal of Cell Biology, 1972, 54: 313-324.
[15] Guglielmi G, Cohenbazire G, Bryant D A. The structure ofand its phycobilisomes[J]. Arch Microbiol , 1981, 129: 181-189.
[16] Zhang J, Ma J, Liu D, et al. Structure of phycobilisome from the red alga Griffithsia pacifica[J]. Nature, 2017.
[17] Marquardt J, Senger H, Miyashita H, et al. Isolation and characterization of biliprotein aggregates from, a Prochloron-like prokaryote containingmainly chlorophyll d [J]. FEBS Lett, 1997, 410: 428-432.
[18] Wehrmeyer W, Zimmermann C, Ohki K, et al. On a new type of cyanobacterial phycobilisome exemplified inGomont[J]. European Journal of Cell Biology, 1988, 46: 539-546.
[19] Wang G, Zhou B, Zeng C. Isolation, properties and spatial site analysis of γ subunits of B-phycoerythrin and R-phycoerythrin [J]. Science China Life Sciences, 1998, 41(1): 9.
[20] Maccoll R. Cyanbacterial phycobilisomes[J]. Journal of Structural Biology, 1988, 124: 311-334.
[21] Brown S B, Houghton J D, Vernon D I. New trends in photobiology biosynthesis of phycobilins. Formation of the chromophore of phytochrome, phycocyanin and phycoerythrin[J]. Journal of Photochemistry, 1990, 5(1): 3-23.
[22] Föster T. Deloealized excitation and exeitation transfer[J]. Modern Quantum Chemsty, 1965, 3: 93-137.
[23] Föster T. Mechanisms of energy transfer[J]. Comprehensive Bioehemisyty, 1967, 22: 61-80.
[24] 马圣媛. 紫球藻藻红蛋白和藻蓝蛋白共价交联物的构建及其与天然藻胆体特性的比较研究[D]. 青岛: 中国科学院海洋研究所, 2001.
Ma S Y. Construction of B-phycoerythrin-R-phycocyanin conjugate and comparative study on properties of the conjugate and natural phycobilisome from porphyridium cruntum[D]. Qingdao: The Institute of Oceanology, Chinese Academy of Sciences, 2001.
[25] Katju A, Brejc R F R H. Isolation, Crystallization, Crystal Structure Analysis and Refinement of Allophycocyanin[J]. Journal of Molecular Biology, 1995, 145: 421-423.
[26] Gantt E. Structure and function of phycobilisomes: light harvesting pigment complexes in red and blue- green algae[J]. International Review of Cytology, 1980, 66: 45-80.
[27] Glazer A N. Light harvesting by phycobilisomes[J]. Annual Review of Bioengineering and Biophysical Chemmistry, 1985, 14(14): 47-77.
[28] 任彦亮. 几种生物光合色素分子体系电子激发光谱的理论研究[D]. 武汉: 华中师范大学, 2007.
Ren Yanliang. A Theoretical Study of the Electron Excitation Spectra of Bio-chromophores of Interest[D]. Wuhan: Central China Normal University, 2007.
[29] Silbey R. Electronic Energy Transfer in Molecular Crystals[J]. Annual Review of Physical Chemistry, 2003, 27(1): 203-223.
[30] Fleming G R, Cho M. Chromophore-solvent dynamics[J]. Annual Review of Physical Chemistry, 2003, 47(47): 109-134.
[31] 陈敏, 王宁, 杨多利, 等. 隐藻藻胆蛋白的结构与能量传递功能[J]. 植物生理学报, 2015, 12: 2070-2082.
Chen Min, Wang Ning, Yang Duoliet at. The Structure and Energy Transfer of Phycobiliproteins in Cryptophytic Algae[J]. Plant Physiology Journal, 2015, 12: 2070- 2082.
[32] Engel G S, Calhoun T R, Read E L, et al. Evidence for wavelike energy transfer through quantum coherence in photosynthetic systems[J]. Nature, 2007, 446(7137): 782.
[33] Harel E, Engel G S. Quantum coherence spectroscopy reveals complex dynamics in bacterial light-harvesting complex 2 (LH2)[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(3): 706-711.
[34] Collini E, Wong C Y, Wilk K E, et al. Coherently wired light-harvesting in photosynthetic marine algae at ambient temperature [J]. Nature, 2010, 463(7281): 644- 647.
[35] Adir N. Elucidation of the molecular structures of components of the phycobilisome: reconstructing a giant[J]. Photosynthesis Research, 2005, 85(1): 15-32.
[36] Maccoll R. Allophycocyanin and energy transfer[J]. Biochimica Et Biophysica Acta, 2004, 1657: 73-81.
[37] Zilinskas B A, Greenwald L S. Phycobilisome structure and function[J]. Photosynthesis Research, 1986, 10(1): 7-35.
[38] 董春霞. 蓝细菌sp. PCC 7120藻胆体吸收光能的状态调节研究[A]. 上海: 中国植物生理学会, 2007, 1.
Dong Chunxia. Study on the regulation of light energy absorbed by cyanobacteriasp. PCC 7120[A]. Shanghai: Chinese Society for Plant Physiology, 2007, 1.
[39] 王广策, 周百成, 曾呈奎. 钝顶螺旋藻C-藻蓝蛋白和异藻蓝蛋白能量传递模型的构建[J]. 科学通报, 1996, 41(8): 741-743.
Wang Guangce, Zhou Baicheng, Zeng Chengkui. Construction of energy transfer model ofC-Phycocyanin and Allophycocyanin[J]. Chinese Science Bulletin, 1996, 41(8): 741-743.
[40] 王广策, 曾呈奎. 钝顶螺旋藻C-藻蓝蛋白分子内不同基团间能量传递的研究[J]. 海洋与湖沼, 1998, 42 (5): 471-476.
Wang Guangce, Zeng Cengkui. Studies on Energy Transfer between different groups inC-Phycocyanin[J]. Oceanologia Et Limnologia Sinica, 1998, 42(5): 471-476.
[41] 王慧, 赵井泉, 蒋金丽. 螺旋藻变藻蓝蛋白内能量传递机制的研究[J]. 生物物理学报, 1999, 15(2): 386- 392.
Wang Hui, Zhao Jingquan, Jiang Jinli. Picosecond Energy Transfer between chromophores in Allophycocyanin[J]. Acta Biophysica Sinica, 1999, 15(2): 386-392.
[42] 张建平, 谢洁, 赵井泉, 等. 多管藻中R-藻蓝蛋白能量传递途径及动力学[J]. 生物物理学报, 2001, 17(4): 767-772.
Zhang Jianping, Xie Jie, Zhao Jingquan. Studies on the Energy Transfer processes and dynamics in R-Phycocyanin from[J]. Acta Biophysica Sinica, 2001, 17(4): 767-772.
[43] 张景民, 郑锡光, 赵福利, 等. C-藻蓝蛋白六聚体内能量传递途径及其机制[J]. 中国科学: 化学, 1998, 5: 445-452.
Zhang Jingmin, Zheng Xiguang, Zhao Fuli, et alPathway and mechanism of Energy Transfer in C-phycocyanin hexamer[J]. Science in China: Chemistry, 1998, 5: 445- 452.
[44] 张景民, 郑锡光, 赵福利, 等. 变藻蓝蛋白内能量传递过程的物理机制-Ⅰ. 单体内的能量传递机制研究的理论方法和实时探测[J]. 科学通报, 1999, 44(1): 40-44.
Zhang Jingmin, Zheng Xiguang, Zhao Fuli, et al. Physical Mechanism of Energy Transfer Process in Allophycocyanin-Ⅰ. Theoretical Methods and Real-time Detection of Energy Transfer Mechanism in Monomers[J]. Chinese Science Bulletin, 1999, 44(1): 40-44.
[45] Debreczeny M P, Sauer K, Zhou J, et al. Comparison of calculated and experimentally resolved rate constants for excitation energy transfer in C-Phycocyanin.II trimers [J]. Journal of Physical Chemistry, 1995, 99(20): 8420-8431.
[46] Gillbro T, Åke Sandström Sundström V, Holzwarth A R. Polarized absorption picosecond kinetics as a probe of energy transfer in phycobilisomes of6301[J]. Febs Letters, 1983, 162(1): 64-68.
[47] Yokono M, Akimoto S, Koyama K, et al. Energy transfer processes in, PCC 7421 that possesses phycobilisomes with a unique morphology[J]. Biochimica Et Biophysica Acta, 2008, 1777(1): 55-65.
[48] Zhang J M, Zhao J Q, Jiang L J. Studies on the energy transfer among the rod-core complex from phycobilisome of, by time resolved fluorescence emission and anisotropy spectra[J]. Biochimica Et Biophysica Acta Bioenergetics, 1997, 1320(3): 285-296.
[49] He J A, Jiang L J, Jiang L, et al. Orientational and spectroscopic studies of—films of a photodynamic pigmental protein, allophycocyanin[J]. Langmuir, 1996, 12(7): 1840-1845.
[50] He J A, Jiang L J, Jiang L, et al. Langmuir-blodgett films of phycobiliproteins (I)-monomolecular film and conformational studies of R-phycoerythrin[J]. Science in China, 1996(3): 105-114.
[51] Suter G W, Holzwarth A R. A Kinetic Model for the Energy Transfer in Phycobilisomes[J]. Biophysical Journal, 1987, 52(5): 673.
[52] Jiang T, Zhang J P, Chang W R. et al. Crystal structure of R-phycocyanin and possible energy transfer pathways in the phycobilisome[J]. Biophysical Journal, 2001, 81(2): 1171-1172.
Structure and Energy Transfer of Phycobilisome
WANG Xiao-xiao1, 2, QIN Song1, YANG Ge2, LI Wen-jun1
(1. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China; 2. Academy of Life Science, Qufu Normal University, Qufu 273165, China)
Phycobilisome (PBS) is a unique light-harvesting pigment complex of red algae and cyanobacteria. It consists of water-soluble phycobiliproteins and linker polypeptides. PBS plays an important role in absorbing and transferring energy during photosynthesis. PBS, as a water-soluble protein complex, is located on the stroma side of the thylakoid with an average molecular weight of up to 10 Mu. PBS can harvest light energy of different wavelengths and can transfer energy to the photoreaction center with an efficiency of more than 95%. Due to its broad absorption wavelength range and environmental friendliness, PBS has great research significance in the theoretical and practical applications of photosynthesis. This review summarizes the research progress on the structure and energy transfer of PBS.
phycobilisome; phycobiliproteins; structure; energy transfer
(本文编辑: 梁德海)
[National Marine Economic Innovation and Development Demonstration (Marine Economic Development and Innovation Demonstration City Start-up Fund) Project, No.YHCX-SW-Y-2017-01; Yantai Science and Technology Plan Project, No.2016JHZB007]
Jan. 22, 2017
王肖肖(1990-), 女, 山东济宁人, 硕士研究生, 研究方向为生物学, 电话: 0535-2109089, E-mail: cpra_yic@sina.com; 李文军,通信作者, 博士, 助理研究员, 研究方向为海洋生物学, 电话: 15605350917, E-mail: wjli@yic.ac.cn
Q944
A
1000-3096(2017)12-0139-07
10.11759/hykx20170627002
2017-01-22;
2017-05-15
国家海洋经济创新发展示范(海洋经济发展创新示范城市启动基金)项目(YHCX-SW-Y-201701); 烟台市科技计划项目(2016JHZB007)

