壳寡糖对海南热带糙海参免疫相关酶的影响
刘均玲, 康静玮, 符中环, 马 莎
壳寡糖对海南热带糙海参免疫相关酶的影响
刘均玲1, 2, 康静玮1, 2, 符中环1, 2, 马 莎1, 2
(1. 海南大学 热带生物资源教育部重点实验室, 海南 海口 570228; 2. 海南大学 海洋学院, 海南 海口 570228)
本研究测定了壳寡糖对海南热带糙海参()体腔液和体壁组织中免疫相关因子, 酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LSZ)和溶血素活性的影响。结果表明, 投喂0.5%壳寡糖对糙海参体腔液中AKP、ACP、LSZ和溶血素活性均有明显增强作用(<0.05), 其中对ACP和LSZ活力有极显著的影响(<0.01), 且投喂6 d内活性均持续增强; 0.5%壳寡糖对体壁组织匀浆液中AKP、ACP活性明显增强(<0.05), 但随着时间延长, 对体壁组织中LSZ和溶血素作用不明显。壳寡糖可以提高海南热带糙海参()的非特异性免疫力。
糙海参(); 酸性磷酸酶; 碱性磷酸酶; 溶菌酶; 溶血素; 壳寡糖
糙海参(), 热带海参优质品种, 皮质粗糙, 体色多呈灰白并具有深色条纹, 属于棘皮动物门(Echinodermata)海参纲(Holothuriidae)中瘤海参亚属(), 主要分布在潮流强、海草多的岸礁边缘或水深10 m以内的浅海海域[1]。海南热带糙海参生长周期较短, 适应性强, 肉厚味美, 成为有潜力的沿海海参养殖种类[2-3]。但随着养殖密度的增加和养殖时间的延长, 糙海参养殖病害问题越来越严重[4]。且大量抗生素的使用, 使有害菌产生耐药性, 在动物体内产生药物残留[5-6]。影响海参生长的因素有很多, 比如水温是刺参生长重要的环境因子, 可以影响消化酶、代谢酶和免疫酶活力[7-8]。其中最重要的是其自身特有的免疫机制, 因此对海参免疫机能的分析, 不仅可以了解免疫的变化, 而且还可以进一步探讨其生态免疫机理[9]。
壳寡糖(chitooligosaccharid, COS)是由2~10 个氨基葡萄糖以-l, 4糖苷键连接而成的低聚糖, 是自然界中唯一的碱性寡糖, 具有相对分子质量小、毒性低、水溶性好、吸收率高等特点。目前, 寡糖在水产动物上的应用越来越多。Shibata等[10]研究证明, 壳寡糖能提高小鼠生产性能和非特异性免疫功能。蔡雪峰等[11]的研究表明, 壳寡糖可显著提高虹鳟的非特异性免疫和抗感染能力。Staykov等[12]在虹鳟饲料中添加甘露寡糖, 结果显示, 甘露寡糖能显著激活虹鳟补体系统, 提高溶菌酶活力和抗体滴度, 增强其免疫功能, 减少死亡率。刘美思等[13]研究报道, 海洋寡糖COS作为仿刺参()的免疫增强剂, 可有效提高幼参的生长性能和免疫力。然而, 壳寡糖用于海南热带糙海参()的研究还未见报道。
本研究拟针对糙海参的免疫系统的特点, 研究壳寡糖对糙海参体腔液和体壁组织免疫相关酶的作用, 通过对比分析, 为深入研究糙海参免疫防御机制提供基本的理论基础, 以期为养殖中糙海参疾病的预防和治疗提供理论基础。
1 材料和方法
1.1 糙海参
实验所用糙海参()于2014年11月采自海南省陵水县黎安港, 体质量45~70 g, 暂养于室内, 充气, 水温(16±1)℃, 盐度30±1, pH7.4± 0.4, 每天更换海水, 使盐度恒定[2]。实验前, 对实验参饥饿24 h。
实验设计: 空白对照, 健康糙海参未投喂0.5%壳寡糖; 实验处理, 健康糙海参投喂0.5%壳寡糖。每个处理3个重复, 实验期间养殖条件相同, 每天更换海水, 并检测温度、盐度、pH等指标, 于投喂后第1、2、3、4、5、6 天制备体腔液和体壁组织液, 测定相关免疫因子。
1.2 实验方法
1.2.1 体腔液的制备
将糙海参, 从腹部距口1/3处抽取体腔液, 4℃ 500 r/min离心10 min, 取上清1 mL, –4℃冰箱保存备用。
1.2.2 体壁酶液的制备
将糙海参体壁组织称重后, 加入体壁组织4倍体积的预冷生理盐水于组织匀浆机中搅拌, 收集研磨液, 4℃下4 000 r/min离心10 min, 取上清, –4℃冰箱保存备用。
1.2.3 溶菌酶活性测定
溶菌酶(LZS)活性通过浊度比色法测定[14]。将活化后的溶壁微球菌(Micrococcus lysoleikticus, 购于广东微生物菌种保藏中心)用0.l mol/L pH6.4的磷酸缓冲液稀释至570为0.35。实验条件下, 以每mL样品每min吸光值减少0.001为1个酶活性单位(U)。
1.2.4 酸性磷酸酶和碱性磷酸酶活性测定
碱性磷酸酶(AKP)、酸性磷酸酶(ACP)活性的测定采用磷酸苯二钠法[15]。
1.2.5 溶血素含量测定
取2.5 mL鸡红细胞悬液加0.1 mL血清(对照组用0.1 mL的生理盐水代替血清), 37℃保温30 min后, 1 000 r/min离心2 min, 于540 nm处测光吸收值。溶血素含量表示为: 所测值´稀释倍数。
1.3 数据处理
数据处理采用Excel和dps进行方差分析, 最小显著差数法(LSD)进行多重比较。
2 结果与分析
由表1可知, 投喂0.5%壳寡糖对糙海参体腔液中免疫相关因子LSZ、ACP、AKP和溶血素活性均有显著的影响(<0.05), 其中对ACP和LSZ活力有极显著的影响(<0.01)。
由表2可知, 投喂0.5%壳寡糖对糙海参体壁组织中免疫相关因子LSZ、ACP、AKP和溶血素活性均有显著的影响(<0.05), 其中对ACP、AKP和LSZ活力有极显著的影响(<0.01)。
2.1 壳寡糖对糙海参AKP活性的影响
投喂0.5%壳寡糖后, 糙海参体腔液和体壁组织中AKP活性均升高。图1表明, 糙海参在投喂0.5%壳寡糖2 d后, 6 d内体腔AKP活性呈现逐渐升高的趋势, 其中前3 dAKP活性变化不明显, 从第4天开始AKP活性逐渐增强。图2表明, 糙海参在投喂0.5%壳寡糖2 d后, 6 d内体壁组织AKP活性呈现逐渐升高的趋势, 其中前4 dAKP活性变化比较缓慢, 平稳上升, 从第5天开始AKP活性明显增强。
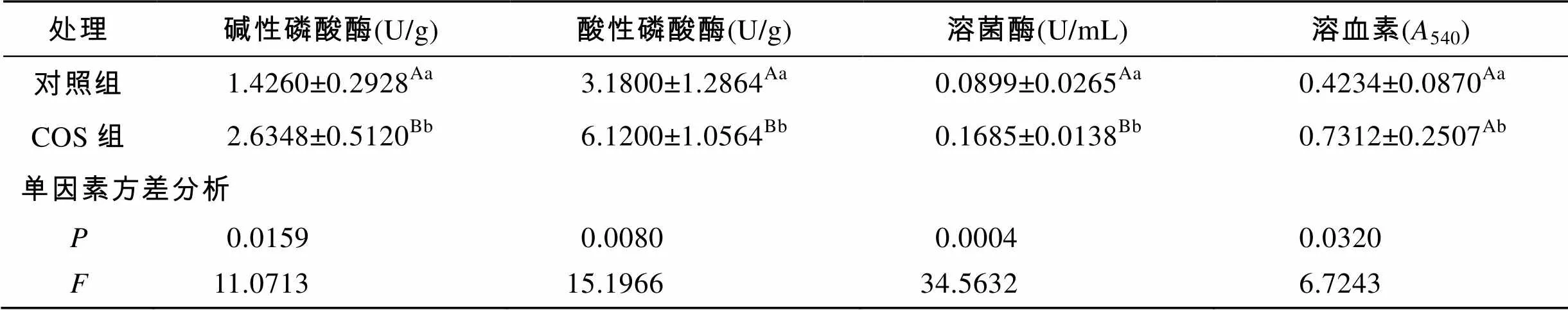
表1 壳寡糖对糙海参体腔液酶的影响(平均值±标准误)
注: 标有不同小写字母上标表示差异显著(<0.05), 标有不同大写字母表示差异极显著(<0.01)
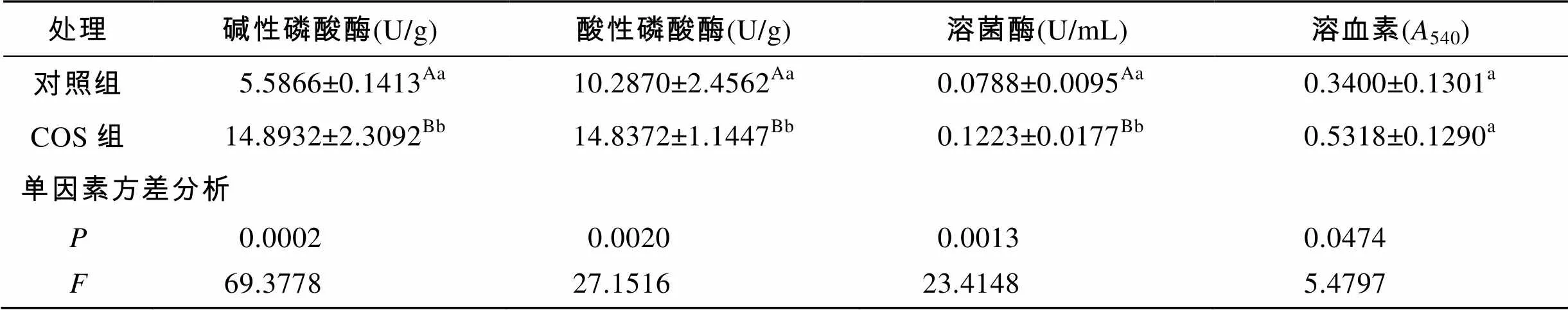
表2 壳寡糖对糙海参体壁酶相关因子的影响(平均值±标准误)
注: 标有不同小写字母上标表示差异显著(<0.05), 标有不同大写字母表示差异极显著(<0.01)
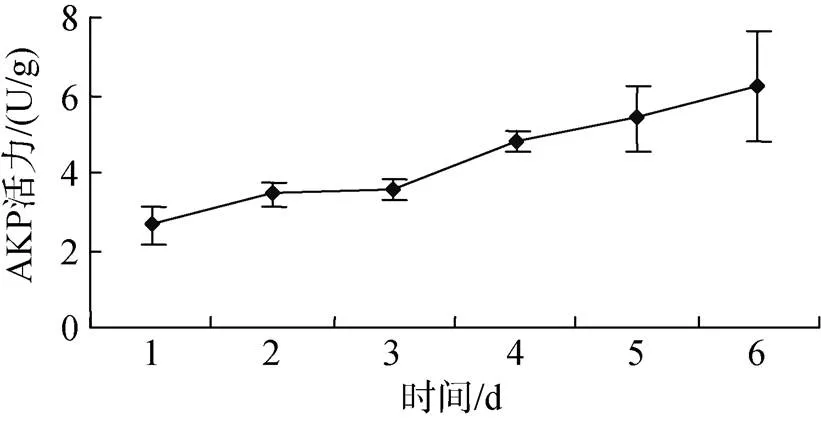
图1 壳寡糖对体腔AKP活性的影响
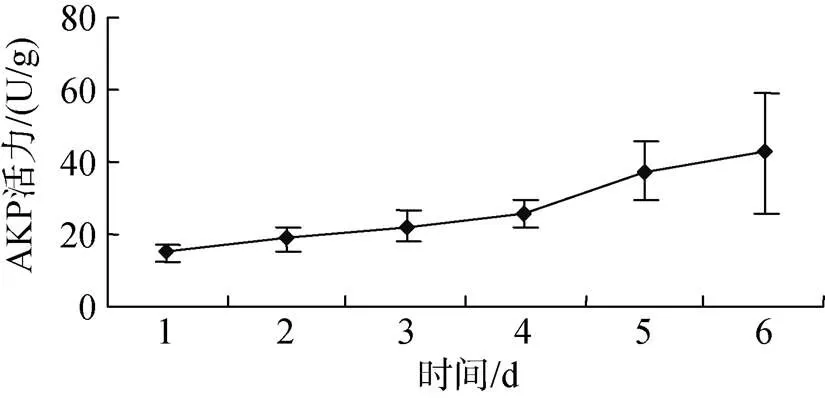
图2 壳寡糖对体壁组织AKP活性的影响
2.2 壳寡糖对糙海参ACP活性的影响
投喂0.5%壳寡糖后, 糙海参体腔液中ACP活性逐渐升高, 体壁组织ACP活性先增强再减弱。图3表明, 糙海参在投喂0.5%壳寡糖2 d后, 6 d内体腔ACP活性呈现逐渐升高的趋势, 其中第2天ACP活性变化明显, 之后每日ACP活性逐渐增强。图4表明, 糙海参在投喂0.5%壳寡糖2 d后, 6日内体壁组织ACP活性呈现先逐渐升高, 再缓慢降低的趋势, 其中前5 dACP活性平稳上升, 第5天ACP活性最高, 从第5天后ACP活性开始减弱。
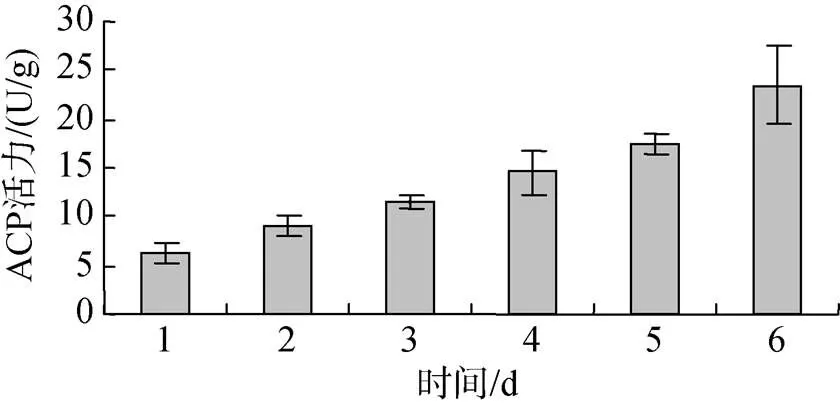
图3 壳寡糖对体腔ACP活性的影响
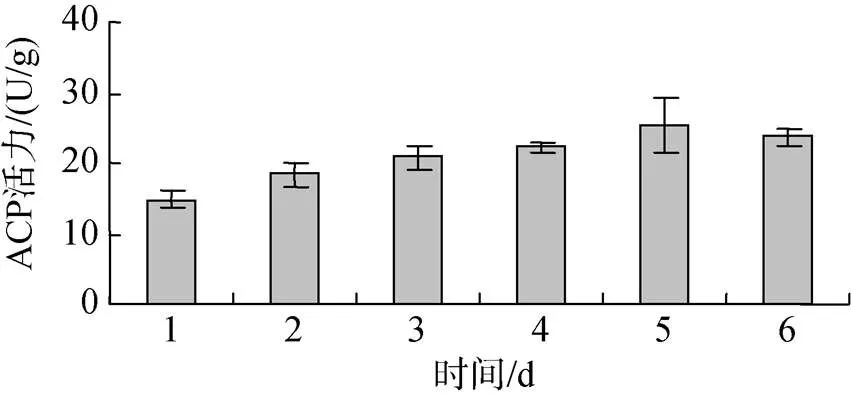
图4 壳寡糖对体壁组织ACP活性的影响
2.3 壳寡糖对糙海参LSZ活性的影响
投喂0.5%壳寡糖后, 糙海参体腔液中LSZ活性逐渐升高, 但是体壁组织LSZ活性先增强再减弱。图5表明, 投喂0.5%壳寡糖2 d后, 糙海参6 d内体腔LSZ活性呈现逐渐升高的趋势, 其中第4天LSZ活性变化最明显, 第5、6天体腔LSZ活性趋于稳定, 变化微弱。图6表明, 投喂0.5%壳寡糖2 d后, 糙海参6 d内体壁组织LSZ活性呈现先逐渐升高, 再缓慢降低的趋势, 其中前3 dLSZ活性平稳上升, 第3天LSZ活性最高, 从第3天后LSZ活性开始减弱, 第5、6天体壁组织LSZ活性趋于稳定。
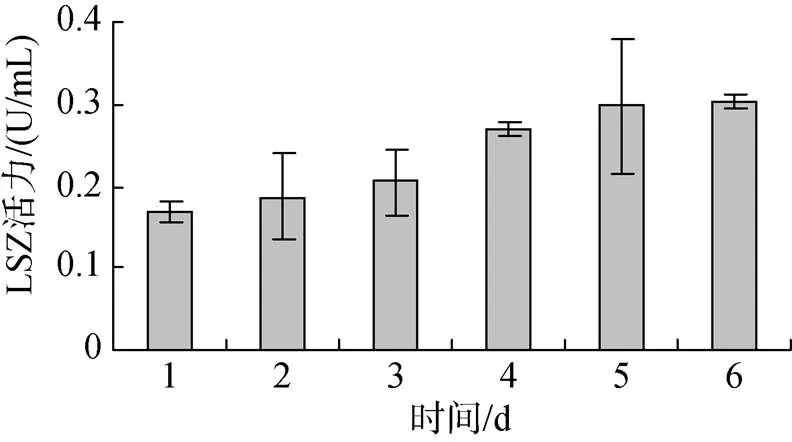
图5 壳寡糖对体腔LSZ活性的影响
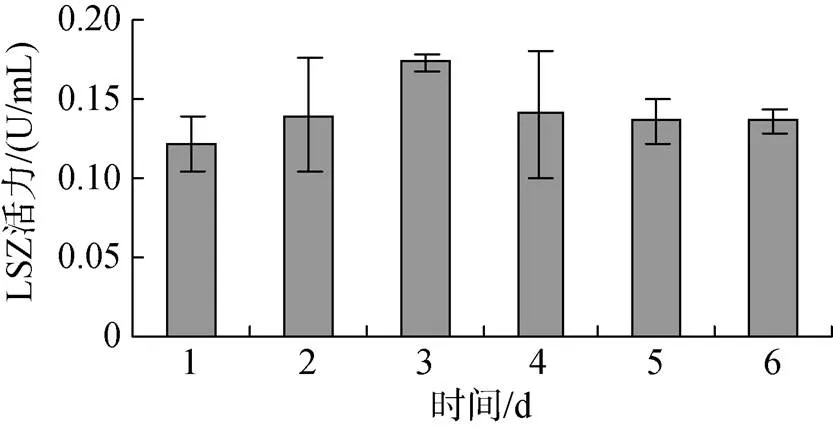
图6 壳寡糖对体壁组织LSZ活性的影响
投喂0.5%壳寡糖后, 糙海参体腔液中溶血素含量逐渐升高, 但是体壁组织LSZ活性先增强再减弱, 变化趋势不稳定, 这可能是由于LSZ主要由体腔细胞分泌, 体壁组织中LSZ含量极少的原因[16]。
2.4 壳寡糖对糙海参溶血素含量的影响
图7表明, 投喂0.5%壳寡糖, 糙海参6 d内体腔溶血素含量呈现小幅度逐渐升高的趋势, 第5、6天体腔溶血素含量趋于稳定, 变化微弱。
图8表明, 投喂0.5%壳寡糖, 糙海参6 d内体壁组织溶血素含量呈现先逐渐升高, 接着急剧降低, 再升高的趋势, 其中前4 d溶血素含量平稳上升, 在第4天达到最高, 第5天溶血素含量急剧减弱, 第6天体壁组织溶血素含量又升高。
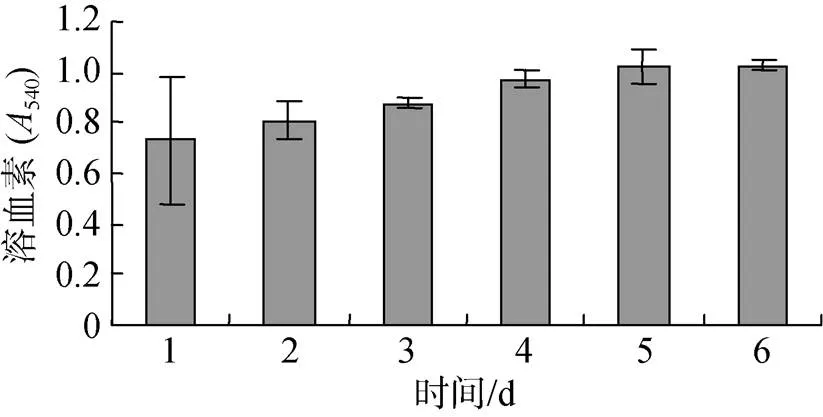
图7 壳寡糖对体腔溶血素含量的影响
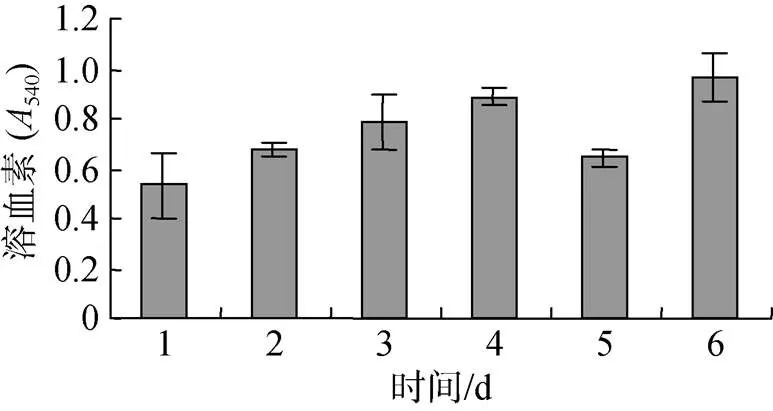
图8 壳寡糖对体壁组织溶血素含量的影响
3 讨论
碱性磷酸酶是一种对底物专一性要求比较低的磷酸单脂水解酶, 广泛存在于生物界, 是重要的解毒体系, 碱性环境下, 可使磷酸单脂水解为乙醇和磷酸。本研究中, 糙海参投喂0.5%壳寡糖6 d内, 体腔液、体壁组织中AKP活性持续升高。近年来, 免疫刺激物在水产生物上的应用研究逐渐受到重视。艾春香等[16]用不同剂量的VE刺激河蟹(), AKP活力有显著升高的趋势; 刘云等[17]研究报道, 刺参()口服不同剂量海藻硫酸多糖和壳聚糖, AKP活力显著增强; 刘树青等[18]用海藻多糖投喂中国对虾(), AKP活性也得到加强。但本实验中AKP活性在投喂结束第6天后, 会不会继续出现高活性值, 需要进一步的研究。
酸性磷酸酶是一种在酸性条件下催化磷酸单酯水解生成无机磷酸的水解酶, 主要存在于巨噬细胞, 定位于溶酶体内。本研究, 糙海参投喂壳寡糖6 d内, 与未投喂壳寡糖的对照海参相比, 糙海参体腔液和体壁组织匀浆液中ACP活性均有极显著的差异(<0.01),这与很多研究报道, 免疫多糖可以诱导ACP活性提高的结论相一致。刘树青等[18]报道中国对虾()摄食海藻多糖可提高ACP活性; 牟海津等[19]报道栉孔扇贝()口服海藻多糖免疫增强剂可以使ACP活性明显升高。
溶菌酶是许多生物组织和体液里普遍存在的碱性蛋白, 是吞噬细胞杀菌的物质基础, 可使革兰氏阳性细菌细胞壁的乙酰基多糖水解释放, 破坏和清除体内的异物。本实验结果显示, 投喂0.5%壳寡糖后, 糙海参体腔液中LSZ活性逐渐升高, 但是体壁组织LSZ活性先增强再减弱, 第3天活性达到最高, 0.5%壳寡糖对体壁组织LSZ活性影响总体不明显。沈锦玉等[20]通过实验证明, 中华绒螯蟹口服壳聚糖免疫增强剂以后的第9天, 血清溶菌酶活性与对照组相比显著增强(<0.05), 这和本实验研究结果基本相同。而体壁组织匀浆液中LSZ活性先升高再降低, 可能是由于体壁组织中LSZ含量很少, 或免疫疲劳等原因。Gopalakannan等[21]研究表明给鲤鱼()投喂壳聚糖饲料添加剂90 d, 其溶菌酶活性显著增强(<0.05)。
溶血素由体腔细胞分泌, 可以与靶细胞接触, 在细胞质膜上形成空洞, 使其裂解死亡[6]。本研究, 糙海参投喂0.5%壳寡糖后, 体腔液中溶血素含量逐渐升高, 但是体壁组织LSZ活性先增强再减弱再升高, 变化趋势不稳定。
综上, 投喂0.5%壳寡糖对糙海参体腔液中AKP、ACP、LSZ和溶血素活性均有明显增强作用, 对体壁组织匀浆液中AKP、ACP活性也有明显增强, 但对体壁组织中LSZ和溶血素作用不明显。江小璐等[22]在基础饲料中添加0.1%褐藻寡糖, 发现均能显著提高AKP、ACP的活性。因此, 寡糖可以提高动物的非特异性免疫力, 可能由于其具有免疫原性, 刺激了机体进行免疫应答, 作为外源抗原的佐剂, 减缓其吸收, 从而增强了动物的细胞和体液免疫反应[23-24]。本研究结论: 投喂壳寡糖可提高海南热带糙海参()免疫相关因子的活性。
[1] 杨学明, 张立, 甘西. 热带海参养殖的优良品种——糙海参[J]. 广西水产科技, 2010, 4: 18-21.
Yang Xueming, Zhang Li, Gan Xi. Tropical sea cucumber breeding fine varieties of sea cucumber[J]. Guangxi Aquatic Science and Technology, 2010, 4: 18-21.
[2] 姚雪梅, 王红勇, 邢少雷, 等. 不同水温和水质理化因子对糙海参摄食、生长影响研究[J]. 水产科学, 2007, 5: 292-295.
Yao Xuemei, Wang Hongyong, Xing Shaolei, et al. Study on the effects of different water temperature and water quality factors on the feeding and growth of rough sea cucumbers[J]. Aquatic Science, 2007, 5: 292-295.
[3] 姚雪梅, 黄勃, 张继涛. 海南的糙海参资源种群和增养殖前景[J]. 科学养鱼, 2003, 6: 5.
Yao Xuemei, Huang Bo, Zhang Jitao. The resource population and increasing breeding prospect of roughened sea cucumber in Hainan[J]. Scientific Fish Raising, 2003, 6: 5.
[4] 王印庚, 荣小军, 张春云, 等. 养殖海参主要疾病及防治技术[J].海洋科学, 2005, 29(3): 1-7.
Wang Yingeng, Rong Xiaojun, Zhang Chunyun, et al. The main diseases and control techniques of aquaculture sea cucumber[J]. Marine Sciences, 2005, 29 (3): 1-7.
[5] 宋宗岩. 海参腐皮综合症病因分析与防治[N]. 中国渔业报, 2005-12-19-005.
Song Zongyan. Analysis and prevention of the cause of skin rot syndrome of[N]. China Fisheries News, 2005-12-19-005.
[6] 张琴. 刺参(Selenka)高效免疫增强剂的筛选与应用[M]. 青岛: 中国海洋大学, 2010.
Zhang Qin. Screening and application of high efficiency immunization enhancer inSelenka[M]. QingDao: Ocean University of China, 2010.
[7] 茹小尚, 高天翔, 刘石林, 等. 温度对刺参繁殖期消化酶和代谢酶活力的影响[J].海洋科学, 2015, 39(3): 1-6.
Ru Xiaoshang, Gao Tianxiang, Liu Shilin, et al. The influence of temperature during the breeding period digestive and metabolic enzymes ofSelenka[J]. Marine Sciences, 2015, 39 (3): 1-6.
[8] 杨宁, 王文琪, 姜令绪, 等. 水温对刺参消化酶和免疫酶活力的影响[J]. 海洋科学, 2014, 38(11): 56-59.
Yang Ning, Wang Wenqi, Jiang Lingxu, et al. Influence of water temperature on digestive enzyme and immune enzyme activity of[J]. Marine Science, 2014, 38 (11): 56-59.
[9] 王方雨, 杨红生, 高菲, 等. 刺参体腔液几种免疫指标的周年变化[J]. 海洋科学, 2009, 33(7): 75-80.
Wang Fangyu, Yang Hongsheng, Gao Fei, et al. Annual changes in several immune indices of the coeluma coelal fluid [J]. Marine Sciencs, 2009, 33 (7): 75-80.
[10] Shibata Y, Foster L A, Metzger W J, et al. Alveolar macrophage priming by intravenous administration of chitin particles polymers of N-acetyl-D-gluco-samlne, in mice[J]. Infection and immunity, 1997, 65(5): 1734- 1741.
[11] 蔡雪峰, 罗琳, 战文斌, 等.壳寡糖对虹鳟幼鱼肠道菌群影响的研究[J].中国海洋大学学报, 2006, 36(4): 606-610.
Cai Xuefeng, Luo Lin, Zhan Wenbin, et al. Study on the effects of chitosan oligosaccharides on the intestinal microflora of young rainbow trout[J]. Journal of Ocean University of China, 2006, 36 (4): 606-610.
[12] Staykov Y, Spring P, Denev S, et al. Effect of a mannan oligosaccharide on the growth performance and immune status of rainbow trout ()[J]. A quaculture International, 2007, 15(2): 153-161.
[13] 刘美思, 程立坤, 罗希, 等. 两种海洋寡糖对仿刺参免疫活性的影响[J]. 2016, 38(1): 51-56.
Liu Meisi, Cheng Likun, Luo Xi, et al. The effects of two kinds of marine oligosaccharides on the immunological activity of[J]. 2016, 38(1): 51-56.
[14] Ellis A. Lysozyme assays. In Stolen J. Fletcher T, Anderson D, Robertsen B, Van Muiswinkel W, editors. Techniques in fish immunology[M]. Fair Haven, NJ: SOS Publications, 1990: 101-103.
[15] 黄旭雄. 中国明对虾免疫水平及免疫增强剂的研究[D]. 上海: 上海水产大学, 2005.
Huang Xuxiong. Study on immune level and immune enhancers of Chinese[D]. Shanghai: Shanghai Fisheries University, 2005.
[16] 艾春香, 陈立侨, 高露娇, 等. VE对河蟹血清和组织中超氧化物歧化酶及磷酸酶活性的影响[J]. 台湾海峡, 2002, 21(4): 431-438.
Ai Chunxiang, Chen Liqao, Gao Lujiao, et al. Effect of VE on serum and tissue of crab superoxide dismutase and phosphatase activity[J]. Taiwan Strait, 2002, 21 (4): 431-438.
[17] 刘云, 孔伟丽, 姜国良, 等. 2种免疫多糖对刺参组织主要免疫酶活性的影响[J]. 中国水产科学, 2008, 15(5): 2-4.
Liu Yun, Kong Weili, Jiang Guoliang, et al. Effects of 2 kinds of immuno polysaccharides on the activity of main immune enzymes in the tissue of the[J]. Chinese Fisheries Science, 2008, 15 (5): 2-4.
[18] 刘树青, 江晓路, 牟海津, 等. 免疫多糖对中国对虾血清溶菌酶、磷酸酶和过氧化物酶的作用[J]. 海洋与湖沼, 1999, 30(3): 278-283.
Liu Shuqing, Jiang Xiaolu Mou Haijin. Source of new biologically immune polysaccharide on, and so on.Chinese shrimp serum lysozyme, phosphatase and peroxidase[J]. Oceanologia and limnologia Sinica, 1999, 30(3): 278- 283.
[19] 牟海津, 江晓路, 刘树青, 等. 免疫多糖对栉孔扇贝酸性磷酸酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J]. 青岛海洋大学学报, 1999, 29(3): 463-468.
Mou Haijin, Jiang Xiaolu, Liu Shuqing, et al. The immune effect of polysaccharides ofin Shell acid phosphatase, alkaline phosphatase and superoxide dismutase activity[J]. Journal of Ocean University of Qingdao, 1999, 29 (3): 463-468.
[20] 沈锦玉, 刘问, 曹铮, 等. 免疫增强剂对中华绒螯蟹免疫功能的影响[J]. 浙江农业大学学报, 2004, 16(1): 25-29.
Shen Jinyu, Liu Wen, Cao Zheng, et al. Effects of immune enhancers on the immune function of[J]. Journal of Zhejiang Kasetsart University, 2004, 16 (1): 25-29.
[21] Gopalakannan A, Arul V. Immunomodulatory effects of dietary intake of chitin, chitosan and levamisole on the immune system of Cyprinus carpio and control of Aeromonas hydrophila infection in ponds[J]. Aquaculture, 2006, 255: 179-187.
[22] 江小璐, 杜以帅, 王鹏. 褐藻寡糖对刺参体腔液和体壁免疫相关酶活性变化的影响[J]. 中国海洋大学学报, 2009, 6: 1188-1192. Jiang Xiaolu, Du Yishuai, Wang Peng. Brown algae oligosaccharides affect the activity of immune related enzymes in body fluid and body wall of[J]. Journal of Ocean University of China, 2009, 6: 1188-1192.
[23] Bornet F R J, Brouns F. Immune-stimulating and gut health-promoting properties of short-chain fructo-oligosaccharides[J]. Nutrition reviews, 2002, 60: 326-334.
[24] 韩丽蓉. 壳寡糖、稀土及壳寡糖稀土配合物对刺参生长、免疫反应和抗病力的影响[M]. 青岛: 中国海洋大学, 2014.
Han Lirong. Effects of chitosan oligosaccharides, rare earth and chitosan oligosaccharides on the growth, immune response and resistance of[M]. Qingdao: Ocean University of China, 2014.
Effect of COS on immune factors in the Hainan tropical sea cucumber
LIU Jun-ling1, 2, KANG Jing-wei1, 2, FU Zhong-huan1, 2, MA Sha1, 2
(1. Key Laboratory of Tropical Biological Resources of Ministry of Education, Haikou 570228, China; 2. The Ocean College Hainan University, Haikou 570228, China)
The influence of chitosan oligosaccharide (COS) on immune factors in the Hainan tropical sea cucumberwas studied. Acid phosphatase (ACP), alkaline phosphatase (AKP), lysozyme (LSZ), and hemolysin activity were detected in the coelomic fluid and body wall. The result showed that feeding 0.5% COS significantly enhanced the activity of AKP, ACP, LSZ, and hemolysin in the coelomic fluid of(< 0.05), which has an extremely significant impacton the activity of ACP and LSZ (< 0.01). The activity was continuously enhanced in 6 days. Further, feeding 0.5% COS significantly enhanced the activity of AKP and ACP in the body wall (<0.05); however, over time, the effect on LSZ and hemolysin activity was not obvious. COS can improve the non-specific immune activity of.
ACPAKP; LSZ; hemolysin;
(本文编辑: 梁德海)
[Hainan province colleges and universities scientific research project, No.Hjkj2013-11; Hainan university youth fund project, No.qnjj1223]
Dec. 13, 2016
刘均玲(1975-), 女, 河北沧州人, 副教授, 主要从事海洋底栖生物学的研究, E-mail: 330108510@qq.com
Q178.1
A
1000-3096(2017)12-0026-06
10.11759/hykx20160601001
2016-12-13;
2017-03-11
海南省高等学校科学研究项目(Hjkj2013-11); 海南大学青年基金项目(qnjj1223)

