热处理对卵转铁蛋白抑菌效果的影响
唐 清, 刘 枫, 周 蓓, 杨严俊, 苏宇杰*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡214122;3.江苏康德蛋业有限公司,江苏 南通226600)
热处理对卵转铁蛋白抑菌效果的影响
唐 清1,2, 刘 枫1,2, 周 蓓3, 杨严俊1,2, 苏宇杰*1,2
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡214122;3.江苏康德蛋业有限公司,江苏 南通226600)
卵转铁蛋白(OVT)是一种具有结合铁能力的球蛋白,具有广谱的抗菌功能,其抑菌活性与其结构密切相关。作者研究热处理对卵转铁蛋白抑菌效果的影响,并通过对其二级结构和疏水作用的分析来揭示其抑菌效果的变化机理。结果表明:随着处理温度的升高,卵转铁蛋白对沙门氏菌和大肠杆菌的抑菌效果呈降低趋势;热处理后卵转铁蛋白的二级结构和疏水作用都发生了变化,随着处理温度的升高以及处理时间的延长,α-螺旋含量呈降低趋势,β-折叠含量呈升高趋势,表面疏水性明显增大,而热处理时间则与卵转铁蛋白的结构与活性无明显关联。
卵转铁蛋白;热处理;蛋白质结构;抑菌效果
卵转铁蛋白(OVT)是鸡蛋清中一种易溶的非结晶蛋白质分子,有两个球状叶瓣结构:N端瓣和C端瓣,并由一条α-螺旋的短肽连接。每一个瓣的肽链又缠绕成两个小区段(N1,N2和C1,C2),且每瓣的两个子区域通过两条反平行的β链连接,铁结合部位即位于两区段间的沟中[1]。每个蛋白质分子可以可逆地结合两个 Fe3+,同时结合两个 CO32-或HCO3-,使得整个OVT分子结构变得更加封闭、紧密,从而更加稳定。
OVT的抑菌活性在第一次被提纯时即被证实,其抑菌机理主要为“铁剥夺”机制,即OVT对铁离子具有较强的亲和性,而铁又是微生物生长繁殖必需的生长因子,OVT螯合了微生物生长必需的铁离子,从而达到抑制细菌生长的效果[2]。这种“铁剥夺”机制使得OVT具有广谱的抑菌功能[3]。但是不同菌种对该机制的敏感性不同,其中最敏感的是大肠杆菌等,抗性较强的为金黄色葡萄球菌等[4]。
OVT作为一种天然的抑菌剂和防腐剂[5],应用前景非常广阔,但它对温度极为敏感,食品加工中常见的热加工会对其结构性质造成一定的影响。详细系统地研究热加工处理后的OVT结构与抗菌性之间的变化关系可以为OVT的深加工提供理论依据,同时对深化蛋品加工、提高蛋品产业效益有重要的意义。作者通过荧光光谱、拉曼光谱等方法研究了热处理后OVT结构的变化,并进一步分析研究了结构变化对其抑菌活性的影响。
1 材料与方法
1.1 实验材料
1.1.1 材料 培养皿、无菌移液管、牛津杯(内径6 mm、外径8 mm、高10 mm)、镊子、接种环、无菌水、OVT:作者所在实验室自制;大肠杆菌(Escherichia coli),沙门氏菌(Salmonella):江南大学食品学院食品生物技术中心提供。
1.1.2 固体LB培养基 水20 mL,牛肉膏1 g,蛋白胨2 g,氯化钠1 g,琼脂4 g。调节pH至7.4,121℃下灭菌20 min。
1.1.3 液体LB培养基 水20 mL,牛肉膏0.2 g,蛋白胨0.4 g,氯化钠0.2 g。调节pH至7.4~7.6,121℃下灭菌20 min。
1.1.4 仪器 YX280A型手提式不锈钢蒸汽消毒器:上海三申医疗机械有限公司;F-7000荧光光谱仪:日本HITACHI公司;LabRAMHR Evolution拉曼光谱仪:法国 HORIBA Jobin Yvon S.A.S.公司; JobinSW-CJ-1FD型超净工作台:苏州安泰生物技术有限公司;SP-250A型生化培养箱:南京实验仪器厂;游标卡尺:哈尔滨量具刃具集团有限责任公司; FE-20型实验室pH计:梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 卵转铁蛋白的热处理 将纯化的OVT稀释至0.2 mg/mL,装在密封的玻璃管中,分别于65、75、85、95℃进行水浴加热处理,分别在5、15、30、45 min取样,并迅速置于冰水浴中冷却备用。
1.2.2 菌种活化与培养
1)菌种活化:取冻干菌种沙门氏菌和大肠杆菌。无菌条件下,在固体LB培养基平板上划线接种,置于37℃恒温培养16 h。
2)制备菌悬液:经活化的大肠杆菌和沙门氏菌在无菌条件下接种,挑取单菌落于液体培养基中,在37℃下恒温振荡培养16 h,将得到的菌液稀释备用。
1.2.3 卵转铁蛋白抑菌效果的研究 采用牛津杯法分析检测OVT的抑菌效果[6],在无菌操作下取0.1 mL菌液均匀涂布于冷却的固体培养基上,然后用无菌镊子将灭过菌的牛津杯轻轻放入培养皿中,每一培养皿置入3个牛津杯,在牛津杯中分别加入0.2 mL不同方式处理后的OVT和无菌水,注意不要让样品溢出牛津杯外,然后小心将培养皿移入37℃恒温培养箱中进行培养。培养24 h后测量各抑菌圈直径作为抑菌效果的指标。
1.2.4 卵转铁蛋白结构的研究
1)卵转铁蛋白表面疏水性分析:OVT表面疏水性的变化采用Takagil报道的荧光探针法检测[7]。将处理后的蛋白质样品溶于0.01 mol/L的磷酸盐缓冲液(pH 7.0)中得到质量浓度分别为0.02、0.04、0.06、0.08、0.10 mg/mL的蛋白质溶液,加入 5 μmol/L的8-苯氨基-1-萘磺酸(ANS)溶液20 μL,混匀,室温反应3 h,测其荧光强度(激发波长395 nm,发射波长467 nm)。以蛋白质质量浓度为横坐标,荧光强度为纵坐标作图,曲线初始阶段的斜率即为蛋白质分子的表面疏水性指数[8]。
2)卵转铁蛋白拉曼光谱分析:用拉曼光谱仪测定OVT的拉曼光谱,激发源为He-Ne激光(632.8nm),到达样品表面的功率小于10 mW。每个样品在400~1 800 cm-1的范围内重复扫描3次,仪器自动累积计算其平均值。使用OMINC软件进行去卷积、Peakfit软件进行曲线拟合和蛋白质各二级结构含量的计算[9]。以表1中各二级结构的峰值为基准进行分析。

表1 卵转铁蛋白各二级结构的峰值Table 1 Peak Value of secondary structure of OVT
2 结果与分析
2.1 热处理对抑菌效果的影响
抑菌效果用抑菌圈法[10]测定。图1表示经热处理后OVT分别对沙门氏菌和大肠杆菌的抑菌效果。比较图1(a)和(b)可以看出,经过热处理的OVT对大肠杆菌和沙门氏菌的抑菌效果变化趋势类似,抑菌效果均随着加热温度的升高和加热时间的延长而逐渐降低。通过对比发现,在65、75℃抑菌效果随处理时间延长呈现明显的下降趋势,而在85、95℃下抑菌效果的下降速度趋于平缓,这一结果和OVT的分子结构有着密切的关系。OVT分子的铁结合部位位于N端瓣和C端瓣的两区段间的沟中,铁原子深藏于分子中,这个沟可以在结合和释放Fe3+时发生构象变化[11]。而OVT受热易变性,在热处理后其分子结构发生改变,两区段间的沟结构开始展开,使得其结合铁离子的能力降低。由于OVT的抑菌机理主要为“铁剥夺”机制,所以随着结构的改变,沟结构的展开,抑菌效果降低。由图1的结果可以推断,在65、75℃时蛋白质结构开始发生变化,随着处理时间延长结构变化程度更明显,抑菌效果呈明显下降趋势,而在85、95℃下卵转铁蛋白分子结构发生彻底变性,所以随着处理时间的延长,其抑菌效果的变化并不明显。这与袁小军的结果存在差异,其研究结果为OVT在65~75℃热处理后对抑制沙门氏菌、大肠杆菌的能力没有太大的影响,但OVT经过75~85℃热处理后,抑菌能力减少较明显[10]。这可能是因为袁小军用于抑菌的OVT溶液蛋白质浓度较低,在热处理后变性程度不明显,最终导致与本研究结果存在差异。

图1 热处理后卵转铁蛋白对沙门氏菌和大肠杆菌的抑菌效果Fig.1 Effect of heat treatment on antibacterial activity of OVT
2.2 热处理对蛋白质结构的影响
2.2.1 蛋白质疏水作用的变化 由图2可以看出,热处理5 min时,OVT溶液在65、75℃时依然保持相对澄清,但是经过85、95℃处理后蛋白质分子发生聚集,产生白色絮状凝聚物。这是由于热处理后蛋白质的疏水性发生变化所导致的。

图2 不同温度下对卵转铁蛋白热处理5 min的影响Fig.2 Effect of heat treatment on OVT at different temperatures after 5 minutes
蛋白质中氨基酸残基非极性侧链之间的疏水相互作用是维持蛋白质独特三维结构关键的作用力。荧光光谱法是研究蛋白质结构及其构象变化的重要手段之一[12]。ANS荧光探针法是评价蛋白质表面疏水性的经典方法,是水溶液中蛋白质三维结构的一种反映。在一定范围内,荧光强度与蛋白质的浓度呈线性关系。利用ANS的这个性质,可以衡量ANS结合的蛋白质部位极性的变化,根据极性的变化又可以进一步推测蛋白质结构的变化。经不同方式热处理的OVT的表面疏水性见图3。结果表明,在相同的处理时间下,表面疏水性随着温度的升高呈上升的趋势。在65、75℃下,随着处理时间的延长,OVT的表面疏水性有明显的升高趋势,在85、95℃下其表面疏水性虽也呈现上升趋势,但变化幅度较小。由此推测:热处理使蛋白质空间结构发生了变化,使得OVT中本来隐藏的疏水基团暴露了出来,温度越高,处理时间越长,结构的展开程度也就越大,暴露的疏水性区域越多,从而导致蛋白质的表面疏水性增加。在65、75℃下OVT结构开始变化,并且随着结构的展开,表面疏水性增大趋势明显,而在85、95℃下,OVT结构的展开已趋于最大化,随着处理时间的延长其结构不再呈现大的变化趋势,也就意味着其表面疏水性也不再有较大的变化。
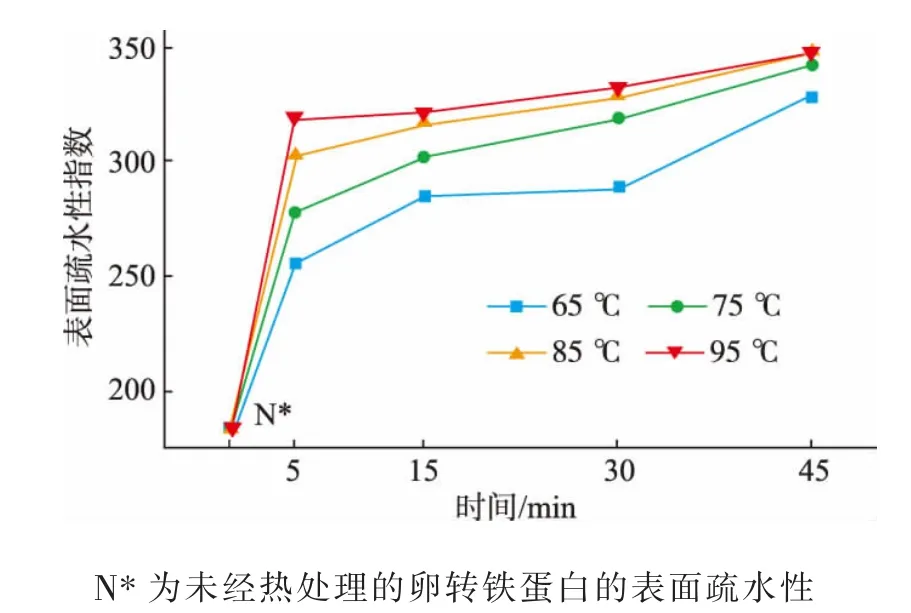
图3 热处理对卵转铁蛋白表面疏水性的影响Fig.3 Effect of heat treatment on surface hydrophobicity
2.2.2 蛋白质二级结构的变化 拉曼光谱是一种定性分析分子结构的散射光谱,具有样品浓度低、无需预处理、分析速度快、灵敏度高、结果客观等特点,可以用于水溶液、晶体、胶体、粉末等[13]。拉曼光谱在生物大分子中主要用于鉴别蛋白质及其组分的差异,由此可获得侧链微环境的化学信息以及多肽骨架构型信息[9]。
OVT的6个二硫键主要被保存在C端瓣:两个在N1区域,三个在2区域,一个在N2区域。从图4可看出,经不同温度处理后,OVT中胱氨酸二硫键的特征峰发生了位移,波数由505 cm-1偏移至507 cm-1。据报道[14],卵白蛋白经过热处理后,其二硫键的特征峰由504 cm-1偏移至507 cm-1。
1 003 cm-1处的苯丙氨酸的峰强度和位置与结构对环境的变化并不敏感,因此可以作为标准,将峰强度进行归一化。酰胺I与酰胺III经常被用来说明蛋白质组成和二级结构,图4中酰胺I与酰胺III键峰分别位于 1 660、1 248 cm-1。该结果与 Igor Chourpa[9]报道的酰胺I与酰胺III键峰分别位于1 650、1 250 cm-1的结果不同,这说明经过热处理后蛋白质二级结构发生变化。
色氨酸残基与蛋白的表面疏水作用密切关联。蛋白质经热处理后色氨酸残基在757 cm-1处的特征峰强度减小,表明色氨酸所处的深藏在分子内部的疏水微环境被展开[9],疏水基团的暴露导致蛋白质表面疏水性增大。拉曼光谱的结果表明,提高处理温度会导致蛋白质表面疏水作用增大,这与通过荧光探针测得的蛋白质表面疏水性的结果相一致。
蛋白质中酪氨酸残基858、836 cm-1特征峰分别为酪氨酸内折和展开的键峰。其比值(I858/I836)可反映酪氨酸微环境的变化及其存在状态,还可以反映酪氨酸所在肽链的骨架结构信息[15]。从图4可看出,在858 cm-1处的光谱强度减小,836 cm-1处的光谱强度基本无变化,从而I858/I836值减小,这说明热处理使得OVT中的酪氨酸残基的微环境发生了一定的变化。
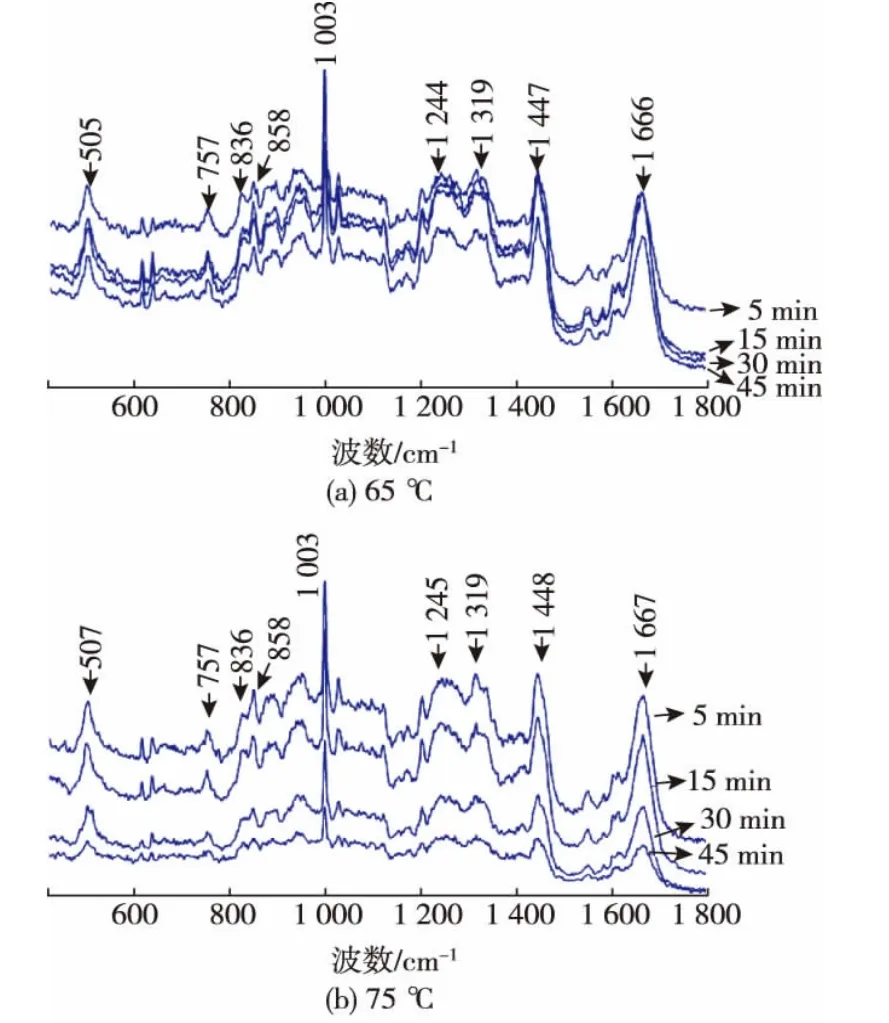
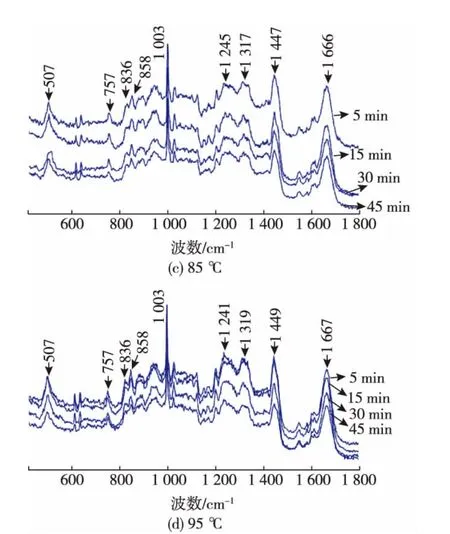
图4 不同温度处理后卵转铁蛋白的拉曼光谱Fig.4 Raman spectroscopy ofOVT atdifferent temperatures
表2为热处理后OVT中各二级结构的含量。可以看出,蛋清中OVT的二级结构主要由α-螺旋、β-折叠、β-转角和无规则卷曲组成,且以β-折叠为主。表2结果表明,温度升高导致α-螺旋明显下降、β-折叠明显上升,β-转角、无规卷曲含量稍微升高,但变化不显著。变化的原因可能是热处理导致蛋白质形成凝胶,使得α-螺旋结构展开,含量呈降低趋势;而后通过分子间暴露的疏水残基相互作用形成了折叠结构和其他的转角和无规则卷曲结构。而加热时间对OVT各种二级结构含量的影响没有明显的规律。
袁小军[10]用圆二色谱法计算得出的OVT二级结构的含量为:α-螺旋(27.2%)、β-折叠(49.7%)、β-转角(7.7%)和无规则卷曲(15.3%),所占比例与本研究的结果存在着较大的差异。其原因可能有两点:一是本研究采用的是拉曼光谱,用OMNIC软件得出其二阶导数曲线和傅立叶自去卷积 (FSD)曲线。而FSD曲线参数选择应以二阶导数曲线和FSD曲线中的各子峰的峰位和峰宽基本吻合为原则。作者采用的参数为:峰宽24 cm-1,增强因子2.6。根据二阶导数曲线选定各子峰的峰位和峰宽,再对所得曲线进行拟合,当确定了各子峰与相应的对应关系后,根据其积分面积计算各种二级结构的相对百分含量。由于峰宽和增强因子是人为选定,所以可能存在较大误差。二是由于本研究热处理的最低温度为65℃,研究已经证实此温度已使OVT发生部分变性,可能已有部分α-螺旋展开和转化成其他的二级结构,从而导致二级结构的含量与袁小军的结果存在差异。

表2 热处理后卵转铁蛋白中各二级结构的含量Table 2 Contents of secondary structure of OVT after heat treatment
3 结语
作者研究了不同温度及加热时间的热处理对OVT抑菌活性、表面疏水性和二级结构的影响,结论为:热处理后的OVT对大肠杆菌、沙门氏菌的抑菌效果均有所下降,并且随着处理温度的升高,其抑菌效果呈现明显的降低趋势。热处理后OVT分子内部的疏水基团暴露,蛋白质表面疏水性增大,并且温度越高,蛋白质的表面疏水性越高,同时随着时间的延长,蛋白质的表面疏水性呈现逐渐增加的趋势;热处理使得蛋白α-螺旋向β-折叠和其他二级结构转化,β-折叠呈上升趋势,而热处理时间与OVT的结构与活性无明显关联;蛋白质结构的展开意味着蛋白结合Fe3+位点结构将发生变化导致结合Fe3+能力的下降,进而引起OVT抑菌活性的下降。
参考文献:
[1]WUJianping,ALEXANDRAAcero-lopez.Ovotransferrin:structure,bioactivities,andpreparation[J].Food Research International,2012,46(2):480-487.
[2]GIANSANTI,ROSSI P,MASSUCEI M T,et al.Antiviral activity of ovotrasnferrin discloses an evolutionary strategy for the defensive activities of lactoferrin[J].Biochemistry and Cell Biology,2002,80(1):125-130.
[3]OPPENHEIMER S J.Iron and its relation to immunity and infectious disease[J].Journal of Nutrition,2001,131(2):6165-6335.
[4]WELLMAN L O,PICMAN J,HINCKE M T,et al.Anti-microbial protein in poultry and its structure,distribution and active property[J].Feed and Animal Husbandry,2008(4):16-21.(in Chinese)
[5]XU Mingsheng,DU Huaying,JIANG Yan,et al.Separation and purification of ovotransferrin in hen egg white[J].Science and Technology of Food Industry,2009(6):209-211(in Chinese)
[6]ZONG Xuyan,LI Li,ZHANG Jing,et al.Antibacterial activity of Escherichia coli by hydrolyzed from brewer's spent grains protein[J].Science and Technology of Food Industry,2012(15):83-85,89(in Chinese)
[7]CARDAMONE M,PURIN K.Spectrofluorometric assessmentofthe surface hydrophobicityofproteins[J].Biochemical Journal,1992,282(2):589-593.
[8]ZENG Maomao,WANG Xiao,CHEN Jie.Correlation and applicability of different methods for determining protein hydrophobicity[J].Food Science,2011(15):117-120(in Chinese)
[9]IGOR Chourpa,VIRGINIE Ducel,JOEL Richard,et al.Conformational modifications of alpha gliadin and globulin proteins upon complex coacervates formation with gum arabic as studied by Raman microspectroscopy[J].Biomacromolecules,2006,7(9):2616-2623.
[10]袁小军.卵转铁蛋白的分离纯化、结构表征及体外抗菌研究[D].武汉:华中农业大学,2011.
[11]YUAN Xiaojun,MA Meihu.Research progressofovotransferrin in poultryeggs[J].Poultry Science,2009(5):40-44(in Chinese)
[12]WAGNER J R,SORGENTINI D A,ANON M C.Thermal and electrophoretic behavior,hydrophobicity,and some functional properties of acid-treated soy isolates[J].Journal of Agricultural and Food Chemistry,1996,44(7):1881-1889.
[13]NONAKA M,LICHAN E,NAKAI S.Raman spectroscopic study of thermally induced gelation of whey proteins[J].Journal of Agricultural and Food Chemistry,1993,41(8):1176-1181.
[14]NGARIZE S,ADAMS A,HOWELL N K.Studies on egg albumen and whey protein interactions by FT-raman spectroscopy and rheology[J].Food Hydrocolloids,2004,18(1):49-59.
[15]SIAMWIZA M N,LORD R C,CHEN M C,et al.Interpretation of the doublet at 850 and 830 cm-1in the Raman spectra of tyrosyl residues in proteins and certain model compounds[J].BIochemistry,1975,14(22):4870-4876.
Research on Antibacterial Activity of OVT under Heat Treatment
TANG Qing1,2, LIU Feng1,2, ZHOU Bei3, YANG Yanjun1,2, SU Yujie*1,2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214000214122,China;3.Jiangsu Kangde Egg Industry Co.Ltd.,Nantong 226600,China)
Ovotransferrin,an iron-binding globulin,had a broad spectrum of antibacterial activity. Its antibacterial activity was closely related with its structure.In this study,the impact of heat treatment on the structure and antibacterial activity of ovotransferrin was studied,and the change mechanism of the antibacterial effect was revealed through the analysis of its secondary structure and hydrophobic effect.Results showed that the antibacterial activity of ovotransferrin on Escherichia coli and Salmonella was decreased with the increase of treatment temperature.The structure of ovotransferrin got changed after the heat treatment,the contents of α-helix and random coil of ovotransferrin were decreased due to the high temperature,meanwhile the contents of β-sheet and the β-turn were increased.Besides,surface hydrophobicity of ovotransferrin was significantly increased.As processing time extension,the antibacterial activity of ovotransferrin had no significant change at the same temperature.
ovotransferrin,heat treatment,protein structure,antibacterial activity
TS 253.4
A
1673—1689(2017)03—0277—06
2015-02-03
国家863计划项目(2013AA102207)。
*通信作者:苏宇杰(1982—),男,山东临沂人,工学博士,副教授,硕士研究生导师,主要从事食品蛋白质分离与性质方面的研究。
E-mail:suyujie@jiangnan.edu.cn
唐清,刘枫,周蓓,等.热处理对卵转铁蛋白抑菌效果的影响[J].食品与生物技术学报,2017,36(03):277-282.

