微小RNA-200c靶向抑制EFNA1基因对胃癌细胞增殖、凋亡及侵袭的影响
李鹰飞,高健伟,王红,周永健,聂玉强
(广州医科大学附属广州市第一人民医院,广州 510180)
微小RNA-200c靶向抑制EFNA1基因对胃癌细胞增殖、凋亡及侵袭的影响
李鹰飞,高健伟,王红,周永健,聂玉强
(广州医科大学附属广州市第一人民医院,广州 510180)
目的 探讨微小RNA(miR)-200c靶向抑制肝配蛋白A1(EFNA1)基因对胃癌细胞增殖、凋亡及侵袭的影响。方法 选取胃癌细胞株SGC7901,随机分为miR-200c模拟物组、模拟物对照组、miR-200c抑制物组、抑制物对照组,分别转染miR-200c模拟物、模拟物对照寡核苷酸、miR-200c抑制物、抑制物对照寡核苷酸,采用CCK-8法检测细胞增殖,流式细胞术检测细胞凋亡,Transwell法检测细胞侵袭。采用双荧光素酶实验验证miR-200c对EFNA1基因的靶向抑制作用。取本院手术切除的胃癌和相应癌旁组织标本48例份,通过免疫组化法检测EFNA1蛋白表达,分析胃癌组织中EFNA1蛋白表达与患者性别、年龄、吸烟、饮酒、病理类型、浸润深度、淋巴结及远处转移、肿瘤部位间的关系。结果 与模拟物对照组相比,miR-200c模拟物组胃癌细胞SGC7901增殖活性降低(P<0.05),总凋亡率升高(P<0.05),侵袭能力降低(P<0.05)。miR-200c模拟物组的荧光素酶活性低于模拟物对照组(P<0.05),而miR-200c抑制物组的荧光素酶活性高于抑制物对照组(P<0.05)。EFNA1蛋白在胃癌组织中表达高于癌旁组织,其高表达与胃癌淋巴结转移有关(P<0.05),与其他临床病理特征均不相关(P均>0.05)。结论 胃癌组织中EFNA1基因呈高表达,miR-200c可通过靶向EFNA1基因抑制胃癌细胞增殖及侵袭,促进凋亡。
胃癌;微小RNA-200c;肝配蛋白A1;细胞增殖;侵袭
Effect of Micro-200c on cell proliferation, apoptosis and invasion of
癌症研究机构近年数据显示,胃癌的发病率居全球恶性肿瘤的第5位,病死率高居第3位[1],而我国每年胃癌新发病例占世界新发病例40%以上。我们前期研究发现,miR-200c在胃癌中呈高表达[2],但受其直接调控的下游基因表达情况尚不明确。通过TargetScan、miRanda、Diana、Pitar等多个miRNA靶基因预测软件均预测了miR-200c与EFNA1结合,miR-200c靶位点在各物种间保守性强,所结合的双链具有极强的热稳定性,miR-200c靶位点邻近终止密码子,但离终止密码子多于15 nt,此类结合位点更具有活性[3]。EFNA1基因可能是miR-200c的靶基因。尽管近年来研究发现EFNA1与多种肿瘤的血管生成及侵袭转移有关[4],但在胃癌中的研究甚少。2016年1~4月,我们探讨了miR-200c靶向抑制EFNA1基因对胃癌细胞增殖、凋亡及侵袭的影响。
1 材料与方法
1.1 材料 人胃癌细胞株SGC7901为本实验室保存。RNA提取试剂盒、质粒提取试剂盒、反转录试剂盒(TaKaRa公司);聚合酶链反应试剂盒、双荧光素酶报告系统(Promega公司);LipofectamineTM2000转染试剂(Invitrogen公司);miR-200c模拟物、miR-200c抑制物、对照寡核苷酸(广州锐博生物公司);兔抗人EFNA1多克隆抗体(Santa Cruz公司);山羊抗兔二抗、DAB显色试剂盒(北京中杉金桥公司);凋亡检测试剂盒、Matrigel胶(BD公司);CCK8试剂(碧云天生物技术公司)。48例胃癌组织标本取自2006年1月~2008年12月于广州市第一人民医院切除的胃腺癌组织标本,癌旁组织取自同一患者距癌灶5 cm以上的组织。患者术前均未接受放化疗治疗。根据美国癌症联合会第7版的胃癌TNM分期标准,依据病理及影像学检测对胃癌进行分期。收集患者的临床病理资料,包括性别、年龄、吸烟、饮酒、病理类型、浸润深度、淋巴结及远处转移、肿瘤部位等指标。本研究获广州市第一人民医院临床医学伦理委员会的批准,入选患者均知情同意。
1.2 细胞培养、分组及转染 将人胃癌细胞SGC7901培养于含10%胎牛血清的1640培养基中,37 ℃、5%CO2的恒温培养箱中培养,待细胞处于对数生长期时进行后续实验。将SGC7901细胞密度调整至2×105/mL,接种于6孔板中,将细胞随机分为miR-200c模拟物组、模拟物对照组、miR-200c抑制物组、抑制物对照组,用LipofectamineTM2000分别转染miR-200c模拟物(50 nmol/L)、模拟物对照寡核苷酸(50 nmol/L)、miR-200c抑制物(100 nmol/L)、抑制物对照寡核苷酸(100 nmol/L),每组设3个复孔,转染后将细胞置于恒温培养箱中继续培养48 h进行后续实验。
1.3 载体构建及荧光素酶活性检测 以健康人外周血DNA为模板,克隆EFNA1 3′非翻译区(UTR) (836 nt)上游引物:5′-CCGCTCGAGATGCCACACCTGGCCTTAAAG-3′,下游引物:5′-ATAAGAATGCGGCCGCTAGCAGGGACTCAATGGTCATATG-3′,EFNA1 PCR产物回收。将PCR产物(EFNA1)及载体(psiCHECK-2)用XhoⅠ与NotⅠ双酶切,酶切后目的片段及载体经T4DNA连接酶连接,连接产物转化DH5α感受态细胞,质粒酶切鉴定阳性克隆,挑取阳性菌落进行测序。胃癌SGC7901细胞以2×104/孔种植于24孔板中,将psiCHECK2:EFNA1 3′UTR质粒和miR-200c模拟物/抑制物共转染细胞,采用Promega公司的Dual Luciferase Reporter Assay System进行样品的荧光素酶活性检测,以空白质粒作为对照,每组实验重复3次。
1.4 细胞增殖能力检测 采用CCK-8法。收集对数生长期的胃癌细胞SGC7901,分为miR-200c模拟物组、模拟物对照组,将细胞浓度调至3.0×103/mL,接种于无菌96孔培养板内,各设3个复孔。连续检测5 d,检测时每孔加入CCK-8溶液10 μL,37 ℃继续孵育3 h,用酶联免疫检测仪以450 nm波长测定光密度(OD)值,绘制细胞生长曲线。
1.5 细胞凋亡检测 采用凋亡试剂盒Annexin V/碘化丙锭,将miR-200c模拟物组、模拟物对照组细胞分别加入Annexin V 5 μL 和碘化丙啶1 μL染色,混匀避光室温孵育15 min。上流式细胞仪检测细胞凋亡情况。
1.6 细胞体外侵袭能力检测 将miR-200c模拟物组、模拟物对照组细胞分别接种于含Matrigel胶的Transwell小室,每组设3个复孔。37 ℃、5%CO2孵育24 h取出小室,4%多聚甲醛固定,结晶紫染色10 min,PBS洗涤。100倍显微镜下随机计数5个视野细胞数,取每组穿过小室细胞数的平均数。
1.7 胃癌及癌旁组织中EFNA1蛋白表达检测 取已包埋好的石蜡切片至4 μm厚,常规脱蜡、水洗后,采用Tris-EDTA(pH 9.0) 高压热修复法,4 ℃兔抗人EFNA1多克隆抗体(1∶125)孵育过夜,PBS洗涤,山羊抗兔二抗37 ℃孵育40 min,PBS洗涤,DAB显色,苏木素复染,梯度乙醇脱水干燥后中性树胶封固。每例镜下随机采集10个视野,以镜下阳性细胞百分比和染色强度给予评分。无阳性细胞为0分,阳性细胞≤25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。染色强度无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两者计分相加即阳性等级:0分为-,1~3分为±,4~5分为+,6~7分为++。
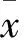
2 结果
2.1 EFNA1 3′UTR质粒构建情况及荧光素酶活性比较 用PCR法从健康人外周血DNA扩增EFNA1 3′ UTR,可见目地片段克隆成功(836 bp)。随机挑选2个psiCHECK2:EFNA1 3′UTR重组质粒进行酶切鉴定,可见酶切产物为目的片段,可送检相应质粒测序鉴定。测序结果鉴定证实psiCHECK2:EFNA1 3′UTR质粒构建成功,可用于后续双荧光素酶实验。双荧光素酶实验表明,miR-200c模拟物组、模拟物对照组的荧光素酶活性分别为0.91±0.01、1.08±0.01,两组比较,P<0.01;miR-200c抑制物组、抑制物对照组的荧光素酶活性分别为1.01±0.01、0.94±0.02,两组比较,P<0.05。
2.2 miR-200c对胃癌细胞增殖的影响 转染miR-200c模拟物后第5天时,胃癌细胞SGC7901 OD值(1.19±0.12)较转染模拟物对照寡核苷酸(1.52±0.09)降低(P<0.05),提示miR-200c可抑制胃癌细胞的增殖活性,见图1。
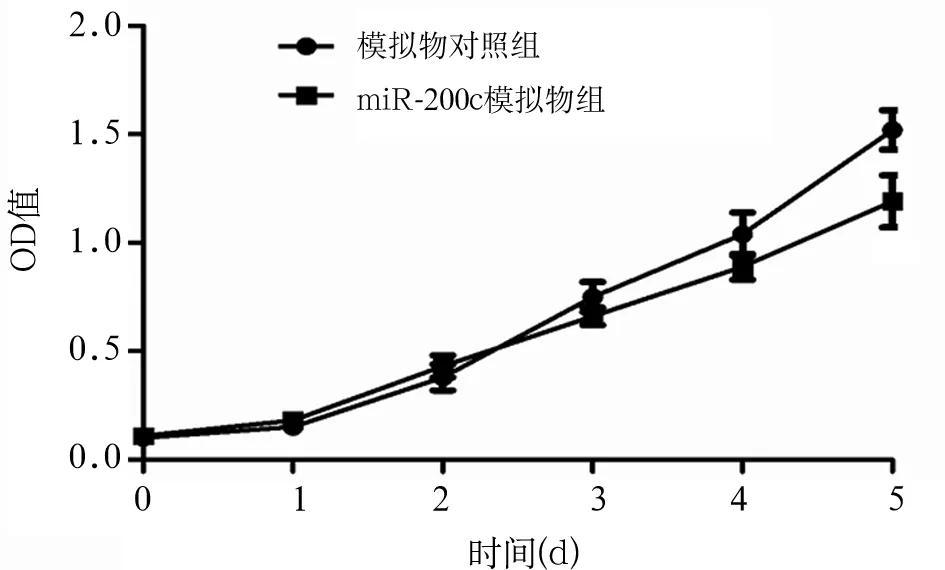
图1 miR-200c模拟物组、模拟物对照组细胞的生长曲线
2.3 miR-200c对胃癌细胞凋亡的影响 miR-200c模拟物组、模拟物对照组细胞总凋亡率分别为(5.82±0.33)%、(3.54±0.28)%,两组比较,P<0.01,提示miR-200c可促进胃癌细胞凋亡。
2.4 miR-200c对胃癌细胞侵袭的影响 Transwell实验表明,miR-200c模拟物组、模拟物对照组穿过滤膜的细胞数分别为(51.00±5.57)、(85.67±4.04)个/视野,两组比较,P<0.01,提示miR-200c能抑制胃癌细胞的侵袭。
2.5 EFNA1蛋白在胃癌及癌旁组织中的表达比较 免疫组化结果显示EFNA1蛋白均在上皮细胞的胞质染色表达。胃癌组织中EFNA1蛋白表达-者5例,±者12例,+者16例,++者15例,癌旁组织中-者12例,±者18例,+者13例,++者5例,Wilcoxon秩和检验分析表明胃癌组织较癌旁组织EFNA1蛋白表达量升高(P<0.01)。进一步分析发现,EFNA1蛋白高表达与胃癌淋巴结转移有关(P=0.03),但与患者性别、年龄、吸烟、饮酒、病理学类型、浸润深度、远处转移及肿瘤部位等指标无显著关系(P均>0.05),见表1。

表1 EFNA1蛋白表达与胃癌患者临床病理特征的关系
3 讨论
MicroRNAs是长22 nt的非编码RNA,可通过其“种子区域”(miRNA 5′端第2~7个核苷酸)与靶mRNA 3′UTR碱基互补,并在RNA诱导的沉默复合体作用下,完全的碱基互补可降解mRNA,不完全的互补可抑制mRNA表达,从而调节细胞的多种生物学功能,包括时序性发育、分化、增殖和凋亡等生命过程,并参与肿瘤的发生发展[5]。
miR-200c是肿瘤上皮间充质转化(EMT)进程中重要的调节因子,可抑制肿瘤细胞EMT及浸润转移。miR-200c能直接靶向抑制转录因子ZEB1和ZEB2,使E-cadherin表达上调,进而阻止EMT进程,抑制肿瘤侵袭和转移[6]。miR-200c还能改善化疗或放疗对肿瘤细胞的敏感性。Shi等[7]发现miR-200c能靶向抑制VEGFR2表达,增加肺癌细胞系A549对放疗的敏感性。Tang等[8]发现miR-200c能靶向抑制胃癌DNMT3A、DNMT3B及转录因子SP1的表达,导致全基因组范围内低甲基化及p16、E-cadherin等抑癌基因的重新表达,从而起到抑癌作用。miR-200c还在调节肿瘤干细胞的生物行为学过程中发挥核心作用[9]。尽管如此,miR-200c调控胃癌侵袭转移所涉及的复杂网络仍未完全阐明。本研究结果表明miR-200c能抑制EFNA1表达,这可能是miR-200c作用的新靶点。
EFNA1是糖基磷脂酰肌醇偶联配体,有205个氨基酸,其与酪氨酸激酶受体EphA2的胞外配体结合区相结合,激活酪氨酸磷酸酶而活化,导致自身磷酸化及下游大量胞内底物蛋白分子的酪氨酸磷酸化,启动不同的信号传导途径,从而引起一系列生物学效应,参与细胞的生长、迁移和分化活动,并在肿瘤形成等方面发挥重要作用[10]。EFNA1及其受体是血管生成的重要信号分子之一。Matthias等[11]研究发现,EFNA1与其受体EphA2结合后,可激活低氧诱导因子-1和血管内皮生长因子表达,使得肿瘤血管大量生长,提高肿瘤的侵袭性,并在结肠癌、前列腺癌及卵巢癌等多种实体肿瘤中发现这一机制的存在[12]。下调EFNA1表达能减少肿瘤诱导的内皮细胞迁移和微血管形成,而EFNA1高表达则能增强内皮细胞迁移活性[13]。目前关于EFNA1和胃癌的研究尚不多见,主要见于胃癌组织中EFNA1蛋白的表达研究。Nakamura等[14,15]研究表明有57%和72.7%的胃癌组织高表达EFNA1蛋白,同时EFNA1表达与TNM分期和淋巴结转移相关。提示EFNA1在肿瘤的血管生成、黏附侵袭和转移过程中有促进作用。本研究结果证实,胃癌组织中EFNA1高表达可促进胃癌淋巴结转移,此与之前研究相符。
综上所述,miR-200c在胃癌细胞中可起到抑癌基因的作用,miR-200c通过靶向抑制EFNA1表达,对胃癌增殖和侵袭进行调控,有可能成为胃癌临床生物治疗的新靶点。鉴于目前尚无EFNA1与肿瘤EMT的报道,下步我们需明确EFNA1过表达是否引起胃癌EMT转化,以及miR-200c逆转胃癌EMT转化过程中EFNA1所扮演的角色。
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015,136(5):E359-386.
[2] Li YF, Nie YQ, Tu SF, et al. Epigenetically deregulated miR-200c is involved in a negative feedback loop with DNMT3a in gastric cancer cells[J]. Oncol Rep, 2016,36(4):2108-2116.
[3] Grimson A, Farh KK, Johnston WK, et al. MicroRNA targeting specificity in mammals: determinants beyond seed pairing[J]. Mol Cell, 2007,27(1):91-105.
[4] Beauchamp A, Debinski W. Ephs and ephrins in cancer: ephrin-A1 signalling[J]. Semin Cell Dev Biol, 2012,23(1):109-115.
[5] Carthew RW, Sontheimer EJ. Origins and mechanisms of miRNAs and siRNAs[J]. Cell, 2009,136(4):642-655.
[6] Mongroo PS, Rustgi AK. The role of the miR-200 family in epithelial-mesenchymal transition[J]. Cancer Biol Ther, 2010,10(3):219-222.
[7] Shi LL, Zhang S, Wu HG, et al. MiR-200c increases the radiosensitivity of non-small-cell lung cancer cell line A549 by targeting VEGF-VEGFR2 pathway[J]. PLoS One, 2013,8(10):e78344.
[8] Tang HL, Deng M, Tang YY, et al. miR-200b and miR-200c as prognostic factors and mediators of gastric cancer cell progression[J]. Clin Cancer Res, 2013,19(20):5602-5612.
[9] Radisky DC. miR-200c at the nexus of epithelial-mesenchymal transition, resistance to apoptosis, and the breast cancer stem cell phenotype[J]. Breast Cancer Res, 2011,13(3):110.
[10] Pasquale EB. Eph receptors and ephrins in cancer: bidirectional signalling and beyond[J]. Nat Rev Cancer, 2010,10(3):165-180.
[11] Matthias CS, Nikolas HS, Joerg T, et a1. The simultaneous expression of both Ephrin B3 receptor and E-cadherin in Barrett′s adenocarcinoma is associated with favorable clinical staging[J]. Eur J Medical Res, 2012,17(5):10-17.
[12] Brantley-Sieders DM, Chen J. Eph receptor tyrosine kinases in angiogenesis: from development to disease[J]. Angiogenesis, 2004,7(1):17-28.
[13] Brantley-Sieders DM, Fang WB, Hwang Y, et al. Ephrin-A1 facilitates mammary tumor metastasis through an angiogenesis-dependent mechanism mediated by EphA receptor and vascular endothelial growth factor in mice[J]. Cancer Res, 2006,66(21):10315-10324.
[14] Nakamura R, Kataoka H, Sato N, et al. EPHA2/EFNA1 expression in human gastric cancer[J]. Cancer Sci, 2005,96(1):42-47.
[15] Yuan WJ, Ge J, Chen ZK, et al. Over-expression of EphA2 and EphrinA-1 in human gastric adenocarcinoma and its prognostic value for postoperative patients[J]. Dig Dis Sci, 2008,54(11):2410-2417.
gastric cancer by targeting EFNA1 gene
LIYingfei,GAOJianwei,WANGHong,ZHOUYongjian,NIEYuqiang
(GuangzhouFirstPeople'sHospitalofGuangzhouMedicalUniversity,Guangzhou510180,China)
Objective To evaluate the effect of microRNA (miR)-200c on regulating cell proliferation, apoptosis and invasion by targeting ephrin A1 (EFNA1) in gastric cancer cells. Methods SGC7910 cells were cultivated and randomly divided into miR-200c mimics group and mimics control group, which were then transfected by miR-200c mimics and mimics oligonucleotides.Cell proliferation was detected by CCK-8, apoptosis was determined by flow cytometry, and cell invasion was assessed using Transwell assay. The target relationship between miR-200c and EFNA1 was measured by the dual luciferase reporter gene system. Cancer and adjacent non-cancerous tissues were obtained from 48 patients who underwent gastrectomy at Guangzhou First People's Hospital, and the protein expression of EFNA1 was tested by immunohistochemistry. The relationship between EFNA1 expression and gender, age, smoking status, alcohol drinking, histological type, depth of invasion, lymph node and liver metastasis was assessed. Results Compared with the mimics control group, the proliferative activity of SGC7910 cells in the miR-200c mimics group was decreased, the whole apoptosis rate was increased and the invasive ability was decreased (allP<0.05). The luminescence intensity was significantly decreased in miR-200c mimic transfected cells than in mimics control cells (P<0.05), and the luminescence intensity was significantly increased in miR-200c inhibitor transfected cells than in inhibitor control cells (P<0.05). EFNA1 was significantly up-regulated in the gastric cancer tissues as compared with that noted in the adjacent non-cancerous tissues. The high expression of EFNA1 was associated with lymph node metastasis (P<0.05), but not associated with other clinicopathological characteristics (allP>0.05). Conclusion EFNA1 gene was highly expressed in the gastric cancer. miR-200c can inhibit gastric cancer cell proliferation and invasion, and enhance cell apoptosis by targeting EFNA1 gene.
gastric carcinoma; micro RNA-200c; ephrin A1; cell proliferation; invasion
国家自然科学基金资助项目(81502040);广州市卫生和计划生育科技一般引导项目(20161A010009)。
李鹰飞(1982-),男,主治医师,主要研究方向为胃癌发病机制研究。E-mail:liyingfei304@163.com
聂玉强(1961-),男,主任医师,教授,主要研究方向为消化道肿瘤发病机制研究。E-mail:nieyuqiang1@21cn.com
10.3969/j.issn.1002-266X.2017.09.005
R735.2
A
1002-266X(2017)09-0016-04
2016-12-21)

