羟基磷灰石/壳聚糖-转化生长因子-β1复合材料对糖尿病兔种植体周围Runx-2/ALP/OC基因的影响*
刘星宇,雷婷婷,苟诗然,郑立舸,郭 玲,牟雁东
(1.西南医科大学附属口腔医院修复科/西南医科大学口颌面修复重建和再生实验室,四川泸州 646000;2.四川大学华西口腔医院/口腔疾病研究国家重点实验室,成都 610041;3.西南医科大学附属医院规划财务部,四川泸州 646000)
论著·基础研究
羟基磷灰石/壳聚糖-转化生长因子-β1复合材料对糖尿病兔种植体周围Runx-2/ALP/OC基因的影响*
刘星宇1,2,雷婷婷3,苟诗然1,郑立舸2△,郭 玲1,牟雁东2
(1.西南医科大学附属口腔医院修复科/西南医科大学口颌面修复重建和再生实验室,四川泸州 646000;2.四川大学华西口腔医院/口腔疾病研究国家重点实验室,成都 610041;3.西南医科大学附属医院规划财务部,四川泸州 646000)
目的 将制备的羟基磷灰石/壳聚糖-转化生长因子-β1缓释微球复合涂层种植体运用于糖尿病兔胫骨,探讨其周围Runx-2/ALP/OC基因表达的改变,从分子水平评估该种植体的成骨性。方法 制备复合涂层种植体,运用扫描电镜(SEM)分析其表面形貌。并建立SPF 级新西兰兔 2 型糖尿病模型,分别在其胫骨干骺端植入种植体,分别于术后 4、8、12周,取出带种植体周围骨组织,采用实时荧光定量PCR(RT-PCR)分别检测普通图和糖尿病兔在不同种植体植入后Runx-2、碱性磷酸酶(ALP)、骨钙素(OC)、晚期糖基化终末产物(AGEs)的表达量。结果 Runx-2、ALP、OC在改性涂层种植体表面的mRNA表达在同一时间点上,改性种植体组的表达量高于普通种植体组;不同时间点上,使用改性种植体的Runx-2、ALP、OC的基因表达量增加高于普通种植体,正常兔改性种植体基因表达最高。结论 复合涂层种植体能促进高糖环境下Runx-2/ALP/OC基因表达,具有一定的临床运用前景。
糖尿病;逆转录聚合酶链反应;种植体;表面改性
种植义齿是目前治疗牙列缺损或缺失的较为理想的修复方式,而糖尿病(DM)作为一种全身性疾病成为种植手术的相对禁忌证,如何提高DM患者种植体的骨结合是目前一个急需解决的问题。本实验在前期实验[1]的基础上,对羟基磷灰石/壳聚糖-转化生长因子-β1缓释微球复合涂层种植体进行进一步的研究,将其运用于DM兔上,验证其成骨效能,为今后的临床运用提供一定的实验依据。
1 材料与方法
1.1 材料 实验动物:6月龄健康雄性新西兰大白兔(西南医科大学实验动物中心)。实验试剂与材料:纳米羟基磷灰石(HA Sigma,美国);明胶粉剂(Sigma,美国);TGF-β1及ELISA试剂盒(Cloud-clone,美国);四氧嘧啶(Sigma,美国);精蛋白长效胰岛素(30R诺和诺德中国制药有限公司);血糖仪及配套血糖试纸(罗氏卓越血糖仪);自行设计种植体(3.3 mm×4.0 mm)。实验仪器:QUANTA 200扫描电子显微镜(SEM,FEI,荷兰);微弧氧化电源(中南民大等离子体研究所);低温离心机(C2500,湖南湘仪实验仪器厂)热循环仪(TCA0096 Thermo Fisher,美国);实时荧光定量PCR(RT-PCR)仪(PIKORed 9,Thermo Fisher,美国)。
1.2 方法
1.2.1 HA/CS-TGF-β1缓释微球复合涂层种植体的制备 HA/CS-TGF-β1缓释微球复合涂层的制备见前置实验,运用此方式,将复合涂层加载于种植体表面[1]。
1.2.2 动物建模及分组 选取雄性的新西兰大白兔共29只,体质量为(2.79±0.24)kg。以100 mg/kg的计量计算并经耳缘静脉缓慢注射新鲜配制的5%四氧嘧啶溶液。于药物注射后的2、4、6 h 分别于新西兰兔的皮下注射 5%葡萄糖溶液3 mL。建模期间,每天检测血糖1次,待实验动物血糖稳定后每3天检测血糖1次。以平均每日血糖稳定于 13.9 mmol/L(25 mg/L)以上为建模成功。将建模成功的实验动物24只分为如下4组,A组(正常兔普通种植体),B组(正常兔改性种植体),C组(DM普通种植体),D组(DM改性种植体);当兔仰卧平躺时,每只兔右脚为普通种植体,左脚为改性种植体。
1.2.3 种植体植入 用戊3%巴比妥钠(40 mg/kg),耳缘静脉注射以麻醉动物。将实验动物术区备皮消毒,沿胫骨上端内侧平面切开,分离肌肉及筋膜完全暴露胫骨面;用生理盐水让术区冷却,使用种植机于胫骨平面中央逐级预备种植窝,并植入复合涂层种植体(图1),深度约2 mm,分层严密缝合。术后每日肌内注射40 万U的硫酸庆大霉素,观察实验动物愈合情况。
1.2.4 RT-PCR检测特定基因
1.2.4.1 RNA的提取与转录 于术后第 4、8、12 周,普通兔组、DM兔组各处死4只新西兰兔,取双侧胫骨(图2)种植体周0.8 cm×0.8 cm×1.0 cm的骨块,经锡箔纸双侧包裹并编号后,温度于80 ℃保存。待3批样本收集齐后,液氮下无菌研磨、离心、振荡、静置、提取含有RNA的上清液,将提取出的 RNA 于-20 ℃ 保存。最后按照说明书依次加入各试剂,置PCR仪上进行反应,完成逆转录。

图1 免胫骨植入 图2 免胫骨改性种植体
改性种植体 骨结合情况
1.2.4.2 引物设计与RT-PCR反应 所有引物均交由上海生工生物工程技术服务有限公司设计合成,所用引物及碱基序列如表1。按照说明书相关使用要求,应用Smart Cycler System RT-PCR Ⅱ扩增仪进行实验。使用Thermo Scientific PikoReal软件(Thermo公司)分析PCR过程各检测样本的CT(Threshold cycle)值,本实验室通过2-△△CT计算X相对mRNA表达水平,GAPDH为内参。
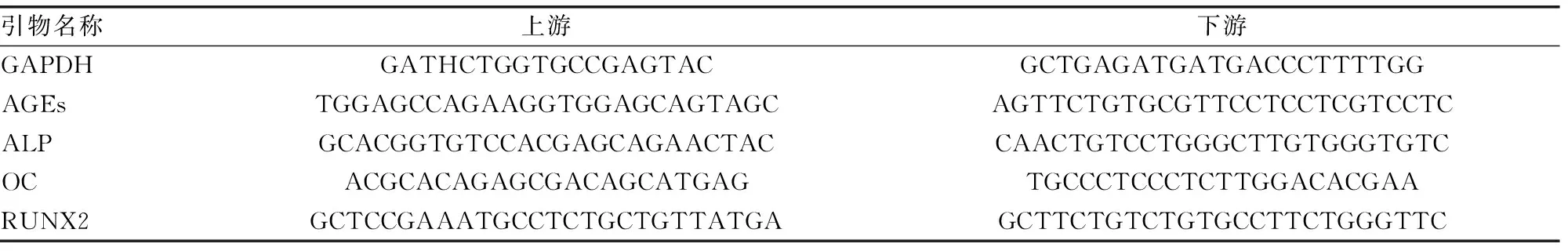
表1 PCR引物及碱基序列(3′~5′)
2 结 果
2.1 种植体的表面形态 由扫描电子显微镜(SEM)分别扫描微弧氧化后种植体和加载蛋白后改性种植体表面,可知种植体表面存在大量加载TGF-β1蛋白的明胶微球,明胶微球表面可见蛋白吸附,测得该微球球径为8~30 μm,见图3、4。

箭头:微孔。
图3 微弧氧化后种植体的表面微孔扫描电镜观察(×10 000)

箭头:加载蛋白。
图4 微弧氧化后种植体的表面微孔扫描电镜观察(×500)
2.2 DM模型的建立 除两只动物建模时死亡,其余动物建模成功。建模后,模型组新西兰兔空腹血糖由(5.93±0.66)mmol/L增高到(18.61±4.87)mmol/L,稳定于13.8 mmol/L以上。而对照组血糖为(6.12±0.62)mmol/L,差异有统计学意义(P<0.05)。
2.3 2-△△CT法转换后不同时间点上各基因表达比较 使用改性种植体的兔子(B、D组),Runx-2、ALP、OC的mRNA表达在同一时间点上高于普通种植体的兔子(A、C组),差异有统计学意义(P<0.05),正常兔子改性种植体基因表达最高,DM兔改性种植体率与正常兔子正常种植体的基因表达差异无统计学意义(P>0.05),DM兔正常种植体最低。而随着时间的增加,使用改性种植体的Runx-2、ALP、OC的基因表达量增加高于普通种植体(P<0.05)。AGEs的表达在普通兔子上,使用普通种植体随时间递增比改性种植体较快(P<0.05),而在DM兔上,使用改性种植体后,AGEs递减较快,普通种植体不变,见表2、图5。

表2 2-△△CT法转换后不同时间点上各基因表达比较±s,n=4)

图5 各组不同时间点上各基因表达比较

图6 部分基因的扩增曲线和溶解曲线
3 讨 论
DM是一种常见的慢性全身性疾病,WHO发布《全球糖尿病报告》来看,目前DM已成为重大的公共卫生问题。以往的研究表明,DM患者的种植体成功率远低于健康人,因此对于DM患者种植体周围健康状况,不仅应该及时进行治疗,更应该提前预防,以达到更好的修复效果[2-7]。
早期更好的骨整合与结合强度是口腔种植材料研究的热点。本实验对种植体进行表面改性,使其表面紧密吸附一层均匀的复合涂层,使种植体具有生物功能性,另一方面表面积增加了的种植体具有更高的骨结合率[8-9]。由电镜来看,种植体表面存在大量的载蛋白微球,这与以往的实验结果相似[1]。扩大了种植适应证,尤其是全身性疾病(如DM、骨质疏松等)的患者时,单一钛种植体表面改性已不能满足目前的临床要求,结合理、化、生物方法及材料优点的改性技术以后必然的发展方向[10]。
本实验同时选取了Runx-2、ALP,AGEs和OC这几个在糖尿病成骨中有标志性的基因进行检测,由实验结果可知Runx-2、ALP、OC的mRNA表达在同一时间点上改性种植体的成骨性要高于普通种植体,DM兔改性种植体率与正常兔子正种植体的基因表达相近。这说明使用复合涂层种植体后,对兔的成骨细胞增殖有促进作用,这可能与复合涂层中存在的TGF-β有关。Liu等[11]研究表明,BMP信号和Runx-2存在相关性,这一级联反应在成骨细胞分化过程中有着十分重要的作用。而在加入TGF-β后细胞Runx-2、BMP2 mRNA表达增加,表明细胞分化成骨能力增加,Sun等[12]发现转化生长因子信号通路是一个重要的信号通路调节成骨细胞的矿化,加入TGF-β将影响ALP和OC的表达。这都与本实验结果基本相符。同时,改性种植体组中的ALP基因的表达量在动物实验的早期都维持在一个较高的水平,且远远大于普通种植体组,这可说明在成骨的早期,该复合涂层种植体提供羟基磷灰石对动物骨的矿化过程有较强的促进作用,复合涂层种植体能有效的促进成骨细胞ALP的基因的表达和其钙离子的释放,从而对成骨细胞的活性和矿化有一定作用。与此同时,在使用同种类型种植体时DM组的Runx-2、ALP和OC表达量少于正常兔子组,说明DM确实会引起实验动物的成骨能力下降。这可能DM的骨代谢有关系密切,DM动物存在着钙磷及维生素D代谢异常,高血糖,糖基化终末产物,细胞因子与Wnt信号途径异常等问题,这些都可能造成糖尿病骨代谢异常从而诱发病理改变如骨愈合不良和骨再生能力受损等问题从而影响标志性基因的表达[13-14]。
与上述基因不同,AGEs是一种与DM有密切关系的产物,是在非酶促条件下,蛋白质、氨基酸、脂类或核酸等大分子物质的游离氨基与还原糖的醛基经过缩合、重排、裂解、氧化修饰后产生一组稳定的终末产物[15-16]。组织中AGEs水平在一定程度上能反映DM肾病的严重程度,同时AGEs可与成骨细胞表面的受体RAGE结合,抑制成骨细胞分化,使成骨细胞成骨能力下降[17]。本实验中,图通AGEs的表达量在普通兔子使用普通时种植体随时间递增较快,而使用改性种植体递增较慢,但二者间差异无统计学意义(P>0.05),说明在普通兔上,AGEs表达改变不明显,而在DM兔上,使用改性种植体后,AGEs递减迅速,普通种植体不变。这说明复合涂层种植体在可抑制AGEs的表达,从而促进DM动物的成骨,可能原因是与AGEs与TGF-β1呈负相关,而复合涂层种植体通过TGF-β1的过表达来抑制AGEs从而在DM中起到骨保护作用。
本实验使用的复合涂层改性种植体,在DM动物体内对于成骨具有明显的促进作用,该材料有望进一步研究以期以后的临床运用。
[1]苟诗然,张帆,李萌婷,等.钛表面羟磷灰石/壳聚糖-转化生长因子-β1缓释微球复合涂层的制备及其对成骨细胞黏附与增殖的影响[J].华西口腔医学杂志,2016,34(3):229-233.
[2]Aloufi F,Bissada N,Ficara A,et al.Clinical assessment of peri-implant tissues in patients with varying severity of chronic periodontitis[J].Clin Implant Dent Relat Res,2009,11(1):37-40.
[3]Abreu MH,Bianchini MA,Magini RS,et al.Clinical and radiographic evaluation of periodontal and peri-implant conditions in patients with implant-supported prosthesis[J].Acta Odontol Latinoam,2007,20(2):87-95.
[4]Crespi R,Capparè P,Gherlone E.A 4-year evaluation of the peri-implant parameters of immediately loaded implants placed in fresh extraction sockets[J].J Periodontol,2010,81(11):1629-1634.
[5]Karoussis IK,Salvi GE,Heitz-Mayfield LJ,et al.Long-term implant prognosis in patients with and without a history of chronic periodontitis:a 10-year prospective cohort study of the ITI dental implant system[J].Clin Oral Implants Res,2003,14(3):329-339.
[6]Yamalik N,Günday S,Kilinc K,et al.Analysis of cathepsin-K levels in biologic fluids from healthy or diseased natural teeth and dental implants[J].Int J Oral Maxillofac Implants,2011,26(5):991-997.
[7]Tang Z,Sha Y,Lin Y,et al.Peri-implant mucosal inflammation and bone loss:clinical and radiographic evaluation of 108 dental implants after 1-year loading[J].Chin J Dent Res,2000,3(2):15-20.
[8]Mendonca G,Mendonca DB,Aragao FJ,et al.Advancing dental implant surface technology-from micron-to nanotopography[J].Biomaterials,2008,29(28):3822-3835.
[9]Dohan ED,Coelho PG,Kang BS,et al.Classification of osseoin-tegrated implant surfaces:materials,chemistry and topogra-phy[J].Trends Biotechnol,2010,28(4):198-206.
[10]Sarkar PD,Choudhury AB.Relationships between serum osteocalcin levels versus blood glucose,insulin resistance and markers of systemic inflammation in central Indian type 2 diabetic patients[J].Eur Rev Med Pharmacol Sci,2013,17(12):1631-1635.
[11]Liu T,Gao Y,Sakamoto K,et al.BMP-2 promotes differentiation of osteoblasts and chondroblasts in Runx-2一deficient cell lines[J].J Cell Physiol,2007,211(3):728-735.
[12]Sun X,Cao Z,Zhang Q,et al.Aluminum trichloride inhibits osteoblast mineralization via TGF-β1/Smad signaling pathway[J].Chem Biol Interact,2016(244),449-2415.
[13]Yamagishi SI.Role of advanced glycation end products (AGEs) in osteoporosis in diabetes[J].Curr Drug Targets,2011,12(14):2096-2102.
[14]Kolluru GK,Bir SC,Kevil CG.Endothelial dysfunction and diabetes:effects on angiogenesis,vascular remodeling,and wound healing[J].Int J Vasc Med,2012(2012):918267.
[15]Bierhaus A,Hofmann MA,Ziegler R,et al.AGE and their interaction with AGE receptor in vascular disease and diabetes Ⅰ.The AGE concept[J].Cardiovasc Res,1998,37(3):586-600.
[16]Mai CY,Wang B,Wen JY,et al.Lipoprotein-associated phospholipase A2 and AGEs are associated with cardiovascular risk factors in women with history of gestational diabetes mellitus[J].Gynecol Endocrinol,2014,30(3):241-244.
[17]Santana RB,Xu L,Chase HB,et al.A role for advanced glycation end products in diminished bone healing in type 1 diabetes[J].Diabetes,2003,52(6):1502-1510.
Investigation of hydroxyapatite/chitosan-TGF-β1 composite coatings on implant surfaces and its effect on the maker gene Runx 2/ALP/OC of diabetic rabbit osteoblasts*
LiuXingyu1,2,LeiTingting3,GouShiran1,ZhengLige2△,GuoLing1,MuYandong2
(1.DepartmentofProsthodontics,theAffiliatedHospitalofStomatologyofSouthwestMedicalUniversity/Laboratory&OralandMaxillofacialReconstructionandRegenerationInstituteofCardiovascularMedicine,SouthwestMedicalUniversity/Luzhou,Sichuan646000,China;2.StateKeyLaboratoryofOralDiseases&theAffiliatedWestChinaStomatologyHospitalofSichuanUniversity,Chengdu,Sichuan610041,China;3.DepartmentofPlanningandFinance,theAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou,Sichuan646000,China)
Objective This study investigated the effects of hydroxyapatite (HA)/chitosan (CS)-transforming growth factor-β1 (TGF-β1) composite coatings on implant surfaces,as well as on the symbol gene of diabetic rabbit osteoblasts.Methods Coatings were prepared on implant surfaces and studied by scanning electric microscope (SEM),New Zealand White rabbits were used to establish the model of type 2 diabetes.Implant the implants in tibial metaphysis of the rabbit and took them and surrounding bone tissue our after 4,8,12 weeks.Detcet the expression of AGEs,ALP,OC,Runx-2 mRNA by semi-quantitative RT-PCR.Results The expression level of Runx-2,ALP and OC mRNA on composite coatings implants tended to be higher than that on normal implant at each time point.The same differences occurred at different points in time,especially the implants in normal rabbits.Conclusion The composite coatings implants significantly promote the proliferation of osteoblast and the expression of Runx-2,ALP and OC in high glucose,and it’s worth of further clinical use.
diabetes mellitus;reverse transcriptase polymerase chain reaction;implant;surface modification
10.3969/j.issn.1671-8348.2017.08.006
口腔疾病研究国家重点实验室开放课题(SKLOD2015OF09);四川省卫生和计划生育委员会科研课题(16PJ173)。 作者简介:刘星宇(1990-),硕士,主要从事口腔修复学研究。△
,E-mail:541148817@qq.com。
R783.4
A
1671-8348(2017)08-1023-04
2016-07-22
2016-09-20)

