口服降糖药致低血糖对糖尿病大鼠神经生长因子mRNA表达的影响*
唐明薇,黎 瑶,王风波
(成都医学院第一附属医院内分泌科,成都 610500)
论著·基础研究
口服降糖药致低血糖对糖尿病大鼠神经生长因子mRNA表达的影响*
唐明薇,黎 瑶,王风波△
(成都医学院第一附属医院内分泌科,成都 610500)
目的 观察糖尿病大鼠脑组织神经生长因子(NGF) mRNA表达变化及口服降糖药致低血糖的影响作用。方法 64只Wistar大鼠分为对照组(16只)、糖尿病模型组(48只),制备高脂高糖饮食+腹腔注射链脲佐菌素致2型糖尿病大鼠模型,模型组分为非药物组(16只)、口服药物治疗组(16只)和低血糖组(16只),口服药物治疗组和低血糖组大鼠均予格列本脲+二甲双胍灌胃给药,低血糖组剂量为口服药物治疗组5倍,每天1次,连续12 d,各组大鼠分别于低血糖反应第3、6、9、12天取脑组织行RT-PCR法NGF mRNA检测。结果 与对照组相比,糖尿病模型组3组大鼠脑组织NGF mRNA表达均不同程度下降,低血糖降低最为显著(P<0.01),与非药物组比较,口服药物治疗组升高明显(P<0.01),低血糖组则进一步降低(P<0.01)。结论 口服降糖药可有效增强糖尿病大鼠脑组织NGF mRNA表达,而口降糖药致低血糖能使NGF mRNA表达进一步下降,不利于糖尿病神经病变的修复。
低血糖症;糖尿病;神经生长因子;口服降糖药
据统计,糖尿病患病率在世界范围内呈急剧上升趋势,现今我国成年人的糖尿病患病率约为9.7%,成人糖尿病总数已超过9 240万,已成为世界上糖尿病患病人数最多的国家,其中2型糖尿病占90.0%以上。我国糖尿病患病率急剧增加的原因可能与城市化、老龄化、生活方式改变等因素相关[1]。糖尿病周围神经病变(DPN)是糖尿病最常见并发症之一,在2型糖尿病患者中发病率超过60.0%,是糖尿病患者致残的重要因素,严重影响着糖尿病患者身心健康。目前,DPN的发病机制尚未完全阐明,有研究证实神经生长因子(nerve growth factor,NGF) 及其受体的改变与缺失在其中起着重要作用,有效地控制血糖则有利于NGF的表达。糖尿病患者的治疗过程中经常发生低血糖反应,低血糖给患者带来的危害远较高血糖更快、更严重,轻者即可致神经功能损害,对DPN的恢复显然是很不利的。本研究通过口服常用降糖药致糖尿病大鼠反复低血糖反应,观察大鼠脑组织NGF mRNA的表达变化情况,旨在进一步探讨低血糖对糖尿病神经系统病变临床治疗的影响作用。
1 材料与方法
1.1 材料 选取64只Wistar成年雄性大鼠,体质量260~300 g,均由成都大学动物实验中心提供;链脲佐菌素(STZ,Sigma公司);Trizol、DEPC(美国Gibco公司);RT-PCR试剂盒(武汉博士德生物工程有限公司);引物合成(上海博亚生物技术有限公司提供);格列本脲片(天津药物研究院药业公司);盐酸二甲双胍片(齐鲁药业);血糖仪及试纸条(罗氏)。
1.2 方法
1.2.1 分组及糖尿病造模 64只健康Wistar大鼠标准饲料适应性饲养7 d,室温24 ℃左右,7 d后分为对照组(n=16)、糖尿病模型组(n=48),糖尿病模型组又分为非药物组(n=16)、
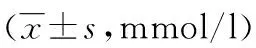
表1 各组大鼠血糖监测情况比较
△:P<0.01,与对照组比较;*:P<0.01,与非药物组比较;#:P<0.01,与口服药物治疗组比较。
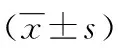
表2 各组大鼠脑组织RT-PCR法NGF mRNA检测情况比较
△:P<0.01,与对照组比较;*:P<0.01,与非药物组比较;#:P<0.01,与口服药物治疗组比较;○:P<0.05,◇:P<0.01,与3 d比较。
口服药物治疗组(n=16)和低血糖组(n=16)。参照张玉领等[2]建立糖尿病大鼠模型:糖尿病模型组大鼠给予高脂高糖饲料(其中15.0%猪油,15.0%蔗糖,2.5%胆固醇,1.0%胆酸盐),高脂高糖饲料喂养1个月后,造模前禁食12 h,予腹腔注射25 mg/kg链脲佐菌素,注射前用0.1 mol/L柠檬酸-柠檬酸钠缓冲液稀释,对照组大鼠腹腔注射等剂量0.1 mol/L柠檬酸-柠檬酸钠缓冲液。注射72 h后取尾静脉血测血糖,随机血糖大于16.7 mmol/L为糖尿病模型建立成功。对照组大鼠饲普通饲料常规饲养。
1.2.2 口服给药方法 糖尿病造模成功后第4天开始给药,口服药物治疗组和低血糖组大鼠均给予格列本脲片+盐酸二甲双胍片溶于生理盐水灌胃。口服药物治疗组按成人剂量给药,即格列本脲片50 μg/kg,盐酸二甲双胍片5 mg/kg,每天2次,低血糖组剂量为口服药物治疗组5倍,每天1次,连续12 d。对照组及非药物组大鼠灌胃同剂量生理盐水。低血糖反应标准:肢体抽搐,反应迟钝或昏迷,血糖小于或等于2.8 mmol/L。20 min后灌胃10%葡萄糖1 mL,低血糖症状缓解。各组大鼠给药期间均普通饲料喂养,分别于给药后第3、6、9、12天各取4只脑组织,断头取脑时间设定为低血糖反应20 min左右,取脑大鼠不予灌胃葡萄糖。
1.2.3 脑组织RT-PCR法NGF mRNA检测 Trizol法提取大鼠脑组织总RNA,核酸紫外分光光度计检测RNA样品A260/A280在1.8~2.0。RT-PCR法:逆转录为cDNA,PCR反应体系50 μL,PCR反应条件为94 ℃预变性5 min、94 ℃变性55 s、57 ℃退火45 s、72 ℃延伸50 s,35个循环后72 ℃终末延伸8 min;NGF上游引物序列:5′-GAT CGG CGT ACA GGC AGA AC-3′,下游引物序列:5′-GGC TCG CCA CTT GGT CTC GA-3′;β-actin上游引物序列:5′-GGT GAA GGT GGG TGG CAA-3′,下游引物序列:5′-TTC CCA TTC TCA GCC TTA AC-3′。将PCR产物经1.5%琼脂糖凝胶电泳,凝胶成像系统分析。
2 结 果
2.1 一般情况比较 糖尿病造模成功后,大鼠在第2~3天逐渐出现不同程度的食量、饮水增加,尿量增多,消瘦,精神不振,体毛缺乏光泽,活动迟缓。口服药物治疗组大鼠上述症状随治疗进程明显改善,而低血糖组大鼠低血糖发作时肢体抽搐,反应迟钝明显甚至昏迷,血糖显著下降,灌胃葡萄糖水后缓解,但精神状态更差,活动减少。低血糖反应后20 min各组大鼠血糖监测情况,见表1。
2.2 4组大鼠脑组织RT-PCR法NGF mRNA检测情况 与对照组相比,糖尿病模型组3组大鼠脑组织NGF mRNA表达均不同程度下降,低血糖组降低最为显著(P<0.01)。与非药物组比较,口服药物治疗组明显升高(P<0.01),低血糖组则进一步降低(P<0.01);不同时间窗比较,非药物组12 d较3 d有一定下降,差异有统计学意义(P<0.05),低血糖组12 d明显低于3 d,差异有统计学意义(P<0.01),对照组、口服药物治疗组各时间点差异无统计学意义(P>0.05),见表2。
3 讨 论
尽管DPN在2型糖尿病患者中发病率很高,严重影响着糖尿病患者的身心健康,但目前DPN的发病机制仍然未能完全阐明。NGF又称神经诱向因子,作为神经营养因子家族中的主要成员之一,具有使神经细胞存活率升高和促神经突触生长的生物活性,与特异性受体TrkA相结合发挥生物学功效,促进受损神经细胞修复,延缓神经细胞的凋亡过程,在神经元的生长发育和神经轴突的再生修复中均扮演着重要角色,目前已在阿尔茨海默病及新生儿缺血、缺氧性脑损伤等中枢神经系统疾病的治疗应用上得到了大量而肯定的研究成果[3]。NGF及其受体的异常在DPN的过程中亦起着重要作用,NGF合成障碍,逆向轴浆运输能力降低及受体TrkA表达异常等均可影响神经损伤后再生修复,参与DPN的发生、发展[4]。近年来大量研究表明,有效控制血糖有利于增加NGF的表达,促进DPN恢复。有研究发现,2型糖尿病大鼠下颌下腺NGF阳性表达明显降低,连续皮下注射胰岛素治疗2个月后糖尿病大鼠血糖得到显著控制,下颌下腺NGF阳性反应明显增强,接近或达到正常水平[5]。王蕾等[6]用降糖通络汤灌胃2型糖尿病大鼠,免疫组织化学法检测到大鼠坐骨神经组织中NGF表达呈渐行增高趋势,与血糖控制水平呈正相关,且施万细胞凋亡率明显降低。吕翠岩等[7]用糖痹康灌胃2型糖尿病大鼠,大鼠坐骨神经组织中NGF水平与NGF mRNA表达显著升高,呈强阳性表达,远优于单纯甲钴胺片营养神经组对NGF表达的提升作用。有学者研究糖尿病大鼠周围神经病变的超微结构变化,发现糖尿病大鼠腰骶部神经髓鞘水肿变性甚至脱落,神经细胞胞质及胶质空泡变性,同时腹腔内注射胰岛素和鼠NGF治疗后,大鼠膀胱逼尿肌细胞和腰骶部神经元中NGF的表达均明显增强,神经变性明显改善,优于单纯胰岛素或鼠神经生长因子治疗组[8]。以上研究均说明,无论中药或西药,只要能够有效控制血糖,均能增强神经组织NGF的表达,促进神经病变的再生修复。
低血糖是糖尿病临床治疗过程当中常见的不良反应,许多糖尿病患者由于缺乏对合理规范服用降糖药物的良好认识,常有低血糖的发生,甚至频繁的低血糖反应发作亦不鲜见。低血糖给患者带来的危害远较高血糖更快更严重,轻者即可致神经功能损害,对包括DPN在内的神经系统损伤恢复是极其不利的。反复重度低血糖对糖尿病大鼠海马PKA磷酸化水平发生明显增高改变,提示可致脑损伤和认知功能障碍,甚至神经元的丧失[9]。有研究用胰岛素诱导大鼠低血糖后在海马区免疫组织化学法检测Nogo-A,发现低血糖组大鼠海马区Nogo-A表达明显降低,而低血糖后葡萄糖再灌注大鼠Nogo-A表达进一步降低,且细胞凋亡最多,提示低血糖不仅导致中枢神经损伤,而且低血糖后葡萄糖再灌注可加剧这种损伤,对于临床常用的补糖纠正低血糖的方法提出了一定警示作用[10]。格列本脲片及盐酸二甲双胍片均有较强的降低血糖作用,虽然格列本脲片不良反应比较大,但是由于价格便宜,在我国广大区域仍是临床常用的口服降糖药物,有报道服用格列本脲片可致较高的低血糖发生率,其中低血糖昏迷高达62.7%,服用格列本脲片的人群以老年人居多,往往合并心脑血管等各种慢性病,肾功能减退,长期混合服用多种药物,更易导致严重的低血糖反应,持久且难以纠正[11]。本实验采用格列本脲片+盐酸二甲双胍片超剂量灌胃2型糖尿病大鼠致反复低血糖发作,观察到低血糖组大鼠较未降糖治疗糖尿病大鼠脑组织NGF mRNA的表达更低,并随着时间呈逐渐加重趋势,虽然未降糖治疗糖尿病大鼠的表达也呈逐渐降低表现,但低血糖组是更加明显,说明低血糖严重妨碍了NGF的合成及表达,尤其频繁反复发作的低血糖影响作用更甚,非常不利于糖尿病性神经病变的再生修复,为临床上口服降糖药治疗糖尿病过程中的低血糖危害性的认识提供了进一步的理论依据。
[1]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013版) [J].中国糖尿病杂志,2014,22(8):2-38.
[2]张玉领,陈培,刘家秀,等.2型糖尿病大鼠模型的建立[J].现代预防医学,2012,39(15):3922-3924.
[3]于洋,洪仕君,赵丽萍,等.神经生长因子NGF 的神经元保护作用机制及临床应用研究现状[J].昆明医科大学学报,2014,35(2):148-151.
[4]Huang EJ,Reichardt LF.Trkreceptors:roles in neuronal signal transduction[J].Annu Rev Biochem,2003(72):609-642.
[5]桂丽,黄大可,王盛花,等.胰岛素对糖尿病大鼠下颌下腺内NGF及VEGF表达的影响[J].中国组织化学与细胞化学杂志,2014,23(3):237-240.
[6]王蕾,吕楠,郝迪,等.降糖通络汤对DPN大鼠NGF mRNA表达的影响及对雪旺细胞抗氧化、抗凋亡作用机制研究[J].中华中医药杂志,2015,30(10):3671-3676.
[7]吕翠岩,李秋明,毛颖秋,等.糖痹康对糖尿病大鼠坐骨神经NGF蛋白及NGF mRNA表达的影响[J].中国实验方剂学杂志,2014,20(5):157-161.
[8]郭学敬,郭跃先,白艳,等.糖尿病大鼠治疗后膀胱和腰骶背根神经节中神经生长因子的表达及超微结构研究[J].现代泌尿外科杂志,2012,17(1):42-45.
[9]项迎春,廖美华,田允,等.反复重度低血糖对糖尿病大鼠海马PKA/PKC/CaMKⅡ磷酸化信号通路的影响[J].中国现代应用药学,2013,30(6):586-590.
[10]王喜云,赵玉武.低血糖后葡萄糖再灌注大鼠海马Nogo-A蛋白的表达[J].脑与神经疾病杂志,2013,21(6):441-445.
[11]郭美华,邱晓红,马满玲,等.格列本脲致低血糖反应的文献分析[J].中国药物警戒,2013,10(7):424-431.
Effect of oral antidiabetic drugs on NGF mRNA expression in rats brain with diabetes*
TangMingwei,LiYao,WangFengbo△
(DepartmentofEndocrinology,theFirstAffiliatedHospitalofChengduMedicalCollege,Chengdu,Sichuan610500,China)
Objective To observe the expression of NGF mRNA in rats brain with diabetes and the effects of hypoglycemia caused by oral antidiabetic drugs on NGF mRNA.Methods A total of 64 adult Wistar rats were randomly divided into control group(16)and diabetes model group(48).Using high fat and high sugar diet+intraperitoneal injection of streptozotocin to prepare type 2 diabetes model.The diabetes model group was randomly divided into non-medication group(16),oral medication group(16) and hypoglycemia group(16).The oral medication rats and hypoglycemia rats were given glibenclamide+metformin by intragastric administration once daily for 12 d,the dose of hypoglycemia rats was 5 times of treatment rats.The brain tissues of rats in each group were used respectively the RT-PCR method to detect NGF mRNA at 3,6,9 and 12 d.Results Compared with the control group,the expression of NGF mRNA in the brain tissues of the 3 groups of diabetic rats were decreased in different degrees and the non-medication group was the most obvious(P<0.01).Compared with the non-medication group,the oral medication group was significantly increased(P<0.01),the hypoglycemia group was further decreased(P<0.01).Conclusion Oral hypoglycemic drugs can effectively enhance the expression of NGF mRNA in brain tissue of diabetic rats,but hypoglycemia caused by Oral antidiabetic drugs can make the expression of NGF mRNA further decreased.So hypoglycemia is not conducive to the repair of diabetic neuropathy.
hypoglycemia;diabetes mellitus;nerve growth factor;oral hypoglycemic drugs
10.3969/j.issn.1671-8348.2017.08.004
四川省卫生厅科研课题(120478)。 作者简介:唐明薇(1982-),主治医师,硕士,主要从事内分泌与代谢疾病诊疗工作。△
,E-mail:251205687@qq.com。
R587
A
1671-8348(2017)08-1017-03
2016-07-20
2016-09-18)

