杯[4]双冠醚的合成及分离高放废液中Cs的研究进展
戴 荧,张安运
(1.浙江大学 化学工程与生物工程学院,浙江 杭州 310027;2.东华理工大学 化学生物与材料科学学院,江西 南昌 330013)
杯[4]双冠醚的合成及分离高放废液中Cs的研究进展
戴 荧1,2,张安运1
(1.浙江大学 化学工程与生物工程学院,浙江 杭州 310027;2.东华理工大学 化学生物与材料科学学院,江西 南昌 330013)
大环超分子识别试剂杯[4]双冠Calix[4]arene-Bis-Crown对发热元素Cs(Ⅰ)有出色的识别性能,在溶剂萃取和色谱分离Cs(Ⅰ)方面备受关注。基于杯[4]双冠潜在的应用背景,综述了近年来杯[4]双冠的合成方法,合成机制,影响合成过程的若干因素,以及其用于分离高放废液中Cs(Ⅰ)方面的研究进展。
杯[4]双冠;合成;高放废液;Cs(Ⅰ);分离
高放废液(high level liquid waste,HLLW)中的Cs主要有135Cs和137Cs两种形式,半衰期分别为200万a和30.2 a。135Cs的半衰期较长,且容易转移,对环境的潜在危害较大。137Cs的半衰期较短,但能释放出γ射线,产生大量热,因此被认为是影响高放废液玻璃固化体安全的最有害元素之一。若能将放射性Cs分离出来,不但能减小玻璃固化体积,缩短废液冷却时间和废物储存年限,而且由于热量释放减少,对地质处置时操作简单化和节约成本非常有利[1]。
杯芳烃,作为第Ⅲ代主体分子,具有非常好的预组织结构,它的一些衍生物具有很强的离子识别能力。如部分锥形构象1,3-二烷氧基-对-特-叔丁基杯[4]-冠-5能够与K+形成稳定配合物,可被用作支持液膜的载体[2-3]。1,3-交替构象的1,3-二烷氧基-对-特-叔丁基杯[4]-冠-6对Cs+有非常强的识别能力[4]。
随着对第Ⅲ代主体分子研究的深入,已发现将杯芳冠醚应用于处理高放废液具有诱人的前景。基于杯芳冠醚优异的Cs离子识别能力,国内外研究者们提出了一些处理含Cs废水流程,如法国原子能机构的CCCEX流程[5],美国橡树岭国家实验室的CSEX流程[6],美国爱达华州国家实验室的FPEX流程[7],中国Zhang A.提出的SPEC流程[8]等。其中,杯[4]-双-辛基苯并-冠-6(BOBCalix[4]C6)作为上述一些流程中的萃取剂表现出良好的萃取能力。
鉴于杯芳双冠醚在处理高放废液中的放射性核素Cs时的作用,综述了杯芳[4]双冠醚的合成方法、合成机制、分类及应用研究进展等。
1 杯[4]芳烃双冠的合成方法
杯[4]双冠的合成方法分为烷化法和分子内成环法。前者以杯芳烃在碱性条件下生成酚氧负离子作为亲核试剂,与作为烷化剂的二卤化物、二对甲苯磺酸酯或二甲磺酸反应。后者先在杯芳烃母体上连接2个或4个短链,再使其通过氧化、缩聚等反应形成一条链。
1.1 烷化法(Dialkylation)
烷化法是将烷化剂与生成酚氧负离子的杯[4]芳烃母体反应制备杯[4]双冠。按反应是否需要制备中间产物杯[4]单冠,分为一步合成法和二步合成法。
1.1.1 一步合成法
一步合成法是直接将2个烷化剂同时与杯[4]芳烃作用生成杯[4]双冠。该法制得的杯[4]双冠具有对称结构,即连接杯[4]芳烃的2个冠醚链相同。一步合成法反应过程如图1所示。
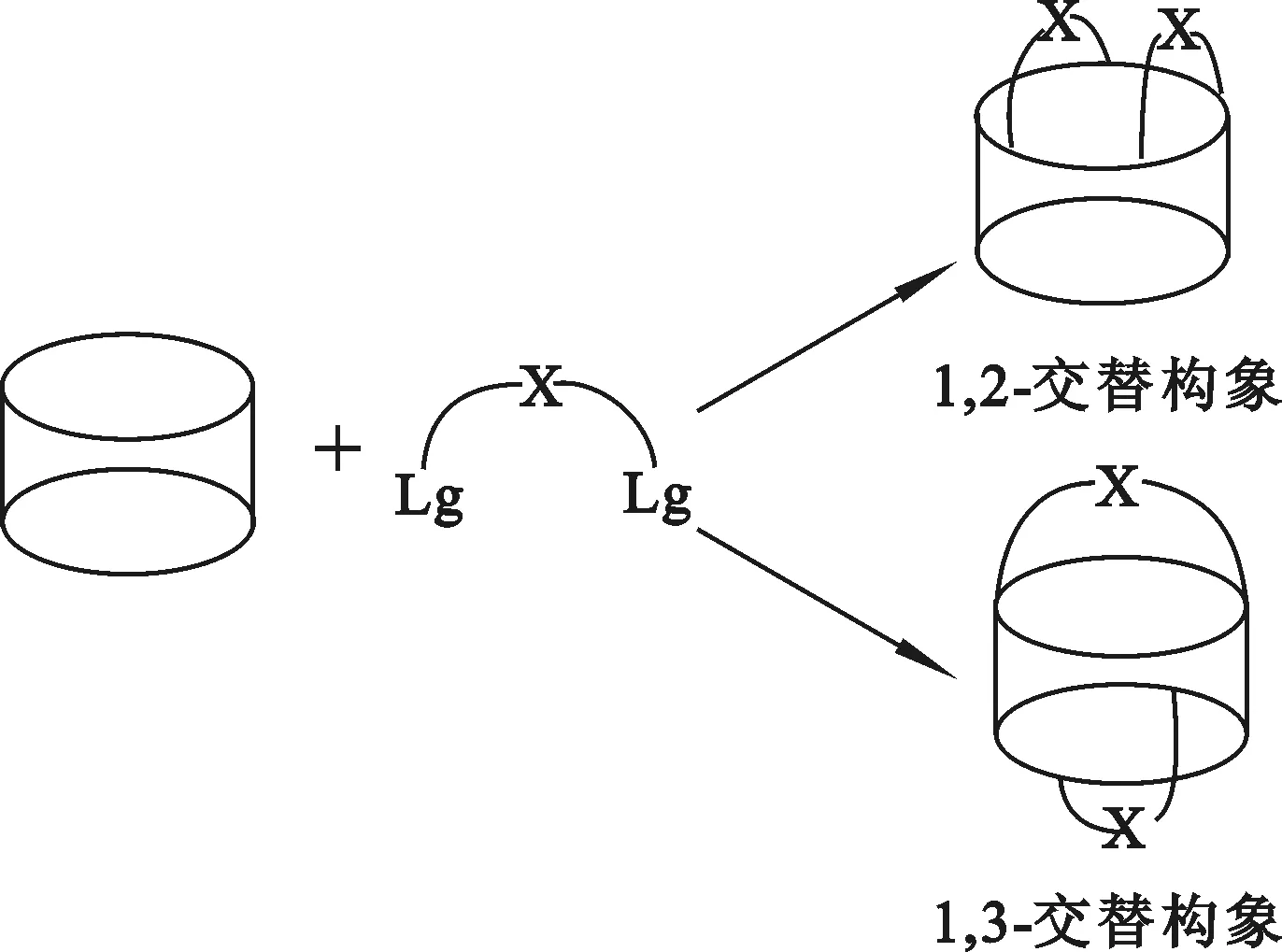
图1 一步法合成杯[4]双冠
式中,Lg=TsO、MsO、Br、I等。2种产物分别代表1,3-交替构象和锥形构象杯[4]双冠。
Asfari等[9]采用一步法,利用锥形构象杯[4]芳烃与多种2对甲苯磺酸酯反应,成功合成多种杯[4]双冠化合物(1~7)(图2),且收率在50%~80%之间,1H NMR证实产物为1,3-交替构象。Asfari还利用该方法合成了杯[4]-1,2-双冠-5[10]。
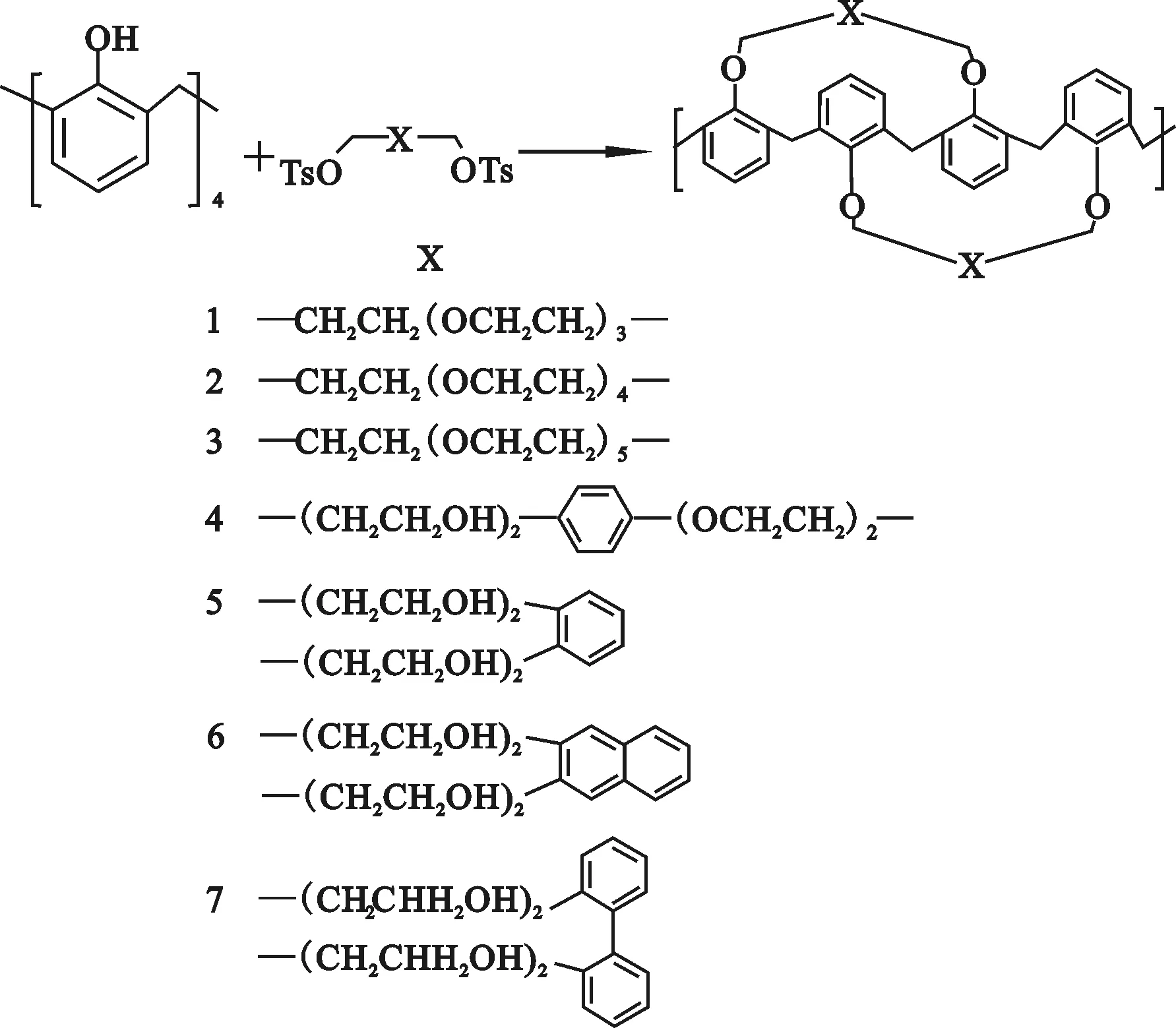
图2 一步法合成杯[4]双冠(1~7)
Kim等[11]利用含二苯并的2对苯甲酸与锥形构象杯[4]芳烃在Cs2CO3/乙腈中反应,制备杯[4]-二苯并-双冠,1H NMR和13C NMR证实产物为1,3-交替构象。
一步合成法过程简单,反应时间大多小于14 d,收率较高,但仅限于合成对称型杯[4]双冠化合物。
1.1.2 二步合成法
二步合成法需要先制备出杯[4]单冠,再将第2条聚醚链与杯[4]单冠剩下的2个苯环连接。与一步法不同,二步法中存在中间产物杯[4]单冠。二步合成法反应过程如图3所示。
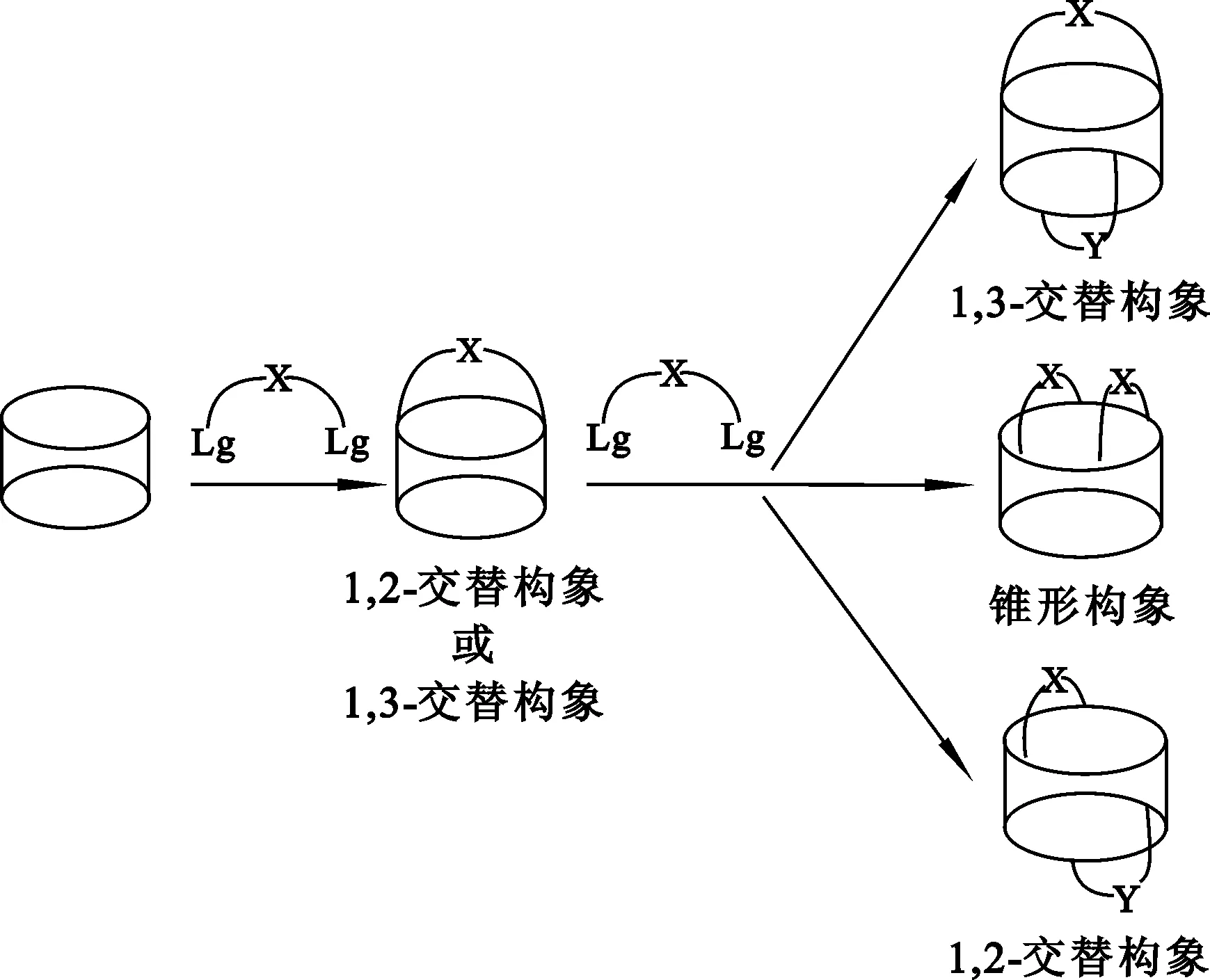
图3 二步法合成杯[4]双冠
当X=Y时,产物为对称型;当X≠Y时,产物为非对称型。
Wenger等[12]首先使锥形构象杯[4]芳烃和四甘醇2对甲苯磺酸酯反应,制备出1,3桥链锥形构象的杯[4]-冠-5,然后按一步法使杯[4]单冠与含有N原子的2对甲苯磺酸酯反应,制备出非对称型杯[4]-氮杂-冠-5-冠-5,收率为20%。
Pulpoka等[13]采用冠-6醚链与杯[4]芳烃键合制得杯[4]-单-冠-6,再使其与含有穴状单元的醚链反应,制备出含有冠-6和穴状单元的杯[4]双冠,但收率仅有8%。
Mathieu等[14]采用二步法制备出1,2-交替构象8a~8e(图4),收率为20%。可以看出,采用二步法可以合成不对称型杯[4]双冠,而且产物种类较多,可选择性大,但由于存在中间产物杯[4]单冠,致使总收率较低。
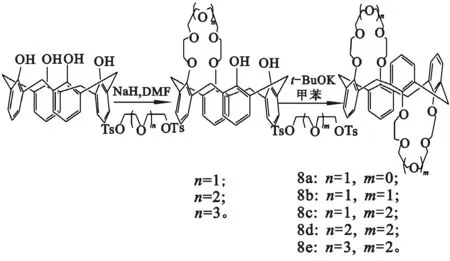
图4 二步法合成若干杯[4]双冠
1.2 分子内成环法(intramolecular cyclization strategy)
分子内成环法指杯[4]芳烃上的短链通过氧化、缩合等反应形成一条链的方法。1995年,Arduini[15]偶然发现杯[4]芳烃上沿2个对位甲醇基通过缩合反应生成1条非常短的—CH2OCH2—,得到杯[4]冠醚。这是首例次以分子内成环法制备杯[4]冠醚。
Saadioui等[16]通过分子内成环法,将杯[4]单冠醚下沿对位2个短链末端的—NH2氧化成—N=N—双键,使2个短链成为1条长链,从而制备出含偶氮苯的1,3-交替构象杯[4]双冠醚,收率为34%。
Kim等[17]采用分子内成环法,通过2条短链末端2个氯的离去成功制备出1,3-交替构象杯[4]-冠-5-氮杂-冠-5(收率为24%)和1,3-交替构象杯[4]-双-氮杂-冠-5(收率52%)。
Lee等[18]采用硫代二硫甘醇连接杯[4]单冠醚下沿的2个短链方式,得到同时含有软原子和硬原子的杯[4]双冠(图5)。
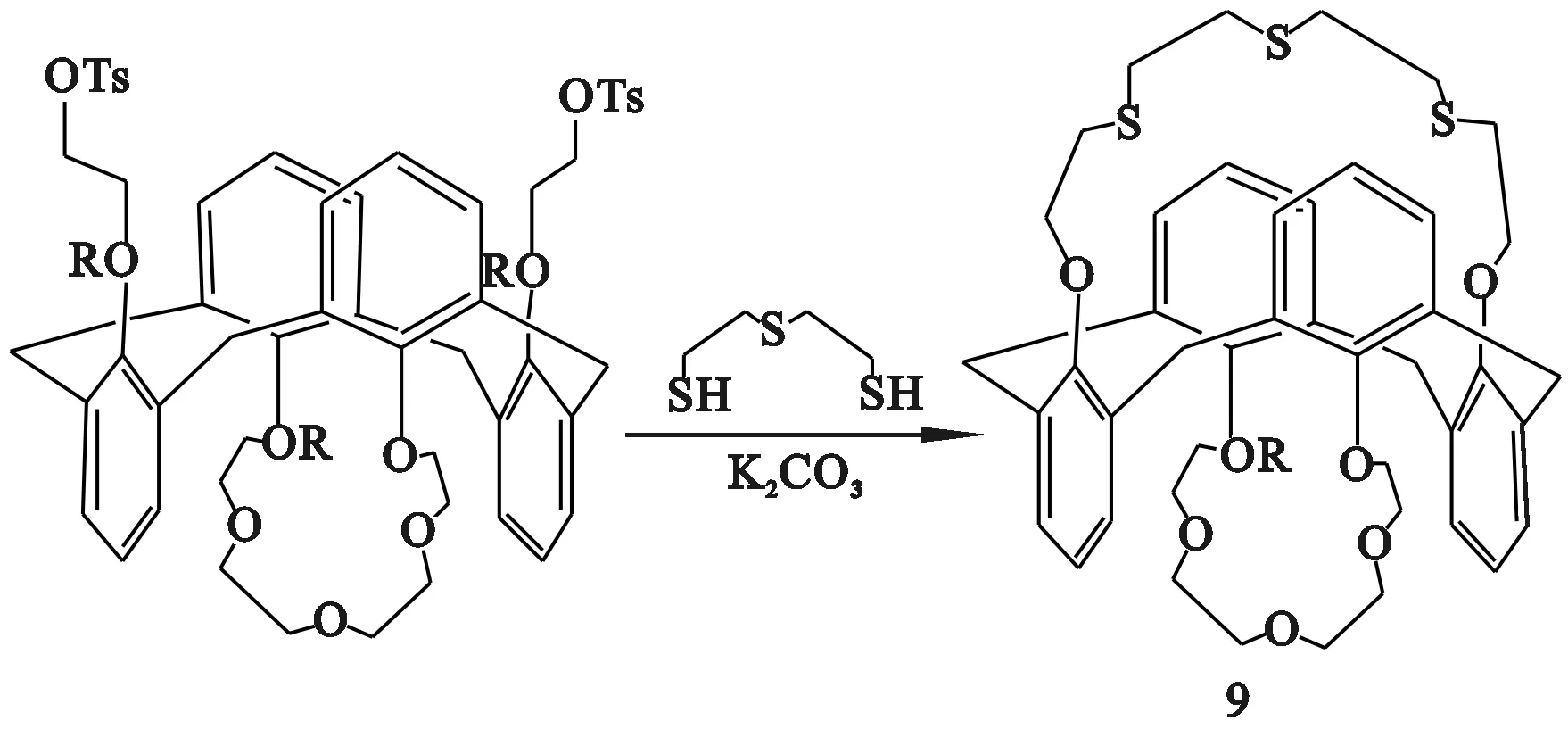
图5 内成环法合成杯[4]双冠
可能是分子内成环过程中的熵不利作用及成环时缺乏金属离子模板效应原因,杯[4]冠醚收率较低,进而阻碍该方法在杯芳烃化学中的应用。但是Xia[19]认为,通过恰当地设计,分子内成环法仍具有2个优势:1)较少依赖模板作用使得成环选择性更大;2)制备含有大尺寸冠醚链的杯芳冠醚时,采用分子内环化法可以避免制备长聚甘醇链和对应的二对甲苯磺酸酯。所以,在合成含有N、S等原子的杯[4]双冠时,分子内成环法仍可作为一种选择。
2 影响杯[4]双冠合成的因素
影响产物杯[4]双冠构象和收率的因素有杯[4]芳烃性质、催化剂性质、聚醚链长度和反应物间计量比等。
2.1 杯[4]芳烃
杯[4]芳烃具有4种构象:锥形构象、部分锥形构象、1,2-交替构象和1,3-交替构象,且构象间具有流动性。目前被用来合成杯[4]双冠的杯[4]芳烃多为锥形构象,产物的构象和收率主要是通过控制碱和冠醚链的性质来控制。如锥形构象杯[4]芳烃在K2CO3/乙腈作用下与二对甲苯磺酸酯反应的产物为1,3-交替构象杯[4]双冠[20],而在NaH/DMF条件下的产物为锥形构象杯[4]-1,2-3,4-双冠。但是也可以采用具有稳定构象的杯[4]芳烃为母体合成杯[4]双冠,反应前后杯芳烃构象不发生变化。以菜酚为基本单元的杯[4]芳烃具有非常稳定的构象,在-60~180 ℃条件下均以1,3-交替构象形式存在,因此,Asfari等[21]利用菜酚杯[4]芳烃分别与三甘醇二对甲苯磺酸酯、四甘醇二对甲苯磺酸酯、五甘醇二对甲苯磺酸酯反应制备1,3-交替构象菜酚杯[4]-双-冠-4、-双-冠-5和-双-冠-6。
2.2 碱
碱在杯[4]双冠合成时发挥2个作用:一是促使杯芳烃下沿的酚羟基形成氧负离子;二是成环时起模板作用。目前,合成时常用到的碱为K2CO3、Cs2CO3、NaH和t-BuOK等。
碱的种类和用量能影响产物的构象和收率。在Cs2CO3/乙腈条件下,杯[4]芳烃和四甘醇二对甲苯磺酸酯反应,产物为锥形构象杯[4]-1,2-3,4-双冠-5,收率为9%。这是因为:当四甘醇二对甲苯磺酸酯链的一端与杯芳烃下沿中的氧原子相连后,Cs+的模板作用会使链的另一端与邻位氧原子连接,从而形成1,2桥连产物[15];而在同样条件下,将催化剂替换为K2CO3,产物则为1,3-交替构象杯[4]-1,3-2,4-双冠-5,收率大于50%[9]。
另外,碱的模板效应还能影响反应时间。菜酚杯[4]芳烃与五甘醇二对甲苯磺酸酯在K2CO3条件下只需要反应24 h即可得到杯芳双冠化合物。相同条件下,菜酚杯[4]芳烃与三甘醇二对甲苯磺酸酯、四甘醇二对甲苯磺酸酯则需要反应10 d才能得到相应的化合物。有研究人员认为,在五甘醇二对甲苯磺酸酯双环化时,K+的模板效应缩短了反应时间[21-22]。
Kim[23]利用二步法制备了一系列杯[4]双冠,发现K2CO3比Cs2CO3更适合作为第一步反应——杯[4]单冠合成的催化剂,无论冠醚环是冠-5还是冠-6。相反,Cs2CO3比K2CO3更适合作第二步反应——杯[4]双冠合成的催化剂,而不论冠醚环多大。
2.3 甘醇链
甘醇链末端基团的种类对杯[4]双冠合成有影响。目前,合成杯[4]双冠时使用较多的甘醇链为聚甘醇二对甲苯磺酸酯,这类甘醇链末端基团为—TsO。大量的杯[4]双冠通过杯[4]芳烃和这种类型甘醇链反应制得[11-12,24-26]。但是将甘醇链的末端基团替换成其他类型,如—MsO、—Br和—I等,也能得到杯[4]双冠[27]。甚至一些反应的收率比末端基团为—TsO时的更高。Kim等[28-29]使用甲磺酸Ms作离去基团,成功合成多种杯芳冠醚类化合物。杯[4]芳烃和聚甘醇二对甲磺酸酯在Cs2CO3/乙腈中反应,得到杯[4]-双-二苯并-冠-6和杯[4]-双-二苯并-冠-7(10a和10b)。经13C NMR证实,该产物为1,3-交替构象。Kim[11]发现,与对应的二对甲苯磺酸酯反应相比,该反应的收率提高了70%。反应如图6所示。
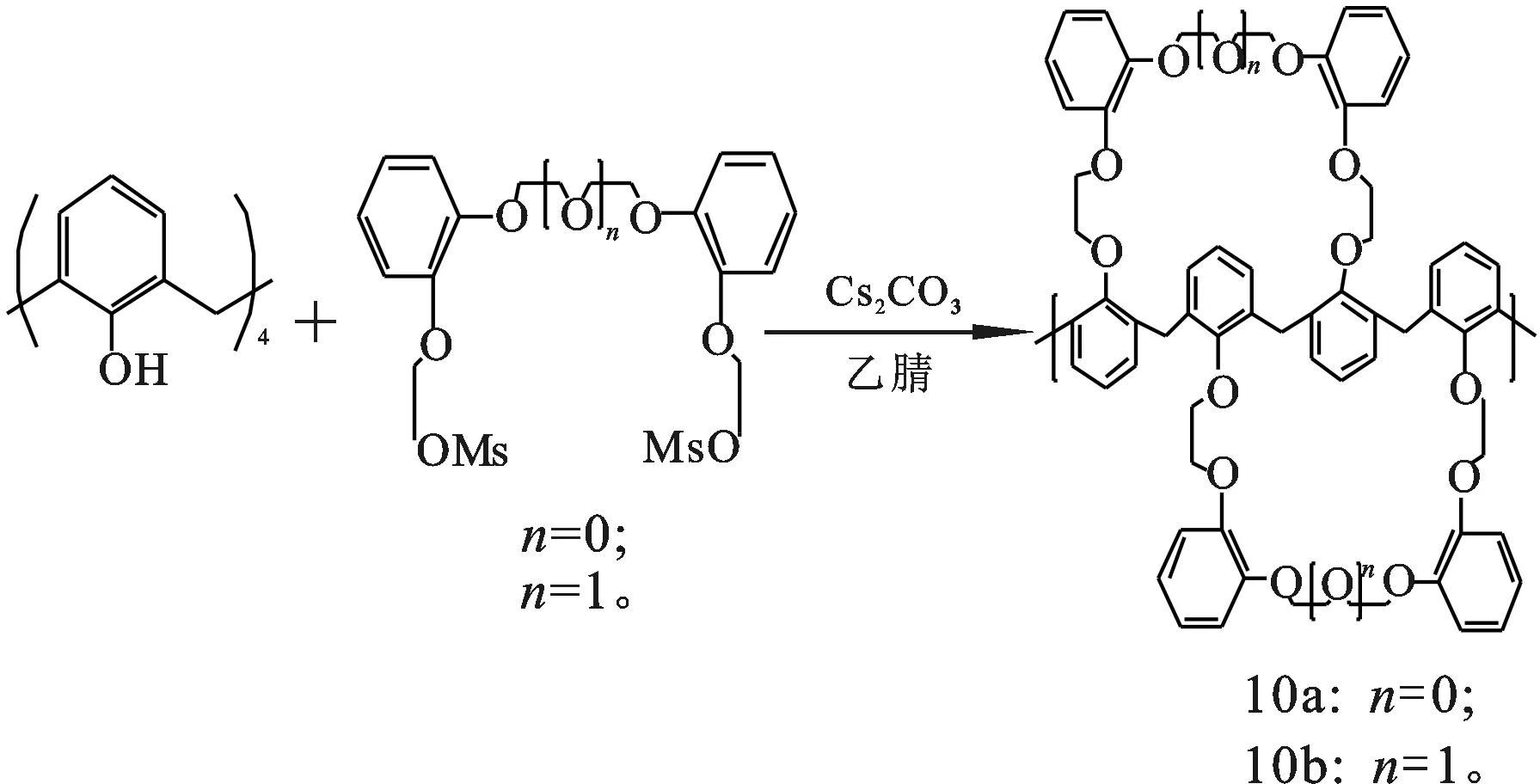
图6 以甲磺酸作离去基团合成杯[4]双冠
Asfari[30]研究发现:当甘醇链较长时,容易制得1,3-交替杯[4]双冠;而甘醇链较短时,易制得双杯[4]冠醚。
2.4 反应物之间的计量比
杯[4]冠醚由杯[4]芳烃与甘醇链反应制得。显然,二者之间的比例对产物有重要影响。当二者的比例约等于1∶1时,产物主要为杯[4]单冠;而比例大致为1∶2时,产物主要为杯[4]双冠。
Kim[23]利用二步法制备不对称型杯[4]双冠过程中,系统地研究了碱的计量对于产物收率的影响。结果发现,对于第一步合成杯[4]单冠,K2CO3为1.0当量时,杯[4]-单-冠-5和杯[4]-单-冠-6的收率最大;0.5当量和2.0当量都不利于提高收率,1.0当量和2.0当量的Cs2CO3也不利于合成。
过量的四甘醇二对甲苯磺酸酯和对-特-叔丁基杯[4]芳烃反应,产物不是杯[4]双冠,而是双对-特-叔丁基杯[4]-双-冠-5(11)[30-31],结构如图7所示。2个1,3-交替构象的杯[4]芳烃被2个冠醚链连接,且每个杯[4]芳烃的1,3位被四乙烯甘醇链桥链。
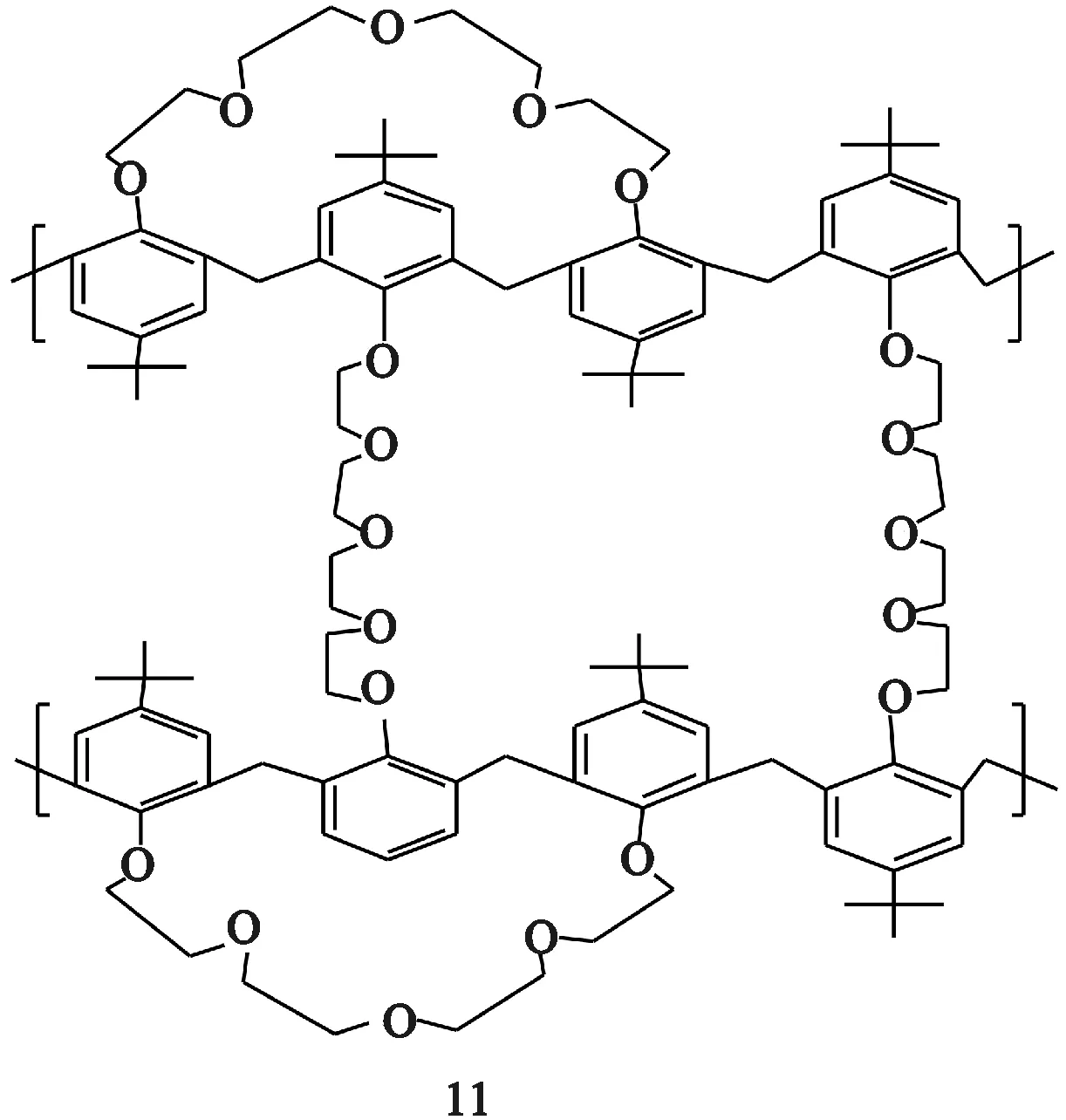
图7 双对-特-叔丁基杯[4]-双-冠-5结构
3 合成机制
通过烷化法制备杯[4]双冠与杯[4]单冠的机制相同,均属于亲核取代反应。碱和杯[4]芳烃在溶剂回流下预先进行离子化反应,生成亲核氧负离子。氧负离子进攻聚醚链中最靠近离去基团的碳正离子,然后脱去离去基团,得到一取代化合物。由于碱的阳离子模板作用,另一个苯环上的氧负离子进攻聚醚链另一端上的碳正离子,形成一个桥连的冠醚环。另一聚醚链以相同的方式与剩下的两个苯环相连。如锥形构象杯[4]-双-冠-5(12),合成机制如图8表示:
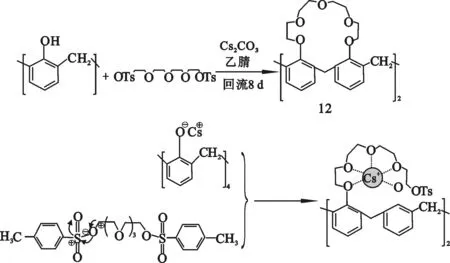
图8 杯[4]-双-冠-5的合成机制
分子内成环方式指杯芳烃上的短链连接成一条链,因此,关环方式不同,其机制也不同,有氧化、缩合等。如2条短链末端的2个—NH2被二氧化锰氧化偶氮双键,形成含有偶氮的聚醚链,制备出偶氮型1,3-交替构象杯[4]双冠[15];2条末端为—TsO基团的短链在K2CO3作用下,与硫代
二硫甘醇反应,缩合成含硫原子的聚醚链[16];末端为卤族元素Cl的2个短链与对甲苯磺酰胺发生缩合反应,生成含有N原子的冠醚链[17]。
4 杯[4]双冠醚分离Cs
高放废液具有酸度高、核素成分复杂、含盐量高、温度较高等特点,使得从中分离Cs成为核工业尚需攻克的难题之一。杯[4]双冠醚具有较高的Cs/Na选择性与化学稳定性,是研究的热点。
Riddle等[7]研究了以煤油作稀释剂,4,4′,(5′)-二-(特丁基二环己基)-18-冠-6(DtBuCH18C6)和BOBCalixC6作萃取剂,1-(2,2,3,3-四氟丙氧基)-3-(4-sec-丁基苯氧基)-2-丙醇(Cs-7SB)为相修饰剂,从酸性溶液中同时分离Sr(Ⅱ)和Cs(Ⅰ)。结果表明:BOBCalixC6和Cs-7SB促进了DtBuCH18C6萃取Sr(Ⅱ);室温下该萃取体系在1.0 mol/L HNO3介质中的Sr(Ⅱ)和Cs(Ⅰ)分配比分别为8.8和7.7。基于该结果,建立了同时萃取分离Sr(Ⅱ)和Cs(Ⅰ)的FPEX(Fission Product Extraction)技术流程[32-34](图9)。
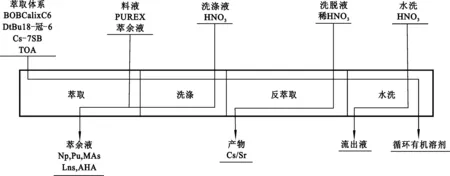
图9 裂变产物萃取流程
一些研究人员提出了从碱性放射性废液中分离Cs(Ⅰ)的CSSX(Caustic-Side Solvent-Extraction)溶剂萃取流程(图10)[35-38]。该流程采用0.01 mol/L的BOBCalixC6为萃取剂,0.50 mol/L Cs-7SB和0.001 mol/L三辛胺为修饰剂,烷烃为稀释剂,研究从萨瓦纳河处理厂的碱性HLW中萃取Cs(Ⅰ)的行为。结果表明:CSSX可有效萃取分离碱性废液中的Cs(Ⅰ)。然而,绝大多数HLW的介质为高浓度HNO3,因此,限制了CSSX萃取流程的应用范围。
Dietz等[39]分别将化合物5和BOBCalixC6注入惰性聚合基体甲基丙烯酸酯交联树脂中,制成了固定相。色谱试验表明:在酸度小于1.0 mol/L条件下,2种材料能选择性分离Cs(Ⅰ);6.0 mol/L HNO3很容易洗脱吸附的Cs(Ⅰ);不同于萃取试验,酸度对色谱分离Cs(Ⅰ)影响很小;与其他材料相比,高分子基材料的吸附容量处于中低水平,适合用于放射性核素分析化学领域中;该类材料在γ辐射下产生一定的分解,适合用在弱γ辐射环境中。
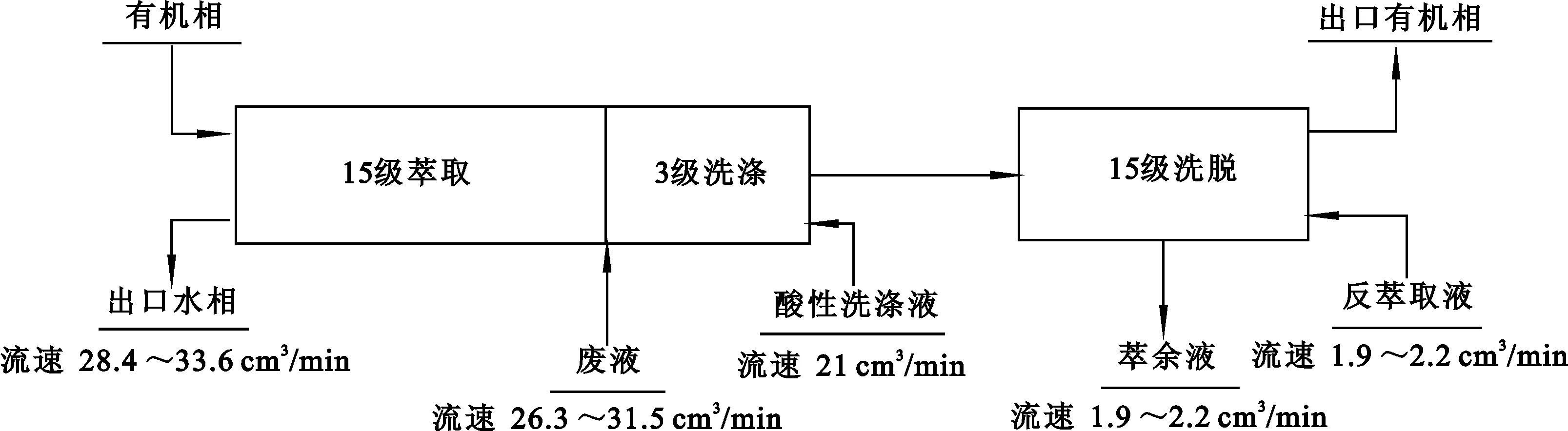
图10 碱性溶剂萃取流程
张安运等[40]合成了一系列具有出色识别能力的超分子识别化合物,并研究了它们在硝酸溶液中分离Cs及共存金属离子的性能。采用辛醇作修饰剂所制备的杯[4]双冠/SiO2-P,在4.0 mol/L HNO3溶液中,对Cs(Ⅰ)有强烈的识别与吸附选择性。基于大量研究,提出了从HLW中有效分离Sr(Ⅱ)和Cs(Ⅰ)的SPEC(Strontium/Cesium Partitioning from HLW by Extraction Chromatography)色谱分离技术流程。
5 结论
最近20 a,杯[4]双冠合成技术发展很快,从最初的杯[4]全氧双冠发展到杯[4]氮杂双冠和杯[4]硫杂双冠等,种类增多,功能也日趋多样。在杯[4]双冠的冠醚中引入芳香基,可使杯[4]双冠更具有疏水性,而引入羟基和羧基则会使杯[4]双冠亲水性更好。但是杯[4]双冠的合成手段未发生革命性变化,最基本的杯[4]双冠合成方法仍然是20 a前的,该方法的主要缺点是耗时过长,需要数天才能完成,一些杯[4]双冠甚至需要14 d才能合成。而目前有关杯[4]双冠的报道多倾向于合成杯[4]双冠的衍生物和应用,因此,如何快速合成杯[4]双冠仍需要科研工作者继续努力。
无论是溶剂萃取还是固相萃取,杯[4]双冠化合物均可有效分离Cs。当前制约Cs分离的主要因素有:1)杯[4]双冠合成成本较高(市售杯[4]双冠单价>1 500元/g);2)由于高放废液产量较小,以不锈钢罐对其进行存储成本在可接受范围内;3)核燃料循环是一个系统工程,究竟采取何种手段处理高放废液仍需统筹考虑。尽管如此,杯[4]双冠终将在核燃料循环中发挥应有的作用。
[1] 张安运,肖成梁,柴之芳.硅基超分子识别材料在乏燃料后处理中的研究进展[J].化学进展,2011,23(7):1355-1365.
[2] GHIDINI E,UGOZZOLI F,UNGARO R,et al.Complexation of alkali metal cations by conformationally rigid,stereoisomeric calix[4]arene crown ethers:a quantitative evaluation of preorganization[J].Journal of the American Chemical Society,1990,112(19):6979-6985.
[3] NIJENHUIS W F,BUITENHUIS E G,JONG F D,et al.Calixcrowns as selective potassium cation carriers in supported liquid membranes[J].Journal of the American Chemical Society,1991,113(21):7963-7968.
[4] UNGARO R,CASNATI A,UGOZZOLI F,et al.1,3-Dialkoxycalix[4] arenecrowns-6 in 1,3-alternate conformation:cesium-selective ligands that exploit cation-arene interactions[J].Angewandte Chemie International Edition in English,1994,33(14):1506-1509.
[5] SIMON N,EYMARD S,TOURNOIS B,et al.Caesium extraction from acidic high level liquid wastes with funchnalized[C]//ATALANTE 2000,Avinon,France:ATALANTE,2000:24-26.
[6] DELMAU L H,VAN BERKEL G J,BONNESEN P V,et al.Improved performance of the alkaline-side csex process for cesium extraction from alkaline high-level waste obtained by characterization of the effect of surfactant impurities[R].Tennessee:ORNL/TM,1999.
[7] RIDDLE C L,BAKER J D,LAW J D,et al.Fission product extraction(fpex):development of a novel solvent for the simultaneous separation of strontium and cesium from acidic solutions[J].Solvent Extraction and Ion Exchange,2005,23(3):449-461.
[8] ZHANG A,HU Q,CHAI Z.SPEC:a new process for strontium and cesium partitioning utilizing two macroporous silica-based supramolecular recognition agents impregnated polymeric composites[J].Separation Science and Technology,2009,44(9):2146-2168.
[9] ASFARI Z,BRESSOT C,VICENS J,et al.Doubly crowned calix[4]arenes in the 1,3-alternate conformation as cesium-selective carriers in supported liquid membranes[J].Analytical Chemistry,1995,67(18):3133-3139.
[10] ASFARI Z,ASTIER J P,BRESSOT C,et al.Synthesis,characterization,and x-ray structure of 1,2-bis-crown-5-calix[4]arene.modeling of metal complexation[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,1994,19(1):291-300.
[11] KIM J S,SUH I H,KIM J K,et al.ChemInform Abstract:selective sensing of caesium ions by novel calix[4]arene bis(dibenzocrown) ethers in an aqueous environment[J].Journal of the Chemical Society Perkin Transactions,1998,1(15):2307-2312.
[12] WENGER S,ASFARI Z,VICENS J.Synthesis of an unsymmetrically doubly bridged calix[4]arene in the 1,3-alternate conformation[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,1994,20(4):293-296.
[13] PULPOKA B,ASFARI Z,VICENS J.Synthesis of unsymmetrical calix[4]arene cryptand crown-6 in 1,3-alternate conformation[J].Tetrahedron Letters,1996,37(35):6315-6318.
[14] MATHIEU A,ASFARI Z,VICENS J.Water-soluble para-sulfonated 1,2, 3,4-calix[4] arene-biscrowns in the cone conformation[J].Tetrahedron Letters,2002,43(7):1225-1229.
[15] ARDUINI A,FANNI S,MANFREDI G,et al.Direct regioselective formylation of tetraalkoxycalix[4]arenes fixed in the cone conformation and synthesis of new cavitands[J].The Journal of Organic Chemistry,1995,60(5):1448-1453.
[16] SAADIOUI M,ASFARI Z,THUÉRY P,et al.An azobenzene 1,3-alternate calix[4]-bis-crown and its 1∶1 complex with cesium[J].Tetrahedron Letters,1997,38(32):5643-5646.
[17] KIM J S,LEE W K,NO K,et al.Two novel 1,3-calix[4]azacrowns[J].Tetrahedron Letters,2000,41(18):3345-3348.
[18] LEE J Y,KIM H J,PARK C S,et al.A calix-bis-crown with hard and soft crown cavities:heterobinuclear k+/ag+complexation in solid and solution states[J].Chemistry-A European Journal,2009,15(36):8989-8992.
[19] XIA Y X,ZHOU H H,YIN Y,et al.Intramolecular cyclization strategy:synthesis of 1,3-and 1,2-calix[4]crown-7 and calix[4]crown-9 cone conformers[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2010,68(3):423-429.
[20] XUE G P,BRADSHAW J S,SU N,et al.Synthesis of two 1,3-2,4-calix[4]bis-crown ethers containing two 1,2-phenylene and one pyridine or anisole units in each crown ether moiety[J].Journal of Heterocyclic Chemistry,2000,37(1):1-3.
[21] ASFARI Z,PAPPALARDO S,VICENS J.New preorganized calix[4]arenes:part Ⅰ:a doubly-crowned calix and a double-calixcrown derived from 4,6,10,12,16,18,22,24,25,26,27,28-dodecamethyl-5,11,17,23-tetrahydroxycalix[4]arene[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,1992,14(2):189-192.
[22] MAKRLIK E,VANURA P,SELUCKY P,et al.Calix[4]arene-bis(coumarin-crown-6) as an extraordinarily effective macrocyclic receptor for Cs+,Ag+,and Tl+[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2015,81(1):169-174.
[23] KIM J S,LEE W K,SIM W,et al.Calix[4]arenes bridged with two different crown ether loops:influence of crown size on metal ion recognition[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2000,37(1):359-370.
[24] THUÉRY P,NIERLICH M,ARNAUD-NEU F,et al.Silver ion complexation by a calix[4]arene bis(crown ether):ambivalence towards ether and polyhapto coordinations[J].Supramolecular Chemistry,1999,11(2):143-150.
[25] PELLET-ROSTAING S,CHITRY F,SPITZ J A,et al.New water-soluble calix[4]arene-bis(benzocrown-6) for caesium-sodium separation by nanofiltration- complexation[J].Tetrahedron,2003,59(51):10313-10324.
[26] KHRIFI S,ASFARI Z,VICENS J,et al.Calixcrown binding to caesium x-ray structural determination of a 1,3-alternate calix[4]arenebiscrown-7 ligand[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,1997,29(2):187-195.
[27] ALEKSEEVA E A,BASOK S S,MAZEPA A V,et al.Facile synthesis of cone p-tert-butylcalix[4]arene-crown conformers[J].Mendeleev Communications,2007,17(6):330-331.
[28] KIM J S,PANG J H,YU I Y,et al.Calix[4]arene dibenzocrown ethers as caesium selective extractants[J].Journal of the Chemical Society,Perkin Transactions 2,1999(4):837-846.
[29] KIM J S,LEE W K,LEE S H,et al.Cesium complex of an unsymmetrical calix[4]crown-dibenzocrown-6[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2001,40(3):183-187.
[30] ASFARI Z,WENGER S,VICENS J.Calixcrowns and related molecules[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,1994,19(1):137-148.
[31] ASFARI Z,ABIDI R,ARNAUD F,et al.Synthesis and complexing properties of a double-calix[4]arene crown ether[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,1992,13(2):163-169.
[32] LAW J,PETERMAN D,RIDDLE C,et al.Advances in development of the fission product extraction process for the separation of cesium and strontium from spent nuclear fuel[C]//American Society of Mechanical Engineers.The 11th International Conference on Environmental Remediation and Radioactive Waste Management,2007:525-528.
[33] MINCHER B J,MODOLO G,MEZYK S P.Review article:The effects of radiation chemistry on solvent extraction:2:a review of fission-product extraction[J].Solvent Extraction and Ion Exchange,2009,27(3):331-353.
[34] MINCHER B,MEZYK S,BAUER W,et al.FPEX γ-radiolysis in the presence of nitric acid[J].Solvent Extraction and Ion Exchange,2007,25(5):593-601.
[35] BONNESEN P V,DELMAU L H,MOYER B A,et al.Development of effective solvent modifiers for the solvent extraction of cesium from alkaline high-level tank waste[J].Solvent Extraction and Ion Exchange,2003,21(2):141-170.
[36] ENGLE N L,BONNESEN P V,TOMKINS B A,et al.Synthesis and properties of calix[4]arene- bis[4-(2-ethylhexyl)benzo-crown-6],A cesium extractant with improved solubility[J].Solvent Extraction and Ion Exchange,2004,22(4):611-636.
[37] WALKER D,NORATO M,CAMPBELL S,et al.Cesium removal from savannah river site radioactive waste using the caustic-side solvent extraction(CSSX) process[J].Separation Science and Technology,2005,40(1/2/3):297-309.
[38] DELMAU L H,HAVERLOCK T J,BAZELAIRE E,et al.Alternatives to nitric acid stripping in the caustic-side solvent extraction(CSSX) process for cesium removal from alkaline high-level waste[J].Solvent Extraction and Ion Exchange,2009,27(2):172-198.
[39] DIETZ M L,ENSOR D D,HARMON B,et al.Separation and preconcentration of cesium from acidic media by extraction chromatography[J].Separation Science and Technology,2006,41(10):2183-2204.
[40] ZHANG A,XIAO C,LIU Y,et al.Preparation of macroporous silica-based crown ether materials for strontium separation[J].Journal of Porous Materials,2010,17(2):153-161.
Progress on Synthesis and Separating Cs in HLLW of Calix[4]biscrown
DAI Ying1,2,ZHANG Anyun1
(1.CollegeofChemicalandBiologicalEngineering,ZhejiangUniversity,Hangzhou310027,China;2.SchoolofChemistry,BiologicalandMaterialsSciences,EastChinaUniversityofTechnology,Nanchang330013,China)
Calix[4]biscrowns is obtaining more and more attention because of its very strong recognition ability for some radioactive elements and was researched extensively in the field of extraction and chromatograph separation of these radioactive elements in high level wastes.Synthesis strategies,synthesis mechanism,influence factors on calix[4]biscrowns,and its utilization in separation Cs(Ⅰ) in HLLW are reviewed.
calix[4]biscrown;synthesis;HLLW;Cs(Ⅰ);separation
2016-08-15
国家自然科学基金资助项目(U1407115,91126021);江西省教育厅科技计划项目(GJJ150560);东华理工大学核资源与环境重点实验室开放基金资助项目(NRE1512);东华理工大学博士启动基金资助项目(DHBK2015301)。
戴荧(1985-),男,江西九江人,博士研究生,讲师,主要研究方向为超分子的制备及其应用。E-mail:mrdaiying@163.com。
张安运(1964-),男,陕西咸阳人,博士研究生,教授,主要研究方向为超分子的制备及其应用。
O625.1
A
1009-2617(2017)02-0083-08
10.13355/j.cnki.sfyj.2017.02.001

