生长调节剂对低温胁迫下酸橙幼苗抗逆生理指标的影响*
梁永富 王康才 薛 启 隋 利 叶 军 陈兴忠
(1.南京农业大学园艺学院 南京 210095; 2.泰州市林业技术指导站 泰州 225300)
生长调节剂对低温胁迫下酸橙幼苗抗逆生理指标的影响*
梁永富1王康才1薛 启1隋 利1叶 军2陈兴忠2
(1.南京农业大学园艺学院 南京 210095; 2.泰州市林业技术指导站 泰州 225300)
【目的】分析不同浓度BRs、BT和SA对低温胁迫下酸橙幼苗抗逆生理指标的影响,寻找缓解酸橙幼苗低温伤害的可行方法,为酸橙的推广种植提供技术参考。【方法】以盆栽酸橙幼苗为材料,叶面分别喷施不同浓度油菜素内酯(BRs)、甜菜碱(BT)和水杨酸(SA)溶液后,置于4 ℃/0 ℃(昼/夜)、光照600 μmol·m-2s-1的人工气候箱内,进行低温胁迫处理。以常温(温度25 ℃/23 ℃(昼/夜),光照600 μmol·m-2s-1)下喷施蒸馏水为CK1,以低温胁迫(4 ℃/0 ℃(昼/夜),光照600 μmol·m-2s-1)下喷施蒸馏水为CK2。低温胁迫处理3天后,测定酸橙幼苗叶片细胞膜透性、丙二醛、脯氨酸、可溶性蛋白、叶绿素含量,以及SOD、POD、CAT抗氧化酶活性。【结果】与CK1相比,低温显著抑制CK2酸橙幼苗叶片抗氧化酶活性,加重低温对细胞膜的伤害,致使细胞膜结构被破坏,不能正常行使其功能,进而引起酸橙幼苗叶片相对电导率和丙二醛含量显著上升。低温处理也会导致叶绿体结构被破坏,引起光合色素的分解,致使叶绿素和类胡萝卜素含量显著下降,不能正常进行光合作用。与CK2相比,叶面喷施生长调节剂可以显著提高酸橙幼苗叶片脯氨酸和可溶性蛋白含量,减轻酸橙幼苗叶片因低温而导致的细胞失水; 提高SOD、POD、CAT抗氧化酶活性,有效清除细胞内过多的活性氧,避免膜脂过氧化的发生,显著降低叶片丙二醛含量和相对电导率,使细胞膜系统代谢正常,减轻低温胁迫对酸橙幼苗叶片造成的伤害。同时,叶面喷施生长调节剂显著提高叶片叶绿素与类胡萝卜素含量,减弱低温对光合作用的抑制影响。随着浓度的升高,生长调节剂对酸橙幼苗低温伤害的缓解作用呈现先增强后减弱的趋势,其中以叶面喷施0.15 mg·L-1BRs、10 mmol·L-1BT、1 mmol·L-1SA溶液的效果最为明显。【结论】叶面喷施浓度为0.15 mg·L-1BRs、10 mmol·L-1BT、1 mmol·L-1SA溶液可明显减轻低温胁迫对酸橙幼苗叶片的伤害。关键词: 酸橙幼苗; 低温胁迫; 外源物质; 抗逆
芸香科植物酸橙(Citrusaurantium)是一种经济及观赏价值较高的果树,也是中药材枳壳的基原植物。枳壳具有理气宽中、行滞消胀的功效,用于治疗胸胁气滞、胀满疼痛、食积不化、痰饮内停、脏器下垂,为常用中药材。酸橙主要分布于江苏、浙江、广东、贵州、四川、江西等省。在江苏泰州大田种植过程中发现,冬春季持续低温会导致酸橙叶片逐渐枯黄掉落,此时酸橙已开始进入春芽和开花期,持续低温给酸橙的花芽分化及坐果造成一定的伤害,严重影响枳壳产量。因此,如何缓解低温伤害,对酸橙的推广种植和提高枳壳产量具有重要意义。
目前研究表明,叶片表面喷施生长调节剂可显著提高植物抗寒性,缓解植物的低温伤害。低温胁迫下,植物激素油菜素内酯(BRs)通过增加电子流向卡尔文循环的转移,减少活性氧(ROS)的产生,从而提高农作物的抗逆性(Yuetal., 2002; 2004; Khripachetal., 2000; Krishnaetal., 2003; Ogwenoetal., 2008)。甜菜碱(BT)能够保护细胞膜和稳定抗氧化酶等生物大分子的结构,增强细胞有效清除ROS的能力,减轻低温对细胞造成的伤害(郭启芳等, 2004; 张波等, 2005)。同时,细胞内BT的增加,还可以降低胞内水势和冰点,减轻植物因失水和结冰而造成的低温伤害(刘文英, 2015)。水杨酸(SA)是植物体内普遍存在的酚类化合物,能够导致逆境反应信号转导分子H2O2含量的上升,从而引发系统获得性抗性反应的产生(Shirasuetal., 1997; Luoetal., 2001; Kratschetal., 2000),帮助植物度过不良环境(Chenetal., 1993a; 1993b)。相关研究表明,用BRs和SA喷施黄瓜(Cucumissativus)幼苗可以缓解其幼苗光合系统的低温伤害(Huetal., 2010; 刘伟等, 2009),提高植物的净光合速率。康国章等(2003)发现SA通过对植物进行类似于冷驯化的锻炼过程,提高抗氧化酶活性,保护光合器官,从而增强香蕉(Musasapientum)抗逆性。低温胁迫下,叶面喷施BT可以显著提高结缕草(Zoysiajaponica)抗氧化酶活性(梁小红等, 2015),外源BT还能提高烟草(Nicotianatabacum)叶片类囊体膜功能,增强烟草对低温胁迫的抵抗力(Wangetal., 2008)。虽然BRs、BT、SA在提高植物抗逆性方面的研究已经很多,但对于低温胁迫下酸橙幼苗抗逆性的影响却未见报道。本文根据酸橙栽培过程中遇到的实际问题,研究喷施不同浓度BRs、BT和SA对低温胁迫下酸橙幼苗叶片生理生化特性的影响,以探讨利用外源物质提高酸橙幼苗抗寒能力的可行性,以期为酸橙的推广种植提供技术参考。
1 材料与方法
1.1 试验材料和处理方法
试验用酸橙幼苗由湖南程锦农业科技开发有限公司提供,是2015年4月中旬经种子发芽的实生苗,试验于2015年9—11月在南京农业大学温室内进行。于2015年9月1日选取生长基本一致、无病虫害、高10 cm 左右的酸橙幼苗栽种于高16 cm、直径14 cm的塑胶盆中,栽培基质为蛭石与营养土以2∶1混合,基质体积约为花盆体积的80%,每盆4株。常规水肥管理,每5天浇水1次,每次浇水量为150 mL,缓苗1个月后进行生长调节剂和低温胁迫处理,此时苗高11.3 cm左右,平均基茎为0.96 cm。
1.2 试验设计
选用SA、BT、BRs 3种生长调节剂处理酸橙幼苗,SA设0.2,0.5,1.0,1.5,2.0 mmol·L-15个浓度,BT设5,10,15,20,25 mmol·L-15个浓度, BRs设0.05,0.1,0.15,0.2,0.25 mg·L-15个浓度。于2015年10月1—3日18:00对酸橙进行叶面喷施,以叶片正反面浸润、向下滴液为度,每处理4盆,连续喷施3天。第3天喷施生长调节剂2 h后(康国章等, 2003; 宋金凤等, 2012),将幼苗连同塑胶盆放入人工气候箱(QHX-800L人工气候箱,金坛市良友仪器有限公司)中进行低温胁迫处理,温度为4 ℃/0 ℃(昼/夜),光照为600 μmol·m-2s-1,同时设置2组对照。对照CK1为置于温度25 ℃/23 ℃(昼/夜),喷施蒸馏水; CK2为低温胁迫,喷施蒸馏水。低温处理3天后(康国章等, 2003; 宋金凤等, 2012; Huetal., 2010)取出苗木,在室温下恢复24 h后,随机采取4~6片成熟叶(幼苗中部)进行相关生理指标测定。
1.3 指标测定
可溶性蛋白含量测定采用考马斯亮蓝G-250染色法; 脯氨酸含量测定采用茚三酮法; 丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)法; 超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性测定分别采用氮蓝四唑(NBT)法和高锰酸钾滴定法; 过氧化物酶(POD)活性测定采用愈创木酚法; 叶绿素含量采用乙醇提取分光光度法; 相对电导率采用电导仪法(李合生, 2000)。
1.4 数据统计与分析
采用Excel 2010和统计软件SPSS 20.0进行统计分析,LSD法检验差异显著性。
2 结果与分析
2.1 低温胁迫下生长调节剂对酸橙幼苗叶片细胞膜透性的影响
2.1.1 MDA含量变化 MDA是膜脂过氧化产物,通过测量MDA含量可以了解细胞膜受到ROS氧化伤害的程度。从表1可知,与CK1相比,CK2酸橙幼苗叶片MDA含量显著增加254.66%。经不同浓度生长调节剂处理后,酸橙幼苗叶片MDA含量较CK2均显著降低,说明叶面喷施生长调节剂能显著减少ROS的产生,降低膜脂过氧化的程度,从而有效抵御低温对酸橙幼苗的伤害。其中0.15 mg·L-1BRs、10 mmol·L-1BT、1 mmol·L-1SA处理效果最为显著,相对于CK2,分别降低57.03%,60.54%,60.54%。2.1.2 相对电导率的变化 相对电导率是衡量细胞膜透性的重要指标,其值越大,说明细胞膜透性越大,细胞受到伤害的程度就越高。从表1可知,与CK1相比,CK2叶片相对电导率显著升高124.23%,说明低温胁迫破坏了酸橙幼苗的细胞膜系统。喷施3种生长调节剂后,与CK2相比,均不同程度降低酸橙幼苗叶片相对电导率,随着3种生长调节剂喷施浓度的升高相对电导率出现先降低后升高的趋势。与CK2相比,浓度为0.15 mg·L-1BRs、10 mmol·L-1BT、1 mmol·L-1SA处理的酸橙幼苗叶片相对电导率显著下降,分别降低41.86%,44.49%,43.07%。

表1 生长调节剂对低温胁迫下酸橙幼苗叶片MDA含量和相对电导率的影响①
① 同一列不同英文字母表示差异显著(P<0.05)。下同。The different letters within the same column mean the significance at the 0.05 level.The same below.
2.2 低温胁迫下生长调节剂对酸橙幼苗叶片抗氧化酶活性的影响
从表2可知,与CK1相比,在低温胁迫下CK2酸橙叶片POD、SOD酶活性显著降低,分别降低33.17%和13.51%,表明低温胁迫显著抑制POD、SOD酶活性。相对于低温处理CK2来说,叶面喷施生长调节剂显著提高酸橙幼苗叶片抗氧化酶POD、SOD和CAT的活性,且均随着生长调节剂浓度的增加呈现先升高后降低的趋势。与CK2相比,酸橙幼苗叶片抗氧化酶POD、SOD和CAT活性均以0.15 mg·L-1BRs、10 mmol·L-1BT、1 mmol·L-1SA处理提高效果最为显著。喷施0.15 mg·L-1BRs,酸橙幼苗叶片POD、SOD和CAT酶活性分别提高49.31%,11.07%,27.6%,喷施10 mmol·L-1BT,酸橙幼苗叶片POD、SOD和CAT酶活性分别提高58.29%,13.34%,27.71%,喷施1 mmol·L-1SA,酸橙幼苗叶片POD、SOD和CAT酶活性分别提高67.00%,15.86%,26.51%。

表2 生长调节剂对低温胁迫下酸橙幼苗叶片抗氧化酶活性的影响
2.3 低温胁迫下生长调节剂对酸橙幼苗叶片渗透调节物质含量的影响
2.3.1 脯氨酸含量变化 脯氨酸是植物重要的抗逆生理指标之一,参与植物细胞的渗透调节过程。从表3可知,酸橙幼苗经低温胁迫处理后,叶片中脯氨酸含量较CK1显著增加。说明低温胁迫下酸橙幼苗能自发产生某种适应低温胁迫的机制,诱导并积累脯氨酸,缓解低温伤害。相对于CK2,叶面喷施不同浓度的生长调节剂可明显提高酸橙幼苗叶片脯氨酸含量。经0.15 mg·L-1BRs、10 mmol·L-1BT、1 mmol·L-1SA处理的酸橙幼苗,叶片脯氨酸含量显著提高33.22%,29.44%,28.41%。
2.3.2 可溶性蛋白含量变化 可溶性蛋白也是植物体内重要的渗透调节物质。从表3可知,低温胁迫下,酸橙叶片可溶性蛋白含量的变化趋势与脯氨酸含量一致,可溶性蛋白含量相对于CK1明显增加。随着BRs、BT、SA浓度的增大,酸橙幼苗叶片可溶性蛋白含量呈现先增加后降低的趋势。相对于CK2,叶面喷施0.15 mg·L-1BRs,酸橙幼苗可溶性蛋白含量显著提高34.43%;叶面喷施10 mmol·L-1BT,酸橙幼苗可溶性蛋白含量显著提高65.20%;叶面喷施1 mmol·L-1SA,酸橙幼苗可溶性蛋白含量显著提高67.88%。
2.4 低温胁迫下生长调节剂对酸橙幼苗叶片叶绿素含量的影响
从表4可知,经低温处理后,光合色素含量显著下降,与CK1相比,CK2酸橙幼苗叶片中叶绿素a、叶绿素b、类胡萝卜素和叶绿素总量分别显著下降18.39%,18.78%,26.46%,18.46%。与CK2相比,叶面喷施不同浓度的生长调节剂能够显著减缓酸橙幼苗叶片叶绿素的下降趋势,其中以0.15 mg·L-1BRs、10 mmol·L-1BT、1 mmol·L-1SA喷施效果最好。相对于CK2,叶面喷施0.15 mg·L-1BRs,类胡萝卜素和叶绿素含量分别增加22.9%,18.67%;叶面喷施10 mmol·L-1BT,类胡萝卜素和叶绿素含量分别增加25.18%,20.62%;叶面喷施1 mmol·L-1BRs,类胡萝卜素和叶绿素含量分别增加34.98%,24.37%。

表3 生长调节剂对低温胁迫下酸橙幼苗叶片渗透调节物质含量的影响
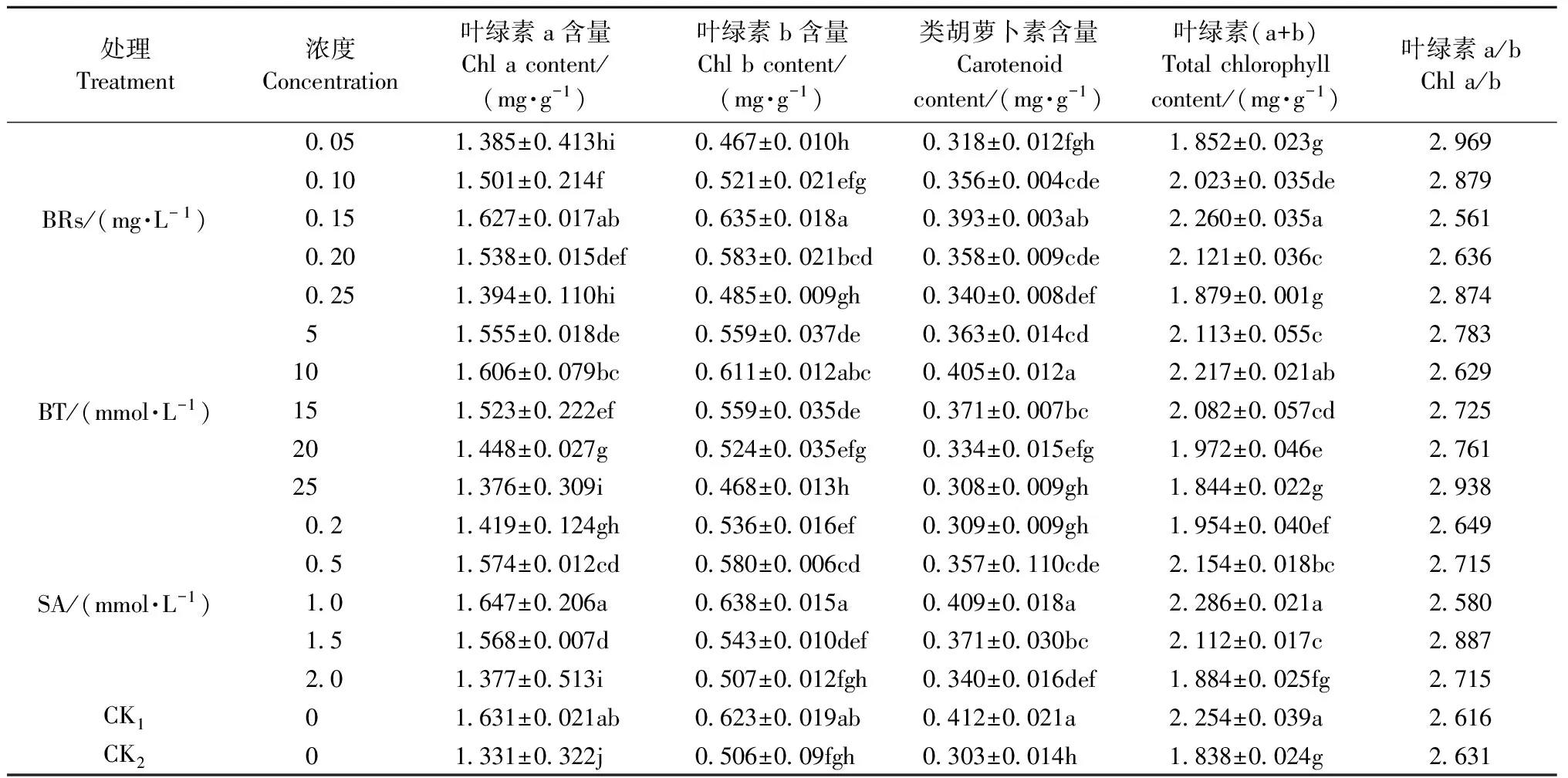
表4 生长调节剂对低温胁迫下酸橙幼苗叶片叶绿素含量的影响
3 讨论
3.1 低温胁迫对酸橙幼苗叶片的伤害

3.2 生长调节剂对低温胁迫下酸橙幼苗的渗透调节作用
低温胁迫引起的植物水分损失与植物根吸收和运输水分以及在随后水分亏缺响应中关闭气孔的能力下降有关(Bloometal., 2004)。植物体内缺水会引起植物叶片及嫩枝的萎蔫甚至死亡。本研究发现,酸橙幼苗顶部新叶在低温处理第1天就出现萎蔫状况,而下部叶片在低温处理完成后仍没有出现严重萎蔫,这可能是因为幼嫩的新叶较酸橙下部叶片对水分更加敏感。植物细胞缺水会促使植物主动积累脯氨酸和可溶性蛋白等渗透物质,以降低细胞渗透势,增加细胞持水量。因此,低温胁迫下植物体内渗透调节物质含量水平对于维持植物体内水分含量、减轻植物的低温伤害具有重要意义。本研究发现,与CK2相比,低温胁迫下用BRs、BT、SA处理的酸橙幼苗,其脯氨酸和可溶性蛋白含量显著提高,进而可以推测SA可能诱导抗冻蛋白和脯氨酸的合成和积累(Chenetal., 1993a),而BRs可能减少ROS的产生(Yuetal., 2002),保护细胞内合成酶类等生物大分子,产生与BT一样的保护作用(郭启芳等, 2004)。3种生长调节剂作用的最终结果都是使细胞内脯氨酸和可溶性蛋白含量增加,减少细胞水分损失,同时稳定酸橙幼苗叶片细胞膜结构与功能,减轻膜脂过氧化程度,显著降低MDA含量和相对电导率,提高酸橙幼苗的抗寒性。
3.3 生长调节剂对低温胁迫下酸橙幼苗抗氧化酶活性的影响
SOD、POD和CAT是植物体内清除ROS和自由基的抗氧化酶,是植物抵抗逆境的第一道防线。低温环境下,植物细胞自由基的产生和清除遭到破坏而出现ROS的过量积累,这种积累超过一定阈值,就会破坏膜系统的结构与功能,发生膜脂过氧化,导致植物死亡(Liuetal., 2013)。因此,抗氧化酶活性越高,植物对逆境的适应能力就越强。本研究发现,叶面喷施BRs、BT、SA能够显著提高低温胁迫下酸橙幼苗叶片SOD、POD和CAT抗氧化酶活性。因此,可以推断3种生长调节剂可以提高酸橙幼苗的抗逆性,增强酸橙对低温环境的抵抗力。3种生长调节剂对抗氧化酶活性的诱导效果不同,可能是因为其对酸橙的作用机制不同: BRs通过促进光合作用电子的运输,减少自由基的产生和自由基对细胞伤害,使细胞代谢正常(Yuetal., 2002); 而SA可能是直接诱导酶活性的产生(Chenetal., 1993a); BT则是通过其对细胞内大分子的保护作用,保护了抗氧化酶和膜系统的结构,使其正常行使功能(郭启芳等, 2004)。3种外源物质通过其特有的作用方式减少ROS的产生,提高抗氧化酶的活性,维持植物体内ROS代谢的平衡,进而减轻低温对酸橙幼苗的伤害。这与前人的研究一致(Scandalioetal., 1997)。
3.4 生长调节剂对低温胁迫下光合色素的保护作用
光合作用为植物生长和发育提供所需的物质和能量,是植物生长发育的基础。低温胁迫对植物光合色素含量、PSⅡ活性及光合能量代谢等一系列生理生化过程都有明显的影响(曾乃燕等, 2000; 刘文英, 2015)。具体表现为,低温会抑制光合作用碳反应的酶活性,使植物发生光抑制现象,进而影响植物的各种生理代谢过程(Alametal., 2002; Powles,2003)。长时间的低温胁迫会加重酸橙幼苗的光抑制现象,导致PSⅡ复合体中的D1蛋白受损,致使PSⅡ活性中心被破坏(郑彩霞, 2013)。同时,光抑制会破坏叶绿体双层膜结构,引起光合色素的降解。本研究发现,与低温胁迫CK2相比,喷施BRs、BT、SA能显著提高酸橙幼苗叶片叶绿素和类胡萝卜素含量,这可能是因为BRs能够促进光合电子向卡尔文循环转移,减少叶绿体中光能积累(Ogwenoetal., 2008); BT保护光合作用的碳反应酶和光合色素合成酶的结构(郭启芳等, 2004),使碳反应能够快速并顺利地进行; SA诱导抗氧化酶产生和保护光合色素合成酶的活性。3种生长调节剂通过其对细胞调节作用,最终可减少酸橙幼苗叶片细胞中ROS含量,避免ROS对叶绿体的破坏,在促进光合色素合成的同时,保护光合色素的结构,使细胞内光合色素的含量维持在一个较高水平。同时,类胡萝卜素等光保护介质的增加,可加快过剩光能的耗散(Demmigetal., 1992),减少D1蛋白受损机率,保护光合系统。
4 结论
低温是影响泰州地区酸橙生长的重要环境因子之一,在酸橙栽培过程中应采取相应措施降低酸橙树苗的低温伤害。本研究发现,在低温来临之前,叶面喷施油菜素内酯(BRs)、甜菜碱(BT)、水杨酸(SA)能够降低低温胁迫下酸橙幼苗MDA含量,提高渗透调节物质含量,减轻叶绿素下降趋势,显著提高SOD、POD、CAT等多种抗氧化酶活性,并最终提高苗木在低温胁迫下的抗逆性。BRs、BT、SA处理酸橙幼苗的适宜浓度分别为0.15 mg·L-1,10 mmol·L-1,1 mmol·L-1。
郭启芳,马千全,孙 灿,等.2004.外源甜菜碱提高小麦幼苗抗盐性的研究.西北植物学报, 24(9):1680-1686.
(Guo Q F, Ma Q J, Sun C,etal. 2004.Effects of exogenous glycinebetaine on the salt-tolerance of wheat. Acta Botanica Boreali-Occidentalia Sinica, 24(9):1680-1686. [in Chinese])
康国章,欧志英,王正询,等.2003.水杨酸诱导提高香蕉幼苗耐寒性的机制研究.园艺学报, 30(2):141-146.
(Kang G Z, Ou Z Y, Wang Z X,etal. 2003.Salicylic acid alleviated the damage caused by low temperature to cell membrane and some photosynthetic functions of banana seedlings. Acta Horticulture Sinica, 30(2):141-146. [in Chinese])
李合生.2000.植物生理生化实验原理和技术. 北京: 高等教育出版社, 134-263.
(Li H S. 2000.Principles and techniques of biochemical and physiological experiments for plants. Beijing: Higher Education Press, 134-263. [in Chinese])
梁小红,安勐颍,宋 峥,等.2015.外源甜菜碱对低温胁迫下结缕草生理特性的影响.草业学报, 24(9):181-188.
(Liang X H, An M Y, Song Z,etal. 2015. Effects of exogenous glycine betaine on the physiological characteristics ofZoysiajaponicaunder low-temperature stress. Acta Prataculturae Sinica, 24(9):181-188. [in Chinese])
刘文英.2015.植物逆境与基因.北京: 北京理工大学出版社, 41-76.
(Liu W Y. 2015.Plant stress and gene. Beijing: Beijing Institute of Technology Press, 41-76. [in Chinese])
刘 伟,艾希珍,梁文娟,等.2009.低温弱光下水杨酸对黄瓜幼苗光合作用及抗氧化酶活性的影响.应用生态学报, 20(2):441-445.
(Liu W, Ai X Z, Liang W J,etal. 2009.Effects of salicylic acid on the leaf photosynthesis and antioxidant enzyme activities of cucumber seedlings under low temperature and light intensity. Chinese Journal of Applied Ecology, 20(2):441-445. [in Chinese])
宋金凤,李 锋,王亚军,等.2012.低温胁迫下外源有机酸对长白落叶松幼苗生理生化特性的影响.林业科学,48(2): 89-95.
(Song J F, Li F, Wang Y J,etal. 2012.Effects of exogenous organic acids on physiological and biochemical characteristics ofLarixolgensisseedlings under low temperature stress. Scientia Silvae Sinicae, 48(2): 89-95.[in Chinese])
曾乃燕,何军贤,赵 文,等.2000.低温胁迫期间水稻光合膜色素与蛋白水平的变化.西北植物学报, 20(1):8-14.
(Zeng N Y, He J X, Zhao W,etal. 2000.Changes in components of pigments and proteins in rice photosynthetic membrane during chilling stress. Acta Botanica Boreali-Occidentalia Sinica, 20(1):8-14. [in Chinese])
张 波,张怀刚.2005.甜菜碱提高植物抗盐性的作用机理及其遗传工程研究进展.西北植物学报, 25(9):1888-1893.
(Zhang B, Zhang H G. 2005.Mechanism for glycine betaine to improve plant salt resistance and its research advances in genetic engineering. Acta Botanica Boreali-Occidentalia Sinica, 25(9): 1888-1893. [in Chinese])
郑彩霞.2013.植物生理学.北京: 中国林业出版社, 125-160.
(Zheng C X. 2013. Plant physiology. Beijing: China Forestry Publishing House, 125-160. [in Chinese])
郑国华,张贺英,钟秀荣.2009.低温胁迫下枇杷叶片细胞超微结构及膜透性和保护酶活性的变化.中国生态农业学报,17(4): 739-745.
(Zheng G H, Zhang H Y, Zhong X R. 2009.Changes in cell ultra-structure, membrane permeability and protective enzyme activity inEriobotryajaponicaLindl. leaves under cold stress. Chinese Journal of Eco-Agriculture, 17(4): 739-745. [in Chinese])
Alam B, Jacob J. 2002. Overproduction of photosynthetic electrons is associated with chilling injury in green leaves. Photosynthetica, 40(1): 91-95.
Alscher R G, Erturk N, Heath L S. 2002. Role of superoxide dismutase (SOD) in controlling oxidative stress in plants. Journal of Experimental Botany, 53(372): 1331-1341.
Bloom A J, Zwieniecki M A, Passioura J B,etal. 2004.Water relations under root chilling in a sensitive and tolerant tomato species. Plant Cell and Environment, 27 (8): 971-979.
Chen Z, Ricigliano J W, Klessig D F. 1993a. Purification and characterization of a solube salicylic acid binding protein from tobacco. Pro Natl Acad Sci USA, 90(20): 9533-9537.
Chen Z, Silva H, Klessig D F. 1993b. Active oxygen species in the induction of plant systemic acquired resistance by salicylic acid. Science, 262(5141):1883-1886.
Demmig A B, Adams W W. 1992. Photoprotection and other responses of plant to high light stress. Annu Rev Plant Physiol Plant Mol Biol, 43(11): 599-607.
Hu W H, Wu Y, Zeng J Z,etal. 2010. Chill-induced inhibition of photosynthesis was alleviated by 24-epibrassinolide pretreatment in cucumber during chilling and subsequent recovery. Photosynthetica, 48 (4): 537-544.
Jung S, Steffen K L, Lee H J. 1998. Comparative photoinhibition of a high and a low altitude ecotype of tomato (Lycopersiconhirsutum) to chilling stress under high and low light condition. Plant Sci,134(1): 69-77.
Khripach V, Zhabinskii V, de Groot A. 2000. Twenty years of Brassinosteroids: Steroidal plant hormones warrant better crops for the XXI century. Ann Bot,86(3): 441-447.
Kratsch H A, Wise R R. 2000. The ultrastructure of chilling stress. Plant Cell and Environment, 23(4): 337-350.
Krishna P. 2003. Brassinoteroid-mediated stress responses. Plant Growth Regul, 22(4): 289-297.
Liu W Y, Yu K M, He T F,etal. 2013. The low-temperature induced physiological responses ofAvenanudaL.,a cold tolerant plant species. The Scientific World Journal, 2013(6):658-793.
Luo J P, Jiang S T, Pan L J. 2001. Enhanced somatic embryogenesis by salicylic acid ofAstragalusadsurgenspall.: relationship with H2O2production and H2O2-metabolizing enzyme activities. Plant Sci, 161(1): 125- 132.
Mittler R. 2002. Oxidative stress, antioxidants and stress tolerance. Trends Plant Sci, 7(9): 405-410.
Nilsen E T, Orcutt D M. 1996.The Physiology of Plants under Stress. New York,NY,USA:John Wiley & Sons, 70.
Ogweno J O, Song X S, Shi K,etal. 2008. Brassinosteroids alleviate heat-induced inhibition of photosynthesis by increasing carboxylation efficiency and enhancing antioxidant systems inLycopersiconesculentum. Plant Growth Regul, 27(1): 49-57.
Powles S B. 2003. Photoinhibition of photosynthesis induced by visible light. Annu Rev Plant Physiol Plant Mol Biol, 35(1): 15-44.
Scandalio J G. 1997. Oxidative stress and the molecular biology of antioxidant defenses. Woodbury,New York:Cold Spring Harbor Laboratory Press, 545-552.
Shirasu K, Nakajima H, Rajasekhar K. 1997. Salicylic acid potentiates an agonist-dependent gain control that amplifies pathogen signal in the activation of defense mechanisms. Plant Cell, 9(2): 261-270.
Tatsumi Y, Murata T. 1981.Relation between chilling sensitity of cucurbitaceae fruit and theme mbranceper meability.Society forHorticultural Science, 50 (1): 108-113.
Wang C, Ma X L, Hui Z,etal. 2008. Glycine betaine improves thylakoid membrane function of tobacco leaves under low-temperature stress. Photosyntheica, 46(3):400-409.
Weng J H, Jhaung L H, Jiang J Y,etal. 2006.Down-regulation of photosystem 2 efficiency and spectral reflectance in mango leaves under very low irradiance and varied chilling treatments. Photosynthetica,44(2): 248-254.
Yu J Q, Zhou Y H, Ye S F,etal. 2002. 2,4-epibrassinolide and abscisic acid protect cucumber seedling form chilling injury. Hort Sci Biotechnol, 77(14): 430-473.
Yu J Q, Huang L F, Hu W H,etal. 2004. A role for brassinosteroids in the regulation of photosynthesis inCucumissativus. Exp Bot, 55(399): 1135-1143.
(责任编辑 王艳娜 郭广荣)
Effects of Exogenous Growth Substances on Physiological Traits of Cold Tolerance inCitrusaurantiumSeedlings
Liang Yongfu1Wang Kangcai1Xue Qi1Sui Li1Ye Jun2Chen Xingzhong2
(1.CollegeofHorticulture,NanjingAgriculturalUniversityNanjing210095; 2.ForestryTechnicalGuidanceStationofTaizhou,JiangsuProvinceTaizhou225300)
【Objective】 In order to reveal feasibility of different concentrations of BRs, BT and SA onCitrusaurantiumunder low temperature stress, the effects of BRs, BT and SA on physiological index were studied. 【Method】 PotC.aurantiumseedlings cultured under the same outdoor conditions were sprayed on the leaves with BRs, BT and SA separately, and then placed in the low incubator [0 ℃/4 ℃ (day/night), light intensity of 600 μmol·m-2s-1], and the seedlings sprayed with distilled water and set at 25 ℃ were served as control Ⅰ(CK1), and the seedlings sprayed with distilled water and set at low temperature stress (0 ℃/4 ℃, day/night) were served as control Ⅱ(CK2). The relative electric conductivity, contents of proline, malondialdehyde, soluble protein, chlorophyll, and activities of SOD, POD and CAT were measured. 【Result】 Compared with normal temperature CK1, low temperature significantly inhibit the antioxidant enzyme activity of CK2, enhanced the cell membrane damage and brought about loss of the normal functions of cell membrane. Thus, low temperature stress caused some increase in relative electric conductivity and MDA content ofC.aurantiumseedlings. Low temperature stress treatment also destroyed the structure of the chloroplast, causing the decomposition of photosynthetic pigment and reducing the content of chlorophyll and carotenoid. Compared with CK2, 0.15 mg·L-1BRs, 10 mmol·L-1BT, 1 mmol·L-1SA enhanced the activities of POD, SOD, and CAT, increased the contents of proline and soluble protein, and effectively reduced the damage of low temperature stress on cell membrane. At the same time, the exogenous BRs , BT and SA increased the contents of chlorophyll and carotenoid, the efficiency of leaf photosynthesis and thus effectively resisted the oxidative stress caused by low temperatures. But with the increasing concentration of spraying, the ability ofC.aurantiumto resist low temperature stress decreased. 【Conclusion】 The foliage spraying with BRs, BT and SA could reduce the damage of low temperature stress onC.aurantiumseedling leaves.
Citrusaurantiumseedlings; low temperature stress; exogenous substances; stress resistance
10.11707/j.1001-7488.20170308
2016-01-14;
2016-03-28。
江苏省林业三新工程(LYSX[2014]48)。
S718.43
A
1001-7488(2017)03-0068-08
*王康才为通讯作者。

