海洋低温α-淀粉酶菌株Bacillus thuringiensisdsh 19-1发酵条件研究
窦少华,周新尚,迟乃玉,修志龙*
(1.大连理工大学生命科学与技术学院,辽宁大连116024;2.大连大学生命科学与技术学院,辽宁大连116622;3.辽宁省海洋微生物生物工程技术研究中心,辽宁大连116622)
海洋低温α-淀粉酶菌株Bacillus thuringiensisdsh 19-1发酵条件研究
窦少华1,2,3,周新尚2,3,迟乃玉2,3,修志龙1*
(1.大连理工大学生命科学与技术学院,辽宁大连116024;2.大连大学生命科学与技术学院,辽宁大连116622;3.辽宁省海洋微生物生物工程技术研究中心,辽宁大连116622)
α-淀粉酶是催化淀粉水解的酶类,其广泛应用于食品、医学等领域。该研究利用响应面法设计试验,优化了海洋低温α-淀粉酶菌株Bacillus thuringiensisdsh 19-1的发酵条件。其最佳发酵条件为发酵时间42.4 h,发酵温度20.6℃,接种量4.1%。在上述优化条件下α-淀粉酶酶活可达3.06 U/mL,较优化前提高17.69%。
低温α-淀粉酶;发酵条件优化;响应面试验
α-淀粉酶(EC3.2.1.1)是一类重要的水解酶,它可将淀粉分子进行内部随机切割α-1,4糖苷键,水解产物包括:糊精、麦芽寡糖、麦芽糖以及葡萄糖[1-2]。α-淀粉酶广泛应用于食品、发酵、纺织和医药等行业,世界淀粉酶产量约占整个酶制剂市场25%~33%[3-4],其中大部分都是α-淀粉酶。目前,国内外市场中常用的α-淀粉酶一般是中温或高温型,最适温度高于50℃,在0~25℃范围活力很低。并且维持其高温作用体系需要的能耗较大,而低温α-淀粉酶的最适作用温度低于40℃[5],与中高温α-淀粉酶相比,其在食品、洗涤、制药等多个领域有无法替代的优越性。
本试验是对大连黄海海泥中分离出一株低温淀粉酶高产菌苏云金芽孢杆菌(Bacillus thuringiensis)dsh19-1的发酵条件进行优化,首先基于Plackett-Burman(P-B)试验设计找出重要影响因子,然后经Minitab15.0软件中响应面Box-Behnken试验设计对响应过程变量进行数学建模及分析,进一步优化响应因子,确定最优发酵条件,从而为该海洋低温α-淀粉酶更深入研究及中试试验奠定基础。
1 材料与方法
1.1 材料与试剂
菌株(Bacillus thuringiensis)dsh19-1:分离自大连黄海海泥,保藏于中国典型培养物保藏中心(编号—CCTCC AB 2015426);蛋白胨、酵母膏、葡萄糖、磷酸氢二钾、可溶性淀粉、牛肉膏、葡萄糖、氯化钠、硫酸亚铁、硫酸镁、琼脂粉:生物工程(上海)股份有限公司。所用试剂均为分析纯。
1.2 仪器与设备
HZP-250全温振荡培养箱、DK-S26电热恒温水浴锅:上海精宏实验设备有限公司;LTI-700低温恒温培养箱:上海爱朗仪器有限公司;DHG-9070电热恒温鼓风干燥箱:上海一恒科技有限公司;UV-2102C紫外可见分光光度计:龙尼柯仪器有限公司;LDZX-40BI立式压力蒸汽灭菌器:上海审安医疗器械厂。
1.3 方法
1.3.1 培养基
种子培养基:蛋白胨10 g/L,酵母膏5 g/L,葡萄糖1 g/L,K2HPO43 g/L,pH 7.0;1×105Pa灭菌30 min。
发酵培养基:可溶性淀粉10 g/L,蛋白胨5 g/L,牛肉膏5 g/L,NaCl 14 g/L,FeSO4·7H2O 0.01 g/L,MgSO4·7H2O 0.05 g/L,pH7.0;1×105Pa灭菌30 min。
1.3.2 培养方法
将斜面保藏菌种活化,将处于对数期菌种按2%的接种量转接至装液量为150 mL的500 mL三角瓶中,20℃、140 r/min振荡培养48 h。
1.3.3 低温淀粉酶粗酶液制备
发酵液于4℃、8 000 r/min离心15 min,上清液即为粗酶液。
1.3.4 酶活测定方法
酶活测定参照OKOLO B N等[6]方法。反应体系如下:1%可溶性淀粉糊化液1.25 mL,0.1 mol/L醋酸-醋酸钠缓冲液(pH6.0)0.25 mL,去离子水0.25 mL,酶液0.25 mL。30℃反应10 min。空白对照:将0.25 mL酶液替换为0.25 mL醋酸-醋酸钠缓冲液(其余条件同上)。波长575 nm处测定吸光度值。酶活单位定义:在分析条件下,1 min释放1 μmol的还原糖所需的酶量定义为1个酶活力单位,酶活力单位为U/mL。还原糖含量以葡萄糖为标准,采用二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法进行测定[7]。
1.3.5 发酵条件响应面优化
在单因素试验的基础上,以低温α-淀粉酶酶活为响应值,选取对其影响显著的因素以及因素较好的水平区间,根据Box-Behnken中心组合试验设计原理,采用响应面分析法对发酵参数进行优化,获得最优发酵条件组成。每组试验重复3次,结果取其平均值。
2 结果与分析
2.1 Plackett-Burman试验设计结果

表1Plackett-Burman试验设计因素与水平Table 1 Factors and levels of Plackett-Burman experiments
响应面法优化发酵工艺是目前优化反应条件和加工工艺参数最常用的方法,而且在很多试验中取得了显著的效果[8-10]。在单因素试验的基础上,选用N=8的Plackett-Burman设计对低温α-淀粉酶发酵条件中的5个因素对低温α-淀粉酶生产的显著性进行考察,试验设计及结果分结果见表1、表2。利用Minitab15.0软件进行分析,发酵时间、发酵温度和接种量为3个影响较为显著的因素。

表2Plackett-Burman试验设计与结果Table 2 Design and results of Plackett-Burman experiments
2.2 最陡爬坡试验
最陡爬坡试验是为了确定显著影响因素的取值逼近中心点以及提高低温α-淀粉酶的产量,发酵时间、发酵温度和接种量这3个因素的变化方向和步长的试验设计及结果见表3。由表3可知,3个显著影响因素的中心点在第2组试验附近,因此确定以第2组的水平作为响应面试验的中心点,即发酵时间、发酵温度、接种量分别为42 h,20℃和4%。

表3 最陡爬坡试验设计及结果Table 3 Design and results of steepest ascent experiments
2.3 响应面设计分析结果
通过Plackett-Burman试验设计,采用Box-Behnken法,以低温α-淀粉酶酶活(Y)为响应值,试验设计及试验结果见表4和表5,利用Minitab15.0软件对结果进行二次回归分析。得到回归方程为:
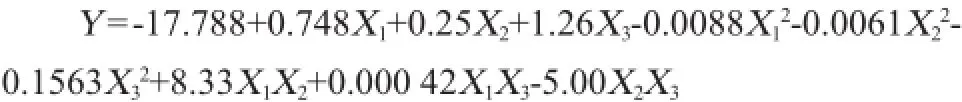
式中:Y为低温α-淀粉酶活力,U/g;X1为发酵时间,h;X2为发
酵温度,℃;X3为接种量,%
回归方程的方差分析结果见表6。由表6可知,显著水平为0.05时,X1,X1X1,X2X2,X3X3是显著的。由表6可知,回归方程显著性(P值)为0.001,为非常显著,模型失拟项:0.178>0.05,模型失拟项不显著,说明模型选择比较合适。回归系数R2=0.978 3>0.9,说明模型相关度很好。因此,可以使用该模型来分析响应值的变化。

表4 菌株发酵条件优化响应面试验因素与水平Table 4 Factors and levels of response surface experiments for strain fermentation conditions optimization

表5 菌株发酵条件优化Box-Behnken设计结果与分析Table 5 Results and analysis of Box-Behnken design for strain fermentation conditions optimization

表6 响应面试验结果方差分析Table 6 Variance analysis of response surface experiments results
2.4 响应面最优结果分析
为了进一步研究相关变量间的交换作用以及确定最优点,通过Minitab软件绘制响应面曲线图进行可视化分析,3组以低温α-淀粉酶酶活为响应值的趋势图见图1。其等高线图可直观反应出两变量交互作用的显著程度,圆形表示两因素交互作用不显著,而椭圆形与之相反。图1A等高线接近圆形,交互作用不显著;图1A、图1B等高线均呈椭圆形,表明两个因素交互作用均显著,并且由图可知,发酵时间与发酵温度,发酵时间与接种量的交互作用最强。
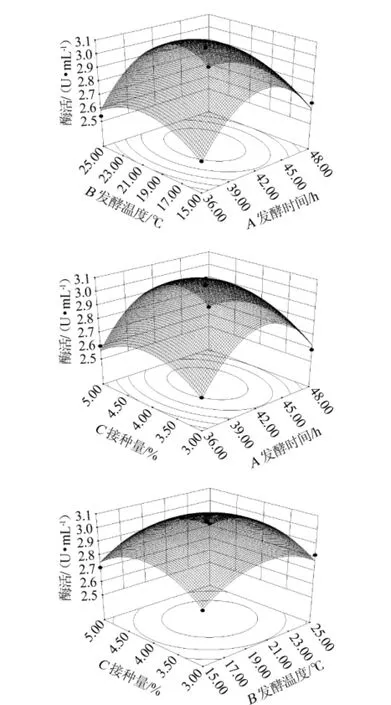
图1 发酵时间、接种量与发酵温度交互作用对酶活的响应曲面和等高线Fig.1 Response surface plots and contour line of effects of interaction between fermentation time,inoculum and temperature on enzyme activity
由图1可知,响应值存在最大值,经软件分析获得酶活预测值最大时对应的发酵条件为:发酵时间42.4 h,发酵温度20.6℃,接种量4.1%,在此条件下预测最大酶活为3.07 U/mL,实测3次平均酶活为3.06 U/mL,与理论值基本一致,表明采用响应面法优化得到的最佳条件准确可靠。
3 结论
采用响应面法对低温α-淀粉酶菌株Bacillusthuringiensis dsh19-1发酵条件进行研究,得到最优发酵条件:发酵时间42.4 h,发酵温度20.6℃,接种量4.1%。此发酵条件下,低温α-淀粉酶酶活达到3.06 U/mL,比优化之前提高了17.69%。
Bacillus thuringiensisdsh19-1最适生长温度为20℃,根据MORITA RY[11]对低温微生物的定义,该菌株属于耐冷菌,发酵粗酶液最适作用温度为20℃,属于低温酶。近年来,随着对极端酶的不断研究,来源于海洋及极地的淀粉酶菌株陆续被发现[12-15],但据文献查阅情况看,目前尚未有苏云金芽孢杆菌(Bacillus thuringiensis)产海洋低温α-淀粉酶的报道。因此,对该菌株发酵条件的研究,可为其进一步发酵放大乃至工业化生产提供理论基础。
[1]ANNOUS B A,BLASCHEK H P.Isolation and characterization of alphaamylase derived from starch-grownClostridium acetobutylicumATCC 824[J].J Ind Microbiol Biot,1994,13(1):10-16.
[2]PAQUET V,CROUX C,GOMA G,et al.Purification and characterization of the extracellular alpha-amylase fromClostridium acetobutylicum ATCC 824[J].Appl Environ Microbiol,1991,57(1):212-218.
[3]GUPTA R,GIGRAS P,MOHAPATRA H,et al.Microbial α-amylases:a biotechnological perspective[J].Process Biochem,2003,38(11):1599-1616.
[4]RAJAGOPALAN G,KRISHNAN C.Alpha-amylase production from catabolite derepressedBacillus subtilisKCC 103 utilizing sugarcane bagasse hydrolysate[J].Bioresource Technol,2008,99(8):3044-3050.
[5]RAO M B,TANKSALE A M,GHATGE M S,et al.Molecular and biotechnological aspects of microbial proteases[J].Microbiol Molecul Biol Rev,1998,62(3):579-635.
[6]OKOLO B N,EZEOGU L I,MBA C N.Production of raw starch digesting amylase byAspergillus nigergrown on native starch sources[J].J Sci Food Agr,2006,69(1):109-115.
[7]MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959,31(3):426-429.
[8]齐西珍,王利强,孟鹏,等.利用响应面法优化α-糖苷酶抑制剂发酵培养基[J].微生物学通报,2012,39(2):203-210.
[9]李雯静,李则静,田中元,等.羊源丁酸梭菌HDRyYB1发酵工艺的优化[J].微生物学通报,2016,43(3):534-540.
[10]袁慎亮,邢德明,窦少华,等.高产纤溶酶菌株CNY16发酵条件优化及其酶学特性初步研究[J].微生物学通报,2014,41(8):1621-1628.
[11]MORITA R Y.Psychrophilic bacteria[J].Bacteriol Rev,1975,39(2): 144-167.
[12]D'AMICO S,GERDAY C,FELLER G.Temperature adaptation of proteins:Engineeringmesophilic-like activityand stabilityin a cold-adapted α-amylase[J].J Mol Biol,2003,332(5):981-988.
[13]LU M,WANG S,FANG Y,et al.Cloning,expression,purification,and characterization of cold-adapted α-amylase fromPseudoalteromonas arcticaGS230[J].Protein J,2010,29(8):591-597.
[14]ZHANG J W,ZENG R Y.Purification and characterization of a coldadapted α-amylase produced byNocardiopsissp.7326 isolated from Prydz Bay,antarctic[J].Mar Biotechnol,2008,10(1):75-82.
[15]吕明生,王淑军,焦豫良,等.海洋低温α-淀粉酶酶解豌豆淀粉及其生物活性[J].食品研究与开发,2016,37(8):99-103.
《中国酿造》杂志广告征订启事
《中国酿造》创刊于1982年,是由中国商业联合会主管,中国调味品协会及北京食品科学研究院主办的综合性科技月刊(国内统一刊号CN 11-1818/TS,国际标准刊号ISSN 0254-5071,广告许可证号:京宣工商广字第0033号)。全国各地邮局均可订阅,邮发代号:2-124;国外总发行:中国国际图书贸易总公司,国外发行代号:BM1437。《中国酿造》历次被评为全国中文核心期刊、中国科技核心期刊、《中国知网》重点收录期刊、《万方数据库》全文收录期刊、《中文科技期刊数据库》来源期刊、中国学术期刊网络出版总库收录期刊、美国《乌利希期刊指南》(UPD)收录期刊、英国《食品科学文摘》(FSTA)收录期刊、英国《国际农业与生物科学研究中心》(CABI)收录期刊、美国《化学文摘》(CA)收录期刊、俄罗斯《文摘杂志》(AJ)收录期刊、中国科学评价研究中心(RCCSE)数据库收录期刊,也是学位与研究生教育的中文重要期刊。
《中国酿造》重点报道调味品、酿酒、食品微生物、食品添加剂、发酵乳制品、生物工程技术、生物化工、生物质能源的开发利用等研究方向的新工艺、新技术、新设备、分析检测、安全法律法规及标准、保鲜与贮运技术、综合利用、质量保障体系等方面的基础理论、应用研究及综述文章。设有“研究报告”、“专论综述”、“创新借鉴”、“经验交流”、“分析检测”、“产品开发”、“酿造文化”、“海外文摘”等栏目。
《中国酿造》发行历史长、范围广、行业知名度高,广告影响面大,效果甚佳,而且价格合理,是一个理想的宣传媒体。欢迎新老广告客户来函、来电、来人联系办理广告业务,我们将提供一切方便,竭诚为您服务。
《中国酿造》是您企业品牌推广、品质提升、技术交流、产品推介的最佳平台。
邮箱:zgnzzz@163.com网站:www.chinabrewing.net.cn电话:010-83152738/83152308
《中国酿造》杂志社
Fermentation conditions of marine low-temperature α-amylase-producingBacillus thuringiensisdsh 19-1
DOU Shaohua1,2,3,ZHOU Xinshang2,3,CHI Naiyu2,3,XIU Zhilong1*
(1.School of Life Science and Biotechnology,Dalian University of Technology,Dalian 116024,China; 2.School of Life Science and Biotechnology,Dalian University,Dalian 116622,China; 3.Liaoning Technology of Marine Microbiological Engineering Research Center,Dalian 116622,China)
α-amylase is an enzyme that catalyzes the hydrolysis of starch,which is widely used in food,medicine and other fields.The fermentation conditions of marine low temperature α-amylase-producingBacillus thuringiensisdsh 19-1 were optimized with response surface methodology.The optimum fermentation conditions were fermentation time 42.4 h,temperature 20.6℃,inoculum 4.1%.Under the conditions,the α-amylase activity was up to 3.06 U/ml,which was 17.69%higher than that of before the optimization.
low-temperature α-amylase;fermentation conditions optimization;response surface experiments
TS23
0254-5071(2017)04-0036-04
10.11882/j.issn.0254-5071.2017.04.008
2017-01-05
辽宁省自然科学基金项目(No.2014020134)
窦少华(1979-),男,副教授,博士研究生,研究方向为微生物工程及酶工程。
*通讯作者:修志龙(1965-),男,教授,博士,研究方向为生物转化与分离。

