开菲尔对高脂金黄地鼠肠道菌群的调节作用研究
高洁,孙静,黄建,刘婷,霍军生*
(1.中国疾病预防控制中心营养与健康所,北京100050;2.国家卫生计生委微量元素营养重点实验室,北京100050;3.中粮营养健康研究院有限公司,北京102209)
开菲尔对高脂金黄地鼠肠道菌群的调节作用研究
高洁1,2,孙静1,2,黄建1,2,刘婷3,霍军生1,2*
(1.中国疾病预防控制中心营养与健康所,北京100050;2.国家卫生计生委微量元素营养重点实验室,北京100050;3.中粮营养健康研究院有限公司,北京102209)
利用高脂金黄地鼠模型研究开菲尔对肠道菌群的调节作用。体质量、肝脏质量、附睾脂肪质量、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)测定结果表明,开菲尔能够有效控制高脂饲料引起的体质量、附睾脂肪质量增加以及LDL-C/HDL-C比值的升高(开菲尔实验组体质量、附睾脂肪质量、LDL-C/HDL-C比值分别为149.8 g、4.0 g、0.7,显著低于高脂饲料对照组的172.1 g、5.5 g、1.1)。高通量测序分析结果显示,开菲尔能够显著下调拟杆菌门、脱铁杆菌门、变形菌门和TM7菌门组成比例和上调厚壁菌门、柔膜菌门和疣微菌门比例;能够上调Akkermansia muciniphila的组成比例,并下调Alistipes indistinctus和Mucispirillum schaedleri的组成比例。因此,推断开菲尔能够调节高脂饲料引起的肠道菌群失调,抑制体质量增加和降低血脂指标。
开菲尔;金黄地鼠;肠道菌群;降血脂
开菲尔(kefir)是一种牧区常见的发酵乳制品,由天然形成的混菌体系,包括乳酸菌、醋酸菌和酵母菌等发酵而成[1]。随着人们对益生菌关注度的提高,开菲尔的有益功能也不断被证实,如抗氧化、抑制肿瘤、降脂、抑菌、改善肠道健康等[2],这些研究多以代谢指标、蛋白或基因为测定靶点,利用人体、动物模型、细胞模型进行开菲尔或其代谢产物与某一特定生物活性功能的关联分析[3]。
作为一个复杂的混菌体系,开菲尔被摄入后首先会与宿主的肠道菌群发生交互作用。近年来对肠道微生态的多项研究表明,肠道菌群与宿主是共生关系,能够被环境和饮食影响,并对宿主健康产生重要作用,特别是与代谢相关的慢性疾病关系密切[4]。与高菌群丰度者相比,低菌群丰度者更倾向于肥胖、胰岛素抵抗、炎症等代谢特征[5]。健康的生活习惯有助于肠道菌群多样性的增加,进而对宿主产生健康作用,而现代快节奏的生活方式和不合理膳食都会导致肠道菌群失衡。开菲尔对肠道健康的改善作用已有较多研究,但大多针对某种症状,如溃疡性结肠炎、便秘、腹泻等,而较少关注对肠道微生态,特别是肠道菌群结构及多样性的影响作用。作为一个对健康有益的混菌体系,其在宿主体内与肠道菌群的互作关系非常具有研究价值。因此,本实验以高脂饲料喂养的金黄地鼠为模型,设置开菲尔灌胃组和脱脂乳灌胃组,并以普通饲料喂养组为对照,进行6周的实验。测定实验动物的体质量、肝脏质量、附睾脂肪质量、血脂以及肠道菌群,研究开菲尔在高脂饲料模式下对实验动物肠道菌群的调节作用,以期为开菲尔的肠道益生作用提供数据基础。
1 材料与方法
1.1 材料与试剂
开菲尔菌粒:实验室保藏;脱脂乳粉:内蒙古伊利实业集团股份有限公司。
实验动物:无特定病原体(specific pathogen free,SPF)级金黄地鼠,8周龄,雄性,体质量(100±10)g,购于北京维通利华实验动物技术有限公司;动物基础饲料购于军事医学科学院实验动物中心;高脂饲料配方:78.8%基础饲料中加入10%猪油、10%蛋黄粉、1%胆固醇、0.2%胆酸盐,定制于军事医学科学院实验动物中心。
血脂四项测定试剂盒:总胆固醇(totalcholesterol,TC)、甘油三酯(triacylglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low densitylipoprotein cholesterol,LDL-C):罗氏(Roche)公司;肠道细菌DNA提取试剂盒:深圳华大基因科技有限公司。
1.2 仪器与设备
COBAS INTEGRA 800全自动生化分析仪:瑞士罗氏(Roche)公司;IlluminaHiSeq2000DNA测序仪:美国Illumina公司;NANO DROP紫外分光光度计:美国Thermo公司;POWERPAC3000电泳仪:美国BIORAD公司;SW-CJ-2FD双人单面垂直净化工作台:苏州智净净化设备有限公司;SQ510C立式压力蒸汽灭菌器:重庆雅马拓科技有限公司。
1.3 方法
1.3.1 灌胃受试物制备
配制质量分数10%的脱脂乳,灭菌冷却后,按照接种量5%接种开菲尔菌粒,28℃恒温条件下培养24 h,过滤去除菌粒后即为试验组的灌胃受试物,对照组以10%灭菌脱脂乳灌胃。
1.3.2 动物实验
金黄地鼠饲养于中国疾病预防控制中心南纬路动物实验室,饲养温度20~26℃,12 h光照,12 h黑暗。适应3 d后根据体质量随机分为3组,每组8只,单笼饲养。各组分别为G1基础饲料对照组、G2高脂饲料对照组、G3高脂饲料试验组,其中G1饲喂基础饲料,G2和G3饲喂高脂饲料,G1和G2采用灭菌脱脂乳灌胃,G3采用开菲尔灌胃,灌胃量均为2 mL/100 g体质量。实验期间自由进食和饮水,连续喂养6周,每周称质量1次。末次给药后,所有动物禁食12 h,称体质量;取各组动物粪便-80℃冷冻保存待测;取肝脏、附睾脂肪称质量;腹主动脉取血,离心收集血清,用试剂盒测定TC、TG、HDL-C、LDL-C等指标。
动物实验已通过中国疾病预防控制中心营养与健康所伦理审查。
1.3.3 肠道菌群高通量测序分析
使用华大基因研发的肠道细菌DNA提取试剂盒对各个金黄地鼠的粪便样本进行DNA提取,并使用通用引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGAC TACHVGGGTWTCTAAT-3′)对其16S rDNA的V4区进行PCR扩增。
将扩增产物在Illumina平台进行双末端测序,下机后得到reads数据,去除低质量reads后使用拼接软件FLASH将其拼接为Tags,拼接的Tags经过优化后,在97%相似度下将其聚类为用于物种分类的分类操作单位(operational taxonomic units,OTU),用于物种注释及菌种α-多样性分析。利用软件USEARCH(v7.0.1090)[6]将拼接好的Tags聚类为OTU。其主要过程如下:
1)利用UPARSE在97%相似度条件下进行聚类,得到OTU的代表序列;
2)利用UCHIME(v4.2.40)[7]将PCR扩增产生的嵌合体从OTU代表序列中去除;
16S嵌合体数据库:gold database(v20110519)
3)使用usearch_global方法将所有Tags比对回OTU代表序列,得到每个样品在每个OTU的丰度统计表[8]。
得到OTU代表序列后,通过核糖体数据计划(ribosomal databaseproject,RDP)classifer(v2.2)软件将OTU代表序列与数据库已知序列比对进行物种注释,置信度阈值设置为0.8。
比对数据库:Greengene:V201305[9];RDP:Rel ease9 201203[10]。
1.3.4 结果统计
利用统计分析软件SPSS 16.0处理得到的数据,采用ANOVA进行方差分析,比较P值,P≥0.05为无显著差异,0.01≤P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 开菲尔对高脂金黄地鼠体重、血脂等指标的作用
实验开始前,各组动物体质量没有显著差异(P≥0.05)。实验结束后,体质量、肝脏质量、附睾脂肪质量以及血脂四项指标检测结果见表1。由表1可知,与G1组相比,G2组体质量、肝脏质量、附睾脂肪质量、TC、TG、LDL/HDL比值指标分别增加了18%、55%、31%、142%、167%和120%,经统计学分析,各项指标增长差异显著(P<0.01),表明金黄地鼠高脂模型构建成功。
G3组体质量、肝脏质量、附睾脂肪质量、TC、TG、LDL/HDL比值各项指标比G1组分别增加了3%、36%、-5%、64%、67%和40%,其中,附睾脂肪质量低于对照组,但无统计学差异,表明开菲尔能够将高脂饲料组动物的附睾脂肪水平控制在正常水平。经统计学分析,体质量、附睾脂肪质量以及LDL-C/HDL-C三个指标变化无明显差异(P≥0.05),结果表明,开菲尔能够有效控制因高脂饲料引起的体质量增加、附睾脂肪质量增加以及LDL-C/HDL-C比值的升高;而肝脏质量、TC和TG三个指标虽然与G1组比较显著增加(P<0.01),但与G2组相比,增加幅度明显降低,且统计分析表明该3项指标值与G2组相比差异显著(P<0.01),表明开菲尔对高脂饲料引起的肝脏质量增加、TC和TG的升高具有明显的改善作用。

表1 各组金黄地鼠体质量、肝脏质量、附睾脂肪质量及血脂指标检测结果Table 1 Determination results of body mass,liver mass,epididymal fat mass and serum lipid of different groups of golden hamster
2.2 开菲尔对高脂金黄地鼠肠道菌群的影响
2.2.1 不同试验组动物肠道菌群门水平的变化
下机数据经过清洗拼接后所得到的OTU进行物种注释分析。G1组得到OTU数量为560,G2组得到OTU数量为526,G3组得到OTU数量为551。各组共注释到11个细菌门类,分别为放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻细菌门(Cyanobacteria)、脱铁杆菌门(Deferribacteres)、迷踪菌门(Elusimicrobia)、厚壁菌门(Firmicutes)、黏胶球形菌门(Lentisphaerae)、变形菌门(Proteobacteria)、TM7菌门(细菌域下的一个门)、柔膜菌门(Tenericutes)和疣微菌门(Verrucomicrobia),各组菌相组成和比例如图1所示。

图1 各组金黄地鼠肠道菌群在门水平上的注释结果Fig.1 Taxonomic composition distribution of intestinal flora in different groups of golden hamsters of Phylum-level
由图1可知,高脂饲料引起了G2组肠道菌群在门水平上较大的变化,其中放线菌门、拟杆菌门、脱铁杆菌门、变形菌门和TM7菌门的组成比例与G1组比较分别上升了356%、17%、122%、143%和128%;而与G1组比较,G3组中放线菌门和脱铁杆菌门分别上升了550%和10%,拟杆菌门、变形菌门和TM7菌门分别下降了4%、6%和18%。这一结果表明,开菲尔能够有效抑制高脂饲料引起的肠道菌群中拟杆菌门、脱铁杆菌门、变形菌门和TM7菌门组成比例的增加。结合2.1中的结果分析可知,该4种细菌门类组成比例的上升可能与宿主的体质量、肝脏质量、附睾脂肪质量增加以及血脂升高具有关联性。
此外,高脂饲料组G2中的蓝藻细菌门、迷踪菌门、厚壁菌门、黏胶球形菌门、柔膜菌门以及疣微菌门组成比例与G1组相比均有所下降,分别降低了60%、8%、23%、27%、93%、84%;而G3组中的上述6种细菌门类与G1组相比分别下降了58%、28%、1%、53%、3%、32%,该结果表明,开菲尔对高脂饲料引起的厚壁菌门、柔膜菌门和疣微菌门比例的下降具有抑制作用。结合2.1中的结果分析可知,该3种细菌门类组成比例的下降可能与宿主的体质量、肝脏质量、附睾脂肪质量增加以及血脂升高具有关联性。
多项研究反复证实厚壁菌门和拟杆菌门的比例可作为判定肥胖潜在可能的依据[11-13],二者组成比例越接近,宿主肥胖的风险越小,与本研究结果一致,本实验中厚壁菌门/拟杆菌门,G1组为0.59,G2组为0.39,G3组为0.62,因此推断开菲尔有助于改善高脂饲料引起的厚壁菌门和拟杆菌门比例失调,而二者比例失调可能与体质量、肝脏质量、附睾脂肪质量以及血脂指数变化相关。
2.2.2 不同试验组动物肠道菌群种水平的变化
能够进行物种注释的OTU会随着注释等级的降低而减少,如在本实验中能够注释到门的有96%以上,而能够注释到种的只有不到5%,3组数据共比对到13个菌种,分别为Akkermansia muciniphila、Alistipes indistinctus、Bacteroides acidifaciens、单形拟杆菌(Bacteroides uniformis)、Butyricicoccus pullicaecorum、DesulfovibrioC21 c20、罗伊氏乳杆菌(Lactobacillus reuteri)、Mucispirillum schaedleri、Parabacteroidesdistasonis、Ruminococcusbromii、生黄瘤胃球菌(Ruminococcusflavefaciens)、活泼瘤胃球菌(Ruminococcus gnavus)、Victivallis vadensis,各组金黄地鼠肠道菌群在种水平上的注释结果如图2所示。
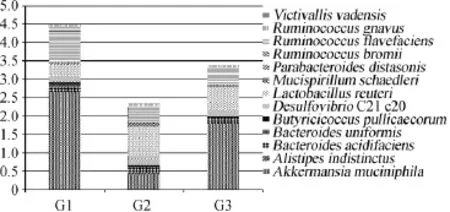
Fig.2 Taxonomic composition distribution of intestinal flora in different groups of golden hamsters of Species-level
由图2可知,与G1组相比,G2组Akkermansiamuciniphila的组成比例下降了84%,Alistipes indistinctus和Mucispirillumschaedleri的组成比例分别上升了376%和122%,而G3组中Akkermansia muciniphila和Alistipes indistinctus分别下降了32%和3%,Mucispirillum schaedleri上升了10%,开菲尔改善了前者的下降以及后两者的上升。结合2.1中的结果分析推测,Akkermansia muciniphila与体质量、血脂等指标的上升为负相关,而Alistipes indistinctus和Mucispirillum schaedleri与之为正相关。已有研究表明,Akkermansia muciniphila是肠道中的一种黏蛋白降解菌[14],在肥胖及相关代谢疾病中(如糖尿病)具有关键作用[15],其组成比例与宿主健康存在正相关[16],有望成为新一代的益生菌。目前存在的主要问题是体外培养技术的发展以及与肠道其他菌群之间作用关系的阐明。Alistipes indistinctus是NAGAI F等[17]分离自人肠道的革兰氏阴性厌氧菌,而Mucispirillum schaedleri是ROBERTSON B R等[18]的分离自小鼠肠道黏液层的革兰氏阴性厌氧菌,结合本实验结果,有待于进一步研究,阐明与宿主健康的关系。
2.2.3 各组金黄地鼠肠道菌群多样性的变化
Alpha多样性(Alpha diversity)是对单个样品中物种多样性的分析[19],包括Observed-species指数、Chao指数、Ace指数,Shannon指数以及Simpson指数。其中,前面4个指数越大,最后一个指数越小,说明样品中的物种越丰富。3组动物肠道菌群α-多样性结果见表2。

表2 肠道菌群α-多样性统计分析Table 2 Alpha diversity statistical analysis of gut microbiota
Observed-species指数、Chao指数和Ace指数反映样品中群落的丰富度(species richness),即简单指群落中物种的数量,而不考虑群落中每个物种的丰度情况,Shannon和Simpson指数反映群落的多样性(species diversity),受样品群落中物种丰富度(species richness)和物种均匀度(species evenness)的影响。相同物种丰富度的情况下,群落中各物种具有越大的均匀度,则认为群落具有越大的多样性。由表2可知,3组之间相比,多样性变化差异不明显,G2组中只有Shannon指数显著低于G1组,而G2组和G3组之间各项指标差异均无显著性(P>0.05)。因此可推断,高脂饲料或开菲尔对肠道菌群的α-多样性没有显著影响。
3 结论
开菲尔能够有效控制因高脂饲料引起的金黄地鼠体质量增加、附睾脂肪质量增加以及LDL-C/HDL-C比值的升高,并对肝脏质量增加、TC和TG的升高具有明显的改善作用。在对高脂饲料引起的肠道菌群改变中,在门水平上,开菲尔能够显著下调拟杆菌门、脱铁杆菌门、变形菌门和TM7菌门组成比例的升高和上调厚壁菌门、柔膜菌门和疣微菌门比例的下降;在种水平上,开菲尔能够上调Akkermansia muciniphila的组成比例,并下调Alistipes indistinctus和Mucispirillum schaedleri的组成比例,以降低高脂饲料造成的负面影响,使宿主的肠道菌群处于正常状态。
[1]BOURRIE B C T,WILLING B P,COTTER P D.The microbiota and health promoting characteristics of the fermented beverage kefir[J].Front Microbiol,2016,7(15):1-17.
[2]许女,王艳萍,习傲登,等.Kefir源植物乳杆菌MA2的牛乳发酵特性研究[J].中国酿造,2011,30(7):33-36.
[3]高洁,俞丹,陈頔,等.传统发酵乳开菲尔的研究进展[J].中国食品学报,2016,16(4):204-211.
[4]ROOKS M G,GARRETT W S.Gut microbiota,metabolites and host immunity[J].Nat Rev Imm,2016,16(6):341-352.
[5]LE C E,NIELSEN T,QIN J,et al.Richness of human gut microbiome correlates with metabolic markers[J].Nature,2013,7464(500):541-546.
[6]EDGAR R C.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nat Meth,2013,10(10):996-1030.
[7]EDGAR R C,HAAS B J,CLEMENTE J C,et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27 (16):2194-2200.
[8]WANG Q,GARRITY G M,TIEDJE J M,et al.Naïve bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy [J].Appl Environ Microbiol,2007,73(16):5261-5267.
[9]DESANTIS T Z,HUGENHOLTZ P,LARSEN N,et al.Greengenes,a chimera-checked 16S rRNA gene database and workbench compatible with ARB[J].Appl Environ Microbiol,2006,72(7):5069-5072.
[10]COLE J R.Ribosomal database project:data and tools for high throughput rRNA analysis[J].Nucl Acid Res,2014,42:633-642.
[11]LEY R E,BÄCKHED F,TURNBAUGH P,et al.Obesity alters gut mi-crobial ecology[J].P Natl Acad Sci USA,2005,102(31):11070-11075.
[12]TURNBAUGH P J,LEY R E,MAHOWALD M A,et al.The gut microbiome as a biomarker and therapeutic target for treating obesity or an obesity related disorder:US,EP2102350[P].2009.
[13]SANDERSON S,BOARDMAN W,CIOFI C,et al.Human gut microbes associated with obesity[J].Nature,2006,444(7122):1022-1023.
[14]DAO M C,EVERARD A,ARONWISNEWSKY J,et al.Akkermansia muciniphilaand improved metabolic health during a dietary intervention in obesity:relationship with gut microbiome richness and ecology [J].Gut,2016,65(3):426-436.
[15]REMELY M,HIPPE B,ZANNER J,et al.Gut microbiota of obese,type 2 diabetic individuals is enriched inFaecalibacterium prausnitzii, Akkermansia muciniphilaandPeptostreptococcus anaerobiusafter weight loss[J].Endocr Metab Immune Disorder Drug Target,2015, 15(1):1-8.
[16]DERRIEN M,BELZER C,VOS W M D.Akkermansia muciniphila, and its role in regulating host functions[J].Microb Pathogenesis,2016, 1(11):1-11.
[17]NAGAI F,MOROTOMI M,WATANABE Y,et al.Alistipes indistinctus sp.nov.andOdoribacter laneussp.nov.common members of the human intestinal microbiota isolated from faeces[J].Int J Syst Evol Micr, 2010,60(6):1296-1302.
[18]ROBERTSON B R,O'ROURKE J L,NEILAN B A,et al.Mucispirillum schaedlerigen.nov.sp.nov.a spiral-shaped bacterium colonizing the mucus layer of the gastrointestinal tract of laboratory rodents[J].Int J Syst Evol Micr,2005,55(3):1199-1204.
[19]SCHLOSS P D,WESTCOTT S L,RYABIN T,et al.Introducing mothur:open-source,platform-independent,community-supported software for describing and comparing microbial communities[J].Appl Environ Microbiol,2009,75(23):7537-7541.
《中国酿造》杂志征稿启事
《中国酿造》创刊于1982年,是由中国商业联合会主管,中国调味品协会及北京食品科学研究院主办的综合性科技期刊。并历次被评为全国中文核心期刊、中国科技核心期刊、《中国知网》重点收录期刊、《万方数据库》全文收录期刊、《中文科技期刊数据库》来源期刊、中国学术期刊网络出版总库收录期刊、美国《乌利希期刊指南》(UPD)收录期刊、英国《食品科学文摘》(FSTA)收录期刊、英国《国际农业与生物科学研究中心》(CABI)收录期刊、美国《化学文摘》(CA)收录期刊、俄罗斯《文摘杂志》(AJ)收录期刊、中国科学评价研究中心(RCCSE)数据库收录期刊,也是学位与研究生教育的中文重要期刊。
本刊主要面向全国各大高等院校、科研院所、各级党政机关、相关企事业单位的广大专家学者、工程技术人员、本科生、硕士博士研究生、管理人员等。
《中国酿造》主要栏目有:研究报告、专论综述、创新与借鉴、经验交流、分析与检测、产品开发、酿造文化、海外文摘等。
欢迎踊跃投稿!
网站:www.chinabrewing.net.cn邮箱:zgnzzz@163.com电话:010-83152738/83152308
征稿范围:
(1)新工艺、新技术、新设备在酿造行业的应用;(2)调味品的研发创新与推广应用;(3)调味品产业生产管理及产品质量安全评价;(4)食品添加剂在酿造行业的应用;(5)现代高新检测技术在酿造行业的应用;(6)酿酒产品开发、生产管理及产品质量安全的控制;(7)发酵法制备酒精、氨基酸、高级醇及有机酸等工艺研究;(8)微生物发酵工艺及培养基发酵条件优化;(9)发酵工程菌种的筛育与人工诱变、杂交选育及基因工程改造研究;(10)生物质能源的开发利用及规模化制备;(11)传统发酵食品生产工艺改进、微生物菌种改良、发酵机理及规模化生产研究;(12)食品及发酵工业废水、废渣处理及综合利用;(13)益生菌及功能型发酵乳制品研究与开发;(14)行业实用技术、政策、法规、标准及行业动态和最新举措等。
注意事项:
(1)来稿要求论点明确、数据可靠、逻辑严密、文字精炼。在文稿首页用脚注说明论文属何项目、何基金(编号)资助,本刊将优先报道国家级、省部级及国际合作项目的科研成果;第一作者及通讯作者(一般为导师)简介(包括姓名、出生年月、性别、职称、学位、研究方向或目前主要从事的工作、邮箱、联系电话)。(2)稿件要求8000字以内,须有中图分类号,文献标志码,中英文标题、单位、作者,并有200~300字的中英文摘要和5~8个关键词,标题、摘要、表题、图题请用中英文对照。摘要内容应包括研究目的、方法、结果和结论;综述文章可写指示性摘要。(3)来稿内容涉及配方时,应写明配料的名称和配比,勿用代号;工艺过程要完整,不要省略;插图、表格需放在正文相应地方,不要集中;引用的图表要有出处,计量要用法定单位。(4)文稿参考文献一般研究论文约25篇参考文献,不可少于20篇,综述论文不少于35篇。研究性论文和综述性论文中近5年文献不少于参考文献总数的一半,外文文献不少于5篇,期格式请参照GB/T 7714-2015《信息与文献参考文献著录规则》。(5)来稿必须是最新的、作者自身创造性的科研成果,且是在中外文正式刊物上未发表的论文。本刊严禁一稿多投、重复内容多次投稿、不同文种重复投稿。(6)我刊以实现对所有来稿的文字复制比对工作,若文字复制比超过30%的稿件我刊不予采用。(7)稿件一经录用,即被认为同意收录于《中国学术期刊(光盘版)》、万方数据库等,同意入编数据库及上网发布,与此有关的作者著作权使用费与稿酬一次性给付。作者如有异议,请在投稿时声明。
Regulation effects of kefir on gut microbiota in high-fat diet fed hamster
GAO Jie1,2,SUN Jing1,2,HUANG Jian1,2,LIU Ting3,HUO Junsheng1,2*
(1.National Institute for Nutrition and Health,Chinese Center for Disease Control and Prevention,Beijing 100050,China; 2.Key Lab of National Health and Family Planning Commission for Microelements Nutrition,Beijing 100050,China; 3.COFCO Nutrition&Health Research Institute,Beijing 102209,China)
A high-fat diet fed hamster model was used to evaluate regulation effects of kefir on gut microbiota.Body mass,liver mass,epididymal fat mass and serum lipid were measured.The results showed that kefir had control effects on body mass,epididymal fat mass,and LDL-C/HDL-C value (the body mass,epididymal fat mass,and LDL-C/HDL-C value in kefir group were 149.8 g,4.0 g and 0.7,respectively,significantly lower than those in high-fat diet group,which were 172.1 g,5.5 g and 1.1,respectively).High-throughput sequencing of gut microbiota indicated that kefir can down-regulate composition ratio of Bacteroidetes,Deferribacteres,Proteobacteria and TM7,and up-regulate Firmicutes,Tenericutes,Verrucomicrobia ratio at Phylum-level.Kefir also can up-regulateAkkermansia muciniphilaratio and down-regulateAlistipes indistinctus,Mucispirillum schaedleri ratio at species-level.So it can be deduced that kefir had regulation effects on gut microbiota,body mass control and serum lipid against the changes induced by high-fat diet.
kefir;hamster;gut microbiota;reducing serum lipid
TS252.54
0254-5071(2017)04-0015-05
10.11882/j.issn.0254-5071.2017.04.004
2017-02-13
科技部-国家重点研发计划课题(2016YFD0400602)
高洁(1983-),女,助理研究员,博士,研究方向为益生菌,肠道微生态。
*通讯作者:霍军生(1962-),男,研究员,博士,研究方向为食品生物技术,强化食品。

