甘草次酸修饰的黄芩苷脂质体的制备工艺研究
周 容,周莉莉,钟思雨,袁 礼,周 玮,李 朝,夏新华*(湖南中医药大学 药学院,湖南 长沙 410208)
甘草次酸修饰的黄芩苷脂质体的制备工艺研究
周 容,周莉莉,钟思雨,袁 礼,周 玮,李 朝,夏新华*
(湖南中医药大学 药学院,湖南 长沙 410208)
目的 制备甘草次酸修饰的黄芩苷脂质体。方法 采用化学合成甘珀酸十八醇酯(18-GA-Suc)作为两亲性导向分子,从稳定性、包封率等方面考察制备甘草次酸修饰的黄芩苷脂质体的最佳方法,单因素和正交试验优选甘草次酸修饰的黄芩苷脂质体的处方和工艺。结果 根据优化工艺制备的甘草次酸修饰的黄芩苷脂质体外观为乳白色,带有淡蓝色乳光,无絮凝现象,包封率为41.75%。结论 甘草次酸修饰的黄芩苷脂质体制备成功,并以包封率为指标对其制备工艺进行优化,可为其肝靶向研究奠定基础,有望成为肝肿瘤靶向的新型载体。
甘草次酸;黄芩苷;脂质体
黄芩苷是从唇形科植物黄芩中分离的一种黄酮类化合物,具有抗炎、抗菌、抗病毒、抗肿瘤等多种生物活性[1]。黄芩苷及其制剂存在口服吸收差、生物利用度低、水溶性及脂溶性差、体内半衰期短等不足,限制了黄芩苷类制剂在临床上的应用。
脂质体近年来广泛用作抗癌药物的载体,能提高药物的生物利用度,降低药物毒性,靶向释药。已有研究证实,肝细胞膜上存在大量的甘草次酸(GA)特异性结合位点,该位点能与GA特异性结合,通过肝细胞内吞作用,可将其配体运送至溶酶体内进行降解[2]。以该受体为靶点,可将药物特异性导入治疗乙型肝炎和原发性肝癌。文献表明,甘草次酸修饰的脂质体具有更好的肝靶向性[3]。本研究以甘草次酸为原料,合成甘珀酸十八醇酯(18-GA-Suc)作为两亲性导向分子修饰黄芩苷脂质体[4]。
1 仪器与材料
1.1 仪器
Agilent 1200型高效液相系统 (美国安捷伦公司);色谱柱 Kromasil C18柱 (250 mm×4.6 mm,5 μm);DF-101S集热式恒温加热磁力搅拌器 (巩义市予华有限公司);TE-214S分析天平 (北京赛多利斯天平有限公);真空旋转蒸发仪(上海亚荣生化仪器厂);Zetasizer 3000HSA型粒径分析仪 (英国Malvern);JEM-1200EX电子显微镜(日本电子株式会社)。
1.2 药品与试剂
黄芩苷(质量分数93.3%,批号110715-201318,中国食品药品检定研究院);大豆磷脂Lipoid S PC-3(德国Lipoid公司);胆固醇(国药集团化学试剂有限公司);葡聚糖凝胶G-50(美国GE公司);磷酸盐缓冲剂(粉剂,0.01 M,pH 7.4,北京鼎国生物技术有限责任公司);甘草次酸(新疆天山制药有限公司);N,N-二甲基甲酰胺(DMF)、N,N-二环己基碳酰亚胺(DCC)(天津市科密欧化学试剂有限公司);4-二甲氨基吡啶(DMAP)(上海展方化工有限公司);石油醚(60~90℃)、乙酸乙酯(成都市科龙化工试剂厂);甲醇(色谱纯,美国Spectrum公司);无水乙醇、甲醇(分析纯,湖南汇虹试剂有限公司)。
2 方法与结果
2.1 导向分子18-GA-Suc的制备
2.1.1 甘草次酸十八醇酯(18-GA)的制备 取甘草次酸1.0 g溶于20 mL DMF中,加入DCC 0.44 g、硬脂醇0.75 g以及DMAP 0.26 g,80℃水浴加热2 h至反应完全,将反应液缓缓滴入水中,产生沉淀,抽滤,得淡黄色固体,55℃干燥即得。对产物过柱纯化并进行质谱鉴定发现有 [M-1]-m/z=721的峰存在,即目标产物18-GA的分子离子峰。
2.1.2 18-GA-Suc的制备 取18-GA 0.5 g,加10 mL吡啶溶解,加入DMAP 0.25 g、丁二酸酐0.5 g,116℃油浴下加热反应12 h,往反应液中加少许水,减压旋转蒸发除去吡啶,得褐色固体。对产物过柱纯化并进行质谱鉴定,有[M-1]-m/z=821强峰存在,可以证明为目标产物18-GA-Suc。
2.2 黄芩苷含量及包封率的测定
2.2.1 色谱条件[5]Kromasil C18色谱柱(250 mm× 4.6 mm,5 μm),流动相甲醇-0.2%磷酸水(47∶53),流速1.0 mL/min,检测波长280 nm,柱温30℃。
2.2.2 标准曲线的建立 对照品溶液的配制:分别配置浓度为 0.003 04、0.006 08、0.015 2、0.030 4、0.045 6、0.060 8 mg/mL的系列对照品溶液,以峰面积对浓度进行线性回归,得到标准曲线回归方程Y= 3×107X-12 189(r=0.999 5),结果表明黄芩苷在0.03 04~0.608 μg与峰面积呈良好线性关系。
2.2.3 精密度试验 取5.598、11.196、55.98 μg/mL 3个高、中、低浓度的黄芩苷溶液,按“2.2.1”色谱条件测定,一日内各进样5次,计算日内精密度;连续5 d各浓度重复测定5次,计算日间精密度。结果表明,日内、日间相对标准偏差均小于2.0%。
2.2.4 洗脱曲线的绘制 精密吸取脂质体样品0.25 mL,加于Sephadex G-50凝胶柱顶部(直径1.5 cm,柱床高25 cm),以纯水洗脱,洗脱流速0.5 mL/min。每2 mL洗脱液为一管,收集洗脱液,分别用色谱甲醇破膜,超声使其澄清后,HPLC进样分析,测定每管样品中黄芩苷的含量。以洗脱体积为横坐标,峰面积为纵坐标,绘制洗脱曲线,脂质体与药物的洗脱峰有明显的分界,可实现良好的分离,见图1。
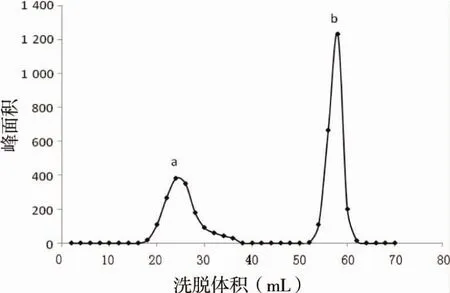
图1 黄芩苷脂质体葡聚糖凝胶G-50纯水洗脱曲线
2.2.5 柱回收率 配制低、中、高三种不同浓度的黄芩苷甲醇溶液,分别加入空白脂质体混合均匀,得标准混合液,精密吸取混合液0.5 mL上柱,按以上洗脱条件进行分离,收集洗脱液,过0.45 μm微孔滤膜,HPLC进样分析,测定药物的浓度,计算柱回收率,结果见表1。
2.2.6 上样量 精密吸取黄芩苷脂质体溶液,分别上柱1.0、0.5、0.25 mL,用纯水以0.5 mL/min流速进行洗脱,其他操作同上“洗脱方法”。以脂质体与游离药物的分离效果、包封率为评价指标进行比较,结果见表2。结果显示,上样量为0.25 mL时,脂质体与游离药物分离良好。
2.2.7 包封率的测定 精密吸取脂质体样品0.25 mL,加于Sephadex G-50凝胶柱顶部(直径1.5 cm,柱床高25 cm),以纯水洗脱,洗脱流速0.5 mL/min。每2 mL洗脱液为一管,收集脂质体流出液,用色谱甲醇破膜,超声使其澄清后,过0.45 μm微孔滤膜,HPLC进样分析。计算包封率。
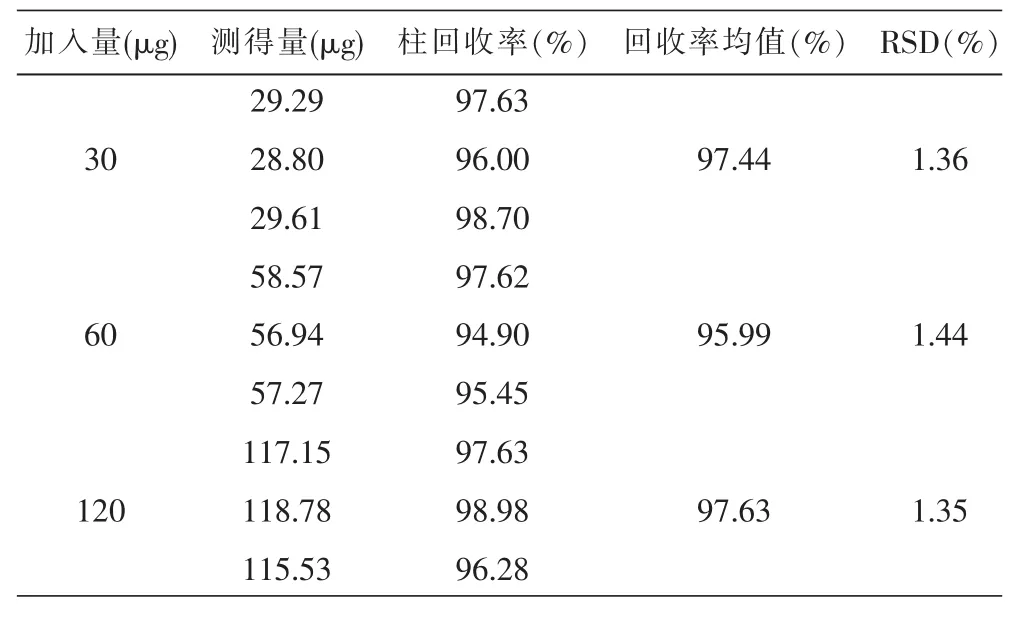
表1 黄芩苷溶液的柱回收率 (n=3)

表2 不同上样量的比较
包封率=系统中包封的药量/系统中包封与未包封的总药量×100%
2.3 脂质体制备方法的研究
2.3.1 乙醇注入法 精密称取磷脂∶胆固醇(4∶1)、黄芩苷、10%的甘草次酸配体,按一定比例溶于无水乙醇中(45℃水浴加热),所得的类脂溶液用细孔径注射器缓慢匀速地注入到恒温55℃ pH 7.0的30 mL磷酸盐缓冲液中,注入过程中用磁力搅拌器搅拌,通氮气除去乙醇,继续搅拌30 min,45℃孵育20 min,冰浴超声8 min,过0.45、0.22 μm微孔滤膜,即得。
2.3.2 薄膜分散法[6]精密称取磷脂、胆固醇、10%的甘草次酸配体,按一定比例,加三氯甲烷30 mL充分溶解,55℃减压蒸发除去有机溶剂,形成均匀脂质膜,再按磷脂:黄芩苷(10∶1)取适量黄芩苷,溶于30 mL pH 6.8的磷酸盐缓冲液,加入脂质膜中进行洗膜,55℃水化1 h,超声30 min,过0.45、0.22 μm微孔滤膜,即得。
2.3.3 两种制备方法的比较 按“2.3.1”及“2.3.2”方法制备脂质体,观察外观性状、测定包封率、粒径、Zeta电位,薄膜分散法粒径较乙醇注入法小,且分布更均匀,包封率更高,且Zeta电位绝对值更大,因此确定用薄膜分散法制备黄芩苷脂质体。结果见表3。

表3 两种黄芩苷脂质体制备方法的比较
2.4 处方及制备工艺单因素考察
2.4.1 溶剂的选择 薄膜分散法中所用溶剂为三氯甲烷,但三氯甲烷毒性大,因此对比考察二氯甲烷、三氯甲烷作为有机溶剂对类脂膜形成的影响。结果表明,二氯甲烷作为溶剂时所形成的脂质膜有很多气泡且不均匀,而三氯甲烷作为有机溶剂时所形成的类脂膜薄而均匀,因此确定三氯甲烷作为有机溶剂。
2.4.2 水相的选择 按“2.3.2”项下条件制备均匀脂质膜,再按一定比例取适量黄芩苷,溶于三种水相中(pH 6.0、pH 6.8、pH 7.0的PBS缓冲液),其余操作同“2.3.2”项下。比较三种水相制得的脂质体外观,测定其包封率,结果见图2。以pH 6.8的PBS缓冲液制备的脂质体包封率最佳。
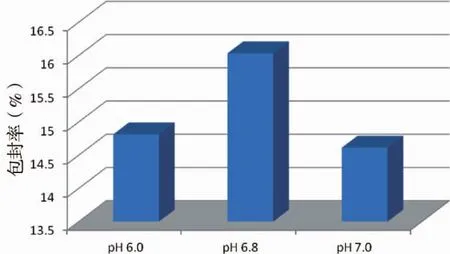
图2 不同pH值的水相对包封率的影响
2.4.3 药量 固定磷脂、胆固醇、黄芩苷、甘草次酸配体的比例,分别称取黄芩苷5、8、10、15、20 mg,其余操作同“2.3.2”项下,比较不同黄芩苷用量所制得的脂质体的外观,测定其包封率,结果见图3。结果表明,黄芩苷用量为10 mg时,所制备的脂质体包封率最好。
2.4.4 胆脂比 固定磷脂、黄芩苷、甘草次酸配体的比例,分别取胆脂比1∶10、1∶4、1∶2.5的胆固醇量,其余操作同“2.3.2”项,比较不同胆脂比所制得的脂质体的外观,测定其包封率,结果见图4。结果表明,胆脂比为1∶4时,所制备的脂质体包封率最好。
2.4.5 水化时间 按“2.2.2项”下条件制备脂质体后,55℃分别水化30 min、1 h、2 h,其余操作同“2.2.2”项,考察不同水化时间对包封率的影响,结果见图5。结果表明,当水化时间为1 h,脂质体包封率最佳。

图3 不同药量对包封率的影响

图4 不同胆固醇量对包封率的影响
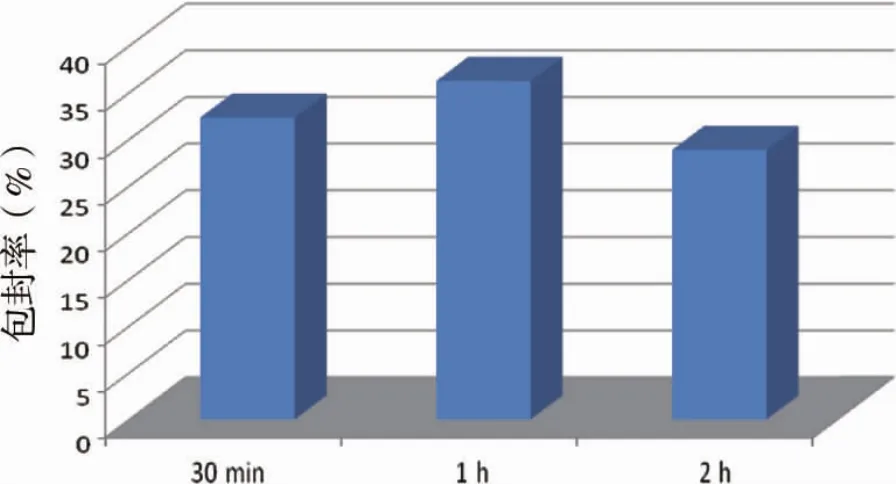
图5 不同水化时间对包封率的影响
2.5 处方的正交优选
在单因素考察的基础上,结合文献,采用正交试验优选黄芩苷肝靶向脂质体处方。固定18-GA-Suc的比例为混合类脂的10%,选择药物与磷脂的质量比(A)、磷脂与胆固醇的质量比(B)、水合时间(C)三个主要因素为变量,各因素分别设3个水平,进行正交设计,以包封率为评价指标筛选处方。用L9(34)正交表安排试验方案,所选因素水平见表4,试验结果见表5。
从表6的结果可知,包封率的影响因素大小为A>B>C,最佳组合为A2B2C3,即药物与磷脂的质量比为1∶10,磷脂与胆固醇的质量比为4∶1,水化时间90 min。按照以上优选的条件制备3批脂质体样品,每批样品测定3次,以验证处方的稳定性,验证结果见表7。

表4 正交试验因素水平表

表5 正交试验结果

表6 正交试验方差分析表
表7 验证试验结果 (±s,n=3)
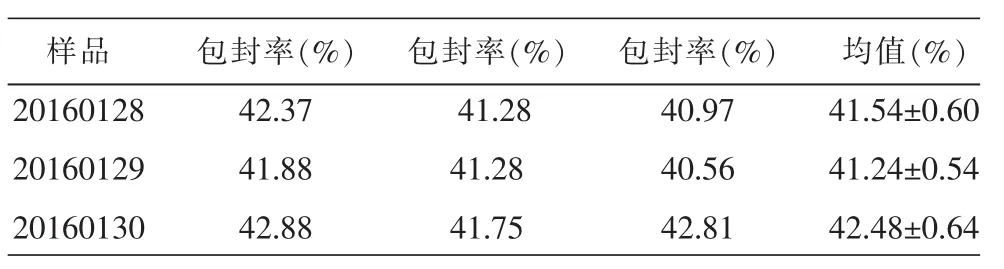
表7 验证试验结果 (±s,n=3)
?
验证结果表明,按最佳处方制备的3批样品总平均包封率为41.75%,RSD为1.94%。说明基于正交设计优化的参数准确可靠,工艺合理可行。
黄芩苷肝靶向脂质体的制备工艺为:精密称取一定量的磷脂∶胆固醇 (4∶1)、10%的甘草次酸配体,加三氯甲烷30 mL充分溶解,55℃减压蒸发除去有机溶剂,形成均匀脂质膜,再按磷脂∶黄芩苷(10∶1)取适量黄芩苷,溶于30 mL pH 6.8的磷酸盐缓冲液,加入脂质膜中进行洗膜,55℃水化90 min,超声30 min,过0.45 μm微孔滤膜,即得,产品冷藏保存。
3 讨论
3.1 肝靶向材料的合成
甘草次酸与硬脂醇反应生成18-GA-Suc的过程为成酯反应,该反应是可逆反应,反应过程中需严格保持容器及溶剂无水。文献报道的第一步反应产物处理方法为旋蒸除去溶剂,但DMF沸点较高,一般旋蒸蒸发难以除去。根据反应产物不溶于水而DMF与水互溶的特点,将反应液倒入水中,再抽滤即可得到反应产物。这样可以简化反应过程。第二步反应中所用溶剂为吡啶,反应结束要除去吡啶需较高温度且所需时间较长,故采用少许水与吡啶形成共沸物再减压除去,可缩短旋蒸时间。
3.2 脂质体包封率的测定
脂质体的包封率是脂质体质量控制的一个重要指标,选择合适的测定方法是脂质体制备前的一项重要考察内容。采用葡聚糖凝胶柱层析法测定包封率时,通常是收集未被脂质体包封的游离药物来进行测定。本实验过程中发现,被包封的脂质体在16~40 mL便可被洗脱出来,且肉眼可直观判断脂质体的流出过程,因此最后确定收集包封的脂质体部分来测定包封率,既节省测定所需时间,也更加简便节约。
本实验中所制备的修饰脂质体包封率较低,其原因可能有:a脂质体的稳定性差,药物在过柱过程中发生了泄漏;b脂质体粒径较大,容易沉降聚集,导致在过柱时被截留在凝胶柱顶端。
3.3 脂质体的制备
脂质体的制备方法很多,不同药物的理化性质有差异,采用的制备方法也不同。脂质体的内水相可以包封水溶性药物,外层的双层膜可包封脂溶性药物,首先应对药物的性质有充分的了解。
脂质体制备的关键在于磷脂的水化及药物的包载,根据药物包载的机制不同,通常可分为被动载药和主动载药两类。被动载药即先将药物溶于水相或有机相中,然后采用注入法、分散法、蒸发法等制备方法得到含药脂质体。主动载药法是通过内外水相的不同离子或化合物梯度进行载药。由于黄芩苷在水及有机溶剂中的溶解性均不好,因此不能直接采用被动载药法[7],需通过磷酸盐缓冲液增强黄芩苷在水溶液中的溶解性,使黄芩苷成为“水溶性”好的药物,因此本试验选用薄膜分散法,制得的脂质体粒径分布均匀,且操作工艺简单。
[1]辛文妤,宋俊科,何国荣,等.黄芩素和黄芩苷的药理作用及机制研究进展[J].中国新药杂志,2013,21(6):647-653,659.
[2]ShojiS,Kunio T,Shingo S,etal.Chemicalmodification of gly-cyrrhetinic acid in relation to the biological activities [J].Chem Pharm-bull,1987,35(5):1910-1918.
[3]栗 婕,柯 学.甘草次酸修饰多西紫杉醇脂质体的制备和体外抑瘤效果[J].药学与临床研究,2011,19(3):207-210.
[4]毛声俊,侯世祥,金 辉,等.肝细胞靶向甘草次酸表面修饰脂质体的制备[J].中国中药杂志,2003,28(4):328-331.
[5]李 朝,夏新华,周 宇,等.黄芩苷的处方前研究[J].湖南中医药大学学报,2016,36(7):51-54.
[6]齐 滨,李 然,刘 莉,等.薄膜分散法制备RGD脂质体[J].长春中医药大学学报,2008,24(2):155-156.
[7]高媛媛,张维农.脂质体的制备与检测方法研究进展[J].武汉工业学院学报,2010,29(3):44-52.
(本文编辑 苏 维)
The Study on Preparation of Baicalin Liposomes Modified by Glycyrrhetinic Acid
ZHOU Rong,ZHOU Lili,ZHONG Siyu,YUAN Li,ZHOU Wei,LI Chao,XIA Xinhua*
(School of Pharmacy,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
Objective To prepare baicalin liposomes modified with glycyrrhetinic acid.Methods The carbenoxolone eighteen alcohol ester(18-GA-Suc)by chemical synthesis method was as amphiphilic guidance molecule.The optimal method was investigated from its stability,encapsulation efficiency.The single factor and orthogonal test was used to optimize the prescription and process.Results According to the optimized process,the appearance of the baicalin liposomes modified by the glycyrrhetinic acid was milky white,with pale blue light and no flocculation,and the encapsulation efficiency was for 41.75%.Conclusion The preparation technology of baicalin was successfully prepared,and the process was optimized by the index of encapsulation efficiency,which could provide the basis for liver targeted research.
glycyrrhetinic acid;baicalin;liposomes
R283
A
doi:10.3969/j.issn.1674-070X.2017.04.007
2016-07-30
湖南省“十二五”中药学重点学科建设项目(湘教通[2011]76号);2016年湖南省创新课题(CX2016B346)。
周 容,女,在读硕士研究生,研究方向:中药新制剂及制剂质量标准。
*夏新华,男,教授,博士研究生导师,E-mail:xiaxinhua001@163.com。
本文引用:周 容,周莉莉,钟思雨,袁 礼,周 玮,李 朝,夏新华.甘草次酸修饰的黄芩苷脂质体的制备工艺研究[J].湖南中医药大学学报,2017,37(4):373-377.

