凹叶厚朴用于细胞悬浮培养的愈伤组织的制备研究
谢燕燕,卫 梅,谢德金,陈剑成,杨德明,荣俊冬,陈礼光,郑郁善,*(.福建农林大学林学院,福建 福州 35000;.福建农林大学园林学院,福建 福州 35000)
凹叶厚朴用于细胞悬浮培养的愈伤组织的制备研究
谢燕燕1,卫 梅2,谢德金1,陈剑成1,杨德明1,荣俊冬1,陈礼光1,郑郁善1,2*
(1.福建农林大学林学院,福建 福州 350002;2.福建农林大学园林学院,福建 福州 350002)
目的 研究凹叶厚朴适用于细胞悬浮培养的愈伤组织。方法 通过对基本培养基(B5、MS和1/2MS)、外植体(茎段、顶芽和叶片)、激素浓度及组合进行筛选的方法进行厚朴愈伤组织诱导和继代研究。结果 B5为最适合厚朴愈伤组织诱导的基本培养基;顶芽是最佳诱导愈伤组织的材料;最适合厚朴愈伤组织诱导的培养基为B5+2.0 mg/L 2,4-D+1.0 mg/L 6-BA;最佳继代培养基为B5+2.0 mg/L NAA+1.0 mg/L 6-BA,愈伤组织生长倍数达到2.87倍。结论 初步筛选出凹叶厚朴用于细胞悬浮培养的愈伤组织,为凹叶厚朴细胞培养奠定基础。
凹叶厚朴;愈伤组织;悬浮培养
本文引用:谢燕燕,卫 梅,谢德金,陈剑成,杨德明,荣俊冬,陈礼光,郑郁善.凹叶厚朴用于细胞悬浮培养的愈伤组织的制备研究[J].湖南中医药大学学报,2017,37(4):365-368.
凹叶厚朴 Magnolia officinalis subsp.biloba (Rehd.et Wils.)Law,为木兰科木兰属皱皮木兰的植物[1-2],集材用、药用、观赏于一体,为我国特有的经济树种,也是国家二级重点保护野生植物[3]。厚朴以干燥树皮和根皮入药,主要用于治疗食积气滞、腹胀便秘、湿阻中焦、脘痞吐泻、痰壅气逆、胸满喘咳等[4]。厚朴药用有效成分主要为厚朴酚及和厚朴酚[5]。近年来,人们过度砍伐厚朴植株,使厚朴资源急剧减少。如今野生资源濒临枯竭,厚朴需 20年左右才能成材入药,如何快速生产有用的植物药物及代谢物质成为热点问题。有相关研究表明植物细胞悬浮培养技术可批量生产有用的植物药物及代谢物质[6],而用于培养厚朴悬浮细胞的愈伤组织的制备成为至关重要的一步。选择生长速度快、疏松易碎的愈伤组织是进行细胞悬浮培养的关键[7]。故本研究通过优化厚朴愈伤组织诱导体系,筛选出最适合用于细胞悬浮培养的愈伤组织的培养条件,以期为今后培养厚朴细胞提供参考。
1 材料与方法
1.1 材料
本次研究的试验材料由福建农林大学工业原料林研究所提供的厚朴 (Magnolia officinalis)优树植株。选取幼嫩、生长健壮而无病虫害的茎段、顶芽、叶片为外植体。愈伤组织诱导试验除取材部位试验外,均选用厚朴嫩叶为外植体。
1.2 方法
1.2.1 材料处理 用洗衣粉清洗、漂洗厚朴外植体,在无菌条件下用75%乙醇消毒30 s,再用0.1%升汞溶液浸泡10 min,无菌水冲洗4~5次。将消毒后的外植体接种到启动培养基上。继代培养即将愈伤组织取出后,尽量除去粘附其上的培养基,并将愈伤组织切成多块转接入继代培养基中。
1.2.2 培养基及激素 以 B5(Gamborg,1968)、MS (Murashige&Skoog,1962)、和1/2MS(1/2MS大量元素,其他成分不变)为基本培养基(蔗糖30 g/L,琼脂8 g/L,pH 5.8),以2,4-D、6-BA、NAA和KT为诱导激素(注:除激素试验外,其他试验均添加NAA 2.0 mg/L+6-BA1.0 mg/L外源激素)。
1.2.3 培养条件 培养温度为(25±2)℃,湿度一般保持在60%~70%,在黑暗条件下培养。每种处理接种30瓶,每瓶接种1~2个外植体,每个处理重复3次。
1.2.4 数据收集 外植体接种后每天观察一次,并记录愈伤组织启动天数和启动效果。同时测定愈伤组织的诱导率、污染率、褐化率及生长倍数,计算公式如下:
愈伤组织诱导率=未污染外植体分化数/未污染的外植体数×100%
污染率=污染外植体数/接种外植体数×100%褐化率=褐变的外植体块数/接种的外植体块数×100%
愈伤组织生长倍数=(生长后质量-接种量)/接种量
2 结果与分析
2.1 基本培养基对厚朴愈伤组织诱导的影响
以厚朴嫩叶为外植体进行的愈伤组织诱导试验,结果如表 1。由此可知,在激素种类和浓度相同的条件下,不同培养基对厚朴愈伤组织的诱导率及启动速度的影响亦不相同。方差分析表明差异达极显著水平(P<0.01),见表2。在B5培养基上的诱导率最高,达到75.00%;在1/2MS培养基诱导率次之,为60.00%;而在MS培养基上的诱导率最低,只有48.08%。在B5培养基中平均启动速度最快,而在1/ 2MS培养基上的外植体启动速度与MS培养基并无明显差异(P>0.05)。因此,选择B5为诱导厚朴愈伤组织的最佳培养基。
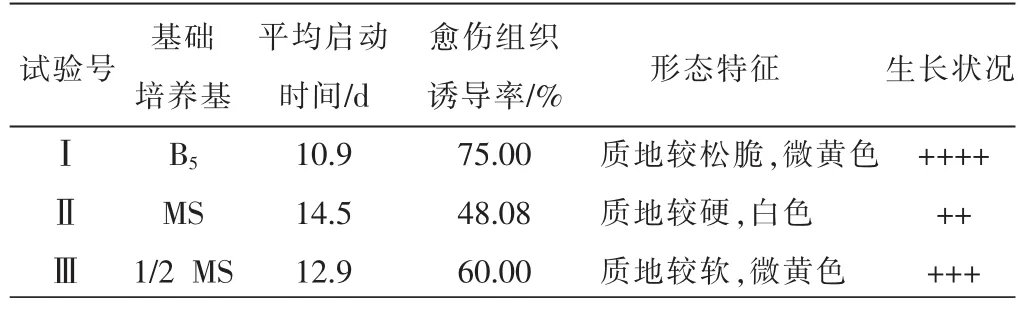
表1 不同基本培养基对叶片愈伤组织诱导的影响

表2 启动速度方差分析表
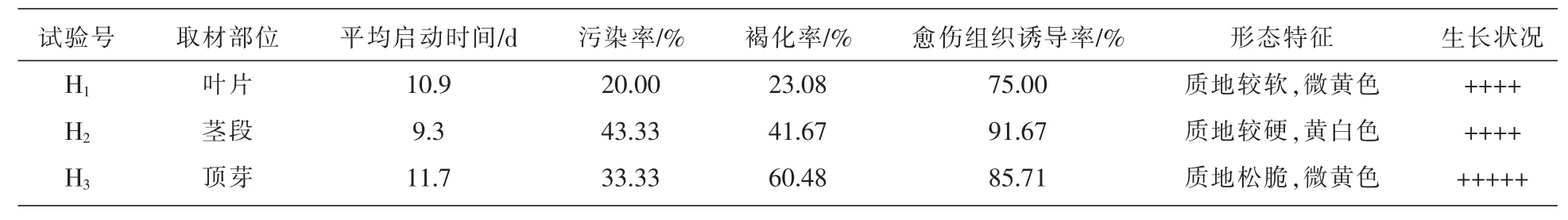
表3 不同取材部位对外植体污染率、褐化率和愈伤组织诱导率的影响
2.2 不同取材部位对外植体污染率、外植体褐化率和愈伤组织诱导率的影响
由表3可知,以叶片为外植体的污染率最低,顶芽次之,茎段的污染率最高。方差分析表明差异达极显著水平(P<0.01),见表4;从褐化率来看,顶芽褐化率最大,茎段次之,叶片褐化率最低,方差分析表明差异达极显著水平(P<0.01),见表5,说明植物不同部位含多酚类化合物存在差异;从诱导率来看,以茎段作为外植体的愈伤组织诱导率最高,顶芽次之,叶片最低,方差分析表明差异达极显著水平(P<0.01),见表6。
愈伤组织诱导率=发生愈伤组织外植体数/接种数×100%(接种数不包括污染和褐化材料)
顶芽褐化率虽高于茎段和叶片,但是顶芽诱导出的愈伤组织生长迅速,质地疏松,微黄色,继代后也能较好生长。而叶片污染率和褐化率虽然都是最低的,但其诱导出的愈伤组织较松散,继代时易分散成颗粒状,过几天后开始褐变死亡。茎段诱导的愈伤组织虽诱导率最高,生长也较迅速,但是其污染率也是最高的,诱导出的愈伤组织质地较硬,不利于为后期的细胞悬浮培养系提供良好材料。因此认为顶芽是最佳诱导厚朴愈伤组织的材料。见图1。
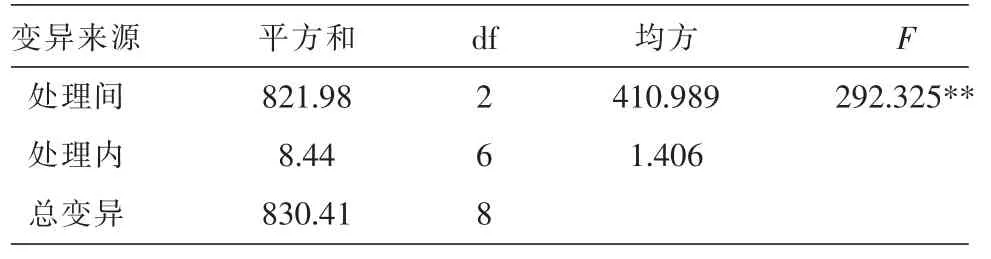
表4 不同外植体污染率的方差分析表

表5 外植体不同部位褐化率方差分析表

表6 不同外植体愈伤组织诱导率的方差分析表
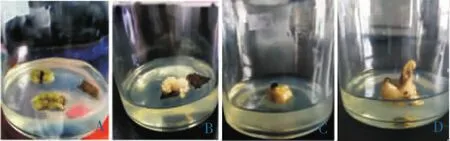
图1 不同取材部位愈伤组织诱导情况
2.3 外源激素配比的筛选
从表7~9的试验结果中可以确定出最适合厚朴愈伤组织诱导的培养基为B5+2.0 mg/L 2,4-D+ 1.0 mg/L 6-BA,启动时间最短,诱导率最高。NAA浓度在1.0~3.0 mg/L之间,启动天数和愈伤组织诱导率随浓度的增加而增加。6-BA较KT对愈伤组织诱导率的影响更大;2,4-D在诱导愈伤组织形成过程中,生理活性较NAA强,启动时间短,且诱导率更多,但试验过程中发现,2,4-D不适合厚朴愈伤组织增殖培养,愈伤组织随着培养时间的延长,颜色逐渐变得淡白,或是发生褐化死亡,原因可能是2,4-D本身具有一定的毒性,具有致癌活性[8]。因此,2,4-D有利于厚朴愈伤组织的诱导,但不适合愈伤组织的增殖培养。此外,从上述3个表中发现,有添加6-BA的培养基其诱导出的愈伤组织的生长状况大部分在4个“+”以上,而在无添加6-BA的培养基上的愈伤组织生长状况均在 2~3个“+”,且随着培养时间的延长,愈伤组织颜色逐渐变得淡白,质地松软,甚至枯死,不适宜进行继代培养。可见6-BA对于保持愈伤组织的活力起到关键的作用。
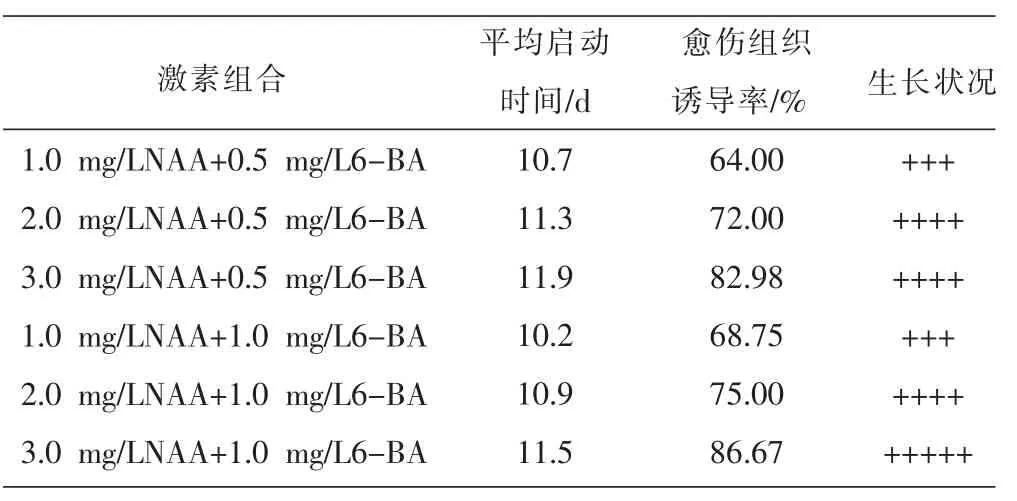
表7 植物生长调节剂NAA和6-BA的激素组合对愈伤组织诱导的影响

表8 植物生长调节剂NAA和KT的激素组合对愈伤组织诱导的影响

表9 植物生长调节剂2,4-D和6-BA的激素组合对厚朴愈伤组织诱导的影响
2.4 厚朴愈伤组织增殖培养试验
由外源激素配比的筛选结果可知,植物生长调节剂NAA和6-BA的激素组合较适合厚朴愈伤组织的继代培养,故本试验添加了不同质量浓度的NAA和6-BA,探索最适合厚朴愈伤组织生长的激素组合浓度,由表10可知,从K1~K8愈伤组织增殖倍数的结果可以看出,当NAA浓度小于或等于2.0 mg/L及6-BA浓度小于或等于1.0 mg/L时,愈伤组织的增殖倍数是与二者的浓度呈正相关的,随着二者的浓度的增加而增加;K7与K8组增殖倍数均低于1.5倍,说明NAA与 6-BA浓度太高会抑制愈伤组织的生长。K6号培养基中生长的愈伤组织生长倍数最大,达到2.865倍,且生长状态较好,淡黄色、较疏松。愈伤组织越疏松,细胞的分散程度就越大,有利于进行细胞悬浮培养。因此认为K6号培养基为厚朴愈伤组织最佳继代培养基,即适宜的培养基为B5+2.0 mg/L NAA+1.0 mg/L 6-BA。
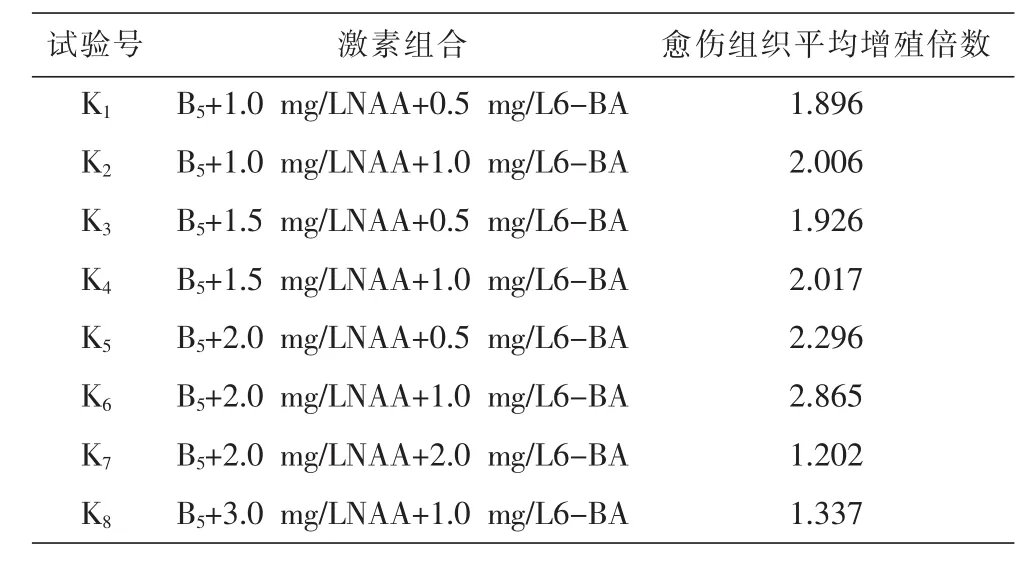
表10 愈伤组织增殖培养效果
3 讨论
适宜的基本培养基对于植物组织培养起着关键的作用[9]。在本次试验中,厚朴外植体在B5培养基上的诱导率最高,这与刘叶曼[2]、童再康[10]、马英姿[11]的研究结果一致。比较3种培养基的离子浓度,可以看出,MS培养基中NH4+浓度较高,而较高NH4+浓度会造成对愈伤组织的毒害,不利于其分化生长。
厚朴不同取材部位的愈伤组织污染率、褐化率和诱导率的高低顺序分别为:(1)污染率:顶芽>茎段>叶片;(2)褐化率:顶芽>茎段>叶片;(3)诱导率:茎段>顶芽>叶片。顶芽污染率最高的原因是顶芽有鳞片,消毒难度肯定会大些。关于褐变机理,一般认为是植物细胞中含有较多的酚类化合物而易被多酚氧化酶氧化成褐色的醌类物质[12]。多酚类化合物含量越多越容易发生褐化。由本次试验研究结果可以得出厚朴顶芽、茎段和叶片含多酚类化合物的高低顺序为:顶芽>茎段>叶片。诱导愈伤组织发生的影响因素较多且复杂,主要分为外因(培养基、培养条件和植物激素)和内因(基因型、生长状况及内源激素),其中内源激素起主要作用[13]。冯质雷研究表明内源激素的含量及不同种类内源激素间的浓度配比是决定玉米自交系愈伤组织诱导率的因素之一[14]。徐刚标等[15]以银杏的子叶、幼叶片和茎段为外植体诱导愈伤组织,发现子叶的愈伤组织诱导率最高,叶片次之,茎段最低。该结果与本试验的研究结果不一致。可见,不同植物体内的内源激素分布情况也不一样。
最适合厚朴愈伤组织诱导的培养基为B5+ 2.0 mg/L 2,4-D+1.0 mg/L 6-BA;最佳继代培养基为B5+2.0 mg/L NAA+1.0 mg/L 6-BA。可见适合诱导愈伤组织的培养基并不一定会适合愈伤组织的继代培养。这一结果与张志强等[16]研究一致。张志强[16]等发现,将诱导出的海巴戟天愈伤组织放入最佳诱导培养基中继代培养,愈伤组织生长极差甚至褐化死亡;而放入增殖培养基培养,愈伤组织增殖效果明显。在愈伤组织诱导试验中发现2,4-D对愈伤组织诱导作用较NAA强,启动时间短,且诱导率更多,但不适合愈伤组织的增殖培养,愈伤组织结构松散且容易发生褐化死亡。此外,在试验过程中发现刚诱导出来的愈伤组织大部分质地较硬,细胞间联系紧密,需对其进行3~4次的继代、筛选后才能用于液体培养。本试验通过优化厚朴愈伤组织诱导体系,初步筛选出了最适合用于细胞悬浮培养的愈伤组织的培养条件,以期为今后培养厚朴细胞研究提供参考。
[1]余盛贤,袁庆军,杨 滨,等.厚朴与凹叶厚朴群体遗传学研究[J].中国中药杂志,2010,35(16):2129-2132.
[2]刘叶蔓,赵碧清,曾 婷.凹叶厚朴愈伤组织的诱导及其有效成分含量的比较[J].中国药房杂志,2008,19(18):1392-1395.
[3]舒 枭,杨志玲,段红平,等.濒危植物厚朴种子萌发特性研究[J].中国中药杂志,2010,35(4):419-422.
[4]李娟梅,吕文良,陈兰羽,等.厚朴的临床应用[J].长春中医药大学学报,2013,29(1):176-177.
[5]王立青,江荣高,陈蕙芳.厚朴酚与和厚朴酚药理作用的研究进展[J].中草药,2005,36,(10):1591-1594.
[6]陈文源,吕一婷.药用植物细胞悬浮培养与新药研发进展[J].亚热带植物科学,2009,38(4):85-88.
[7]武丽娜.金银花疏松愈伤组织诱导及细胞悬浮培养研究[J].北方园艺,2012(20):107-109.
[8]于 娅,舒岸博.NAA和2,4-D对云南红豆杉愈伤组织诱导增殖的影响[J].武汉生物工程学院学报,2014,10(1):10-14.
[9]董 燕,刁玲武,周 联.药用植物细胞悬浮培养的影响因素[J].中医药信息,2011,28,(3):36-40.
[10]童再康,朱玉球,王章容.厚朴组织培养与高产细胞系建立的研究[J].南京林业大学学报:自然科学版,2002(4):23-26.
[11]马英姿,王志毅,许 欢,等.凹叶厚朴愈伤组织诱导及其有效成分量变化研究[J].中草药,2014(4):1-6.
[12]马 玺,马 英,刘 威,等.红豆杉细胞培养生产紫杉醇[J].药物生物技术,2004,11(6):401-405.
[13]蔡长福.三尖杉细胞培养及其三尖杉酯碱次生代谢的研究[D].福州:福建农林大学,2007.
[14]冯质雷.玉米未成熟胚胚性愈伤组织诱导率与内源激素的关系[D].杨凌:西北农业大学,2004.
[15]徐刚标,何 方,陈良昌.银杏愈伤组织诱导与继代培养的研究[J].中南林学院学报,1999,19(3):32-36.
[16]张志强,李永成.海巴戟天愈伤组织诱导及细胞悬浮培养试验[J].广东农业科学,2014,(4):108-112.
(本文编辑 杨 瑛)
Study on the Preparation of Callus of Magnolia officinalis Using on Cell Suspension Culture
XIE Yanyan1,WEI Mei2,XIE Dejin1,CHEN Jiancheng1,YANG Deming1,RONG Jundong1, CHEN Liguang1,ZHENG Yushan1,2*
(1.College of Forestry,Fujian Agriculture and Forestry University,Fuzhou,Fujian 350002,China;2.College of Landscape Architecture,Fujian Agriculture and Forestry University,Fuzhou,Fujian 350002,China.)
Objective To study the callus of Magnolia officinalis suitable for cell suspension culture.Methods Callus induction and subculture study were carried out through the selection of basic mediums(B5,MS and 1/2MS),explants(stems, phyllophores and leaves)and concentrations of hormone.Results The best basic medium for callus induction of Magnolia biloba was B5.Phyllophor is the best explant for callus induction of magnolia biloba.The best medium for callus induction of magnolia biloba was B5+2.0 mg/L 2,4-D+1.0 mg/L 6-BA.The best subculture medium for callus of Magnolia officinalis was B5+2.0 mg/L NAA+1.0 mg/L 6-BA,callus growth rate reached 2.87 times.Conclusion The callus of Magnolia officinalis suitable for cell suspension culture has been preliminary screened,which laying the foundation for cell suspension culture of Magnolia officinalis.
Magnolia officinalis;callus;suspension culture
R282.2
B
doi:10.3969/j.issn.1674-070X.2017.04.005
2016-09-10
“十二五”国家科技支撑计划项目(2011BAI01B06)资助;福建省科技创新平台(2008Y2001)资助。
谢燕燕,女,在读硕士研究生,研究方向:从事药用植物栽培与利用森林培育方面研究。
*郑郁善,男,教授,博士研究生导师,E-mail:zys1960@163.com。

