葛根素纳米晶的制备工艺及其表征
杜俊锋,涂亮星,胡凯莉*,奉建芳,2*(.上海中医药大学,上海 20203;2.桂林医学院,广西 桂林 45004)
葛根素纳米晶的制备工艺及其表征
杜俊锋1,涂亮星1,胡凯莉1*,奉建芳1,2*
(1.上海中医药大学,上海 201203;2.桂林医学院,广西 桂林 451004)
目的 研究葛根素纳米晶的制剂处方、制备工艺及其对粒径的影响,并对葛根素纳米晶进行表征。方法 采用高压均质法制备葛根素纳米晶,以粒径为指标,考察稳定剂、药辅比、投料量、制备温度等参数对纳米晶制备的影响。在此基础上,考察干燥工艺对葛根素纳米晶固化的影响。采用扫描电镜(SEM)及透射电镜(TEM)进行葛根素及纳米结晶形态学的观察。结果 采用聚维酮K30作为稳定剂、药辅比为1∶2、制备温度43℃以上时,可制得粒径为20~50 nm的葛根素纳米晶。投药量对纳米晶粒径没有显著性影响,投药量为10%(w/v)时,采用700 bar 5次的高压均质条件即可制得所需的纳米晶。冷冻干燥可以用于纳米晶的干燥。将葛根素制成纳米结晶之后,其外观由不规则状态变为圆整的球形。结论 所确定的葛根素纳米晶制剂处方与制备工艺条件可行,可有效地制备100 nm以下的葛根素纳米晶。
葛根素;纳米晶;制备工艺;粒径;表征
从中药葛根(Pueraria lobata)提取的异黄酮类有效成分葛根素具有扩张血管、增加心肌收缩力、抗氧化及肝保护等作用,临床上主要用于心脑血管疾病的治疗,如心肌缺血、心绞痛及高血压等。葛根素溶解度低,口服生物利用度较差(约3.7%)[1],目前临床上只能注射给药。在葛根素注射液中,加入了50%(v/v)的丙二醇作增溶剂。增溶剂的刺激作用及注射给药易造成高血药浓度,使用过程中易产生一些不良反应,如溶血、发热、皮肤瘙痒和胸闷气短等。葛根素在人体内的消除半衰期较短,为了达到治疗目的,需要经常静脉注射高剂量的葛根素注射液,导致药物中毒等严重的不良反应。如果能把葛根素制备成口服制剂,将解决注射剂使用过程中的不良反应且大大提高患者的顺应性。
纳米粒是利用天然高分子或合成的化学物质为载体制成的直径10~1 000 nm的载药微粒,葛根素制备成固体脂质纳米粒等对葛根素口服生物利用度提高有限,达不到临床理想的治疗要求,此外还存在有机溶剂残留及辅料使用量大等问题。上世纪90年代初,纳米晶技术首次由Liversidge等[2]引入制药领域,系直接将药物制备成纳米级结晶。该技术因载药量高、制备简单、易于放大、对物料理化性质没有要求等优点,得到迅速发展,并在口服给药、靶向给药等多种给药途径上显示出较大的优势,可以很好地避免上述纳米粒所存在的局限性。目前已有近10个基于纳米晶技术的上市产品和超过20个处于临床研究不同阶段的品种[3],而纳米晶技术在口服给药上表现的优势最大,被关注也最多。本研究拟运用纳米晶技术制备葛根素纳米晶,以期提高葛根素口服给药的生物利用度。本文考察了葛根素纳米晶的制备工艺并对其特性进行表征。
1 实验材料与仪器
1.1 实验材料与试剂
葛根素(质量分数>98%,南京泽朗医药科技有限公司);羟丙基甲基纤维素(HPMC),泊洛沙姆188 (P188)及十二烷基苯磺酸钠均由美国Sigma公司提供;甲基纤维素(MC),普流尼克127(F127),吐温80 (P80),十二烷基硫酸钠(SDS),聚乙烯醇(PVA),司盘60(Span 60),聚维酮K30(PVP K30)等其它试剂均由国药集团化学试剂有限公司提供。
1.2 实验仪器
高剪切分散乳化机(德国Fluko公司);高压均质机 (AH-100D,加拿大ATS公司);NICOMP 380 ZLS Zeta电位/粒度分析仪(美国PSS公司);ME分析天平 (瑞士Mettler Toledo公司);JY电子天平(上海上天精密仪器有限公司);冷冻干燥机(MODULYOD,美国Thermo Fisher公司);喷雾干燥仪(SD-06AG,英国Labplant公司);场发射扫描电镜(SEM,S-4800,日本Hitachi公司);高分辨透射电镜(TEM,JEM-2100,日本JEOL公司)。
2 方法
2.1 制剂处方及制备工艺筛选
2.1.1 稳定剂的筛选 以粒径为考察指标,对稳定剂的种类、用量等进行筛选。粒径测定采用动态光散射法(Dynamic Light Scattering,DLS),具体操作:将制剂置于比色皿,在25℃下,于粒度仪中测其粒径,每份样品平行测定3次,粒径结果以强度径表示并记录粒子的多分散系数(P.I)。
稳定剂考察时,按药物∶辅料=1∶2的比例,投药量1%(w/v),于16 000 r/min高剪切分散后,在高压均质机中于1 000 bar均质20次,制备体积为40 mL。考察的稳定剂有MC、HPMC、P188、F127、P80、SDS、十二烷基磺酸钠、PVA、Span 60、PVP K30,另外,保持药辅比不变,考察了SDS、P80、P188及PVP K30之间等比例联用对制剂的影响。
考察不同药辅比对制剂的影响,保持总固体含量不变,即葛根素和稳定剂的总量为3%(w/v),以HPMC、P188、PVA、SDS、PVP K30为研究对象,设定药辅比为1∶1、1∶2,于1 000 bar下均质20次。
此外,分别以SDS、PVP K30为稳定剂,保持药物∶辅料=1∶2的比不变,设定投药量为1%、1.5%、2%、3%(w/v),考察投药量对制剂的影响。
2.1.2 制备温度对制剂制备的影响 对制备过程的温度进行测定,以制剂达到理想的较小粒径并在至少6 h内稳定为制备成功,每个温度段均进行了不同均质条件(均质压力、均质体积等)的实验,且制剂例数均不小于5。统计数据并分析,以期发现制备温度对制剂制备的影响规律。
2.1.3 投药量对制剂性质的影响 保持药辅比不变,增加投药量,按1 000 bar 20次的均质方法制备2%、3%、4%、5%、6%、7%、8%、9%、10% 投药量的制剂,并测定其在24 h内的粒径,考察投药量对纳米晶制备的影响。
2.1.4 不同均质压力对制剂制备的影响 取Pue 6.0 g+PVP K30 12.0 g,加入300 mL纯净水,搅拌分散,再经高剪切分散(16 000 r/min×1 min)后于700 bar或1000 bar均质10次,维持制备温度在43℃左右。制剂在进行700 bar或1 000 bar均质前于200 bar和500 bar各均质2次,均质后记为均质0次。考察不同均质压力对制剂粒径的影响。
2.2 干燥工艺的选择
2.2.1 冷冻干燥 选用Pue投药量为10%(w/v)的纳米晶进行冻干工艺研究。为避免冻干过程中纳米晶的破坏,分别加入2%、6%、10%甘露醇和6%葡萄糖及6%蔗糖,另外取适量不加冻干保护剂的纳米晶液体,于-20℃预冻后,置于冻干机中进行冻干,考察冻干保护剂对纳米晶粒径的影响。冷冻干燥条件如下:冷冻干燥温度-45℃;真空度200 μbar;时间24 h。
2.2.2 喷雾干燥 控制制备温度为43~50℃,分别制得投药量为2%、4%和10%的制剂,按如下条件进行喷雾干燥:A-2%投药量,进风温度180℃,流速8 r/mim。B-4%投药量,进风温度180℃,流速 4 r/min。C-4%投药量,进风温度200℃,流速 6 r/min。D-10%投药量,进风温度200℃,流速 4 r/min。
2.3 形态学观察
分别采用SEM和TEM对原料药和纳米晶进行形态学观察。纳米晶的形态学研究采用冻干粉末,将其用水再分散后,滴至铜网上,自然晾干后,置于TEM下进行观察。
3 实验结果
3.1 制剂处方及制备工艺筛选
3.1.1 稳定剂的筛选结果 在1%(w/v)投药量,药辅比为1∶2条件下,以纳米晶16 h内稳定为成功制剂,优选出的稳定剂有HPMC、P188、SDS、PVA及PVP K30。
将上述稳定剂按药辅比为1∶1与1∶2进行纳米晶制备,其制备结果及粒径如表1所示。能够使制剂达到稳定状态的药辅比最低为1∶2。其中,PVP K30为稳定剂的葛根素纳米晶的粒径能够达到27.3 nm,粒径最小。
在药铺比为1∶2,投药量为1%、1.5%、2%、3%时,以SDS、PVP K30为稳定剂的制剂粒径结果如表2所示。结果显示,以PVP K30为稳定剂的制剂投药量可达3%(w/v)以上,以SDS为稳定剂的制剂最大投药量应在1%(w/v)左右。

表1 不同稳定剂和辅药比对葛根素纳米晶粒径的影响(n=3,nm)
表2 不同稳定剂和投药量对纳米晶粒径的影响 (n=3,nm,±s)

表2 不同稳定剂和投药量对纳米晶粒径的影响 (n=3,nm,±s)
稳定剂PVP K30 PVP K30 PVP K30 PVP K30 SDS SDS投药量(w/v) 1.0% 1.5% 2.0% 3.0% 1.0% 2.0% 0 h 25.2±2.3 27.4±1.1 34.1±0.7 36.5±1.8 305.9±5.9 601.5±24.8 14 h 26.2±1.1 27.1±0.5 34.1±0.3 33.8±0.1 298.9±21.0大量沉淀
3.1.2 制备温度对制剂制备的影响 当温度为30~35℃时,纳米晶制剂的成功率为0;当温度升至35~40℃时,成功率达到约80%;当温度升至40~43℃时,成功率达到96%左右;当温度大于43℃时,成功率达到100%,表明提高制备温度对葛根素纳米晶的成功制备非常有利。
3.1.3 投药量对纳米晶制备的影响 投药量对纳米晶制备的影响结果如表3,表明,采用PVP K30为稳定剂的葛根素纳米晶,在制备过程中,投药量对粒径的影响不大;基于固含量太高,高压均质有难度的考虑,最大投药量设定为10%(w/v)。
表3 不同投药量不同时间点纳米晶粒径 (n=3,nm,±s)
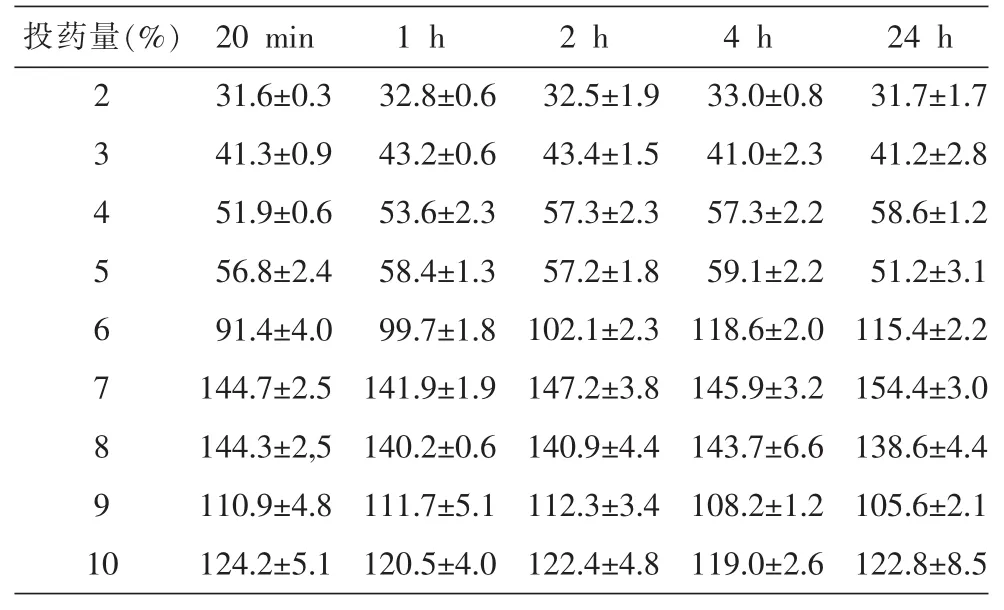
表3 不同投药量不同时间点纳米晶粒径 (n=3,nm,±s)
注:测量前未稀释。
投药量(%)2 3 4 5 6 7 8 9 1 0 20 min 31.6±0.3 41.3±0.9 51.9±0.6 56.8±2.4 91.4±4.0 144.7±2.5 144.3±2,5 110.9±4.8 124.2±5.1 1 h 32.8±0.6 43.2±0.6 53.6±2.3 58.4±1.3 99.7±1.8 141.9±1.9 140.2±0.6 111.7±5.1 120.5±4.0 2 h 32.5±1.9 43.4±1.5 57.3±2.3 57.2±1.8 102.1±2.3 147.2±3.8 140.9±4.4 112.3±3.4 122.4±4.8 4 h 33.0±0.8 41.0±2.3 57.3±2.2 59.1±2.2 118.6±2.0 145.9±3.2 143.7±6.6 108.2±1.2 119.0±2.6 24 h 31.7±1.7 41.2±2.8 58.6±1.2 51.2±3.1 115.4±2.2 154.4±3.0 138.6±4.4 105.6±2.1 122.8±8.5
3.1.4 不同均质压力对制剂制备的影响 不同均质压力下粒径结果如图1。结果发现:两种制剂在高压均质过程中,粒径先增大,后减小;700 bar与1 000 bar的均质压力在均质5次左右时,差异很大,但在均质5次后,没有显著差异,说明均质压力为700 bar及1 000 bar对纳米晶的制备无影响。

图1 700 bar和1 000 bar一系列均质次数下葛根素纳米晶粒径(n=3)
3.2 干燥工艺的选择结果
3.2.1 冷冻干燥 冷冻干燥前纳米晶的粒径为(27.1±1.5)nm,冷冻干燥后,粒径的变化如表4所示。结果发现,是否加入冻干保护剂,对纳米晶的粒径没有显著性的影响。

表4 加不同保护剂冷冻干燥后葛根素纳米晶的粒径 (n=3)
3.2.2 喷雾干燥 按照A、B、C、D条件制备了不同的葛根素纳米晶,并对其进行不同的喷雾干燥工艺考察,各制剂喷雾干燥前后的粒径测定结果如图2所示。
结果显示,A、B条件下(进风口温度180℃)喷雾干燥对粒径没有显著性影响 (P>0.05),C、D条件下(进风口湿度200℃)喷雾干燥对粒径有显著影响(P<0.05),因此,可以选择A、B条件进行喷雾干燥。

图2 喷雾干燥条件对葛根素纳米晶粒径的影响(n=3)
3.3 葛根素制备纳米晶前后形态学观察
分别采用SEM和TEM对原料药和纳米晶进行形态学观察,结果如图3。原料药外观不圆整,粒径在20 μm以上且分布不均一;纳米晶外观圆整,粒径集中在20~50 nm且分布较窄,TEM的观察结果和采用DLS测得的粒径结果一致。

图3 葛根素原料药(A)的SEM照片和纳米晶(B)的TEM照片
4 讨论
高压均质法 (high pressure homogenization)系Müller等人于1994年发明的一种纳米晶制备方法。均质压力及均质次数是影响均质效果的主要因素。压力越大,可能纳米晶粒径越小,制备过程中,所采用的压力一般为500~1 500 bar。本研究发现采用700 bar与1 000 bar对纳米晶粒径没有显著性差异,故采用700 bar的均质压力进行制备。随着均质次数的增加,粒径逐渐减小,且均质5次时,粒径达到最小。纳米晶的粒径一般为200~500 nm,目前报道最小纳米晶是60~80 nm[4],本研究中制备的葛根素纳米晶粒径为30~40 nm,具有很好的研究价值。
制备温度是影响高压均质效果的又一重要参数。葛根素具有较好的热稳定性,高温制备对其稳定性没有显著影响。考察不同温度下纳米晶制备后发现,低于35℃,无法得到所需的纳米晶,而超过43℃,700 bar高压均质10次,纳米晶制备成功率达到100%,表明提高制备温度,对采用以PVP K30为稳定剂的葛根素纳米晶的制备非常有利,最后确定的制备温度为43~50℃。
研究发现,不加稳定剂时,在1%(w/v)的投样量下制备的纳米晶粒径最低为300 nm左右,但是其粒径分布范围较广(P.I>1),所制得的纳米晶稳定性极差。故在制备过程中,加入稳定剂。在纳米晶的制备中稳定剂一般为表面活性剂、聚合物或两者的混合物。P80、SDS和P188等为常用的表面活性剂,常用的聚合物有HPMC、HPC及PVA等[5]。我们发现PVP K30为稳定剂时,所制得的纳米晶粒径<50 nm且分布范围较窄 (P.I≈0.3),制剂具有良好的稳定性。在制备的过程中,我们考察不同药辅比对葛根素纳米晶制备的影响,结果发现当药辅比低于1:2时,体系不能维持稳定状态。
在冷冻干燥过程中,一般加入一定量冻干保护剂来减小冷冻损伤和固化损伤。常用的冻干保护剂为葡萄糖等糖类及甘露醇,使用比例一般为1%~10%(w/w)[6]。我们考察加入不同比例的冻干保护剂,对纳米晶冷冻干燥粉末的影响,结果发现,对冷冻干燥粉末的粒径没有明显的改变。
[1]Pitha J,Milecki J,Fales H,et al.Hydroxypropyl-β-cyclodextrin: preparation and characterization; effects on solubility of drugs[J].Int J Pharm,1986,29:73-82.
[2]Merisko-Liversidge E,Liversidge GG.Nanosizing for oral and parenteral drug delivery:a perspective on formulating poorlywater soluble compounds using wet media milling technology[J].Adv Drug Deliv Rev,2011,63:427-440.
[3]Colombo P,Sonvico F,Colombo G,et al.Novel platforms for oral drug delivery[J].Pharm Res,2009,26:601-611.
[4]Böhm BHL,Müller RH.Lab-scale production unit design for na nosuspensions of sparingly soluble cytotoxic drugs[J].Pharm Sci Tech Today,1999,2:336-339.
[5]Mosharraf M,Nyström C.The effect of particle size and shape on the surface specific dissolution rate of microsized practically insoluble drugs[J].Int J Pharm,1995,122:35-47.
[6]Müller RH,Peters K.Nanosuspensions for the formulation of poorly soluble drugs:I.Preparation by a size-reduction technique[J].Int J Pharm,1998,160:229-237.
(本文编辑 苏 维)
Characteristics and Process Technology of Peurarin Nanocrystals
DU Junfeng1,TU Liangxing1,HU Kaili1*,FENG Jianfang1,2*
(1.Shanghai University of Chinese Medicine,Shanghai 201203,China;2.Guilin Medical University, Guilin,Guangxi 451004,China)
Objective In this study,the production,process technology and effects ofparticle size ofpuerarin nanocrystals were investigated,and the puerarin nanocrystals were characterized.Methods High pressure homogenization (HPH)was used for formula and production studies.Particle size as an indicator,we studied the effects of stabilizers,drug/ stabilizer ration,drug input and production temperature on the production of peurarin nanocrystals,and then drying method were introduced to study the solidification of nanocrystals.We introduced scanning electron microscopy(SEM)and transmission electron microscopy (TEM)formorphologic observation forcrystalline study.ResultsIn the production study,puerarin nanocrystal with diameter of 20~50 nm could be produced after using PVP K30 as stabilizer,with drug/stabilizer ratio 1∶2, temperature above 43℃.The amounts of puerarin input has no significant influence on nanocrystals production.In poilet scaled experiments,nanocrystals with puerarin input of 10% (w/v)were produced at 700 bar for 5 cycles,and the nanocrystals prepared were solidified by freezing drying and spray drying.We found that after transferred puerarin into nanocrystals,the irregular shape for puerarin was changed to spherical shape for nanocrystals.Conclusion The formula and production processes estabilished were reliable and repeatability,the puerarin nanocrystals with diameter below 100 nm could be prepared effectively.
puerarin;nanocrystals;process technology;particle size;superficial characteristics
R283
A
doi:10.3969/j.issn.1674-070X.2017.04.006
2016-11-21
国家 “973”计划项目 (2009CB930300);上海市优秀技术带头人计划项目 (13XD1425300);上海市科委纳米专项项目(11nm0506700)。
杜俊锋,男,在读硕士,研究方向:中药新剂型。
*胡凯莉,女,副研究员,硕士生导师,E-mail:kaili-hu@163.com;奉建芳,男,教授,博士生导师,E-mail:fengjianfang@vip.163.com。
本文引用:杜俊锋,涂亮星,胡凯莉,奉建芳.葛根素纳米晶的制备工艺及其表征[J].湖南中医药大学学报,2017,37(4):369-372.

