基于水杨醛席夫碱结构的锌离子选择性荧光探针
李媛媛,侯不唯,李 恺
(1.河南工业大学 化学化工与环境学院,河南 郑州 450001; 2.郑州大学 化工与能源学院,河南 郑州 450001; 3.郑州外国语学校AP中美班,河南 郑州 450001; 4.郑州大学 化学与分子工程学院,河南 郑州 450001)
基于水杨醛席夫碱结构的锌离子选择性荧光探针
李媛媛,侯不唯3,李 恺4
(1.河南工业大学 化学化工与环境学院,河南 郑州 450001; 2.郑州大学 化工与能源学院,河南 郑州 450001; 3.郑州外国语学校AP中美班,河南 郑州 450001; 4.郑州大学 化学与分子工程学院,河南 郑州 450001)
设计并合成了一种新型锌离子荧光探针——4-N,N-二乙胺基水杨醛-2-吡啶肼席夫碱(1). 在pH为7.0的50%水/乙醇(体积比)体系中,1对锌离子表现出显著的荧光增强响应. 提高体系中的乙醇含量有利于获得更高的荧光放大倍数,在纯乙醇中,1对锌离子的荧光增强可达100倍. 1对锌离子的荧光检测表现出良好的选择性,尤其可以区分锌离子的常见干扰离子镉离子. 其线性范围为0.1~1.0 μmol/L,检测限达到35 nmol/L. 同时,1被成功用于实际水样中锌离子的定量检测.
锌离子;荧光增强;探针;席夫碱
锌离子是生命体所需的重要微量元素,其在人体内的含量仅次于铁,在血液中的最高浓度可达10 μmol/L[1]. 锌离子在多种生命过程中扮演着重要角色,对包括神经传导、基因表达、酶活性、细胞代谢以及DNA和RNA的合成等许多生命活动有着重要的影响[2-3]. 锌也被人类广泛使用在各类工业生产中,如合金制造、机械加工、电镀防腐、电池电极等. 然而,随着工业生产的进行,大量的锌以阳离子的形式进入环境,成为一种常见的环境污染物. 人体过多摄入锌元素,会导致一系列的不良反应与疾病[4]. 因此,对锌离子的高效、快速、选择性检测显示出了重要的意义[5].
目前,常见的锌离子检测方法包括原子吸收/发射光谱法、色谱法、比色法、荧光法等[6-8]. 其中荧光法由于其高选择性、低检测限、简便快捷、可原位分析等突出优点得到了越来越广泛的应用[9-15]. 在锌离子荧光探针的开发和应用中,由于锌离子和镉离子具有高度相似的电子层结构和络合性能,使得其检测常常会受到镉离子的干扰,选择性不佳[16-21]. 本研究设计合成了4-N,N-二乙胺基水杨醛-2-吡啶肼席夫碱(1)作为锌离子选择性荧光探针,其通过与锌形成2∶1络合物,表现出蓝绿色荧光. 最重要的是,其对锌离子具有良好的选择性,可以有效的将锌离子从其他金属离子(尤其是镉离子)中区分出来. 在pH为7.0的50%水/乙醇(体积比)体系中,探针对锌离子表现出超过10倍的荧光增强响应,发射波长474 nm. 在纯乙醇中,探针对锌离子的荧光增强倍数可高达100倍以上.
1 实验部分
1.1 试剂
本实验中所采用的试剂均为市售分析纯试剂,所采用的水为二次蒸馏去离子水. 4-N, N-二乙胺基水杨醛和2-肼基吡啶购买于安耐吉化学试剂有限公司. 实验中所采用的金属离子为该金属的可溶性硝酸盐或高氯酸盐. 其他药品和所用有机溶剂都购买于国药集团北京化学试剂有限公司.
1.2 仪器
荧光光谱:采用JASCO FP-8300荧光光谱仪测得;紫外光谱:采用JASCO V-750紫外可见光谱仪测得;pH:采用METTLERTOLEDO-FE20/EL20型pH计测得;核磁共振谱:采用Bruker-DPX-400型核磁共振仪测得,磁场强度400 MHz;质谱:采用Agilent 6420型液相色谱/质谱仪测得.
1.3 合成与表征
4-N,N-二乙胺基水杨醛-2-吡啶肼席夫碱(1)的合成路线如图1所示:将193 mg(1 mmol)4-N, N-二乙胺基水杨醛和109 mg(1 mmol)2-肼基吡啶分别溶于10 mL无水乙醇后,加入50 mL圆底烧瓶中. 体系在室温下搅拌2 h,过滤所得沉淀,用30 mL无水乙醇洗三次,在红外灯下烘干,即可获得目标产物,产率为77%. 核磁:1H NMR (DMSO-d6)δ:1.06 (t,6H),3.31 (m,4H),6.09 (d,1H),6.21 (d,1H),6.67 (m,1H),6.81 (m,1H),7.14 (m,1H),7.58 (m,1H),8.07 (m,2H),10.52 (s,1H),10.67(s,1H).13C NMR (DMSO-d6)δ:13.07,44.29,98.19,104.19,105.99,108.27,114.81,130.01,138.44,142.68,148.51,149.61,156.94,158.70. 质谱:m/z285.3 ([M + H]+),计算值 285.2([M + H]+).
4-N,N-二乙胺基苯甲醛-2-吡啶肼席夫碱(2)的合成:将177 mg(1 mmol)N,N-二乙基-4-氨基苯甲醛和109 mg(1 mmol)2-肼基吡啶分别溶于10 mL无水乙醇后,加入50 mL圆底烧瓶中. 体系在室温下搅拌2 h,过滤所得沉淀,用30 mL无水乙醇洗三次,在红外灯下烘干,即可获得目标产物,产率为83%. 核磁:1H NMR (DMSO-d6)δ:1.09 (t,6H),3.35 (m,4H),6.67 (s,3H),7.16 (s,1H),7.44 (d,3H),7.90 (s,1H),8.06 (s,1H),10.50 (s,1H).13C NMR (DMSO-d6)δ:12.91,44.16,106.40,111.69,114.47,122.59,127.97,138.13,140.55,148.16,148.24,157.89. 质谱:m/z269.2 ([M + H]+),计算值 269.2([M + H]+).
4-N,N-二乙胺基水杨醛苯肼席夫碱(3)的合成:将193 mg(1 mmol)4-N, N-二乙胺基水杨醛和108 mg(1 mmol)苯肼分别溶于10 mL无水乙醇后,加入50 mL圆底烧瓶中. 体系在室温下搅拌2 h,过滤所得沉淀,用30 mL无水乙醇洗三次,在红外灯下烘干,即可获得目标产物,产率为85%. 核磁:1H NMR (DMSO-d6)δ:1.09 (t,6H),3.31 (m,4H),6.14 (m,2H),6.73 (t,1H),6.90 (d,2H),7.23 (m,3H),8.01 (s,1H),10.02 (s,1H),10.85 (s,1H).13C NMR (DMSO-d6)δ:13.01,44.22,98.17,104.05,108.31,111.76,118.72,129.71,130.21,141.34,145.61,149.23,158.44. 质谱:m/z283.2 ([M + H]+),计算值 283.2 ([M + H]+).
1.4 测试方法
本实验中所有的紫外光谱和荧光光谱均在具有一定pH的10 mmol/L Tris-HCl与有机溶剂缓冲体系中测量得到,测试温度为25 ℃. 测试前,先配置好所需比例和pH的Tris-HCl/有机溶剂缓冲体系,并将1用DMSO逐级稀释配置成1.00×10-3mol/L储备液,将金属硝酸盐或高氯酸盐用去离子水逐级稀释配置成1.00×10-2mol/L储备液备用. 测试时,将0.030 mL的1.00×10-3mol/L的1储备液稀释于配置好的3.00 mL的Tris-HCl/有机溶剂缓冲体系中,混匀并静置1 min后进行测试. 金属离子根据需要的添加量加入体系中,混匀并静置1 min后进行测试.
2 结果与讨论
2.1 探针1与锌离子的结合及其光谱变化
首先,我们采用了紫外滴定和荧光滴定的方法,研究了1与锌离子的络合情况. 如图2A所示,在pH为7.0的50%水/乙醇(体积比)体系中,随着锌离子浓度的逐渐增加,10 μmol/L探针1的紫外吸收光谱表现出非常规则的比率变化:在364 nm的吸收峰逐渐降低,在402 nm的吸收峰相应升高. 同时,可以清楚的看到,在384 nm附近出现了一个等吸收点. 这些结果表明在锌离子加入后,体系中有新的物质生成,我们推测应该是形成了1与锌离子的络合物(图1). 在紫外滴定曲线中可以看到(图2B),当锌离子浓度超过探针浓度的0.5倍后,紫外吸收信号基本达到饱和,不再发生改变. 这说明探针与锌离子所形成的络合物的结合比为2∶1. 在荧光滴定实验中,可以得到类似的结果. 如图3所示,随着锌离子的加入,体系在474 nm处的荧光峰逐渐增强,当锌离子浓度超过探针浓度的0.5倍后,荧光信号达到饱和. 在锌离子加入前到饱和后,1表现出了超过10倍的荧光增强响应,该响应肉眼可见,由此可实现对锌离子的裸眼快速检测.
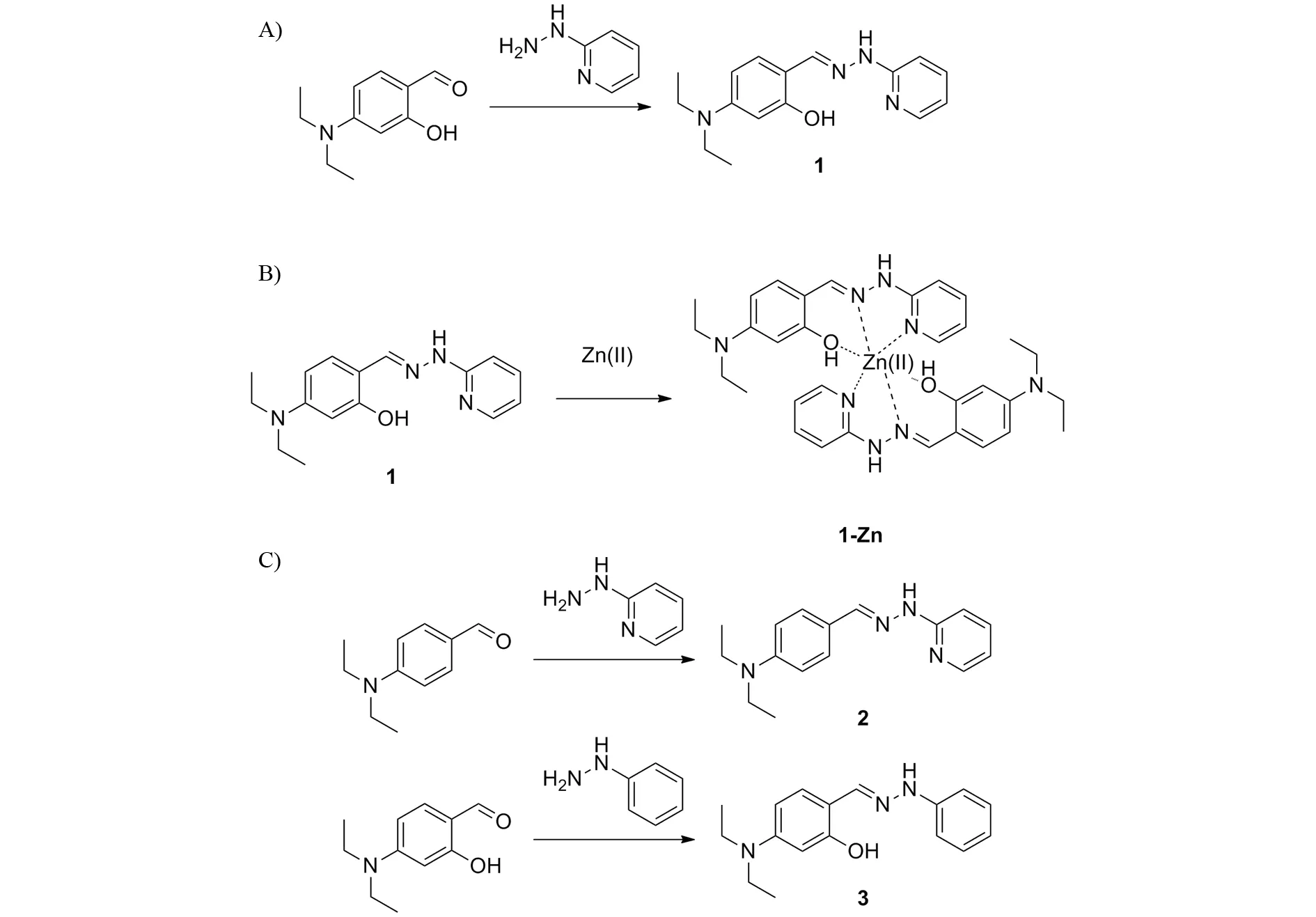
图1 A)1的合成;B)1与锌离子形成络合物的示意图;C) 对比化合物2和3的合成Fig.1 A) Synthesis of 1. B) Formation of 1-Zn complex. C) Synthesis of compounds 2 and 3
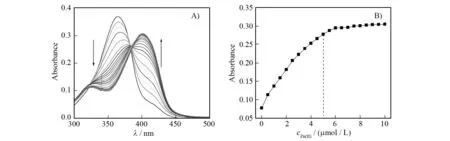
图2 A)1随锌离子浓度增加的紫外光谱变化;B)402 nm处吸光度随锌离子浓度增加的变化. 条件:[1] = 10 μmol/L,[Zn(Ⅱ)] = 0~10 μmol/L,50%水/乙醇(体积比),10 mmol/L Tris-HCl缓冲体系,pH = 7.0Fig.2 A) Absorption spectra of 1 upon the addition of Zn(Ⅱ). B) The absorbance at 402 nm as a function of Zn(Ⅱ) concentration. Conditions: [1] = 10 μmol/L, [Zn(Ⅱ)] = 0-10 μmol/L, water/EtOH (Vwater/VEtOH=50%) at pH 7.0 buffered by 10 mmol/L Tris-HCl
为了进一步明确1与锌离子所形成的络合物的结合比,我们采用了Job’s plot方法进行测试. 控制1和锌离子的总浓度为10 μmol/L,改变两者比例,记录402 nm处紫外吸收峰的强度变化. 如图4所示,当1和锌离子的浓度比到达2∶1时,402 nm处吸光度达到极大值,这再次说明1和锌离子形成了2∶1结合的络合物.
众所周知,配体与金属离子形成络合物时,五元环和六元环的结构最有利于络合物的稳定. 因此,根据1的结构,我们推测1应该是以其结构中的酚羟基、席夫碱的氮原子和吡啶基团的氮原子为结合位点,与锌离子形成络合物结构(图1B). 为了确定探针1与锌离子的结合位点,我们分别合成了对比化合物2和3. 相对于1来说,化合物2的结构中没有酚羟基而化合物3的结构中则不存在吡啶氮原子,其结构如图1C所示. 随后,我们分别在pH为7.0的50%水/乙醇(体积比)体系中,对化合物2和3对锌离子的结合进行了研究,其结果如图5所示. 加入锌离子前后,化合物2和3的紫外光谱都几乎没有发生变化. 由此可知,酚羟基和吡啶氮原子在1与锌离子的络合过程中起了不可替代的作用. 进一步,我们通过核磁滴定对1与锌离子的络合进行了研究,其结果如图6所示. 由于金属离子的加入,化合物苯环区的氢原子化学位移发生不同程度的变化:其中,3号、5号、7号氢原子由于与作用位点最近,向低场的移动最为明显,化学位移的改变最大;与吡啶氮原子处于间位的4号、6号两个氢原子的化学位移则相对略小;1号、2号氢原子与作用位点最远,化学位移在锌离子加入前后几乎没有变化;8号氢原子所在的氮原子和相邻的起络合作用的氮原子并不共轭链接,所以配位前后化学位移也几乎没有变化. 该结果再次印证了我们对于锌离子与1结合位点的推测.
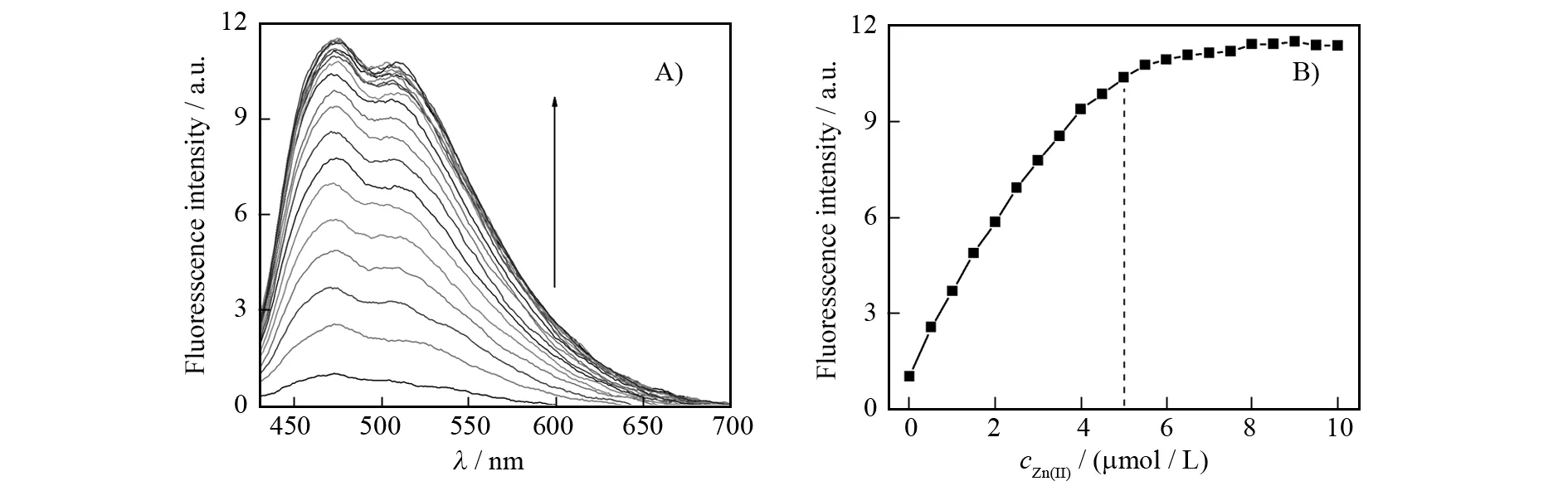
图3 A)1随锌离子浓度增加的荧光光谱变化;B)474 nm处荧光强度随锌离子浓度增加的变化. 条件:[1] = 10 μmol/L,[Zn(Ⅱ)] = 0~10 μmol/L,50%水/乙醇(体积比),10 mmol/L Tris-HCl缓冲体系,pH = 7.0Fig.3 A) Fluorescence spectra of 1 upon the addition Zn(Ⅱ). B) The fluorescence intensity at 474 nm as a function of Zn(Ⅱ) concentration. Conditions: [1] = 10 μmol/L, [Zn(Ⅱ)] = 0-10 μmol/L, water/EtOH (Vwater/VEtOH=50%) at pH 7.0 buffered by 10 mmol/L Tris-HCl

图4 以Job’s plot方法,通过402 nm处吸光度变化测定1-Zn络合物的结合比. 条件:[1] + [Zn(Ⅱ)] = 10 μmol/ L,50%水/乙醇(体积比),10 mmol/L Tris-HCl缓冲体系,pH = 7.0 Fig.4 Job’s plot method for evaluating the stoichiometry of 1-Zn complex by measuring the change of absorbance at 402 nm. Conditions: [1] + [Zn(Ⅱ)] = 10 μmol/L, water/EtOH (Vwater/VEtOH=50%) at pH 7.0 buffered by 10 mmol/L Tris-HCl

图5 化合物2和3在锌离子加入前后紫外光谱的变化. 条件:[2] = [3] =10 μmol/L,[Zn(Ⅱ)] = 10 μmol/L,50%水/乙醇(体积比),10 mmol/L Tris-HCl缓冲体系,pH = 7.0Fig.5 Absorption spectra of 2 and 3 before and after the addition of Zn(Ⅱ). Conditions: [2] = [3] =10 μmol/L, [Zn (Ⅱ)] = 10 μmol/L, water/EtOH (water/EtOH (Vwater/VEtOH=50%) at pH 7.0 buffered by 10 mmol/L Tris-HCl
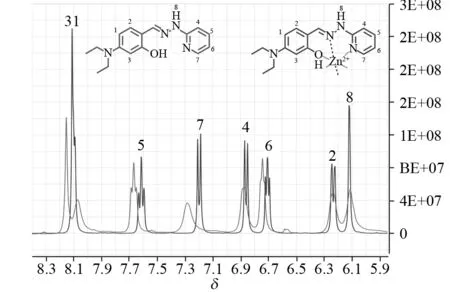
图6 加入锌离子前后1的核磁1H谱的变化Fig.6 1H-NMR spectrum of 1 before and after the addition of Zn(Ⅱ)
2.2 检测条件优化
2.2.1 探针1对锌离子检测的选择性和抗干扰能力
如图7所示,分别加入2当量的不同金属离子于10 μmol/L探针1溶液中,只有锌离子产生了明显的荧光增强响应. 其他16种常见金属离子,包括对锌离子常常发生干扰的镉离子,都未表现出任何荧光增强. 这说明1对锌离子具有良好的选择性. 进一步,研究1在不同金属离子存在时检测锌的抗干扰能力,我们在体系中加入2当量锌离子的同时,也加入了2当量的其他干扰离子(图7网格柱状部分). 结果表明,碱金属、碱土金属以及绝大多数常见金属离子对锌离子的检测都不会产生干扰,其中包括镉离子. 只有钴、铜、镍三种金属离子由于其本身的顺磁作用及较强的络合能力,对体系的荧光产生了一定的猝灭,而这种猝灭通常是不可避免的[16-26]. 总而言之,1对锌离子的检测具有非常好的选择性和一定的抗干扰能力.

图7 探针1对Zn(Ⅱ)的选择性和抗干扰能力,荧光激发波长410 nm,发射波长474 nm. 条件:[1] = 10 μmol/L,[Zn(Ⅱ)] = 10 μmol/L,[M] = 10 μmol/L,50%水/乙醇(体积比),10 mmol/L Tris-HCl缓冲体系,pH = 7.0Fig.7 Selectivity of 1 in the presence of different metal ions with or without Zn(Ⅱ). Excitation and emission was at 410 and 474 nm, respectively. Conditions: [1] = 10 μmol/L, [Zn(Ⅱ)] = 10 μmol/L, [M] = 10 μmol/L, water/EtOH (Vwater/VEtOH=50%) at pH 7.0 buffered by 10 mmol/L Tris-HCl
2.2.2 有机溶剂的选择和用量
探针1在纯水体系中,对锌离子没有荧光增强响应,需要体系中存在一定的有机溶剂方可实现对锌离子的响应. 我们首先对有机溶剂的种类进行了筛选,结果如图8所示. 将乙醇、DMSO和乙腈这三种可以和水任意比例互溶的常用溶剂与10 mmol/L pH为7.0 的Tris-HCl水溶液配置成缓冲体系. 在这三种体系中,分别测试1在加入2当量锌离子前后的荧光强度. 结果表明,在水/乙醇中,1对锌离子表现出了最佳的荧光增强响应. 在水/DMSO中,探针的背景荧光较高. 而在水/乙腈中,探针的荧光增强倍数较小. 同时,考虑到乙醇是一种常见的低毒性、廉价的有机溶剂,因此选择水/乙醇作为分析体系.
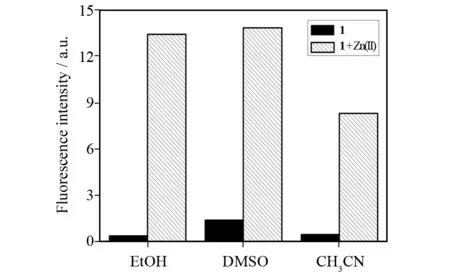
图8 水/不同有机溶剂混合体系中,向1中添加2当量锌离子前后的荧光强度. 激发波长410 nm,发射波长474 nm. 条件:[1] = 10 μmol/L,[Zn(Ⅱ)] = 10 μmol/L,50%水/有机溶剂(体积比),10 mmol/L Tris-HCl缓冲体系,pH = 7.0Fig.8 Fluorescence intensity of 1 in the absence and presence of 2 equiv. Zn(Ⅱ) in water/different organic solvent mixture. Excitation and emission was at 410 and 474 nm, respectively. Conditions: [1] = 10 μmol/L, [Zn(Ⅱ)] = 10 μmol/L, water/organic solvent (Vwater/Vorganic solvent=50%) at pH 7.0 buffered by 10 mmol/L Tris-HCl
在确定水/乙醇的分析体系后,我们进一步对乙醇用量对探针响应性能的影响进行了探究. 如图9所示,随着体系中乙醇所占比例的升高,探针对锌离子的荧光增强倍数逐渐增大. 在乙醇含量达到50%时,荧光增强倍数已超过10倍;在纯乙醇体系中,荧光增强倍数甚至超过100倍. 然而,过高的有机溶剂含量常对实际样品的分析带来不便. 因此,综合考虑荧光增强效果和有机溶剂含量,采用 50%水/乙醇(体积比)体系作为对锌离子检测的最佳体系.
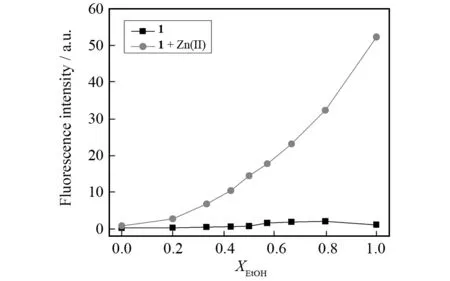
图9 在不同比例的水/乙醇体系中,向1中添加2当量锌离子前后的荧光强度. 激发波长410 nm,发射波长474 nm. 条件:[1] = 10 μmol/L,[Zn(Ⅱ)] = 10 μmol/L,10 mmol/L Tris-HCl缓冲体系,pH = 7.0Fig.9 Fluorescence intensity of 1 in the absence and presence of 2 equiv. Zn(Ⅱ) in different water/EtOH mixture. Excitation and emission was at 410 and 474 nm, respectively. Conditions: [1] = 10 μmol/L, [Zn(Ⅱ)] = 10 μmol/L, pH 7.0 buffered by 10 mmol/L Tris-HCl
pH对探针的响应性能也有着重要的影响. 如图10所示,向含有10 μmol/L探针1的不同pH的50%水/乙醇溶液中加入2当量锌离子后,荧光强度具有明显区别,1在pH为7.0时表现出最高倍数的荧光增强. 其可能的原因是:在酸性条件下,溶液中的氢离子会使1中的吡啶基团结合质子,降低了其对金属离子的结合能力,影响了1-Zn络合物的生成;而在碱性条件下,体系中的氢氧根与锌离子结合,同样会影响1-Zn络合物的生成. 因此,中性条件被确定为1对锌离子检测的最佳条件.
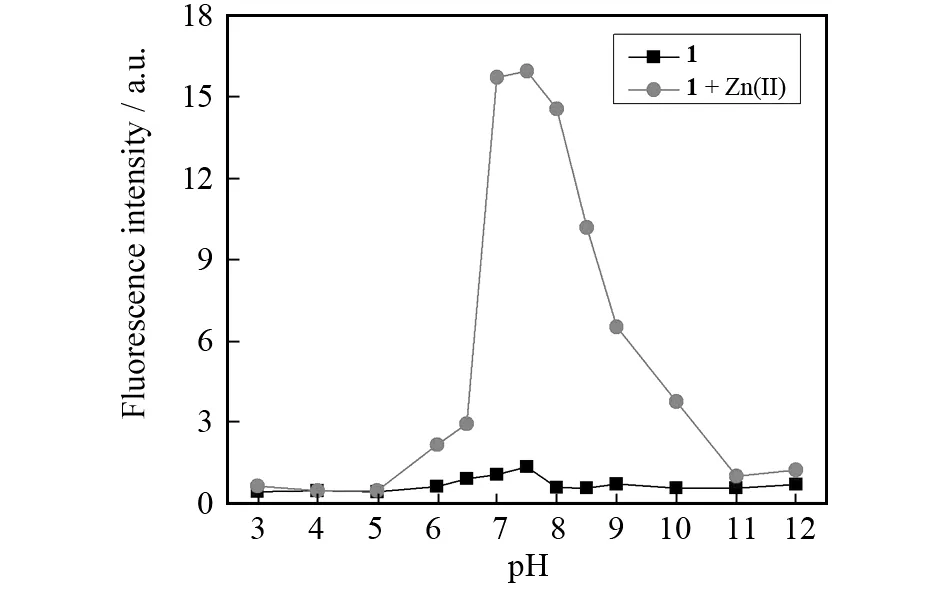
图10 不同pH条件下探针1与Zn(Ⅱ)结合前后的荧光强度,激发波长410 nm,发射波长474 nm. 条件:[1] = 10 μmol/L,[Zn(Ⅱ)] = 10 μmol/L,50%水/乙醇(体积比),10 mmol/L Tris-HCl缓冲体系Fig.10 Fluorescence intensity of 1 in the absence and presence of Zn(Ⅱ) at different pH. Excitation and emission was at 410 and 474 nm, respectively. Conditions: [1] = 10 μmol/L, [Zn(Ⅱ)] = 10 μmol/L, water/EtOH (Vwater/VEtOH=50%) buffered by 10 mmol/L Tris-HCl
2.3 探针1对锌离子的荧光检测性能
2.3.1 锌离子检测的工作曲线及检测限
根据2.2实验所得的锌离子检测的最佳条件,我们对1对锌离子检测的工作曲线及检测限进行了测量和计算. 在含有10 μmol/L探针1的pH为7.0的50%水/乙醇缓冲体系加入0.1~1.0 μmol/L的锌离子标准溶液,测量其在474 nm处的荧光信号. 实验结果表明(图11),1对至少在0.1~1.0 μmol/L的范围内的锌离子具有极好的线性荧光响应,其滴定曲线的相关系数可达0.999(n=3). 对于0.50 μmol/L锌离子进行了三次平行测量,其结果的相对标准偏差为1.6%. 根据IUPAC对检测限的定义(CDL= 3Sb/m),计算得1对锌离子的检测限为35 nmol/L.

图11 1对锌离子的荧光检测工作曲线,激发波长410 nm,发射波长474 nm. 条件:[1] = 10 μmol/L,[Zn(Ⅱ)] = 0.1-1.0 μmol/L,50%水/乙醇(体积比),10 mmol/L Tris-HCl缓冲体系,pH = 7.0Fig.11 Fluorescence intensity of 1 as a function of Zn(Ⅱ) concentration (0.1-1.0 μmol/L). Excitation and emission was at 410 and 474 nm, respectively. Conditions: [1] = 10 μmol/L, [Zn(Ⅱ)] = 0.1-1.0 μmol/L, water/EtOH (Vwater/VEtOH=50%) at pH 7.0 buffered by 10 mmol/L Tris-HCl
2.3.2 对实际水样的检测
根据2.3.1获得的工作曲线,我们用1对自来水及合成水样中的锌离子浓度进行了测定,结果如表1所示. 对于合成水样(在去离子水中加入5.00 μmol/L的Zn(Ⅱ), 5.00 μmol/L的Cd(Ⅱ), Pb(Ⅱ), Ag(I), Hg(Ⅱ)和10.0 μmol/L的Na(I), K(I), Mg(Ⅱ), Ca(Ⅱ)制得),我们准确测得了其中锌离子的含量,回收率分别为98.2%和102.7%,三次测量的相对标准偏差分别为2.2%和1.7%. 对于自来水样,同样获得了很好的回收率和理想的相对标准偏差. 这表明,1可以应用于实际水样的检测.

表1 探针1用于实际水样品中Zn(Ⅱ)浓度的测定
3 结论
设计并合成了一种新型锌离子增强型荧光探针1. 该探针合成简单,成本低廉,在50%水/乙醇(体积比)缓冲体系中性pH条件下,与锌离子形成2∶1的络合物,伴随超过10倍的荧光增强响应. 更重要的是,1对锌离子表现出了极佳的选择性,即使镉离子也不会对其检测产生干扰. 1可以用于对锌离子的快速裸眼检测和定量分析检测,检测限达到35 nmol/L.
[1] OHALLORAN T V. Transition-metals in control of gene-expression [J]. Science, 1993, 261(5122): 715-725.
[2] BURDETTE S C, LIPPARD S J. Meeting of the minds: Metalloneurochemistry [J]. Proceedings of the National Academy of Sciences, 2003, 100(7): 3605-3610.
[3] FREDERICKSON C J, KOH J Y, BUSH A I. The neurobiology of zinc in health and disease [J]. Nature Reviews Neuroscience, 2005, 6(6): 449-462.
[4] CUAJUNGCO M P, LEES G J. Zinc and alzheimer’s disease: Is there a direct link? [J]. Brain Research Reviews, 1997, 23(3): 219-236.
[5] ARAGAY G, PONS J, MERKOÇI A. Recent trends in macro-, micro-, and nanomaterial-based tools and strategies for heavy-metal detection [J]. Chemical Reviews, 2011, 111(5): 3433-3458.
[6] ARMELIN M J A, PIASENTIN R M, PRIMAVESI O. Neutron activation analysis of zinc in forages used in intensive dairy cattle production systems [J]. Journal of Radioanalytical and Nuclear Chemistry, 2002, 252(3): 585-587.
[7] RAO K S, BALAJI T, RAO T P, et al. Determination of iron, cobalt, nickel, manganese, zinc, copper, cadmium and lead in human hair by inductively coupled plasma-atomic emission spectrometry [J]. Spectrochimica Acta Part B, 2002, 57(8): 1333-1338.
[8] NASCENTES C C, ARRUDA M A Z, NOGUEIRA A R A, et al. Direct determination of Cu and Zn in fruit juices and bovine milk by thermospray flame furnace atomic absorption spectrometry [J]. Talanta, 2004, 64(4): 912-917.
[9] LI K, TONG A. A new fluorescent chemosensor for Zn2+with facile synthesis: “Turn-on” response in water at neutral pH and its application for live cell imaging [J]. Sensors and Actuators B: Chemical, 2013, 184(7): 248-253.
[10] LI K, WANG X, TONG A. A “turn-on” fluorescent chemosensor for zinc ion with facile synthesis and application in live cell imaging [J]. Analytica Chimica Acta, 2013, 776: 69-73.
[11] SU H, CHEN X, FANG W. On-off mechanism of a fluorescent sensor for the detection of Zn(Ⅱ), Cd(Ⅱ), and Cu(Ⅱ)transition metal ions [J]. Analytical Chemistry, 2014, 86(1): 891-899.
[12] DING Y, TANG Y, ZHU W, et al. Fluorescent and colorimetric ion probes based on conjugated oligopyrroles [J]. Chemical Society Reviews, 2015, 44(5): 1101-1112.
[13] PENG J, XU W, TEOH C L, et al. High-efficiency in vitro and in vivo detection of Zn2+by dye-assembled upconversion nanoparticles [J]. Journal of the American Chemical Society, 2015, 137(6): 2336-2342.
[14] WU L, GUO Q S, LIU Y Q, et al. Fluorescence resonance energy transfer-based ratiometric fluorescent probe for detection of Zn2+using a dual-emission silica-coated quantum dots mixture [J]. Analytical Chemistry, 2015, 87(10): 5318-5323.
[15] LI Y, LI K, HE J. A “turn-on” fluorescent chemosensor for the detection of Zn(Ⅱ) in aqueous solution at neutral pH and its application in live cells imaging [J]. Talanta, 2016, 153: 381-385.
[16] LIU T, LIU S. Responsive polymers-based dual fluorescent chemosensors for Zn2+ions and temperatures working in purely aqueous media [J]. Analytical Chemistry, 2011, 83(7): 2775-2785.
[17] LIN W, BUCCELLA D, LIPPARD S J. Visualization of peroxynitrite-induced changes of labile Zn2+in the endoplasmic reticulum with benzoresorufin-based fluorescent probes [J]. Journal of the American Chemical Society, 2013, 135(36): 13512-13520.
[18] CHYAN W, ZHANG D Y, LIPPARD S J, et al. Reaction-based fluorescent sensor for investigating mobile Zn2+in mitochondria of healthy versus cancerous prostate cells [J]. Proceedings of the National Academy of Sciences, 2014, 111(1): 143-148.
[19] GUPTA V K, MERGU N, SINGH A K. Fluorescent chemosensors for Zn2+ions based on flavonol derivatives [J]. Sensors and Actuators B: Chemical, 2014, 202(10): 674-682.
[20] LIU H M, VENKATESAN P, WU S P. A sensitive and selective fluorescent sensor for zinc(Ⅱ) and its application to living cell imaging [J]. Sensors and Actuators B: Chemical, 2014, 203(1): 719-725.
[21] MAO Z, HU L, DONG X, et al. Highly sensitive quinoline-based two-photon fluorescent probe for monitoring intracellular free zinc ions [J]. Analytical Chemistry, 2014, 86(13): 6548-6554.
[22] XU Z, BAEK K H, KIM H N, et al. Zn2+-triggered amide tautomerization produces a highly Zn2+-selective, cell-permeable, and ratiometric fluorescent sensor [J]. Journal of the American Chemical Society, 2010, 132(2): 601-610.
[23] SUN F, ZHANG G, ZHANG D, et al. Aqueous fluorescence turn-on sensor for Zn2+with a tetraphenylethylene compound [J]. Organic Letters, 2011, 13(24): 6378-6381.
[24] INGALE S A, SEELA F. A ratiometric fluorescent on-off Zn2+chemosensor based on a tripropargylamine pyrene azide click adduct [J]. The Journal of Organic Chemistry, 2012, 77(20): 9352-9356.
[25] LIN W, BUCCELLA D, LIPPARD S J. Visualization of peroxynitrite-induced changes of labile Zn2+in the endoplasmic reticulum with benzoresorufin-based fluorescent probes [J]. Journal of the American Chemical Society, 2013, 135(36): 13512-13520.
[26] SYU J H, CHENG Y K, HONG W Y, et al. Electrospun fibers as a solid-state real-time zinc ion sensor with high sensitivity and cell medium compatibility [J]. Advanced Functional Materials, 2013, 23(12): 1566-1574.
[责任编辑:刘红玲]
A fluorescence probe based on a schiff base structure for the detection of zinc ion with good selectivity
LI Yuanyuan1,2*, HOU Buwei3, LI Kai4
(1.SchoolofChemistry,ChemicalandEnvironmentalEngineering,HenanUniversityofTechnology,Zhengzhou450001,Henan,China; 2.SchoolofChemicalEngineeringandEnergy,ZhengzhouUniversity,Zhengzhou450001,Henan,China; 3.ZhengzhouForeignLanguageSchool,Zhengzhou450001,Henan,China; 4.CollegeofChemistryandMolecularEngineering,ZhengzhouUniversity,Zhengzhou450001,Henan,China)
N,N-Diethylaminosalicylaldehyde-2-pyridinehydrazone (1) was designed and synthesized as a fluorescence probe for the detection of Zn(Ⅱ). In water/EtOH (Vwater/VEtOH=50%, pH = 7.0), 1 showed a fluorescence “turn-on” response to Zn(Ⅱ). Higher content of EtOH was beneficial for the amplification of fluorescence signal. A fluorescence enhancement of 100-fold could be obtained in absolute EtOH. 1 exhibited good selectivity to Zn(Ⅱ) over other metal ions (especially for Cd(Ⅱ), which was a typical interfering ion for Zn(Ⅱ) detection). The linear range for the detection of Zn(Ⅱ) was 0.1-1.0 μmol/L and the detection limit was calculated as 35 nmol/L. 1 was successfully used in the detection of Zn(Ⅱ) in real water samples.
zinc ion; fluorescence “turn-on”; probe; Schiff base
2016-11-16.
国家自然科学基金(51502079, 21501150),郑州大学优秀青年教师发展基金(1521316005).
李媛媛(1986-), 女, 讲师, 研究方向为小分子荧光探针.
*通讯联系人, E-mail:yuanyuanli@haut.edu.cn.
O614.24+1
A
1008-1011(2017)02-0177-08

