淀粉衍生物微球的制备及其表征
张常虎
(西安文理学院 化学工程学院,陕西 西安 710065)
淀粉衍生物微球的制备及其表征
张常虎*
(西安文理学院 化学工程学院,陕西 西安 710065)
以可溶性淀粉为原料,环氧氯丙烷(ECH) 与N,N-亚甲基双丙烯酰胺分别为交联剂(MBAA),Span 60和Tween 60为乳化剂,环己烷和三氯甲烷混合液为油相,硝酸铈铵为引发剂,反相乳液聚合法合成淀粉衍生物微球. 通过红外光谱判定主要官能团的变化,借用图片直观淀粉衍生物微球的形貌,判断其控制聚合变量各种因素对合成微球形貌的影响,找到最佳合成条件为可溶性淀粉浓度5%,交联剂用量3 g,引发剂硝酸铈铵用量 0.15 g,水油相体积比 2∶5,聚合温度65 ℃,聚合时间2 h. 使得聚合衍生微球在形体类似球型,体内多孔多面,为进一步探讨吸附作用完成前期工作.
淀粉;反相乳液聚合;表征
目前,淀粉衍生物微球的制备方法[1-3]有物理法、化学法、酶解法和反相乳液聚合,逆向悬浮聚合法[4],在几种方法中最精典的是反相乳液聚合. 反相乳液聚合作为一种新的高分子材料合成技术,具有聚合速度快,产物固形物含量高、相对分子质量大且分布窄、反应条件温和等特点[5-6], 在水处理、食品工业及医学[7]等领域有着广阔的应用前景. 近年来,将逆向悬浮聚合法,反相乳液聚合技术用于淀粉微球合成的研究正在被广泛关注[8],原因在于相乳液体系的稳定直接影响着聚合微球的粒径大小、粒径分布等质量指标,就目前研究的重点集中于淀粉微球的合成机理和反应动力学上,而对含淀粉反相乳液体系稳定性的研究报道较少.
本实验采用反相乳液聚合淀粉衍生物微球,考察其单因素条件,对影响淀粉微球的反相乳液聚合的规律,建立稳定性良好的反相乳液体系. 以此为基础,以可溶性淀粉为原料,环氧氯丙烷或者MBAA(N,N-亚甲基双丙烯酰胺)为交联剂,合成交联淀粉微球,优化微球合成工艺.
1 实验部分
1.1 实验试剂和仪器
可溶性淀粉,分析纯,天津市天力化学试剂有限公司;三氯甲烷,分析纯;环己烷,分析纯,天津市红岩化学试剂厂;乙酸乙酯,分析纯,天津市致远化学试剂有限公司;丙酮,分析纯,洛阳昊华化学试剂有限公司; Tween 60,化学纯,天津市东区天大化学试剂厂;Span 60,分析纯,上海山潽化工有限公司;环氧氯丙烷,分析纯,国药集团化学试剂有限公司.
DF-101S 集热式恒温加热磁力搅拌器; Nicoiet IS 50 FT-IR傅立叶红外光谱仪;DHB-9023A电热恒温鼓风干燥箱;尼康 D810 数码照相机.
1.2 淀粉微球的制备
油相制备:取V三氯甲烷∶V环己烷= 1∶4的混合液150 mL,置入250 mL三颈烧瓶中作为油相,按照乳化剂mSpan60∶mTween60=3∶2加入适量,水浴55 ℃加热,搅拌使乳化剂完全溶解.
水相:称取2.5 g可溶性淀粉,加水,配制成不同浓度5%或10%的淀粉溶液,考虑其在弱碱性条件下利于溶解,用NaOH溶液调节pH至8~9,加热80 ℃,糊化50 min后,冷却至40 ℃,加入MBAA或环氧氯丙烷溶液,待用.
聚合:将上述的水相用逐滴加入油相中,控制搅拌速度为250 r·min-1,控制不同的油水相比例,15 min后加入引发剂硝酸铈铵, 1.5 h后停止搅拌,静置,除去上层油相,离心,对聚合物依次用乙酸乙酯、丙酮、无水乙醇洗涤3次,再在鼓风恒温干燥箱50 ℃烘 24 h,得白色至微黄色微球.
1.3 红外表征
将可溶性淀粉,丙烯酰胺及淀粉衍生物样品先干燥再经KBr压片(mKBr∶m样品=98∶2)进行红外吸收测量,记录500~4 000 cm-1的红外光谱,比较分析样品和原样的波峰变化.
1.4 照片拍摄
将样品烘干,摊平在黑色的样板上进行拍照,最后所用照片大约都在1 000倍左右,然后比较分析微球的形貌.
2 结果分析与讨论
2.1 FT-IR分析
由图1A所示,b 图氨基的对称和反对称出现在3 100~3 400 cm-1,a 图在同样出处有单峰是NH的伸缩振动,说明丙烯酰胺的氨基发生了断键连接[9];b图1 920 cm-1处羰基的伸缩振动,a图较b图透过率高,吸收强度增加,诱导效应增强. 两图在1 610 cm-1处都有吸收峰,a图较b图强,是C=C双键的吸收峰向低波数移动,说明发生共轭,形成C=C-C=C基团[10];2 500~2 200 cm-1峰宽且强,是-OH的多聚体表现,所以可以看出淀粉衍生物合成的过程中与丙烯酰胺发生了替代和多聚.
由图1B所示,两条谱线在3 500~3 200 cm-1处都出现宽而强的-OH吸收峰,说明在交联前后官能团-OH都存在,但淀粉微球的吸收峰比可溶性淀粉的吸收峰宽,2 090 cm-1附近是C-H的吸收峰,微球随着碳链的增长波谱会向高波移动. b图与a图在1 820~2 330 cm-1处吸收峰差异比较大,说明部分氢键已被取代[10];淀粉微球在1 650~1 300 cm-1处振动光谱峰形发生了变化,峰强度减少,可判定淀粉衍生物微球合成过程中淀粉发生了交联反应[6].
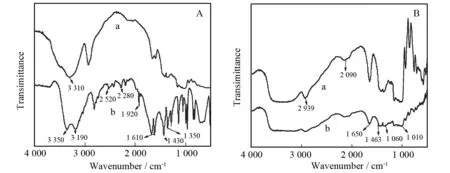
A-b丙烯酰胺图谱; B-b可溶性淀粉图谱.图1 FT-IR, A-a和B-a淀粉衍生物微球图谱Fig.1 FT-IR. A-a and B-a starch derivative microsphere graphs
2.2 油水比对微球形貌的影响
图2A大小不规则,呈块状;图2B淀粉微球较小,呈片状;图C 颗粒大小均匀,成圆球状. 油水比例主要影响淀粉微球的形状,油相过大,粘性相对增大,合成的微球颗粒不能有效分散,在相同的交联剂情况下,有效碰撞次数减少,从而导致微球不能很好地交联;油水比过小时,不能有效的形成油包水的环境,这样就不能把水相分开,而引发剂和交联剂相对较多的形成不规则且成块状的微球.

A-2∶1; B-5∶1; C-5∶2.图2 油水比不同的淀粉衍生物微球形貌Fig.2 Morphology of starch derivative microsphere on the phase volume ratio of oil and water
2.3 淀粉浓度对微球形貌的影响
图3A图的淀粉浓度是5%,B图是10%,B图的颗粒比A图大,有些呈块状. 淀粉的浓度过高时,淀粉分子在水相中不能及时的伸展分散,粘稠度增加,增加了单体和自由基的扩散阻力,再加上引发剂在加入的极短时间挥发,快速反应,一般情况下本来就容易呈块状. 淀粉的浓度太低,在水相中可能分散较好,即使引发剂分散不均匀,反应速度快,但是淀粉之间不能很好地交联而得到大小不均匀,有些甚至粉末状的微球. 因此,应该选择5%左右的淀粉浓度.

图3 不同淀粉浓度的衍生物微球形貌Fig.3 Morphology of starch derivatives microspheres on different starch concentration
2.4 交联剂对微球形貌的影响
图4A图有个别微球,大部分成粉末状; B图颗粒较小但均匀,成扁平状较多;C图微球分布大小均匀,成球状;D图微球较大,大小不一,球形不规则. 交联剂影响微球形貌结构,用量过大或过小都会导致反应体系出现凝聚甚至无法成球,用量过大,反应活性强,反应体系不稳定易形成结块;用量过小,淀粉不能很好地进行交联,成粉末. 4张图中B,C图合成的微球都可以,但从坚固性和球形状态来看C图比B图好些,所以选用交联剂3 g左右最合适.

A-1 g;C-2 g;B-3 g; D-4 g.图4 不同交联剂用量下淀粉衍生物微球的形貌Fig.4 Morphology of starch derivative microspheres at different dosages of cross-linking agent
2.5 引发剂对微球形貌的影响
图5A图微球大小不均匀;B图微球大小不均匀,有些成块状,表面粗糙成多孔;C 图微球大小均匀,颗粒较小;D图微球呈块状,颗粒较大比B图坚固. 引发剂用量增多,自由基生成的速率增加,淀粉生成的自由基占据主导位置,体系的活性位点增多,促进了交联反应不断的进行. 但引发剂的用量不断增加,引发剂交联剂相互碰撞的几率也增加,从而导致交联程度降低[11].

A-0.1 g; B-0.2 g; C-0.15 g; D-0.3 g.图5 不同引发剂浓度下淀粉衍生物微球的形貌Fig.5 Morphology of starch derivative microspheres at the different concentration of initiator
2.6 交联单体对微球形貌的影响
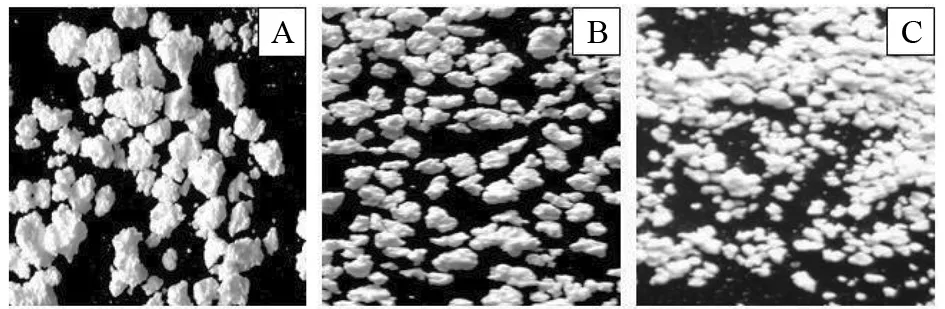
A-淀粉;B-丙烯酰胺;C-丙烯酸.图6 不同单体衍生物微球的形貌Fig.6 Morphology of starch derivatitves microspheres on the different monomer
图6A淀粉微球表面粗糙多孔,易结块;B图微球大小均匀,颗粒成球状,较坚固;C图微球大小不一,有些结块,表面较A光滑,整体要比A图好. 淀粉变性后之间的交联就如简单的淀粉嫁接堆砌,加上烯烃类单体,有利于支链的链接. 所以淀粉衍生物微球的制备过程中应加少量的烯烃类物质.
3 结论
以可溶性淀粉为原材料,两种交联剂,硝酸铈铵为引发剂进行反相乳液聚合制备淀粉衍生物微球的条件优化,合成的产物大体成球状,大小不均匀. 经过试验探究发现最佳合成方案:5%的可溶性淀粉,油水比5∶2,交联剂3 mL,引发剂0.15 g,再加少量的丙烯酰胺或丙烯酸效果更佳,为下一步研究吸附材料奠定坚实的基础.
[1] 苏秀霞, 张春兰, 李运涛. 玉米淀粉微球的制备与应用研究[J]. 陕西师范大学学报(自然科学版), 2006, 34(4): 61-64.
SU X X, ZHANG C L, LI Y T. Study on the preparation and application of corn starch micro-sphere [J]. Journal of Shaanxi Normal University (Natural Science Edition), 2006, 34(4): 61-64.
[2] 尚小琴, 童张法, 龚福忠, 等. 含固相淀粉的反相乳液体系稳定性研究[J]. 高分子材料科学与工程, 2007, 23(3): 70-73.
SHANG X Q, TONG Z F, GONG F Z, et al. The stability of inverse emulsion including starch granule [J]. Polymer Materials Science and Engineering, 2007, 23(3): 70-73.
[3] 邱莉, 朱春山, 袁艳丽. 以煤油为油相的淀粉微球的制备[J]. 河南工业大学学报(自然科学版), 2012, 33(2): 52-56.
QIU L, ZHU C S, YUAN Y L. Preparation of starch microspheres by using kerosene as oil phase [J]. Journal of Henan University of Technology(Natural Science Edition), 2012, 33(2): 52-56.
[4] 乔支卫, 汤建萍, 丁立稳. 交联木薯淀粉微球的合成与表征[J]. 化学研究, 2011, 22(4): 60-65.
QIAO Z W, TANG J P, DING L W. Synthesis and characterization of crosslinked cassava starch microspheres [J]. Chemical Research, 2011, 22(4): 60-65.
[5] 王雪毓, 何小维, 黄强, 等. 淀粉微球的研究与开发进展[J]. 食品研究与开发, 2009, 30(7): 155-158.
WANG X Y, HE X W, HUANG Q, et al. Study and development of starch microsphere [J]. Food Research and Development, 2009, 30(7): 155-158.
[6] 孙庆元,于英梅, 倪长军. 反相微乳法合成淀粉微球的研究[J]. 大连轻工业学院学报, 2007, 26(1): 5-8.
SUN Q Y, YU Y M, NI C J, et al. Preparing starch microspheres in inverse microemulsion [J]. Journal of Dalian Institute of Light Industry, 2007, 26(1): 5-8.
[7] 王楠楠, 柴云, 董发才. 磁性壳聚糖微球的制备和应用[J]. 化学研究, 2016, 27(3): 395-402.
WAN W W, CHAI Y, DONG F C. Review of preparation and application of magnetic chitosen microspheres [J]. Chemical Research, 2016, 27(3): 395-402.
[8] 朱旻鹏, 王俊伟, 张博. 含淀粉反相乳液及交联淀粉微球制备[J]. 安徽农业科学, 2011, 39(3): 1518-1520.
ZHU M P, WANG J W, ZHANG B. Preparation of inverse emulsion containing starch and cross-linked starch microspheres [J]. Journal of Anhui Agriculture Science, 2011, 39(3): 1518-1520.
[9] 郑怀礼, 张鹏, 朱国成. 红外光谱法测定PDA中残留丙烯酰胺含量[J]. 光谱学与光谱分析, 2011, 11(11): 44-47.
ZHENG H L, ZHANG P, ZHU G C. Determination of acrylamide in PDA with near infrared refiectance spectroscopy [J]. Spectroscopy and Spectral Analysis, 2011, 11(11): 44-47.
[10] 陈和生, 邵景昌. 丙烯酰胺的红外光谱分析[J].分析仪器, 2011, 3(11): 36-40.
CHEN H S, SHAO J C. Analysis of polyaeryamide by infrared spectroscopy [J]. Analytical Instrument, 2011, 3(11): 36-40.
[11] 李光辉, 张贵才, 葛际江, 等. 单分散聚合物微球的合成方法进展[J]. 材料工程, 2014, 8(8): 97-104.
LI G H, ZHANG G C, GE J J, et al. Progress of synthesis method for monodisperse polymer microsphere[J]. Journal of Materials Engineering, 2014, 8(8): 97-104.
[责任编辑:刘红玲]
Preparation and characterization of starch derivatives microspheres
ZHANG Changhu*
(CollegeofChemicalEngineering,Xi’anUniversity,Xi’an710065,Shaanxi,China)
Starch derivatives microspheres were prepared by the inverse emulsion polymerization, and with soluble starch as the raw material, epichlorohydrin as the crosslinking agent, span60 and tween60 as the emulsifier, cyclohexane and chloroform as the oil phase, amonium cerium nitrate as the initiotor. The main function groups of derivatives microsphere were observed through the FT-IR.Taking some pictures to know the starch microsphere morphology and controlling variable fators to study the influence of polymerizing starch microspheres. Finally, the found optimum polymerization conditions were as follows: 5% of soluble starch solution, 3 g of crosslking agent, 0.15 g of Ce(NH4)2(NO3)6, 2∶5 of the water-oil phase volume ratio, polymerization temperature at 55 ℃and polymerization time for 1.5 h. So we had gained similar spherical microspheres in vivo, porous face, and accomplished the adsorption sectional work for the further study.
starch; inverse emulsion polymerization; characterization
2016-11-18.
西安市科技计划项目(CXY1531WL32), 陕西省教育厅项目(15JK2154).
张常虎(1979-),男,实验师,研究方向为高分子材料化学,*
,E-mail:zhangchanghu12@163.com.
O363.1
A
1008-1011(2017)02-0254-04

