响应面法优化麦麸酯酶提取工艺
叶 麟,杨 雪,2,张志清,申光辉,黎杉珊,吴贺君,高 玮,陈思莹
(1.四川农业大学食品学院,四川雅安 625014; 2.攀枝花市食品药品检验所,四川攀枝花 617000)
响应面法优化麦麸酯酶提取工艺
叶 麟1,杨 雪1,2,张志清1,申光辉1,黎杉珊1,吴贺君1,高 玮1,陈思莹1
(1.四川农业大学食品学院,四川雅安 625014; 2.攀枝花市食品药品检验所,四川攀枝花 617000)
为提高小麦加工副产物麦麸的利用率,从中提取植物酯酶,并优化麦麸酯酶的提取工艺,本研究以NaNO3-磷酸缓冲液为溶剂对麦麸酯酶进行水浴静置提取,在单因素试验的基础上,利用Box-Behnken试验,进一步研究了NaNO3浓度、提取时间、提取温度3个因素的交互作用对麦麸酯酶活力的影响。最终确定麦麸酯酶的最佳提取工艺为NaNO3浓度0.15 moL·L-1、提取温度35 ℃、提取时间60 min,此条件下单位酶活的预测值为23 338 U·mL-1,验证值为23 018.7 U·mL-1,达到预测值的98.63%。综上所述,此优化条件能够较好地从麦麸中提取植物酯酶,并保持较高的酶活性。
麦麸;植物酯酶;提取工艺;响应面优化
我国是小麦生产大国,年产量已超过1亿t,年产麸皮可达2 000万t以上[1-2]。利用麦麸提取的植物酯酶(plant esterase,PE)可用于有机磷和氨基甲酸酯类农药的快速检测[3-4],因具有和胆碱酯酶相似的检测限而被越来越多的学者关注[5-7]。PE属于羧酸酯水解酶类,广泛存在于小麦、玉米等谷物中[8-9]。陈士恩等[10-11]、江媛媛等[12]分别采用蒸馏水、磷酸缓冲液振荡提取法从小麦、大豆等植物中提取了PE。吴 定等[13]的研究结果表明,从小麦粉中提取酯酶较动物提取酯酶方法简便、成本低。王振宁等[14]研究了盐溶液提取对植物酯酶的影响,确定NaCl盐溶液的提取效果最佳。本研究以小麦加工副产物麦麸为原料,采用单因素试验确定各因素对麦麸PE提取效果的影响,通过响应面法优化提取工艺,以期为深入研究麦麸酯酶的酶学性质提供技术参考,为小麦副产物麦麸的深加工利用提供科学依据。
1 材料与方法
1.1 试验材料
麦麸为雅安市售,粉碎后过80目筛,以100目筛上物为试验材料。
1.2 测定项目与方法
1.2.1 麦麸酯酶的提取
取5 g供试麦麸,加入25 mL 0.2 mol·L-1PBS(磷酸氢钠)缓冲液,搅拌均匀后于35 ℃水浴静置60 min,纱布粗过滤,4 ℃、8 000 r·min-1冷冻离心5 min,取上清液即得粗酶液,测定酶活时需先稀释。
1.2.2 α-萘酚标准曲线的绘制
取0.25 mL不同浓度α-萘酚标准溶液至4.5 mL pH 7.2的PBS缓冲液中,40 ℃恒温水浴5 min;加入0.25 mL 0.03%固兰B盐、0.25 mL 4.25%SDS溶液,混匀;加入0.25 mL1∶1盐酸溶液;599 nm处读取OD值。未加α-萘酚标准溶液作空白。以α-萘酚浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.2.3 酶活力测定
参照王振宁等[14]方法并稍作修改。将粗酶液用去离子水稀释5倍后,取0.25 mL稀释液至4.25 mL pH 7.2的PBS缓冲液中,其余测定步骤同1.2.2,未加麦麸酯酶溶液作空白。
酶活力=[(C1-C2)×N×V1]/(5×V2)
式中,C1为样品的α-萘酚浓度(μmol·mL-1) ;C2为空白对照的α-萘酚浓度(μmol·mL-1);V1为反应液总体积(mL);V2为样品反应时所吸稀释液的体积(mL);N为酶液稀释倍数;5为测定反应时间(min)。
1.2.4 影响麦麸酯酶活性的主要因素选择试验
(1)提取方式的选择:蒸馏水为提取剂、料液比1∶5、提取温度为35 ℃、提取时间60 min条件下,分别采用水浴静置、气浴震摇以及超声破碎3种方式提取酯酶,通过测定酶活确定最优提取方式。
(2)pH值缓冲液的选择:分别以pH为5.5、6.0、6.5、7.0、7.5的PBS(0.2 mol·L-1)缓冲液和蒸馏水为提取剂,料液比1∶5、35 ℃最优方式提取60 min,通过测定酶活确定最优pH值缓冲液。
(3)盐类型的选择:以上述最优pH值缓冲液配制0.15 mol·L-1NaCl、Na2SO4、NaNO3、KCl 4种中性盐溶液,以最优pH值缓冲液为提取液,料液比为1∶5、35 ℃最优方式下提取60 min后,通过测定酶活确定最优盐类型。
(4)盐溶液浓度的选择:以选择出的最优pH值缓冲液分别配置0.025、0.05、0.1、0.15和0.2 mol·L-1浓度的上述最优盐溶液为提取液,料液比1∶5,35 ℃最优方式提取60 min,通过测定酶活确定最优提取液浓度。
(5)提取温度的选择:在以上最优条件下,料液比1∶5,分别在25、30、35、40和45 ℃最优方式提取60 min,通过测定酶活确定最优提取温度。
(6)提取时间的选择:在以上最优条件下,料液比1∶5,提取40、60、80、100和120 min,通过测定酶活确定最优提取时间。
(7)料液比的选择:在以上最优条件下,分别以料液比(m/v)为1∶3、1∶4、1∶5、1∶6、1∶7、1∶8提取麦麸酯酶,通过测定酶活确定最优料液比。
1.2.5 响应面试验设计
根据单因素试验结果,运用Box-Behnken的中心组合设计原理,利用Design-Expert 10软件,以X1、X2、X3……为试验因子,以麦麸酯酶活性为响应值,设计3因素3水平的响应面试验,进行二次多项回归方程拟合及其优化分析。
1.3 数据处理
采用Excel 2013对数据进行整理与作图;采用SPSS 22对数据进行显著性分析;采用Design Expert 10对响应面试验数据进行统计分析。
2 结果与分析
2.1 α-萘酚标准曲线的确定
通过对不同浓度的α-萘酚吸光值的测定,得到α-萘酚浓度(X)与吸光值Y之间的线性回归方程为Y=834.57X-0.127 2,R2为0.999 5,说明线性关系较好。
2.2 单因素试验结果分析
2.2.1 提取方式对单位酶活的影响
由图1可知,水浴静置提取出来的酯酶活性最大(20 038.66 U·mL-1),显著高于气浴振摇和超声波破碎方式。气浴振摇(12 824.57 U·mL-1)和超声波破碎(11 181.41 U·mL-1)提取的酯酶活性无显著差异。可能是由于振摇过程中,细胞与细胞之间的摩擦、碰撞等机械力过大[6],破坏了细胞中活性物质的空间结构,导致酶活偏低;而超声提取可能由于空化效应中,空化泡破裂时产生瞬时高温(5 000℃)、高压(500×104Pa),导致多聚物降解、酶失活、脂质过氧化和细胞杀伤等[15-16]。故选用水浴静置方式提取麦麸酯酶。

图柱上不同字母表示处理间差异显著(P<0.05)。下同。
Different small letters above column mean significant differerce among treatments at 0.05 level. The same below.
图1 不同提取方式对麦麸酯酶活性的影响
Fig.1 Effect of different extraction methods on wheat bran esterase activity
2.2.2 pH值磷酸缓冲液对单位酶活的影响
由图2可知,pH 6.5的PBS缓冲液提取效果最好(23 301.92 U·mL-1),且显著高于蒸馏水(P<0.05)。而pH 7.5的缓冲液提取效果最差(19 468.61 U·mL-1),可能pH 太大对酶的构象稳定性有较大影响,引起了酶蛋白的聚集、变形等,造成酶活降低[17]。

图2 不同pH值缓冲液对麦麸酯酶活性的影响
2.2.3 盐类型对麦麸酯酶单位酶活的影响
由图3可知,NaNO3缓冲液提取的酶活性最大(21 138.13 U·mL-1),NaCl次之(20 204.52 U·mL-1),均显著高于pH 6.5缓冲液提取的效果(18 996.31 U·mL-1)。说明加入NaNO3盐有利于提高麦麸酯酶的活性。这是因为在提取液中加入少量的NaNO3,可增加蛋白质分子表面的电荷,增强蛋白质分子与水分子的作用,从而使蛋白质在水溶液中的溶解度增大[18-19]。
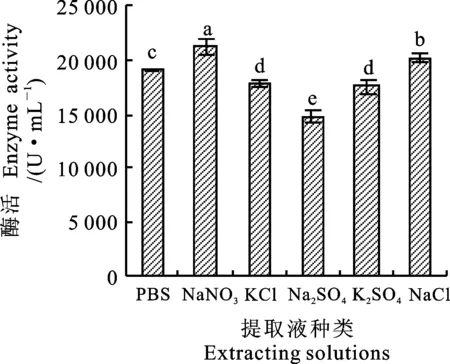
图3 不同提取液对麦麸酯酶活性的影响
2.2.4 盐溶液浓度对麦麸酯酶单位酶活的影响
由图4可知,在本试验NaNO3浓度下,酶活先升高后降低,浓度为0.15 mol·L-1时酶活达到最高(21 665.35 U·mL-1),且显著高于其他浓度(P<0.05)。说明低浓度的NaNO3可使酶的溶解度增加,而过高的NaNO3浓度使麦麸酯酶处于高渗透压的环境中,破坏了蛋白质在水中存在的两个稳定因素(水化层和电荷),进而发生盐析作用,使蛋白质沉淀,导致酶活降低[20]。
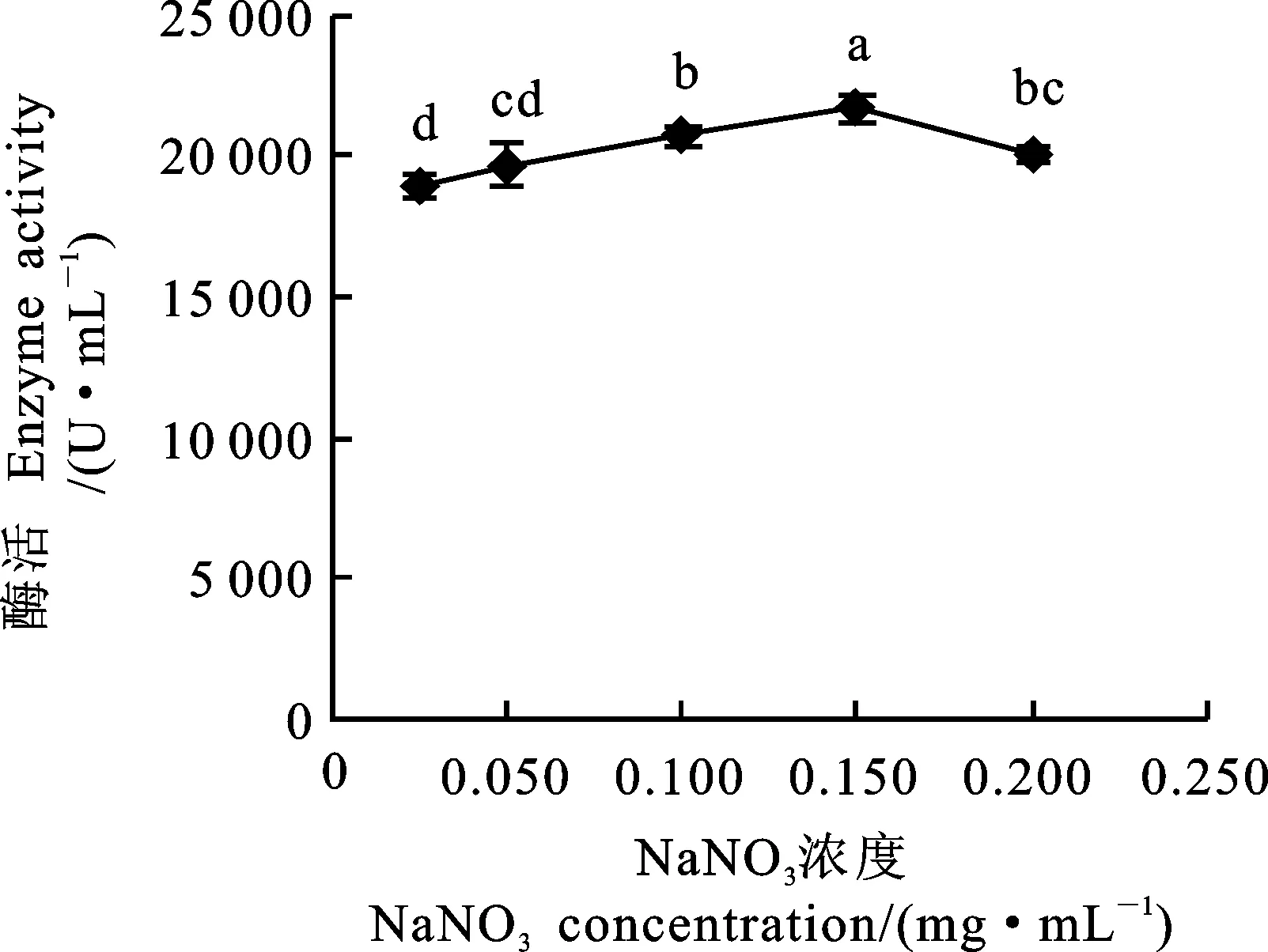
图4 不同NaNO3浓度对麦麸酯酶活性的影响
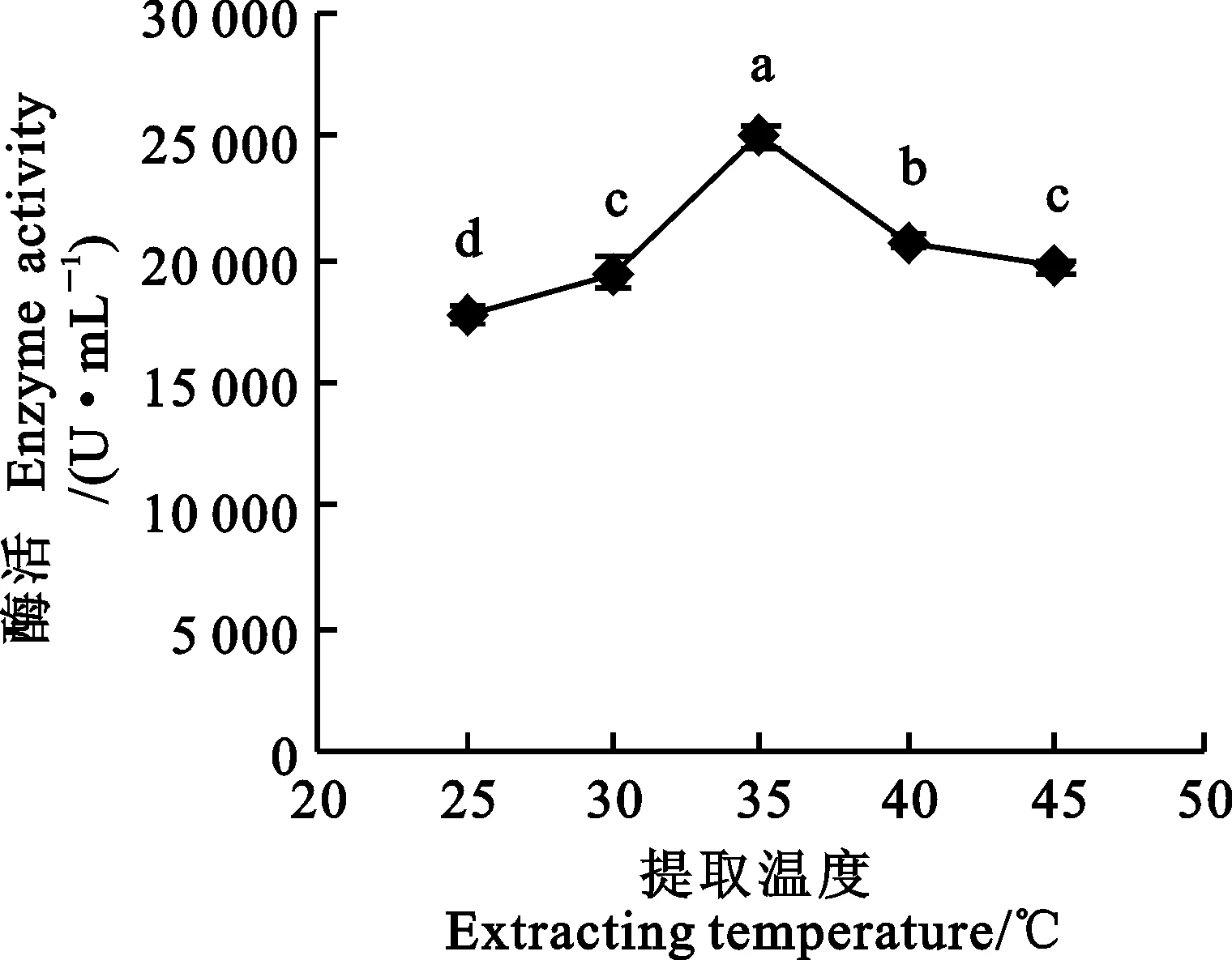
图5 不同提取温度对麦麸酯酶活性的影响
2.2.5 提取温度对麦麸酯酶单位酶活的影响
由图5可知,随着提取温度的升高,酶活先增后减,35 ℃时酶活达到最大值(24 960.46 U·mL-1) ,且显著高于其他温度的酶活。温度过高,蛋白质结构容易发生改变或变性,使酶活降低;另外,温度还可以影响氨基酸侧链的离子化,通过影响pH值而影响某个活性基团或整个反应体系,从而改变酶活性[21]。
2.2.6 提取时间对麦麸酯酶单位酶活的影响
由图6可知,提取时间40~60 min时,酶活随时间延长逐渐上升至最大(22 390.27 U·mL-1) 且显著高于其他处理;60 min以后酶活逐渐下降,80~120 min时,酶活趋于稳定。由于酶蛋白在溶液状态下构象不稳定,提取时间过长,麦麸中的其他成分物质易发生氧化[22-23]、降解[24-25]等反应,导致蛋白质空间结构发生变化,从而使酶活降低。因此选择提取时间为60 min。

图6 不同提取时间对麦麸酯酶活性的影响

图7 不同料液比对麦麸酯酶活性的影响
2.2.7 料液比对麦麸酯酶单位酶活的影响
由图7可知,随着料液比的不断增大,麦麸酯酶的单位酶活不断下降;而酯酶的总酶活逐渐上升,当料液比达到1∶7之后,总酶活趋于稳定。料液比过低造成麦麸酯酶提取率偏低,过大的料液比则会不利于后续分离纯化,费时、费力且不经济。综合考虑,选取料液比1∶5为最佳。在后续试验中以单位酶活力作为考察指标。
2.3 响应面法优化试验
2.3.1 因素与水平的选择
根据单因素试验结果,选择连续变量中对酶活影响显著的NaNO3浓度(X1),提取时间(X2),提取温度(X3)作为影响因子,以酶活为响应值,设计3因素3水平的响应面试验,因素编码及水平见表1。
2.3.2 回归模型的建立与检验
响应面设计方案及结果见表2,每个试验做3组平行,取其平均值。采用Design Expert 10软件对表2中的数据进行多元回归拟合,得到麦麸酯酶活性对NaNO3浓度(X1)、提取时间(X2)、提取温度(X3)的二元多项式回归模型为:

表1 响应面分析因素水平表
Table 1 Factors tested in response surface analysis

水平Level因素 FactorNaNO3浓度(X1)NaNO3concentration/(mol·L-1)提取时间(X2)Extractiontime/min提取温度(X3)Extractiontemperature/℃-10.10403000.15603510.208040
表2 响应面试验设计与结果
Table 2 Box-Behnken design and results of response surface analysis

试验号TestnumberX1:NaNO3浓度NaNO3concentration/(mol·L-1)X2:提取时间Extractiontime/minX3:提取温度Extractiontemperature/℃单位酶活Unitenzymeactivity/(U·mL-1)10.10403520285.120.20803520141.830.20603020231.340.20604019547.150.10603020252.360.15603523432.770.10803519995.680.15603523215.390.10604020281.2100.15804020120.9110.20403519892.8120.15803020122.4130.15403020336.1140.15603523237.7150.15603523321.2160.15603523462.1170.15404020114.7
表3 回归方程方差分析及回归系数显著性分析
Table 3 Analysis of variance for the established regression model
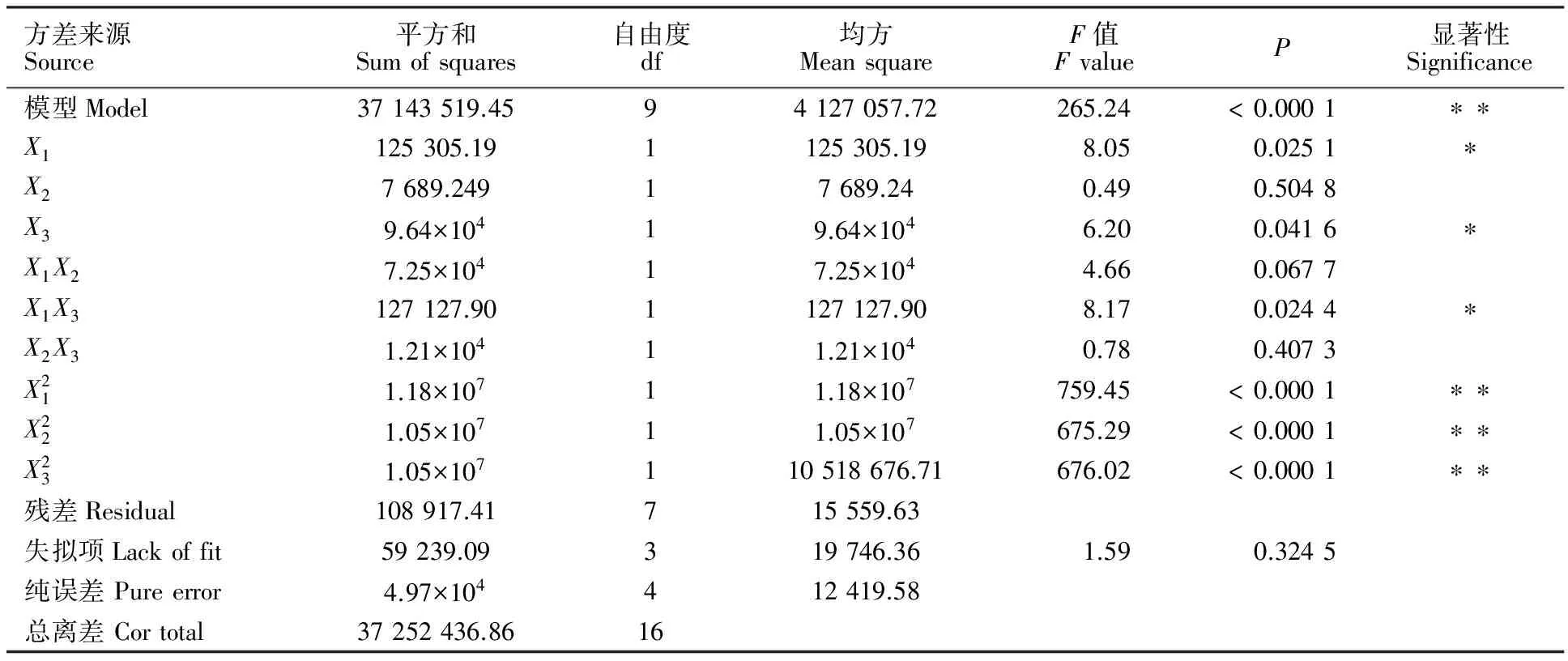
方差来源Source平方和Sumofsquares自由度df均方MeansquareF值FvalueP显著性Significance模型Model37143519.4594127057.72265.24<0.0001∗∗X1125305.191125305.198.050.0251∗X27689.24917689.240.490.5048X39.64×10419.64×1046.200.0416∗X1X27.25×10417.25×1044.660.0677X1X3127127.901127127.908.170.0244∗X2X31.21×10411.21×1040.780.4073X211.18×10711.18×107759.45<0.0001∗∗X221.05×10711.05×107675.29<0.0001∗∗X231.05×107110518676.71676.02<0.0001∗∗残差Residual108917.41715559.63失拟项Lackoffit59239.09319746.361.590.3245纯误差Pureerror4.97×104412419.58总离差Cortotal37252436.8616
**:P<0.01;*:P<0.05.
2.3.3 麦麸酯酶提取工艺条件的确定及验证
根据Box-Behnken试验所得的结果和二次多项回归方程,利用Design-Eepert 10软件获得了酯酶提取的最佳工艺条件为:NaNO3浓度0.15 mol·L-1、提取温度34.84 ℃、提取时间59.77 min,此条件下酶活的预测值为23 338.0 U·mL-1。为了检验模型预测的准确性,考虑到实际操作的可行性,实际提取工艺条件修订为:NaNO3浓度0.15 mol·L-1、提取温度35 ℃、提取时间60 min。在以上优化条件下进行验证试验,所得酶活平均值为23 018.7 U·mL-1,与预测值较为接近。

图8 NaNO3浓度与提取温度交互作用对麦麸酯酶活性影响的响应面(A)及等高线(B)图
3 讨 论
目前,对植物酯酶的提取原料主要集中于植物种子,如小麦、大豆、玉米、豇豆等[12,26-28],对于这些原料加工副产物的植物酯酶利用则少见报道。李绍中等[25]得出小麦中植物酯酶的最佳提取工艺为以含0.1 mol·L-1NaCl水溶液为提取剂(1∶5)搅拌提取。温艳霞等[29]对比了振荡与搅拌对小麦酯酶的提取效果,发现两个方式提取的酯酶活性无显著差异。本研究结果表明,水浴静置提取效果显著高于振摇和超声波破碎提取,具体原因有待进一步研究。江媛媛[26]发现0.04 mol·L-1pH 7.0的缓冲溶液提取小麦中的植物酯酶效果显著高于蒸馏水。熊晓辉等[30]发现用0.15 mol·L-1NaCl水溶液提取小麦中的植物酯酶的效果显著高于蒸馏水。王振宇等[14]认为0.164 mol·L-1NaCl 水溶液提取小麦中的植物酯酶效果显著高于PBS缓冲液。本研究发现0.15 mol·L-1NaNO3pH 6.5缓冲液(0.2 mol·L-1的PBS)提取效果显著高于蒸馏水和PBS缓冲液,可能因为含少量中性盐的提取液能一定程度提高酶的溶解性,从而增加提取效率。
4 结 论
本研究在单因素试验的基础上,运用Box-Behnken响应面设计,建立了麦麸酯酶提取工艺参数的二次多项式数学模型,经检验该模型合理可靠。对麦麸酯酶酶活影响的主要因素依次为NaNO3浓度>提取温度>提取时间,NaNO3浓度与提取温度的交互作用对麦麸酯酶酶活影响显著。麦麸酯酶的最佳提取条件为NaNO3浓度0.15 mol·L-1、提取温度35 ℃、提取时间60 min。
[1] 王丽丽,陶海腾,徐同成,等.麦麸酚类化合物研究进展[J].中国食物与营养,2013,18(12):36.
WANG L L,TAO H T,XU T C,etal.Research on phenolic compounds of wheat bran [J].FoodandNutritioninChina,2013,18(12):36.
[2] 郑青焕,李晓萍,郭 超,等.21 份印度小麦高分子谷蛋白亚基,醇溶蛋白及品质分析[J].麦类作物学报,2016,36(1):62.
ZHENG Q H,LI X P,GUO C,etal.Identification of HMW-GS,gliadin and quality property of twenty-one indian wheats [J].JournalofTriticeaeCrops,2016,36(1):62.
[3] VIDAL J C,ESTEBAN S,GIL J,etal.A comparative study of immobilization methods of a tyrosinase enzyme on electrodes and their application to the detection of dichlorvos organophosphorus insecticide [J].Talanta,2006,68(3):791.
[4] YIN H,AI S,XU J,etal.Amperometric biosensor based on immobilized acetylcholinesterase on gold nanoparticles and silk fibroin modified platinum electrode for detection of methyl paraoxon,carbofuran and phoxim [J].JournalofElectroanalyticalChemistry,2009,637(1):21.
[5] 王亚飞,张金艳.农药残留检测用植物酯酶源的筛选[J].江苏农业科学,2011,39(4):375.
WANG Y F,ZHANG J Y.Screening of pesticide residue detection with botanical esterase [J].JiangsuAgriculturalSciences,2011,39(4):375.
[6] 温艳霞.植物酯酶的筛选纯化及其对农药敏感性的研究[D].西安:陕西师范大学,2006:58.
WEN Y X.Studies on screening and purification of phytoesterase and its sensitivities to pesticide residues [D].Xi'an:Shaanxi Normal University,2006:58.
[7] HOU C J,HE K,YANG L M,etal.Catalytic characteristics of plant-esterase from wheat flour [J].WorldJournalofMicrobiologyandBiotechnology,2012,28(2):541.
[8] BEAUGRAND J,CRNIER D,DEBEIRE P,etal.Arabinoxylan and hydroxycinnamate content of wheat bran in relation to endoxylanase susceptibility [J].JournalofCerealScience,2004,40(3):223.
[9] 曹 健,师俊玲.食品酶学[M].郑州:郑州大学出版社,2011:222.
CAO J,SHI J L.Food Enzymology [M].Zhengzhou:Zhengzhou University Press,2011:222.
[10] 陈士恩,罗振兴,霍生东,等.小麦酯酶分离纯化及酶促反应条件优化的研究[J].黑龙江畜牧兽医,2012(3):76.
CHEN S E,LUO Z X,HUO S D,etal.Study on isolation and purification of wheat esterase and enzymatic reaction conditions optimization [J].HeilongjiangAnimalScienceandVeterinaryMedicine,2012(3):76.
[11] 陈士恩,申晓蓉,罗振兴,等.植物酯酶分离纯化及酶促反应条件优化的研究[J].西北民族大学学报(自然科学版),2012,33(1):41.
CHEN S E,SHEN X R,LUO Z X,etal.Study on isolation and purification of plant esterase and enzymatic reaction conditions optimization [J].JournalofNorthwestMinoritiesUniversity(NaturalScienceEdition),2012,33(1):41.
[12] 江媛媛,刘 芳,陈庆川,等.农药检测用植物酯酶的筛选及提取正艺优化[J].食品与机械,2012,28(2):69.
JIANG Y Y,LIU F,CHEN Q C,etal.Selection of phyto esterases used in pesticide residues detection and extraction process optimization [J].FoodandMachinery,2012,28(2):69.
[13] 吴 定,鞠兴荣,刘长鹏,等.小麦粉中植物酯酶提取、纯化及应用研究[J].中国粮油学报,2007,22(2):8.
WU D,JU X R,LIU C P,etal.Extraction,purification and application of plant-esterase from wheat flour [J].JournaloftheChineseCerealsandOilsAssociation,2007,22(2):8.
[14] 王振宇,王 涛.小麦酯酶提取纯化工艺的研究[J].中国食品学报,2009,9(3):92.
WANG Z N,WANG T.Studies on the extraction and purification technology of wheat esterase [J].JournalofChineseInstituteofFoodScienceandTechnology,2009,9(3):92.
[15] 张 婵,郑爽英.超声空化效应及其应用[J].水资源与水工程学报,2009,20(1):136.
ZHANG C,ZHENG S Y.Effect of ultrasonic cavitation and its application [J].JournalofWaterResourcesandWaterEngineering,2009,20(1):136.
[16] 张 斌,许莉勇.超声萃取技术研究与应用进展[J].浙江工业大学学报,2008,36(5):558.
ZHANG B,XU L Y.Research and application advance of ultrasound extraction [J].JournalofZhejiangUniversityofTechnology,2008,36(5):558.
[17] JESIONOWSKI T,ZDARTA J,KRAJEWSKA B.Enzyme immobilization by adsorption:A review[J].Adsorption,2014,20(5-6):801.
[18] 周艳明,刘 丹,胡 睿,等.有机磷农残检测用植物酯酶的分离纯化及酶学性质的研究[J].食品科技,2008(3):53.
ZHOU Y M,LIU D,HU R,etal.Study on purification and characterization of plant-esterase for detecting the residues of organophosphate pesticides [J].FoodScienceandTechnology,2008(3):53.
[19] 步宇翔.蛋白质电子跳跃转移与溶剂化电子结构[J].山东大学学报( 理学版),2011,46(10):152.
BU Y X.Electron hopping transfer in proteins and structures of solvated electrons [J].JournalofShandongUniversityScience,2011,46(10):152.
[20] 吴少辉,刘光明.蛋白质分离纯化方法研究进展[J].中国药业,2012,21(1):1.
WU S H,LIU G M.Research progresses in protein separation and purification [J].ChinaPharmaceuticals,2012,21(1):1.
[21] 李绍中,黄晓东,高新义,等.植物胆碱酯酶提取新工艺的研究[J].食品科技,2007(4):41.
LI S Z,HUANG X D,GAO X Y,etal.Study on botanical esterase extraction craft [J].FoodScienceandTechnology,2007(4):41.
[22] 杨立红,高兴喜,缪 静,等.斑玉蕈酸性磷酸酯酶的酶学性质研究[J].菌物学报,2011,30(5):744.
YANG L H,GAO X X,MIAO J,etal.Enzymic properties of acid phosphatase fromhypsizygusmarmoreus[J].Mycosystema,2011,30(5):744.
[23] 阮长青,杨 娟,郭德军.不同植物酯酶对α-乙酸萘酯催化活性研究[J].食品科学,2009(13):183.
RUAN C Q,YANG J,GUO D J.Catalytic activity of esterases from different crops to α-naphthalene acetic acid [J].FoodScience,2009(13):183.
[24] 温艳霞,李建科.有机磷农残检测用植物酯酶的研究[J].食品科学,2006,27(4):123.
WEN Y X,LI J K.Phytoesterase study on detecting the residues of organophosphate pesticides [J].FoodScience,2006,27(4):123.
[25] 赵武玲.基础生物化学[M].北京:中国农业大学出版社,2008:136.
ZHAO W L.Fundamentals of Biochemistry [M].Beijing:China Agricultural University Press,2008:136.
[26] 江媛媛.有机磷农药检测用植物酯酶的研究[D].长沙:中南林业科技大学,2012:17.
JIANG Y Y.The Researches on phytoesterase used for the detection of organophosphorus pesticides [D].Changsha:Central South University of Forestry and Technology,2012:17.
[27] 穆随选.有机磷及氨基甲酸酯类农药残留检测用豇豆酯酶的初步研究[D].杨凌:西北农林科技大学,2009:21.
MU S X.Elementary research onVignaunguiculata(linn.) esterase used for detecting organophosphorus and carbamate pesticides residues [D].Yangling:Northwest A&F University,2009:21.
[28] 胡晓燕.有机磷农药对植物酯酶的抑制及应用研究[D].杭州:浙江工业大学,2009:29.
HU X Y.Research and application on plant-esterase inhibition by organophosphorous pesticides [D].Hangzhou:Zhejiang University of Technology,2009:29.
[29] 温艳霞,李建科,张晓敏,等.植物酯酶法检测有机磷农药的敏感性和检测限的研究[J].食品科学,2006,27(9):186.
WEN Y X,LI J K,ZHANG X M,etal.Studies on sensitivity and detection limit of phytoesterase on organophosphate pesticides [J].FoodScience,2006,27(9):186.
[30] 熊晓辉,丁安帮,游京晶,等.小麦酯酶提取及其对有机磷农药检测初探[J].粮食与油脂,2010(9):35.
XIONG X H,DING A B,YOU J J,etal.Extraction of wheat esterase and detection of organophosphorus pesticide [J].Cereals&Oils,2010(9):35.
Optimization of Extraction Process for Wheat Bran Esterase by Response Surface Methodology
YE Lin1,YANG Xue1,2,ZHANG Zhiqing1,SHEN Guanghui1,LI Shanshan1,WU Hejun1,GAO Wei1,CHEN Siying1
(1.College of Food Science,Sichuan Agricultural University,Ya’an,Sichuan 625014,China;2.Panzhihua Institute of Food and Drug Control,Panzhihua,Sichuan 617000,China)
In order to improve the utilization of by-product of wheat bran,plant esterase can be extracted from wheat bran. The extraction of plant esterase from wheat bran with sodium hydrogen phosphate buffer as extraction solvent was optimized. On the basis of single-factor experiments,the Box-Behnken center-united experimental design principles were used to design the experiment and the response surface analysis of three factors(concentration of NaNO3,extraction temperature and time)were determined. The optimum extraction conditions were recommended 0.15 mol·L-1as sodium nitrate,35 ℃ as extraction temperature and 60 minutes as extraction time. Based on these conditions,the predicted value of the unit enzymatic activity was 23 338 U·mL-1,and its verified value was 23 018.7 U·mL-1,which was 98.63% agreed with the predicted value. To sum up,the optimized conditions are able to better extraction of plant esterase from wheat bran,and maintain a high enzyme activity.
Wheat bran; Plant esterase; Extraction technology; Response surface method
时间:2017-03-07
2016-06-03
2016-07-02
四川农业大学学科双支计划项目(03572107)
E-mail:yelinyy@hotmail.com 通讯作者:张志清(E-mail:zqzhang721@163.com)
S512.1;Q814.1
A
1009-1041(2017)03-0420-08
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170307.1639.042.html

