基于癌症基因图集数据库与免疫组织化学方法分析SMARCB1对肝细胞癌早期诊断及预后的作用*
王 健, 张升敏, 吴佳勉, 卢卓才, 杨建荣, 巫泓生, 陈 浩, 林 波, 许荣华, 曹天生△
(1南方医科大学附属花都人民医院普外科,广东 广州 510800; 2海南医学院附属医院肿瘤外科,海南 海口 570102)
基于癌症基因图集数据库与免疫组织化学方法分析SMARCB1对肝细胞癌早期诊断及预后的作用*
王 健1, 张升敏1, 吴佳勉1, 卢卓才1, 杨建荣1, 巫泓生1, 陈 浩1, 林 波1, 许荣华2△, 曹天生1△
(1南方医科大学附属花都人民医院普外科,广东 广州 510800;2海南医学院附属医院肿瘤外科,海南 海口 570102)
目的: 通过研究SMARCB1在肝细胞癌(hepatocellular carcinoma,HCC)组织的表达,阐明其对HCC的早期诊断及预后的作用。方法: 在癌症基因组图集(The Cancer Genome Atlas,TCGA)数据库中筛选出SMARCB1基因,运用免疫组织化学(immunohistochemistry,IHC)技术和TCGA分析SMARCB1在HCC组织和正常组织的表达情况,阐述其在HCC发生、发展进程中的作用。 结果: IHC结果证实,与正常肝组织相比,HCC中SMARCB1的蛋白表达量显著上升(P<0.01)。IHC的结果显示SMARCB1的蛋白表达量与原发肿瘤分期呈正相关(P<0.05),即SMARCB1表达量越高,原发肿瘤分期越趋向晚期。TCGA的结果显示SMARCB1的高表达是HCC的独立预后因素(P<0.05)。 结论:SMARCB1可能起着促癌基因的作用,临床上根据其在组织中的表达差异,可鉴别早期的HCC及良性组织,并可能有效地进行预后判断。
肝细胞癌; SMARCB1; 诊断; 预后
肝细胞癌(hepatocellular carcinoma,HCC)是世界上第五大恶性肿瘤,病死率高居第3位[1-2]。我国是乙型肝炎大国,约有3 000万慢性病毒性肝炎患者,而慢性病毒性肝炎可逐渐演变为肝硬化,其中90%左右的肝硬化患者晚期可合并HCC,我国已成为全世界HCC高发地区之一[3-4]。根据预后的不同,HCC患者可以采取切除,肝移植,姑息性治疗等治疗手段[5]。但临床上,仍然没有一种公认临床方法能准确地诊断HCC肿瘤及预测HCC患者预后。
SMARCB1(SWI/SNF-related, matrix-associated,actin-dependent regulator of chromatin,subfamily b,member 1)位于22号染色体长臂11区13带。由于SMARCB1在恶性横纹肌样瘤组织中双等位基因失活,SMARCB1被认为属于抑癌基因[6]。同时,作为一种结合蛋白,它能结合人类免疫缺陷病毒1 整合酶(human immunodeficiency virus-1 integrase,HIV-1 INT;一种逆转录病毒的DNA整合到宿主细胞所必须的整合酶),从而激活HIV-1 INT活性,使逆转录病毒双链DNA整合至宿主DNA中[7]。越来越多的证据表明,乙型肝炎病毒(hepatitis B virus,HBV)DNA整合入人类肝细胞DNA与原发性HCC的发生密切相关[8-9]。然而,SMARCB1在HCC中临床意义还没有被详细阐述。
材 料 和 方 法
1 材料
1.1 临床组织芯片 免疫组织化学(immunohistochemistry,IHC)分析所使用的组织芯片购自西安艾丽娜生物科技有限公司,芯片编号为LV809,点直径为1.5 mm,该芯片包含70例HCC组织及8例正常肝组织,均已经过病理确诊。
1.2 癌症基因组图集(The Cancer Genome Atlas,TCGA)数据库 为了在HCC患者中找到并确定与肿瘤进展及诊断有关的候选基因,我们在TCGA数据库(包括337例临床样本相应的mRNA的高通量测序数据)中筛选出具有生存期与生存状态的134例HCC。应用R语言软件进行对数秩检验(log-rank test)分析所有的20 485个基因的表达量高低(以表达量中位数为分界点)对患者生存时间的影响,以双侧P<0.05为差异有统计学意义挑选研究的目标基因。统计数据库中所有的134例患者都进行了0~107个月(平均20个月)不等的随访。
2 临床组织芯片的IHC分析
临床标本组织被切成厚度为4 μm的石蜡切片,二甲苯脱蜡后水化使之能够进行IHC-DAB染色,染色在DAKO EnVision 系统中进行。简短地进行蛋白酶消化和过氧化物酶阻断后,按1∶400的比例稀释 I 抗(Abcam),将稀释后的 I 抗孵育切片,4 ℃过夜。次日洗净切片,用过氧化物标记的多聚物及色原体基质处理以发现目标蛋白的染色情况。具体评分方法如下:取10个典型的显微镜下视野并数出阳性染色细胞数,计算出阳性细胞比例,根据抗体说明书,细胞质染色即为阳性。由于目标蛋白染色的异质性,对肿瘤切片评分采取半定量的方式。根据染色细胞的比例(<5%为0分; 6%~25%为1分; 26%~50%为2分; 51%~75%为3分; >75%为4分)及染色的深度(阴性为0分; 弱阳性为1分; 中等阳性为2分; 强阳性为3分)来评定每一个肿瘤组织切片目的蛋白表达水平。染色细胞比例评分及染色深度评分相乘构成了最终的免疫反应评分(immunoreactivity score,IRS)。
3 统计分析
数据统计分析用SPSS 17.0统计软件包处理。IHC评分的所有2×2表格进行Fisher精确检验,非2×2表格进行Pearson卡方检验,TCGA数据进行独立样本t检验,使用Kaplan-Meier方法和log-rank检验进行生存分析,Cox危险因素回归模型用于分析单因素和多因素的生存分析,以P<0.05为差异有统计学意义。
结 果
1 SMARCB1在HCC临床组织标本中表达上调
我们在包含HCC组织(70例)和正常肝组织(8例)的组织芯片中进行SMARCB1的IHC检测。在HCC组织中,SMARCB1在细胞质中表达较强;在正常肝组织中,SMARCB1表达较弱;IRS结果显示,与正常肝组织相比,HCC组织内SMARCB1的蛋白表达量上升(P<0.01),见图1。
此外,2×2表格统计分析的结果显示SMARCB1在HCC组织内蛋白表达量上升(P<0.01),在原发肿瘤分期晚期的HCC组织内蛋白表达量亦上升(P<0.05),见表1。
2 SMARCB1表达量对于预后的作用
在TCGA数据库中我们使用Kaplan-Meier 图表分析HCC患者总体生存率与SMARCB1表达量之间的联系。SMARCB1高表达组比低表达组有更短的生存期(P<0.01),见图2。
随后我们进一步对SMARCB1在预后中的作用进行分析。在单因素分析中,高表达组与低表达组在生存期上也表现出明显差异(HR 为2.013, 95% CI为1.203~3.371,P<0.01)。此外,在多因素分析结果中,表达上调的SMARCB1(HR为 2.068, 95% CI 为1.015~4.214,P<0.05)是预后独立的预测因子,见表2。
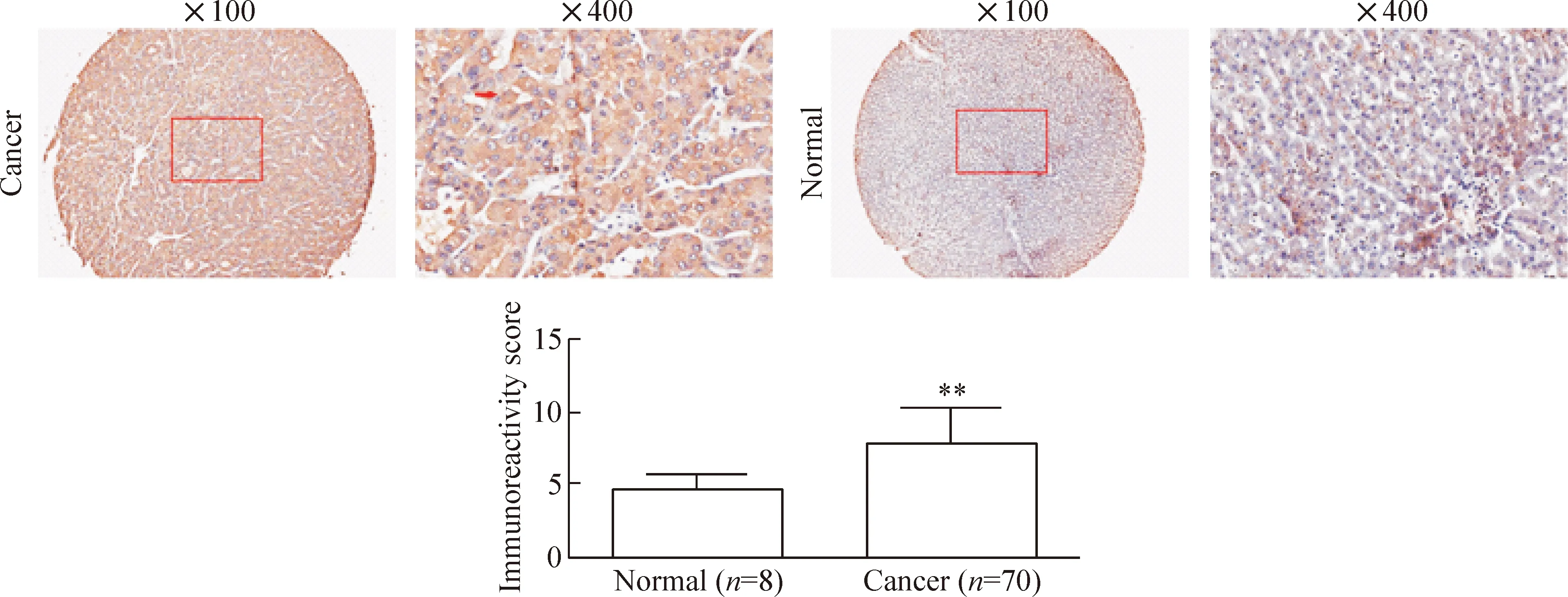
Figure 1.Immunohistochemical staining of cancer tissues and normal tissues. Mean±SD.**P<0.01vsnormal.
图1 HCC组织及正常肝组织的免疫组化结果

表1 SMARCB1 IHC结果
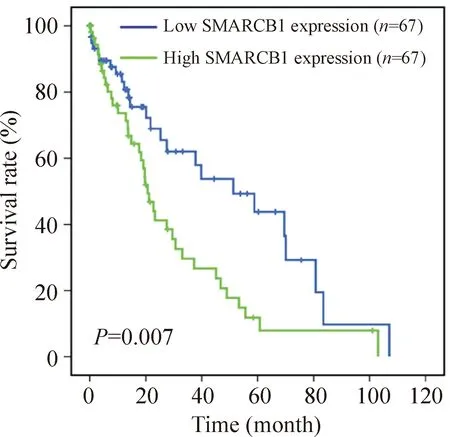
Figure 2.The expression of SMARCB1 was associated with the overall survival in the HCC patients.
图2 SMARCB1表达相关的总体生存率曲线
表2 COX风险预测模型中SMARCB1表达量对预后的价值
Table 2.Association between overall survival and SMARCB1 expression in Cox regression model

AnalysisOverallsurvivalHazardratio(95%CI)PUnivariateanalysis Gender(malevsfemale)1.312(0.782-2.201)0.304 Age(≥60vs<60)0.654(0.382-1.121)0.123Tumorstage(T1-T2vsT3-T4)1.315(0.794-2.178)0.288 Nodestage(N0vsN1-N2)0.676(0.091-5.005)0.702 Metastasisstage(M0vsM1)2.917(0.879-9.674)0.080 SMARCB1(lowexpression vshighexpression)2.013(1.203-3.371)0.008Multivariateanalysis Gender(malevsfemale)1.521(0.705-3.284)0.285 Age(≥60vs<60)0.542(0.248-1.183)0.124Tumorstage(T1-T2vsT3-T4)1.584(0.764-3.283)0.216 Nodestage(N0vsN1-N2)1.291(0.161-10.330)0.810 Metastasisstage(M0vsM1)2.044(0.524-7.978)0.303 SMARCB1(lowexpression vshighexpression)2.068(1.015-4.214)0.045
讨 论
HCC是一种高病死率的恶性肿瘤。由于大多数HCC患者有肝炎、肝硬化等基础肝脏疾病,发病初期较隐匿,临床诊断时多已发展至中晚期,且常伴有肝内或肝外转移,治疗效果差[10]。近年来,随着IHC等技术的发展,在多种癌症中发现了有效的生物标记物[11-12]。然而,仍然没有一种有效的生物标记物能准确地诊断HCC肿瘤及预测HCC患者预后。在本研究中,我们发现与正常肝组织相比,HCC组织中SMARCB1蛋白表达量明显上升,SMARCB1蛋白表达量与原发肿瘤分期呈正相关,SMARCB1的mRNA表达量是HCC患者预后的独立因素。
在前人的研究中,由于SMARCB1双等位基因失活伴随着恶性横纹肌样瘤的发生,并且在上皮样肉瘤、肾髓质癌和未分化肉瘤中检测到SMARCB1表达缺失,SMARCB1被认为属于抑癌基因[6,13]。但我们的研究结果表明SMARCB1在HCC中可能具有促癌作用。SMARCB1致癌的机理可能与其参与逆转录病毒基因组整合进入宿主基因组的过程有关。在逆转录病毒基因组整合进入宿主基因组的过程中,SMARCB1参与组成改变染色质结构的SWI/SNF染色质重塑复合物,并结合与激活HIV-1 INT等相关蛋白,从而使逆转录病毒整合进入相应位置,病毒整合可导致宿主染色体失稳及DNA 重排, 基因结构和表达的异常不断积累, 最终导致细胞表型改变及恶性转化[14-15]。Kalpana等[14]的研究已经证实,在酵母双杂交系统中,SMARCB1能结合与激活HIV-1 INT,一种逆转录的病毒DNA整合到宿主细胞所必须的整合酶。张婷等[15]的研究则证实,HBV序列整合是HCC发生中的一个早期事件。我们的研究结果显示,与正常肝组织相比,HCC组织内SMARCB1的蛋白表达量显著上升,这与上述研究结果相一致。
本研究表明SMARCB1可能在HCC发生预测中扮演重要角色,SAMRCB1的表达增加可能会有效地预测HCC患者的预后。这些研究结果在HCC基因诊断方面丰富了SMARCB1的意义和内涵,不仅为认识HCC提供了新的视角,也为临床工作者提供针对HCC患者制定个性化的治疗方案。
[1] 付顺军, 李绍强, 林 杰, 等. Glypican-3在原发性肝细胞癌中的表达及其对预后的影响[J]. 中国病理生理杂志, 2010, 26(12): 2351-2357.
[2] Koniaris LG, Levi DM, Pedroso FE, et al. Is Surgical resection superior to transplantation in the treatment of hepatocellular carcinoma?[J]. Ann Surg, 2011, 254(3): 527-538.
[3] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[4] Ni X, Suhail MM, Yang Q, et al. Frankincense essential oil prepared from hydrodistillation of Boswellia sacra gum resins induces human pancreatic cancer cell death in cultures and in a xenograft murine model[J]. BMC Complement Altern Med, 2012,12:253.
[5] Colleoni M , Audisio RA, De Braud F, et al. Practical considerations in the treatment of hepatocellular carcinoma[J]. Drugs, 1998, 55(3): 367-382.
[6] Modena P, Lualdi E, Facchinetti F, et al.SMARCB1/INI1 tumor suppressor gene is frequently inactivated in epithelioid sarcomas[J]. Cancer Res, 2005, 65(10): 4012-4019.
[7] Pyeon D, Price L, Park IW. Comparative molecular genetic analysis of simian and human HIV-1 integrase interactor INI1/SMARCB1/SNF5[J]. Arch Virol, 2015, 160(12): 3085-3091.
[8] Murakami Y, Minami M, Daimon Y, et al. Hepatitis B virus DNA in liver, serum, and peripheral blood mononuclear cells after the clearance of serum hepatitis B virus surface antigen[J]. J Med Virol, 2004, 72(2): 203-214.
[9] Murakami Y, Saigo K, Takashima H, et al. Large scaled analysis of hepatitis B virus (HBV) DNA integration in HBV related hepatocellular carcinomas[J]. Gut, 2005, 54(8): 1162-1168.
[10]赵秀英, 李 宁, 丁惠国, 等. 血清高尔基体糖蛋白73在肝细胞癌诊断中的作用[J]. 中华肿瘤杂志, 2010, 32(12): 943-946.
[11]Paliouras M, Borgono C, Diamandis EP. Human tissue kallikreins: the cancer biomarker family[J]. Cancer Lett, 2007, 249(1): 61-79.
[12]Srinivas PR, Verma M, Zhao Y, et al. Proteomics for cancer biomarker discovery[J]. Clin Chem, 2002, 48(8): 1160-1169.
[13]Eaton KW, Tooke LS, Wainwright LM, et al. Spectrum of SMARCB1/INI1 mutations in familial and sporadic rhabdoid tumors[J]. Pediatr Blood Cancer, 2011, 56(1): 7-15.
[14]Kalpana GV, Marmon S, Wang W, et al. Binding and stimulation of HIV-1 integrase by a human homolog of yeast transcription factor SNF5[J]. Science, 1994, 266(5193): 2002-2006.
[15]张 婷, 许 强, 杨紫伟, 等. 原发性肝细胞癌中乙型肝炎病毒基因整合的突变分析[J]. 首都医科大学学报, 2011, 32(3): 313-317.
(责任编辑: 林白霜, 罗 森)
Effect of SMARCB1 on early diagnosis and prognosis of hepatocellular carcinoma
WANG Jian1, ZHANG Sheng-min1, WU Jia-mian1, LU Zhuo-cai1, YANG Jian-rong1, WU Hong-sheng1, CHEN Hao1, LIN Bo1, XU Rong-hua2, CAO Tian-sheng1
(1DepartmentofGeneralSurgery,HuaduDistrictPeople’sHospital,SouthernMedicalUniversity,Guangzhou510800,China;2DepartmentofOncologySurgery,TheAffiliatedHospitalofHainanMedicalCollege,Haikou570102,China.E-mail:sywang36@163.com;xu9.student@126.com)
AIM: To illuminate the effect of SWI/SNF-related, matrix-associated, actin-dependent regulator of chromatin, subfamily b, member 1 (SMARCB1) in early diagnosis and prognosis of hepatocellular carcinoma (HCC) by determining the clinical expression of SMARCB1 in HCC tissue and benign liver tissue. METHODS: The specific target geneSMARCB1 was selected from these genes by using The Cancer Genome Atlas (TCGA). SMARCB1 expression in HCC tissue and benign liver tissue was measured by immunohistochemistry. Further statistical analysis of TCGA was performed to illuminate the role of SMARCB1 on HCC occurrence and progression. RESULTS: Compared with the benign liver tissue, immunohistochemical staining showed that SMARCB1 expression was significantly up-regulated in the HCC tissue (P<0.01). In addition, SMARCB1 expression was significantly associated with advanced tumor stage (P<0.05). The relation between SMARCB1 expression at mRNA level and clinical prognosis was analyzed. The results indicated that high SMARCB1 expression was an independent prognostic factor for HCC (P<0.05). CONCLUSION:SMARCB1 may play a part as a carcinogenic gene in tumorigenesis. We can distinguish primary HCC samples from non-malignant samples according to its different clinical expression. High SMARCB1 expression probably predicts poor outcome in HCC patients.
Hepatocellular carcinoma; SMARCB1; Diagnosis; Prognosis
1000- 4718(2017)04- 0754- 04
2016- 06- 22
2016- 12- 22
海南省自然科学基金资助项目(No.ZDXM2015080; No.309063); 广州市花都区科技和信息化局项目(No.15-HDWS-012)
R730.23
A
10.3969/j.issn.1000- 4718.2017.04.030
△通讯作者 曹天生 Tel: 020-86823779; E-mail: sywang36@163.com; 许荣华 Tel: 0898-66528114; E-mail: xu9.student@126.com

