pH值对呼吸道分离肺炎克雷伯菌抗药性及生物膜形成能力的影响
宋洁,洪海
(1第三军医大学西南医院预防保健科,重庆 400038;2北京郑常庄离职干部休养所卫生所,北京 100141)
细菌生物膜是指细菌在细胞外多聚物包裹中形成的具有立体结构的细胞群落,生物膜内的细菌可在信号分子的调控下分工协作,使生物膜内的细菌具有与高等细胞相似的功能[1,2]。细菌形成生物膜后可使其抗药性成百上千倍增高,且在多糖等保护下可逃避免疫系统的攻击,导致感染治疗的失败,这已成为抗感染领域的难题,临床上85%的感染都和细菌生物膜相关[3]。
pH是肺部内环境的一个重要影响因素,人体气道表面液体和肺泡液体pH值为6.6~6.9[4]。在疾病过程中,由于肺组织感染及呼吸性酸碱中毒等疾病的影响,患者呼吸道内的pH值可随病情有所改变,从而影响细菌的清除和抗菌药物的活性[4,5]。研究发现,肺部感染时由于细菌代谢等因素,感染局部组织呈酸性。肺炎克雷伯菌是呼吸道感染的常见病原菌,我们对pH值酸性条件下肺炎克雷伯菌的抗药性及生物膜形成能力的变化进行研究,以期为临床医师提供用药指导。
1 对象与方法
1.1 研究对象
12株肺炎克雷伯菌(K1-K12)均分离自第三军医大学西南医院预防保健科呼吸科住院患者的痰液标本。
1.2 试剂与设备
抗菌药物左氧氟沙星、庆大霉素和头孢他啶购自中国食品药品检定研究院。结晶紫购自Sigma公司,冰醋酸购自重庆川东化工有限公司。血琼脂平板购自重庆庞通医疗器械有限公司,MH和LB培养基购自北京陆桥生物技术有限公司,96孔板购自美国康宁公司,酶标仪购自美国MD公司。
1.3 方法
1.3.1 不同pH值条件下最低抑菌浓度的测定 采用微量肉汤稀释法测定不同pH值环境下抗菌药物对细菌的最低抑菌浓度(minimal inhibitory concentration,MIC)。肺炎克雷伯菌划线接种于血琼脂平板上,37℃培养过夜。挑取细菌单菌落接种于10 ml MH培养基中,37℃、200转/ min培养18 h。用无菌生理盐水稀释校正菌液至0.5麦氏单位(约108 CFU/ml),然后分别用不同pH值(5.5、6.5和7.5)的MH培养基稀释1000倍。抗菌药物分别用pH值为5.5、6.5和7.5的MH培养基进行倍比稀释。然后在96孔板中每孔加入100 μl菌液和100 μl不同浓度的抗菌药物溶液,使药物终浓度分别为256和0.125 μg/ml。37℃孵育18 h后判断结果,以能完全抑制细菌生长的最低药物浓度为MIC。
1.3.2 不同pH值对黏附能力的影响 黏附能力检测采用菌落计数法[6]。将肺炎克雷伯菌过夜培养物用无菌生理盐水稀释至0.5麦氏单位,再用不同pH值(5.5、6.5和7.5)的LB培养基稀释100倍。在CLSM培养皿中加入2 ml稀释菌液。37℃孵育4 h后,用无菌的磷酸盐缓冲液(phosphate buffer saline,PBS)轻柔冲洗2次,去除浮游菌。然后在培养皿中加入PBS超声10 min使黏附的细胞脱落。最后将细胞悬浮液稀释至适当倍数后,取100 μl菌液涂布于LB固体培养基上,37℃培养 24 h 后计数。每个样本设置3个平行组,实验重复3次。
1.3.3 不同pH值对生物膜形成能力的影响 生物膜形成能力检测采用96孔板结晶紫染色法[7]。将肺炎克雷伯菌过夜培养物用无菌生理盐水稀释至0.5 麦氏单位,再用不同pH值(5.5、6.5和7.5)的LB培养基稀释100倍。然后每孔分别加入200 μl菌液,37℃孵育24 h。小心去除浮游菌,PBS轻柔冲洗两次,倒置风干固定。然后加入1%结晶紫溶液染色10 min,用流水冲洗3次,再次倒置风干。最后每孔加入100 μl 30 %冰醋酸溶液,用酶标仪在590 nm处测定吸光度值。每组设置3个复孔,实验重复3次。
1.4 统计学处理

2 结 果
2.1 抗菌药物对肺炎克雷伯菌的MIC
头孢他啶对12株肺炎克雷伯菌的MIC值随着pH值升高而逐渐增加;随着pH值升高,左氧氟沙星对肺炎克雷伯菌的MIC值降低;庆大霉素对肺炎克雷伯菌的MIC值与pH变化没有明显相关性(表1)。
2.2 不同pH值对肺炎克雷伯菌黏附能力的影响
随着pH值升高,肺炎克雷伯菌黏附能力增强。两独立样本比较结果显示,与pH 5.5相比,pH 6.5条件下有6株菌黏附细胞数显著增加(P<0.05),而pH 7.5条件下所有(12株)菌株黏附细胞数均显著增加(P<0.05)。多独立样本比较结果显示,pH 6.5组肺炎克雷伯菌黏附能力与pH 5.5组细菌黏附能力没有统计学差异(P>0.05),且pH 7.5组细菌黏附能力与pH 5.5组差异亦无统计学意义(P>0.05;表2)。
2.3 不同pH值对肺炎克雷伯菌生物膜形成能力的影响
随着pH值升高,肺炎克雷伯菌生物膜形成能力均有不同程度的增强。两独立样本比较结果显示,与pH 5.5相比,pH 6.5条件下有8株细菌的生物膜形成能力显著增高(P<0.05),而pH 7.5条件下所有(12株)细菌的生物膜形成能力均显著增高(P<0.05)。多独立样本比较结果显示,与pH 5.5组相比,pH 6.5组和pH 7.5组肺炎克雷伯菌生物膜形成能力均显著增高(P<0.01;图1)。
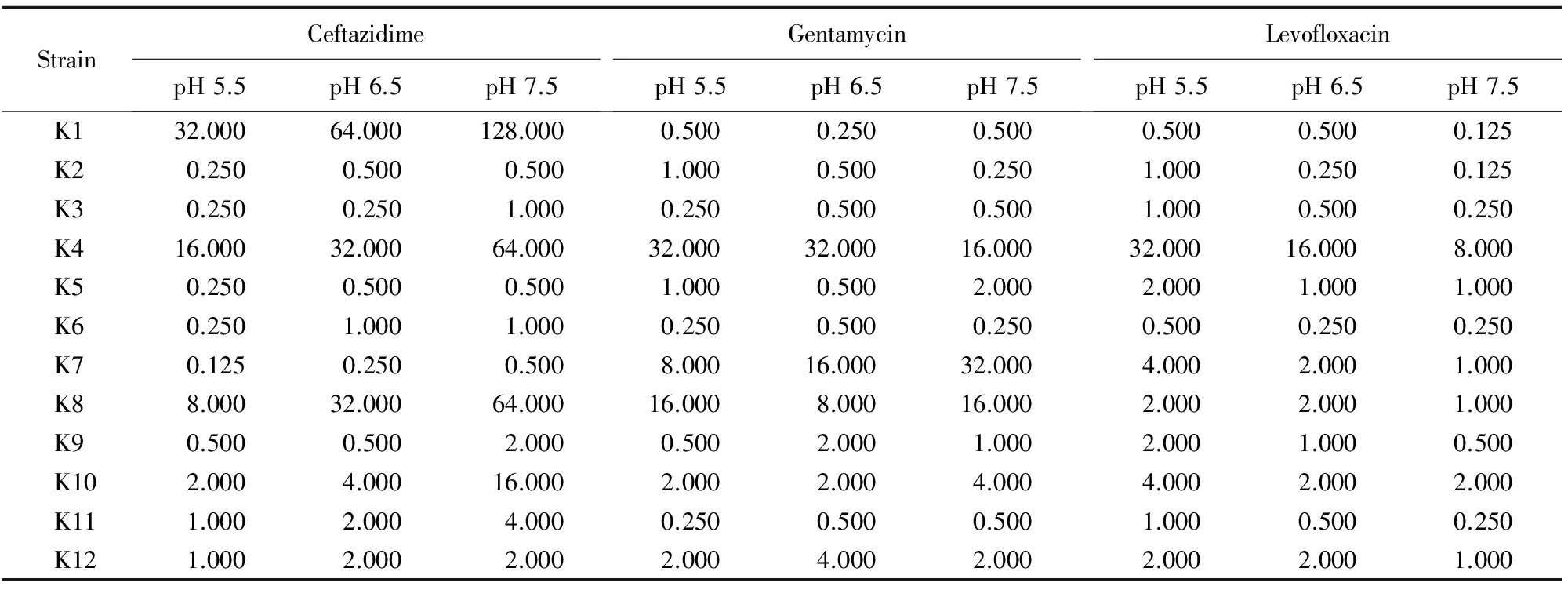
表1 不同pH值条件下抗菌药物对肺炎克雷伯菌的MICTable 1 MIC for antimicrobial agents to Klebsiella pneumonia in different pH conditions (μg/ml)
MIC: minimal inhibitory concentration
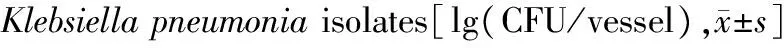
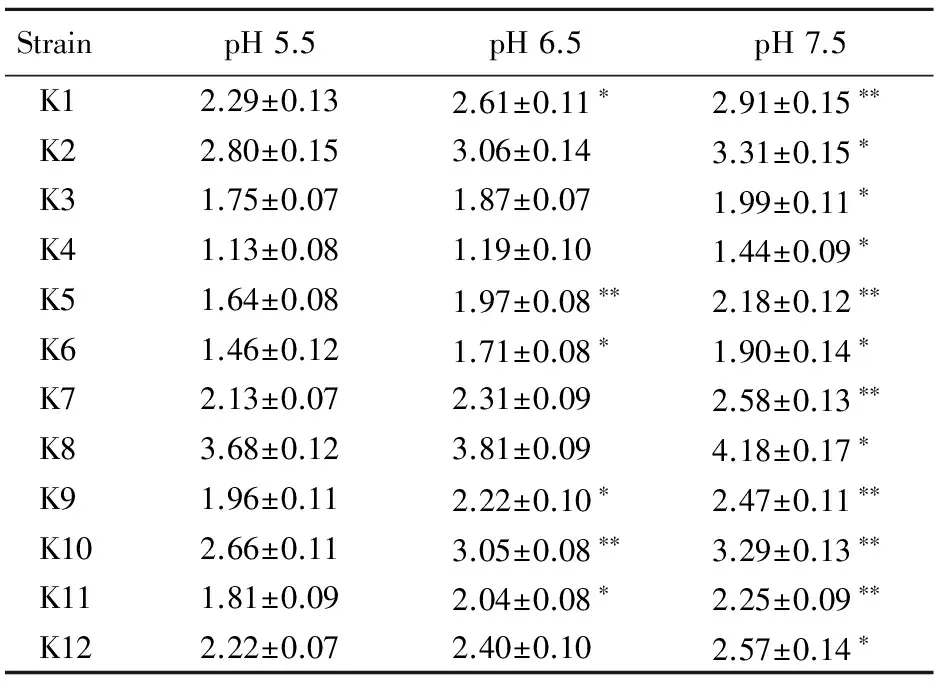
Strain pH5.5pH6.5pH7.5K12.29±0.132.61±0.11∗2.91±0.15∗∗K22.80±0.153.06±0.143.31±0.15∗K31.75±0.071.87±0.071.99±0.11∗K41.13±0.081.19±0.101.44±0.09∗K51.64±0.081.97±0.08∗∗2.18±0.12∗∗K61.46±0.121.71±0.08∗1.90±0.14∗K72.13±0.072.31±0.092.58±0.13∗∗K83.68±0.123.81±0.094.18±0.17∗K91.96±0.112.22±0.10∗2.47±0.11∗∗K102.66±0.113.05±0.08∗∗3.29±0.13∗∗K111.81±0.092.04±0.08∗2.25±0.09∗∗K122.22±0.072.40±0.102.57±0.14∗
Compared with pH 5.5,*P<0.05,**P<0.01
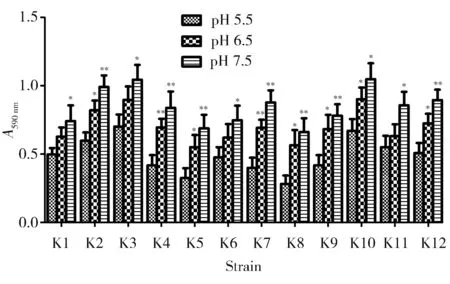
图1 不同pH值对肺炎克雷伯菌生物膜形成能力的影响Figure 1 Effect of different pH values on the biofilm formation of Klebsiella pneumonia isolates Compared with pH 5.5, *P<0.05, **P<0.01
3 讨 论
肺炎克雷伯菌属于革兰氏阴性菌,是人类呼吸道的常寄居,在机体免疫力低下的患者中可引起呼吸道部位的感染[8],是典型的条件致病菌。随着临床上广谱抗菌药物的大量应用,由该菌引起的医院感染和耐药率呈上升趋势[8,9],特别是肺炎克雷伯菌多重耐药和生物膜的产生给临床抗感染治疗带来了巨大困难。本研究对不同pH值条件下3种抗菌药物对肺炎克雷伯菌MIC的影响进行了研究,结果显示,酸性pH条件下,头孢他啶可以降低肺炎克雷伯菌的MIC值,而左氧氟沙星则增加细菌的MIC值。有研究表明碱性条件下喹诺酮类药物可以降低奇异变形杆菌的MIC值[10],提示在相同pH条件下喹诺酮类药物对不同细菌都具有类似的作用效果。
细菌生物膜的形成包括初始黏附和生物膜的形成,其中黏附是评价细菌生物膜形成能力的重要指标[11,12]。在体外,细菌生物膜的产生依赖于各种物理和化学因素,例如培养基的组成、温度、pH、氧等[13-15]。本研究考察了不同pH值对肺炎克雷伯菌黏附性和生物膜形成能力的影响,结果显示,随着pH值增加,肺炎克雷伯菌黏附细胞数和生物膜形成能力均有不同程度的增加。本研究结果显示,pH 6.5组和pH 7.5组肺炎克雷伯菌生物膜形成能力与pH 5.5组间差异具有统计学意义(P<0.01),而这两组细菌黏附性与pH 5.5组间差异没有统计学意义,这可能与本研究细菌样本量少有关。关于铜绿假单胞菌和嗜麦芽窄食单胞菌,也有培养基pH与生物膜产生能力之间成正比关系的类似报道[13,14]。研究表明,碱性环境下细菌生物膜形成能力大于酸性的原因在于产生了较高的藻酸盐,因为在碱性pH条件下细菌细胞壁外膜孔蛋白的扩大促进碳的累积,进而使得藻酸盐的合成增加[16]。
综上所述,本研究结果表明,不同pH环境可以改变肺炎克雷伯菌的药物敏感性和生物膜形成能力,β-内酰胺类抗菌药物头孢他啶在酸性pH条件下具有较好的抗菌活性。提示临床医师应根据患者内部环境pH的变化选择抗菌药物。本研究局限性在于只选择了β-内酰胺类、氨基糖苷类和喹诺酮类中的一种药物进行研究,对于这3类中的其他抗菌药物是否具有相同作用效果以及其他类别抗生素的作用均有待于进一步研究。
【参考文献】
[1] Høiby N. A short history of microbial biofilms and biofilm infec-tions[J]. APMIS, 2017, 125(4): 272-275. DOI: 10.1111/apm.12686.
[2] 方向群. 细菌生物被膜相关感染的致病机制及药物治疗[J]. 中华老年多器官疾病杂志, 2007, 6(5): 299-301. DOI: 10.3969/j.issn.1671-5403.2007.05.003.
Fang XQ. Pathogenesis and drug therapy of bacterial biofilm associated infection[J]. Chin J Mult Organ Dis Elderly, 2007, 6(5): 299-301. DOI: 10.3969/j.issn.1671-5403.2007.05.003.
[3] Vo GD, Brindle E, Heys J. An experimentally validated immersed boundary model of fluid-biofilm interaction[J]. Water Sci Technol, 2010, 61(12): 3033-3040. DOI: 10.2166/wst.2010.213.
[4] Ng AW, Bidani A, Heming TA. Innate host defense of the lung: effects of lung-lining fluid pH[J]. Lung, 2004, 182(5): 297-317. DOI: 10.1007/s00408-004-2511-6.
[5] Percival SL, McCarty S, Hunt JA,etal. The effects of pH on wound healing, biofilms, and antimicrobial efficacy[J]. Wound Repair Regen, 2014, 22(2): 174-186. DOI: 10.1111/wrr.12125.
[6] 欧倩怡, 何召云, 夏培元, 等. 亚抑菌浓度头孢他啶对临床尿管分离大肠埃希菌生物膜的作用[J]. 第三军医大学学报, 2015, 37(2): 111-115. DOI: 10.16016/j.1000-5404.201409097.
Ou QY, He ZY, Xia PY,etal. Effect of sub-minimal inhibitory concentration of ceftazidime on biofilm formation ofEscherichiacoliisolated from urethral catheters[J]. J Third Mil Med Univ, 2015, 37(2): 111-115. DOI: 10.16016/j.1000-5404.201409097.
[7] 孙凤军, 陈盛, 枉前, 等. 亚抑菌浓度莫匹罗星对烧伤创面分离铜绿假单胞菌生物膜的影响[J]. 中国药房, 2015, 26(14): 1939-1941. DOI: 10.6039/j.issn.1001-0408.2015.14.21.
Sun FJ, Chen S, Wang Q,etal. Effect of sub-minimal inhibitory concentration mupirocin on biofilm ofPseudomonasaeruginosaisolated from burn wounds[J]. China Pharm, 2015, 26(14): 1939-1941. DOI: 10.6039/j.issn.1001-0408.2015.14.21.
[8] 许毛宇, 吴胜军. 2010-2014年杭州邵逸夫医院临床分离肺炎克雷伯菌的药敏分析[J]. 中华全科医学, 2017, 15(2): 304-307. DOI: 10.16766/j.cnki.issn.1674-4152.2017.02.037.
Xu MY, Wu SJ. Susceptibility ofKlebsiellapneumoniaeclinical strains isolated from 2010 to 2014 in Sir Run Run Shaw Hospital of Hangzhou[J]. Chin J Gen Pract, 2017, 15(2): 304-307. DOI: 10.16766/j.cnki.issn.1674-4152.2017.02.037.
[9] 王靖, 杨爱芝, 赵应兰, 等. 2012-2014年某医院肺炎克雷伯菌耐药监测分析[J]. 中国消毒学杂志, 2017, 34(1): 90-92. DOI: 10.11726/j.issn.1001-7658.2017.01.034.
Wang J, Yang AZ, Zhao YL,etal. Surveillance of drug resistance ofKlebsiellapneumoniaein a hospital from 2012 to 2014[J]. Chin J Disinfect, 2017, 34(1): 90-92. DOI: 10.11726/j.issn.1001-7658.2017.01.034.
[10] Irwin NJ, McCoy CP, Carson L. Effect of pH on theinvitrosusceptibility of planktonic and biofilm-grownProteusmirabilisto the quinolone antimicrobials[J]. J Appl Microbiol, 2013, 115(2): 382-389. DOI: 10.1111/jam.12241.
[11] de Andrade JP, de Macêdo Farias L, Ferreira JF,etal. Sub-inhibitory concentration of piperacillin-tazbactam may be related to virulence properties of filamentousEscherichiacoli[J]. Curr Microbiol, 2016, 72(1): 19-28. DOI: 10.1007/s00284-015-0912-9.
[12] Buzón-Durán L, Alonso-Calleja C, Riesco-Peláez F,etal. Effect of sub-inhibitory concentrations of biocides on the architecture and viability of MRSA biofilm[J]. Food Microbiol, 2017, 65: 294-301. DOI: 10.1016/j.fm.2017.01.003.
[13] Harjai K, Khandwahaa RK, Mittal R,etal. Effect of pH on production of virulence factors by biofilm cells ofPseudomonasaeruginosa[J]. Folia Microbiol (Praha), 2005, 50(2): 99-102. DOI: 10.1007/BF02931455.
[14] Di Bonaventura G, Stepanovi'c S, Picciani C,etal. Effect of environmental factors on biofilm formation by clinicalStenotrophomonasmaltophiliaisolates[J]. Folia Microbiol (Praha), 2007, 52(1): 86-90.
[15] Hostacká A, Ciznár I. Biofilms formation and response to oxidative stress inPseudomonasaeruginosaandVibriocholeraenon-O1 depending on culture media[J]. Epidemiol Mikrobiol Imunol, 2007, 56(4): 186-190.
[16] Heyde M, Portalier R. Regulation of major outer membrane porin proteins ofEscherichiacoliK 12 by pH[J]. Mol Gen Genet, 1987, 208(3): 511-517. DOI:10.1007/BF00328148.

