人卵泡壁层颗粒细胞源性非整合诱导多能干细胞的制备
蔡炳,脱颖,李宇彬,麦庆云,刘新颜,徐艳文,周灿权*
(1. 中山大学附属第一医院生殖医学中心,广州 510080;2. 广东省生殖医学重点实验室,广州 510080;3.中山大学附属第一医院病理科,广州 510080)
人卵泡壁层颗粒细胞源性非整合诱导多能干细胞的制备
蔡炳1,2,脱颖3,李宇彬1,2,麦庆云1,2,刘新颜1,2,徐艳文1,2,周灿权1,2*
(1. 中山大学附属第一医院生殖医学中心,广州 510080;2. 广东省生殖医学重点实验室,广州 510080;3.中山大学附属第一医院病理科,广州 510080)
目的 探索将卵泡液中壁层颗粒细胞诱导为非整合的诱导多能干细胞(iPS细胞),并检测其颗粒细胞方向的分化能力。 方法 在取卵的操作过程中,收集废弃的壁层颗粒细胞,在颗粒细胞培养至第4天时,加入iPS仙台病毒,经过20余天的维持,挑取iPS细胞克隆,并扩增培养。对其多能基因表达情况、外源基因整合情况、自然分化能力、颗粒细胞定向分化能力进行鉴定,并与皮肤细胞来源的iPSC系进行平行分化能力比较。 结果 成功建立了壁层颗粒细胞来源的iPS细胞系,其通过了类似胚胎干细胞的多能性检测及体外三胚层的分化能力检测,尤其在定向分化为颗粒细胞时,分化出了大量FOXL2、CYP19A1和FSHR阳性的细胞,经ELISA试剂盒检测,发现该分化细胞可以分泌AMH并且能够将雄激素转化成雌激素;且颗粒细胞源iPS系较皮肤细胞源的iPS系在颗粒细胞方向的分化效率更高。 结论 提供了一种从人颗粒细胞建立iPSC的方法,并验证了其颗粒细胞方向分化的优势。该系统不仅可以用于建立生殖不孕疾病的iPSC库,还为颗粒细胞功能障碍不孕的患者提供了一种细胞治疗的新思路。
非整合诱导多能干细胞; 壁层颗粒细胞; 分化效率
(JReprodMed2017,26(4):313-319)
诱导多能干细胞(induced pluripotent stem cells,iPS细胞)技术是一种经由过表达 Oct4/Sox2/Klf4/c-Myc等重编程因子,使成体细胞发生基因重编程而获得类似于胚胎干细胞生物学特性的技术[1]。经过重编程得到的iPS细胞具有和胚胎干细胞相似的形态、生长特性、基因表达模式和多向分化能力。该技术避免了胚胎干细胞制备的伦理学问题,且可以实现目的细胞的分化和移植,不具有免疫排斥问题。
在iPS技术发展的领域继采用Yamanaka的四基因病毒体系建立iPS细胞系之后,鉴于癌基因的介入和病毒介导的潜在危险,人们开始追求更为安全的制备方法,如腺病毒[2]、质粒[3]、蛋白小分子[4-5]、人工合成的mRNA[6]等方法,上述方法可以去除外源性基因对宿主基因组的影响并获得iPS细胞系,但制备效率都很低。相较于这些非整合的制备方式,仙台病毒法序列最终并不会残留于基因组,安全性高,且重编程效率高,是一种非常稳定的非整合的iPS诱导方法[7]。
目前已经有不同类型的原代细胞如皮肤细胞、上皮细胞等成功制备了iPS细胞系,对于这些不同类型原代细胞来源的iPS细胞系分化能力的区别,目前认为重编程后的细胞依旧携带了之前原代细胞的部分印记基因特点,即在分化时会更倾向于原代细胞类型的方向进行分化[8],这也提示我们去建立不同类型原代细胞来源的iPS细胞,为未来的细胞移植治疗提供更稳定的种子细胞。
颗粒细胞在卵泡发生的过程中对卵泡的生长和发育起到重要作用。它提供了卵母细胞发育必需的营养成分并堆积了卵母细胞分泌的代谢产物,还负责了卵泡生长中雌激素的合成和排卵后孕激素的分泌[9]。在辅助生殖的胚胎培养室中,颗粒细胞会出现在超声引导取卵手术得到的卵泡液中,但由于其并不被IVF周期所使用,故在日常操作中基本被丢弃。因此,本文拟利用人颗粒细胞结合非整合iPS的诱导技术,建立人卵泡壁层颗粒细胞源性非整合iPS细胞系(Granulosa cell iPSC,GC-iPSC),并将其与皮肤成纤维细胞来源的iPS细胞(Skin fibroblast iPSC,SF-iPSC)进行颗粒细胞方向的分化,比较其分化效率,探讨该细胞系的特殊性。
材料与方法
一、材料
1.涉及的组织细胞标本:颗粒细胞来自于本生殖中心废弃卵泡液;非整合的仙台病毒诱导的人皮肤成纤维细胞来源的SF-iPSC细胞系为本实验室已建立细胞系;H1胚胎干细胞来自于ATCC细胞库(美国)。
2.相关试剂:胚胎干细胞E8培养基(Invitrogen,美国)、颗粒细胞培养基(Invitrogen,美国)、仙台病毒诱导非整合iPS细胞试剂盒(Invitrogen,美国)、免疫组化染色试剂盒(Invitrogen,美国)、BD胞浆蛋白流式检测专用试剂盒(BD Biosciences,美国)、雌激素(Cayman Chemical,美国)及AMH(Beckman Coulter,美国)分析试剂盒。
二、方法
1.颗粒细胞的原代制备:利用本生殖中心的捡卵操作时机械切割获取ICSI方案女性患者的壁层颗粒细胞,细胞团块使用DPBS(Gibco,美国)不断清洗,使用红细胞裂解液(BD Biosciences,美国)去除红细胞,后使用I型胶原酶处理10 min,1 500 rpm离心,种植于M199培养基中(含10% FBS)进行贴壁培养,隔2 d换液,在传代前完成iPS诱导,故不进行传代操作。
2.仙台病毒诱导的非整合人壁层颗粒细胞源iPS细胞系的建立:重编程采用CytoTune-iPS 2.0 Sendai Reprogramming Kit (Life Technologies,美国)。六孔板一孔种植大约1 ×105的颗粒细胞,培养液为 M199(含10% FBS);病毒感染日按照病毒说明书计算病毒用量,加入到培养基中感染12 h,后换回正常培养液培养;6 d后将感染后的细胞按1.5 ×105的密度种于经过照射的不增殖的小鼠胚胎皮肤细胞上(irMEF),培养液换为胚胎干细胞的培养液[80% DMEM/F-12 (Life Technologies,美国)、20% KSR(Life Technologies,美国)、Glutamax (Life Technologies,美国)、0.1 mM β-巯基乙醇 (Sigma,美国)和1%非必需氨基酸(Life Technologies,美国)]。完全重编程克隆挑至无饲养层培养体系,换用E8和matirgel进行培养,全程37℃、5% CO2。重编程完成后检测细胞中仙台病毒序列的存在情况,并对所建立的细胞系进行iPS多能性的检测,如Oct4、Nanog和Tra-1-60等多能性基因的表达、体内外三胚层的分化实验等。
3.iPS细胞系向颗粒细胞的体外分化:iPS细胞使用机械传代至低粘附性板,使用拟胚体(EB)培养液成胚体(80% DMEM/F12、20%KSR、4 ng/ml bFGF、0.1 mmol/L β-巯基乙醇和1%非必须氨基酸)培养2 d。随后添加BMP4培养24 h,继而添加BMP4、WNT3A、activin-A和bFGF (R&D Systems,美国)维持3 d,后转入明胶包被的孔板贴壁培养,培养基中加入BMP4、bFGF和follistatin(R&D Systems,美国)再维持6 d,进行相关鉴定。
4.荧光定量PCR(RT-PCR):使用RNA提取试剂盒(Qiagen,美国)提取相关细胞系的总RNA,使用逆转录试剂盒(Roche,美国)合成cDNA,并使用Sybr Green(Roche,美国)和特定引物配置体系在7500 Fast Real-Time PCR(Applied Biosystems,美国)机器上对基因表达水平进行检测。GAPDH作为内参基因,使用△△CT法计算相对表达量。
5.包膜和胞浆内蛋白的流式细胞检测:细胞培养物使用0.5%胰蛋白酶消化收集,并使用流式细胞固定液(R&D Systems,美国)固定,用流式细胞穿透和10%的人和驴血清封闭(包膜组无需穿透)。使用到的一抗如下:胞浆抗体 CYP19A1(Bioss,美国)、FOXL2(Bioss,美国);包膜抗体FSHR(Bioss,美国)。阴性对照组使用相对应的Isotype对照组。流式样品在 BD Influx 细胞分析仪(BD Biosciences,美国)上检测,使用FlowJo软件分析。
6.免疫组织化学:贴壁培养细胞用0.01 mol/L PBS洗2次,每次10 min;4%的多聚甲醛固定20 min,0.01 mol/L PBS洗3次,每次10 min;用0.2% Triton X100室温穿透及1% BSA封闭 30 min,吸弃血清后,加入一抗4℃孵育过夜;胞膜分子标记检测组则直接使用1% BSA 封闭30 min,吸弃血清后,加入一抗4℃孵育过夜;0.01 mol/L PBS洗3次,每次10 min;二抗(Alexa Fluor 488 或 Alexa Fluor 594)室温孵育1 h;0.01 mol/L PBS洗3次,每次10 min;1 g/ml DAPI 复染细胞核;荧光显微镜下观察拍照。
选用胚胎干细胞标志:Nanog、Oct4、SSEA4、Sox2、Tra-1-60和TRA1-81;三胚层分化标志:Tuj1、Fibronectin、AFP;选用颗粒细胞的标志:FOXL2、CYP19A1及FSHR。
7.相关激素测定:芳香化酶活性检测是通过在培养基中加入睾酮,然后检测其中雌激素的水平。种植4×105的未分化的iPS细胞及分化后的颗粒细胞样细胞分别于六孔板不同孔内。在24 h内,这些细胞均进行50 ng/ml睾酮(Sigma-Aldrich,美国) 的处理。收集各孔的培养液,使用雌激素分析试剂盒(Cayman Chemical,美国)进行检测。该试剂盒标准曲线的跨度为6.6~4 000 pg/ml,雌激素检测吸光度为405 nm。
AMH的检测为上述密度细胞收集其更换培养基后48 h的培养液,使用AMH-EIA (Beckman Coulter,美国)按照说明书步骤进行检测。标准曲线范围为1 pM~150 pM,吸光度为450 nm。
所有实验平行重复三次。
三、统计学方法
应用SPSS 13.0软件进行数据处理和统计分析。计量资料采用均数±标准差(±s)表示,组间比较采用方差分析检验。P<0.05为差异有统计学意义。
结 果
一、人卵泡壁层颗粒细胞源性非整合iPS细胞(GC-iPSC)的制备
使用仙台病毒法过表达颗粒细胞OCT3/4、SOX2、KLF4和c-MYC的转录水平建立非整合的诱导多能干细胞系,在转染后20 d挑取胚胎干细胞样克隆,使用无饲养层培养(图1)。并通过免疫组化、体内外分化等手段,证明其表达多能性标志(图2),且具有体内外三胚层多向分化的能力(图3)。
二、GC-iPSC向颗粒细胞的体外定向分化
经过成拟胚体悬浮培养转贴壁培养,并在相关诱导因子的处理下,诱导12 d的细胞出现颗粒细胞样的外观,通过流式检测和免疫组化发现分化后的细胞大量表达颗粒细胞特异标志CYP19A1、FOXL2和FSHR(图4)。
三、不同原代细胞来源iPS细胞系向颗粒细胞体外分化效率的比较
颗粒细胞源性iPS和皮肤成纤维细胞源性iPS平行进行颗粒细胞方向的定向分化,检测定向分化12 d时的细胞。发现颗粒细胞源性组具有更高水平的相关颗粒细胞标志基因(FSHR、FOXL2、CYP19A1)的转录水平(P<0.01),且具有更强的芳香化酶的活性,即将睾酮转化为雌激素的能力(P<0.05),具有更强的分泌AMH的能力(P<0.05)(图5)。
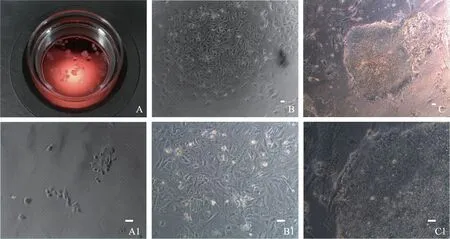
A:捡卵操作中收集的颗粒细胞(培养前);A1:颗粒细胞培养4 d后;B:转染仙台病毒4 d后;B1:B高倍像,诱导后细胞形态发生变化,增殖变快;C:诱导20 d出现胚胎干细胞样克隆;C1:C高倍像;Bar=100 μm图1 颗粒细胞原代培养及iPS诱导过程

A:克隆白光、碱性磷酸酶染色及多能基因SSEA4/OCT4/NANOG/SOX2/TRA-1-60/TRA-1-81的免疫荧光染色;Bar=200μm; B:RT-PCR检测颗粒细胞源iPS(GC-iPSC)多能基因的表达情况 图2 颗粒细胞源iPS的多能性鉴定
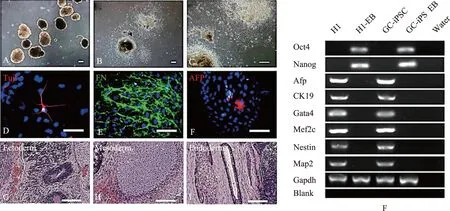
A~C:拟胚体的悬浮及贴壁白光;D~F:免疫组化鉴定三胚层分化标志,Tuj1(外胚层,D)、FN(中胚层,E)、 AFP(内胚层,F);G~I:畸胎瘤的内部形成内(G)、中(H)、外(I)胚层组织形态;Bar=100 μmF:RT-PCR检测颗粒细胞源iPS拟胚体(GC-iPS EB)分化基因的表达情况图3 颗粒细胞源iPS分化能力的鉴定
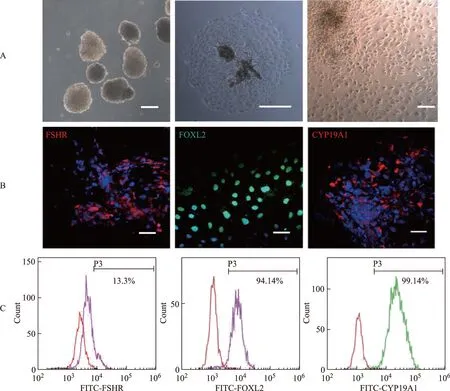
A:拟胚体的形成及贴壁12 d后白光;B:免疫组化鉴定定向分化细胞颗粒细胞标志FSHR、FOXL2、CYP19A1;Bar=100μm; C:流式细胞仪鉴定定向分化细胞颗粒细胞标志FSHR、FOXL2、CYP19A1图4 颗粒细胞源iPS向颗粒细胞定向分化的鉴定
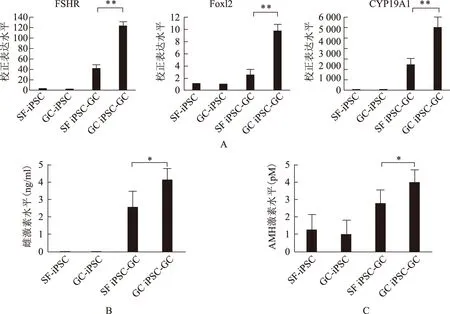
A:Real-time PCR比较颗粒细胞源性iPS(GC-iPSC)和皮肤成纤维细胞源性iPS(SF-iPSC)在颗粒细胞(GC)标志基因FSHR、FOXL2、CYP19A1的表达差异;B:GC-iPSC和SF-iPSC将睾酮(50 ng/ml)转化为雌激素的能力比较;C:GC-iPSC和SF-iPSC分泌AMH的能力比较。*P<0.05,**P<0.01图5 颗粒细胞源性iPS和皮肤成纤维细胞源性iPS体外颗粒细胞定向分化能力比较
讨 论
iPS细胞可以作为疾病的细胞模型,在体外模拟疾病的发病过程,从而能够深入研究相关疾病的发病机制;另一方面,诱导分化的有缺陷的靶细胞可以为基因修复治疗、药物筛选、毒理评价提供细胞工具。目前已有很多人类遗传病被报道建立了疾病iPS细胞系,并成功完成了体外的疾病模拟。Lee等[10]首次建立了家族性自主神经功能异常(FD)患者体细胞来源的iPS细胞系,发现在FD iPS往神经方向分化时具有大量异常蛋白,并具有神经元分化能力缺陷,而当细胞加以激动素处理后该缺陷得以修复,该实验为使用激动素进行长期治疗可能有益于FD患者的观点提供了最好的证据。本生殖中心在植入前遗传诊断(PGD)方面一直处于全国前列,集合了大量遗传病标本资源,通过取遗传病患者的颗粒细胞,可以因此而建立大量遗传疾病的iPS 库,并开展疾病的体外模拟,研究发病机制。
同时经大量研究发现颗粒细胞亚群中存在干性的细胞类型[11]。这个现象首次由 Kossowska-Tomaszczuk等[12]发现,该研究组证实了IVF实验室获取的颗粒细胞能够分化成其他组织类型的细胞,如神经元、软骨细胞、成骨细胞。Mao等[13]发现小鼠颗粒细胞不表达分化细胞标志Lamin A,内源性表达Sox2和c-Myc转录因子,并使用2因子法(O/S)建立了小鼠颗粒细胞来源的iPS细胞系,因此人颗粒细胞来源的iPS细胞应该有更高的诱导效率。但本文并没有在诱导效率这一点进行深入探讨。
颗粒细胞在卵泡发生的过程中对卵泡的生长和发育起到重要作用。目前认为女性生殖细胞的丢失和卵巢颗粒细胞的衰减是早衰的根本原因。已发现卵巢早衰患者的颗粒细胞的凋亡率较正常人要高,因此补充颗粒细胞是一种预期可以改善卵巢功能的方法。且目前已经有从大鼠、小鼠和人iPSC向卵巢颗粒细胞分化的较成熟方案[14-15],且发现该类细胞当移植入小鼠体内会出现归巢效应,将会围绕在卵母细胞的周围[16]。目前临床主要以雌/孕激素替代疗法来治疗卵巢早衰,但目前这些治疗方法尚不能从根本上修复受损的卵巢功能,且长期应用激素还可能会引起一些副作用,甚至可能还存在增加乳腺癌等恶性肿瘤、心脏病和中风的风险[17]。所以,怎样提前预防和恢复衰退的卵巢功能,寻求新的治疗方法,从而恢复患者的生育功能是生殖医学领域面临的一个挑战。结合iPS印记基因的效应,颗粒细胞来源的iPS细胞系可能是最理想的一种种子细胞,可以高效地分化为更接近于本体的颗粒细胞,可能会对卵巢环境的修复产生正面影响。
综上所述,建立人卵泡壁层颗粒细胞源性非整合iPS的技术将会推进生殖中心利用本中心的遗传疾病颗粒细胞这个标本资源建立一系列的具有生殖细胞印记的iPS细胞,该类细胞可以高效分化为颗粒细胞样细胞,可能对卵巢损伤后微环境的改善具有一定作用,而使用仙台病毒非整合基因组的诱导特点也将为未来的细胞移植治疗的安全性提供一定的保障。
[1] Takahashi K,Tanabe K,Ohnuki M,et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J]. Cell,2007,131:861-872.
[2] Eggenschwiler R,Cantz T. Induced pluripotent stem cells generated without viral integration[J]. Hepatology,2009,49:1048-1049.
[3] Okita K,Matsumura Y,Sato Y,et al. A more efficient method to generate integration-free human iPS cells[J]. Nat Methods,2011,8:409-412.
[4] Kim D,Kim CH,Moon JI,et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins[J]. Cell Stem Cell,2009,4:472-476.
[5] Zhou H,Wu S,Joo JY,et al. Generation of induced pluripotent stem cells using recombinant proteins[J]. Cell Stem Cell,2009,4:381-384.
[6] Warren L,Manos PD,Ahfeldt T,et al. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA[J]. Cell Stem Cell,2010,7:618-630.
[7] Lee HK,Morin P,Xia W. Peripheral blood mononuclear cell-converted induced pluripotent stem cells (iPSCs) from an early onset Alzheimer’s patient[J]. Stem Cell Res,2016,16:213-215.
[8] Nishizawa M,Chonabayashi K,Nomura M,et al. Epigenetic variation between human induced pluripotent stem cell lines is an indicator of differentiation capacity[J]. Cell Stem Cell,2016,19:341-354.
[9] Su YQ,Sugiura K,Eppig JJ. Mouse oocyte control of granulosa cell development and function:paracrine regulation of cumulus cell metabolism[J]. Semin Reprod Med,2009,27:32-42.
[10] Lee G,Papapetrou EP,Kim H,et al. Modelling pathogenesis and treatment of familial dysautonomia using patient-specific iPSCs[J]. Nature,2009,461:402-406.
[11] Kossowska-Tomaszczuk K,De Geyter C. Cells with stem cell characteristics in somatic compartments of the ovary[J]. Biomed Res Int,2013,2013:310859.
[12] Kossowska-Tomaszczuk K,De Geyter C,De Geyter M,et al. The multipotency of luteinizing granulosa cells collected from mature ovarian follicles[J]. Stem Cells,2009,27:210-219.
[13] Mao J,Zhang Q,Ye X,et al. Efficient induction of pluripotent stem cells from granulosa cells by Oct4 and Sox2[J]. Stem Cells Dev,2014,23:779-789.
[14] Zhang J,Li H,Wu Z,et al. Differentiation of rat iPS cells and ES cells into granulosa cell-like cells in vitro[J]. Acta Biochim Biophys Sin (Shanghai),2013,45:289-295.
[15] Lan CW,Chen MJ,Jan PS,et al. Differentiation of human embryonic stem cells into functional ovarian granulosa-like cells[J]. J Clin Endocrinol Metab,2013,98:3713-3723.
[16] Woods DC,White YA,Niikura Y,et al. Embryonic stem cell-derived granulosa cells participate in ovarian follicle formation in vitro and in vivo[J]. Reprod Sci,2013,20:524-535.
[17] Shelling AN. Premature ovarian failure[J]. Reproduction,2010,140:633-641.
[编辑:罗宏志]
Derivation of integration-free iPSCs from human mural granulosa cells
CAIBing1,2,TUOYing3,LIYu-bin1,2,MAIQin-yun1,2,LIUXin-yan1,2,XUYan-wen1,2,ZHOUCan-quan1,2*
1.ReproductiveMedicineCenter,theFirstAffiliatedHospitalofSunYat-senUniversity,Guangzhou510080 2.GuangdongKeyLaboratoryofReproductiveMedicine,Guangzhou510080 3.DepartmentofHistopathology,theFirstAffiliatedHospitalofSunYat-senUniversity,Guangzhou510080
Objective:To induce human mural granulose cells to integration-free induced pluripotent stem cells(iPSC),and test the differentiation potential of granulosa cell-like (GC-like) cells.Methods:Human mural granulosa cells were collected during oocyte retrieval process from women undergoing infertility treatment. iPS Sendai virus was added to the 4thday of granulosa cell cultured. After 20 days of maintenance,iPS cell clones were picked and cultured. The ability of pluripotent gene expression,the integration of foreign genes,and the ability of differentiation of GC-like cells were identified and compared with the iPSC derived from skin cells.Results:mGC-iPSCs were successfully generated,and passed the tests of similar pluripotency of embryonic stem cells and differentiation ability of three germ layers in vitro. The differentiated GC-like cells expressed the granulosa cell specific marker FOXL2,CYP19A1 and FSHR. These GC-like cells were also capable of producing AMH and aromatizing testosterone to estradiol,which suggested that they were biologically functional. mGC-iPSCs have higher differentiation` efficiency thanbroblast-iPSCs.Conclusions:The study provides a safety method for generating human iPSCs from human mural granulosa cells,and finds that mGC-derived iPSCs reveal higher differentiation efficiency thanbroblast-derived iPSCs. The system can not only be used to establish the iPSC library for reproductive infertility,but also to provide a new idea for cell therapy for the infertile patients with granule cell dysfunction.
Integration-free iPSCs; Mural granulosa cells; Differentiation efficiency
10.3969/j.issn.1004-3845.2017.04.004
2017-02-05;
2017-02-28
国家自然青年基金(31401269);广东省公益研究基金(2014A020211012);广州市生殖医学转化中心项目(201508020006)
蔡炳,男,浙江宁波人,博士,干细胞与组织工程专业.(*
,Email:zhoucanquan@hotmail.com)

