加压毛细管电色谱-固相萃取测定链格孢霉毒素
薛羚伟,胡代玉,张秋月,郝雨婞,孙琴,袁博,蒋继宏,*
(1.江苏师范大学江苏省药用植物生物技术重点实验室,江苏徐州221116;2.山东省东阿县农业局,山东聊城252200;3.江苏师范大学生命科学学院,江苏徐州221116)
加压毛细管电色谱-固相萃取测定链格孢霉毒素
薛羚伟1,胡代玉2,张秋月3,郝雨婞3,孙琴3,袁博1,蒋继宏1,*
(1.江苏师范大学江苏省药用植物生物技术重点实验室,江苏徐州221116;2.山东省东阿县农业局,山东聊城252200;3.江苏师范大学生命科学学院,江苏徐州221116)
以霉变柑橘为材料,建立同时检测链格孢酚甲基乙醚(AME)、链格孢酚(AOH)和链格孢毒素(ALT)3种链格孢霉菌毒素的固相萃取-加压毛细管电色谱(SPE-pCEC)快速检测、通过乙腈提取,无水MgSO4和NaCl脱水盐析,C18SPE萃取净化,以C18毛细管色谱柱为分离柱,以含0.1%甲酸的乙腈为流动相进行梯度洗脱,利用荧光检测器进行检测。该方法在2μg/L~200 μg/L范围内线性关系良好,相关系数r2≥0.991 5,检出限为0.1 μg/kg~0.9 μg/kg。结果表明,该方法快速、准确、灵敏,适用于食品、水果中常见的3中链格孢霉毒素的快速分析及检测。
加压毛细管电色谱;固相萃取;链格孢霉毒素
链格孢是一类常见的致病性真菌,在自然界中的分布广泛。它不但能引起多种田间农作物病害,给全球的经济粮食作物造成重大损失,同时还能污染食物和饲料,产生的毒素能导致人和动物中毒[1]。文献表明,链格孢可以产生70多种毒素(以下简称链格孢霉毒素),包括链格孢酚甲基乙醚(AME)、链格孢霉素(ALT)、链格孢酚(AOH)等[2-3]。这些毒素进入人和动物体内后,会导致人和动物不同程度的中毒,一些毒性较大的链格孢霉毒素还有致癌、致畸和致突变等危害[4-5]。目前,我国现行的食品和饲料标准中尚未有对该类毒素的限量标准[6],加之含量较低,我国尚未制定标准方法。因此,建立快速、灵敏和准确的链格孢霉毒素检测方法具有重要的意义。
加压毛细管电色谱(Pressure Capillary Electrochromatography)是近些年迅速发展的一种微分离技术,具有高效、高选择、高分辨、快速、使用样品和流动相少等特点。近些年在农残检测、药物分析、食品检测等领域得到了广泛的应用[7-10]。
目前,检测链格孢霉毒素的方法主要有高效液相色谱法、液质联用法(LC-MS)、薄层色谱法(TLC)、毛细管电泳法以及免疫学检测法等[11-15]。这些方法大多具有较高的灵敏度和分辨度,具有一定的应用前景。但尚未有文献报道使用加压毛细管电色谱分析链格孢霉毒素的文献,本文使用固相萃取柱对霉变柑橘中的链格孢霉毒素进行富集,利用加压毛细管电色谱这一新兴分析技术对3种常见的链格孢霉毒素进行分析测定。建立的方法快速、准确、灵敏,可用于3种链格孢霉毒素的快速分析及检测。
1 材料与方法
1.1 材料、试剂与仪器
链格孢酚甲基乙醚、链格孢霉素、链格孢酚标准品:购置于新加坡Pribolab公司和美国Sigma公司;SPE固相萃取柱:购置于天津博纳艾杰尔公司;乙腈和甲醇(色谱纯):购置于Fisher公司;甲酸、氯化钠(分析纯):购置于国药集团;
加压毛细管电色谱TriSep-2100(配激光诱导荧光检测器)、C18毛细管电色谱柱:上海通微分析技术有限公司;HS 501振荡器:德国IKA公司;Mili-Q超纯水系统:美国Millipore公司。
1.2 方法
1.2.1 标准溶液的配制
参照史文景方法[16],取3种链格孢霉毒素标准品制备3种链格孢霉毒素母液,然后用稀释法配制0.05 mg/mL~0.25 mg/mL标准溶液,置于-30℃保存。以没有霉变的柑橘皮和果肉制备基质空白溶液,利用基质空白溶液稀释母液到0.05 mg/mL~0.25 mg/mL,得到基质空白标准工作溶液。
1.2.2 样品提取和净化
柑橘处理:市场购置柑橘60个,其中30个喷洒链格孢菌悬浮液后存放于4℃冰箱贮存,待长满霉菌后用捣碎机将样品加工成浆状,混匀,装入洁净的盛样容器中编号,其余30个直接制样编号。
取柑橘样品5.0 g(精确至0.01 g)于50 mL具塞试管中,加5 mL去离子水、4.0 g氯化钠和15 mL乙腈,提取60 min,4 500 r/min离心3 min,重复提取3次,合并上清溶液,过无水Na2SO4脱水后,将其置于40℃下真空浓缩至干,用1 mL甲醇溶解浓缩后得到残渣,加9 mL水稀释。将Oasis HLB固相萃取柱用5 mL甲醇和水活化,将提取得到的样品提取液上样,用2 mL甲醇-水(2∶8)淋洗,减压抽干5 min。在NH2固相萃取柱上端装填约2 cm高的硫酸钠,用5 mLCH2Cl2淋洗串联固相萃取柱,用乙酸乙酯-1%甲酸化的甲醇(1∶1)洗脱,收集洗脱溶液,浓缩至干,并用氮气吹干。用初始流动相定容至1.00 mL,过0.22 μm微孔滤膜,待用。
1.2.3 仪器条件
色谱柱:C18毛细管色谱柱;流动相体系:0.1%甲酸溶液-乙腈;梯度洗脱,在0~5 min,乙腈由20%线性增至80%,保持2 min,在0.1 min内恢复至20%,保持1 min;进样量3 nL;流速0.05 mL/min;检测荧光波长:0~3 min激发波长和发射波长分别为323 nm和478 nm,3 min~5 min以后激发波长和发射波长分别为339 nm和404 nm,之后激发和发射波长分别为340 nm和408 nm。
利用单因素法对提取时间、溶剂选择、SPE填料选择以及洗脱溶液体积以3种链格孢毒素标准品回收率为指标进行优化。
2 结果与分析
2.1 提取系统的建立
固相萃取前处理一般采用液液萃取的办法,为保证提取效果,在样品中先加入少量水使得样品分散,然后进行萃取,本文考察乙酸乙酯、二氯甲烷、丙酮、甲醇和乙腈这几种提取溶液的提取效果,结果见图1所示。
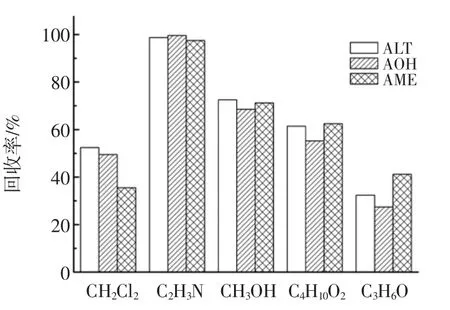
图1 提取溶剂的选择Fig.1 The selection of extraction solvents
从图1可以看出,二氯甲烷和丙酮对3种链格孢霉毒素的加标回收率不到60%,用乙腈和甲醇提取到的回收率较好,但甲醇提取时会融入一部分脂溶性成分(比如色素),在后续净化时会增加工作量。乙酸乙酯在提取时溶液较浑浊,而且大部分脂溶性成分也进入乙酸乙酯中。此外,甲醇与水可以轻易互溶,会造成水溶性杂质被提取出来,不利于后续的浓缩,在过SPE柱子时也会造成固相萃取柱堵塞,而乙腈在高浓度盐存在的情况下能够与水有效分层,避免了粘液质和糖类物质等水溶性杂质的提出,有效减少了色素的提取,对后续的盐析、浓缩和净化都有较好的效果,所以最终选择乙腈为提取溶剂。
2.2 提取时间的优化
本试验以乙腈为提取剂,以振荡的形式进行提取,考察提取时间对于3种链格孢霉毒素回收率的影响,结果如图2所示。
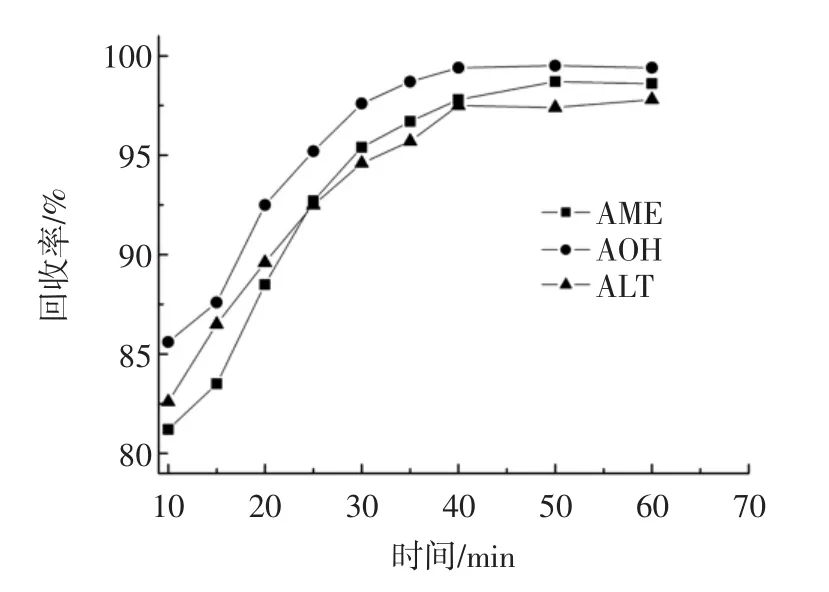
图2 提取时间对3种毒素回收率的影响(0.1 mg/kg加标量)Fig.2 Effect of extraction time on the recoveries of three mycotoxins(at spiked level 0.1 mg/kg)
从图2可以看出,10 min~30 min内,3种链格孢霉毒素的回收率增加速度较快,当提取时间超过30min过后,3种链格孢霉毒素的回收率仍有提高,但提高速度变缓,其中链格孢酚甲基乙醚(AME)的变化最为明显。当时间大于40 min后,3种链格孢霉毒素的回收率都变化不大,因此本试验将40 min作为提取的最佳时间。
2.3 固相萃取柱的选择
固相萃取柱有很多类型,在实际的萃取中可以选用性质不同的固相萃取小柱进行测试,本试验考察了Florisil固相萃取小柱和C18、HLB固相萃取柱的净化效果,通过加标回收来对固相萃取小柱进行选择。结果见图3所示。
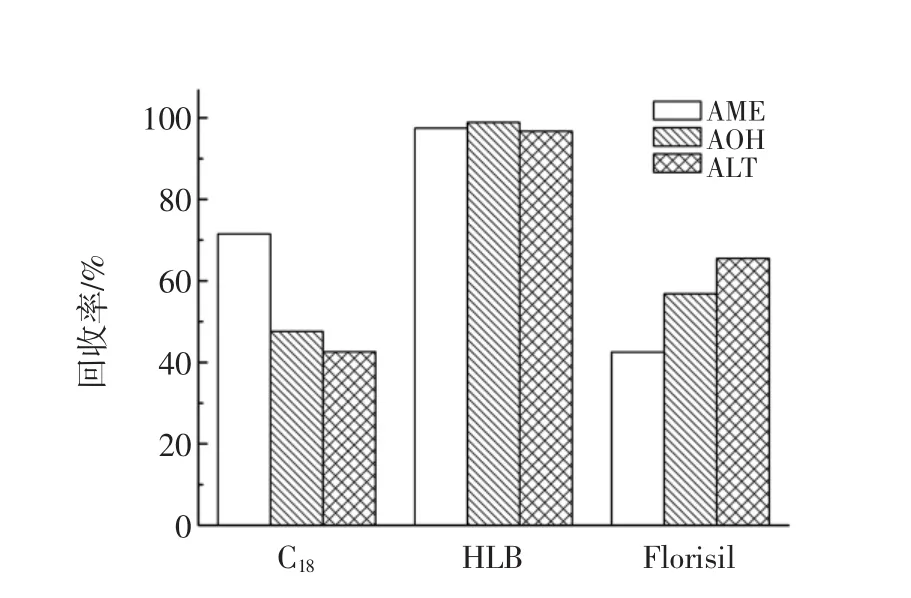
图3 固相萃取小柱的选择Fig.3 The selection of solid phase extraction column
通过图3可以看出,C18柱净化后3种霉毒素除了AME之外,其余两种霉毒素回收率均不到50%,Florisil柱净化后,AOH和ALT回收率较高,但AME回收率不高,然而HLB固相萃取柱净化后,3种霉毒素回收率均达到96%以上,因此可以选择HLB固相萃取柱作为净化柱使用。
2.4 洗脱溶剂的优化
确定固相萃取体系后,对洗脱液[乙酸乙酯-1%甲酸化的甲醇(1∶1)]体积的选用进行了优化。固相萃取柱上样后用不同体积的洗脱溶剂淋洗,用标准品加标回收法进行测定,结果如图4所示。

图4 洗脱溶剂体积的选择Fig.4 The selection of solvent elution volume
从图4可以看出,随着洗脱溶剂体积的不断加大,3种毒素的回收率也是逐渐增加的,使用8 mL时毒素的回收率已经到达最大,因此洗脱体积选择8 mL为适宜体积。
2.5 方法的评价
2.5.1 线性关系和检出限
利用pCEC测定复杂基质样品时,基质效应会干扰样品分析的准确性,很容易降低方法的灵敏度[6,16]。基质空白标准工作溶液使得标准溶液和样品溶液的吸收条件相同,这样可以减弱基质效应,因此本试验采用基质空白标准工作溶液进行制作标准曲线,结果见表1。
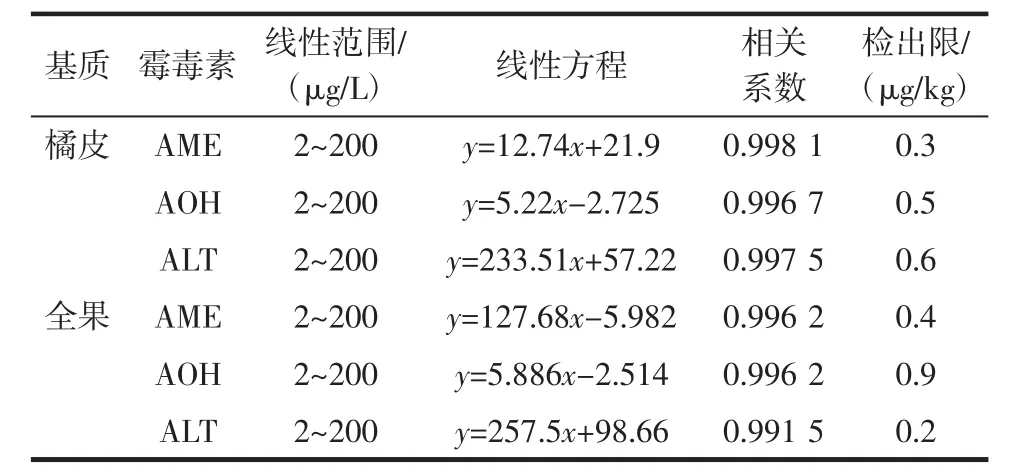
表1 3种霉毒素的线性范围、线性方程、相关系数和检出限Table 1 Liner ranges,linear equations,correlation coefficients and limits of detection(LODs)for three patulin
如表1所示,3种链格孢霉毒素在2 μg/L~200 μg/L范围内线性关系良好,相关系数都大于0.991 5,以3倍信噪比(S/N)计算,3种链格孢霉素的检出限均低在0.2 μg/kg~0.9 μg/kg之间。
2.5.2 加标回收率和精密度
制备果皮和全果样品,添加10、50、100 μg/kg 3个水平的3种霉毒素,每个添加水平重复测定5次,结果见表2。
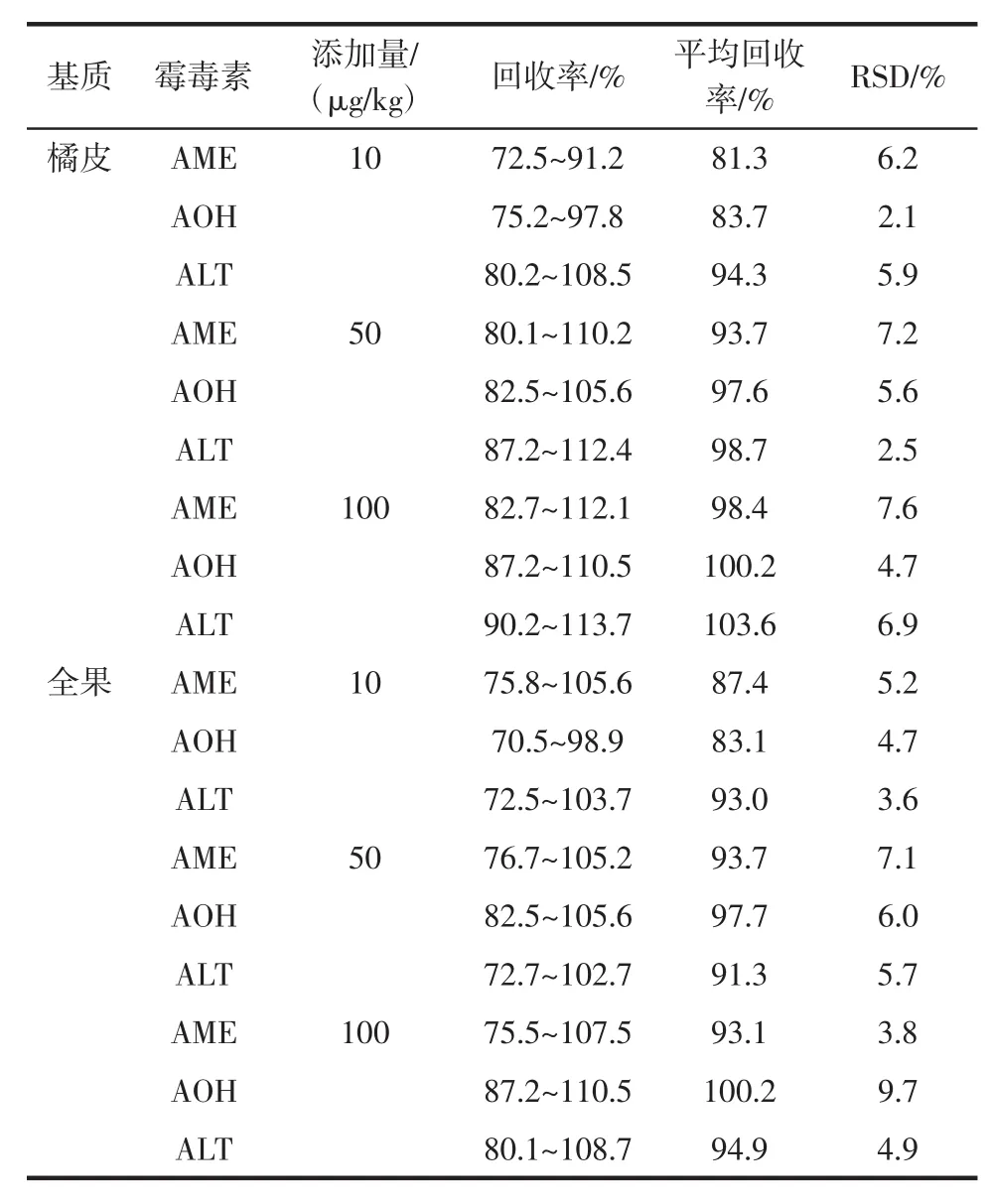
表2 柑橘果皮、全果3种霉毒素的添加回收率和精密度(n=5)Table 2 Recovery rates and precision for three patulin in citrus peel and whole fruits(n=5)
如表2所示,3种毒素物质在3个加标水平的平均回收率为81.3%~103.6%,相对标准偏差(RSD)为2.1%~9.7%,具有较高的回收率和精密度,表明该方法适用于3种毒素的检测。
2.5.3 实际样品测定
从市场上随机抽取50个柑橘样本,按方法准备果皮、全果样品,先使用免疫法进行筛选,然后用SPE-pCEC法分析测定。
首先将3个对照品进行混标处理,继而对混标样品进行pCEC分析,同时对样品进行分析。结果如图5所示。
从图5可知,3种链格孢毒素的分离度良好,能很好分离开3种毒素,且在10 min内完成分析。样品谱图中3种毒素保留时间与混标样品基本一致,且各组分分离度良好。通过标准曲线方程进行3种链格孢毒素含量的定量计算,结果列于表3。
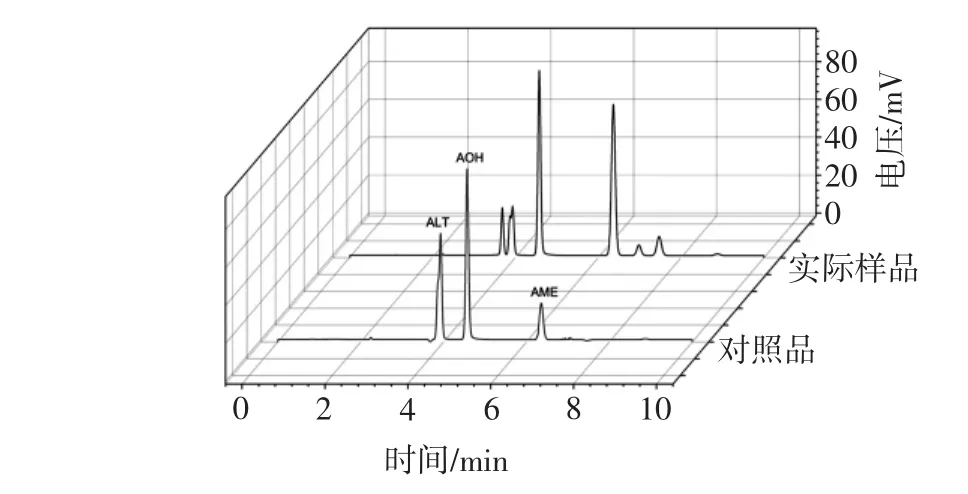
图5 3种链格孢毒素以及样本的pCEC谱图Fig.5 The pCEC spectrograms of three kinds of A.alternata toxin and sample
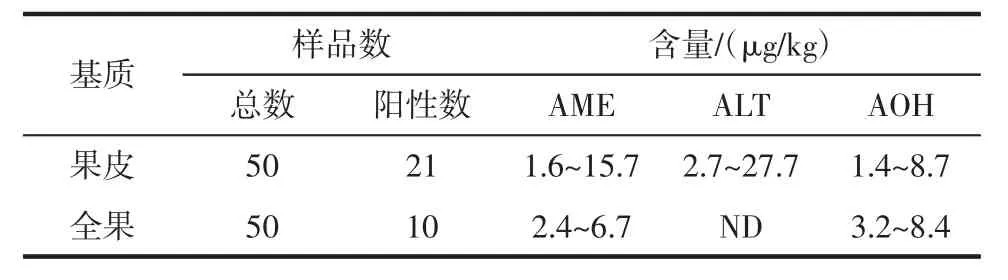
表3 利用SPE-pCEC检测链格孢毒素的含量Table 3 The contents of three patulin by the SPE-pCEC
由表3可知,21份果皮样本呈阳性,对这21份样本测定,3种链格孢霉毒素含量在1.4 μg/kg~27.2 μg/kg之间,10份全果样本呈阳性,但只检出AME和AOH,含量分别为2.4 μg/kg~6.7 μg/kg和3.2 μg/kg~8.4 μg/kg。
3 结论
本试验建立了SPE-pCEC检测3种常见的链格孢霉毒素,利用SPE方法优化了提取和净化条件。利用pCEC检测方法具有快速、简便、准确、检出限低、重现性好,能够在10 min内完成检测。利用该方法随机检测水果中3种链格孢霉毒素,能很好地测定出样本中的毒素含量,通过本研究,证明SPE-pCEC方法适用于对链格孢霉毒素的快速以及含量监控。
[1]秦燕,陈毓芳,林峰,等.固相萃取-高效液相色谱法同时测定牛奶中的多种四环素残留[J].食品科学,2005,26(3):202-204
[2]刘玉晓,龚丽丽,刘芳,等.链格孢菌毒素对莱茵藻光系统Ⅱ的多重影响[J].西北植物学报,2008,28(1):119-124
[3] Chen S,Dai X,Qiang S,et al.Effect of a nonhost-selective toxin from Alternaria alternata on chloroplast-electron transfer activity in Eupatorium adenophorum[J].Plant pathology,2005,54(5):671-677
[4]王洪凯,张天宇,张猛.链格孢属真菌分类研究进展[J].山东农业大学学报(自然科学版),2001,32(3):406-410
[5] Cheng Dan Dan,Jia Yu Jiao,Gao Hui Yuan,et al.Characterization of the programmed cell death induced by metabolic products of Alternaria alternata in tobacco BY-2 cells[J].Physiologia Plantarum, 2001,141(2):117-129
[6]史文景,赵其阳,焦必宁.UPLC-ESI-MS-MS结合QuEChERS同时测定柑橘中的4种真菌毒素[J].食品科学,2014,35(20): 170-174
[7] Ye F G,Xie Z H,Wu X P,et al.Determination of pyrethroid pesticide residues in vegetables by pressurized capillary electrochromatography[J].Talanta,2006,69(1):97-102
[8]吴孔弦,谷雪,阎超.加压毛细管电色谱法用于银杏叶的指纹图谱研究[J].分析化学,2009,37(4):581-584
[9] Jia L,Liu Y L,Du Y Y,et al.Pressurized capillary electrochromatographic analysis of water-soluble vitamins by combining with online concentration technique[J].J Chromatogr A,2007,1154(1/2): 416-422
[10]万青云,茹鑫,王晓曦,等.加压毛细管电色谱-激光诱导荧光法检测4种黄曲霉毒素[J].分析化学,2015(7):1063-1068
[11]陈月萌,李建华,张静,等.高效液相色谱-荧光检测法同时测定水果中的3种链格孢霉毒素[J].分析试验室,2012(6):70-73
[12]何强,李建华,孔祥虹,等.超高效液相色谱-串联质谱法同时测定浓缩苹果汁中的4种链格孢霉毒素[J].色谱,2010,28(12): 1128-1131
[13]JURG N,PATRICK S,MARTIN R,et al.Determination of six Alternaria toxins with UPLC-MS/MS and their occurrence in tomatoes and tomato products from the Swiss market[J].Mycotoxin Research, 2011,27(5):265-271
[14]DUAN Zhao hui,LIN Zhuang sen,YAO He rui,et al.Preparation of artificial antigen and egg yolk-derived immunoglobulin(IgY)of citrinin for enzyme-linked immunosorbent assay[J].Biomedical and Environmental Sciences,2009,22(3):237-243
[15]杜建中,陈海莉,吴金媚,等.毛细管电泳分离测定霉变食品中桔青霉素的研究[J].食品科学,2009,30(6):183-187
[16]PAUL J T.Matrix effects:the achilles heel of quantitative high performance liquid chromatography-electrospray-tandem mass spectrometry[J].Clinical Biochemistry,2005,38(4):328-334
Simultaneous Determination of Alternaria mycotoxins in Food by Pressure Capillary Electrochromatography Combined with SPE
XUE Ling-wei1,HU Dai-yu2,ZHANG Qiu-yue3,HAO Yu-xing3,SUN Qin3,YUAN Bo1,JIANG Ji-hong1,*
(1.Key Laboratory of Biotechnology for Medicinal Plant of Jiangsu Province,Jiangsu Normal University,Xuzhou 221116,Jiangsu,China;2.Dong'e Agriculture Bureau,Liaocheng 252200,Shandong,China;3.School of Life Science,Jiangsu Normal University,Xuzhou 221116,Jiangsu,China)
A method was developed for simultaneous determination of three mycotoxins(AME,AOH and ALT)with SPE-pCEC using the material of moldy citrus.After being extracted by acetonitrile,salted-out dehydration by anhydrous MgSO4and NaCl,purified by C18SPE extraction,the test samples were gradient elution of acetonitrile with containing 0.1%formic acid as mobile phase and separating column with C18capillary as chromatographic column,using fluorescence detector for testing.The linearity of this method in the range of 2 μg-200 μg/L is good.The r2correlation coefficient was over 0.991 5.The detection limit was 0.1 μg/kg-0.9 μg/kg. Results showed that this method was rapid,accurate,sensitive and suitable for the fast detection of the three kinds of common alternaria mycotoxins comes from food and fruit.
pressurized capillary electrochromatography;solid phase extraction;Alternaria mycotoxins
10.3969/j.issn.1005-6521.2017.08.022
2016-08-04
国家自然基金项目(31170605,31370646);江苏师范大学创新训练计划项目(201510320103X,201603017,201603018)
薛羚伟(1992—),男(汉),硕士研究生,研究方向:药食植物分析检测。
*通信作者:蒋继宏(1962—),男(汉),教授,博士。

