硫酸酯化裂褶菌多糖的制备及其抗氧化活性研究
张虽栓,蔡花真
(河南质量工程职业学院,河南平顶山467000)
硫酸酯化裂褶菌多糖的制备及其抗氧化活性研究
张虽栓,蔡花真
(河南质量工程职业学院,河南平顶山467000)
采用水提醇沉法提取裂褶菌多糖,用磺酰化法对其进行硫酸酯化,经红外光谱定性分析,硫酸钡比浊法定量计算得出硫酸基的含量。采用邻二氮菲-Fe2+氧化法测定裂褶菌多糖和裂褶菌硫酸酯对羟自由基的清除作用。结果表明:硫酸基含量为13.9%,硫酸基取代度(DS)为1.26时,硫酸酯化裂褶菌多糖的抗氧化活性比裂褶菌多糖增加2.6倍。硫酸酯化修饰能提高裂褶菌多糖的抗氧化活性。
裂褶菌多糖;硫酸酯化;硫酸基鉴定;抗氧化
裂褶菌多糖(Schizophyllan polysaccharide)是从裂褶菌子实体、菌丝体或发酵液中提取出来的水溶性多糖,具有β-(1,6)分支的β-(1,3)-D-吡喃型葡聚糖[1],是裂褶菌中最主要的生物活性物质之一,具有抗肿瘤、抗菌、抗辐射、提高机体免疫力等多种药理活性[2]。
研究发现,在天然多糖分子中引入某种离子基团并且具有恰当的取代度时,不仅能够显著改善多糖在水溶液中的溶解度,而且可以使多糖在水溶液中的链构象发生改变,从而使其具有某种特定的结构而提高生物活性[3]。硫酸酯化多糖是多糖大分子链中单糖分子上某一个或几个羟基被硫酸根所取代而形成的天然及半合成的生物活性多样、构效关系鲜明的多糖修饰物,由于具有抗凝血、抗病毒、抗肿瘤、抗氧化等诸多独特的作用[4],受到人们的广泛重视。
本文以裂褶菌多糖为原料,采用磺酰化法对裂褶菌多糖进行硫酸化修饰,研究裂褶菌多糖及其硫酸酯对超氧阴离子自由基的清除能力,以期了解裂褶菌多糖硫酸酯修饰对多糖抗氧化作用的影响,为裂褶菌多糖及其衍生物的开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
原料:裂褶菌,产自于云南昆明云蕈科技开发有限公司。氯磺酸、无水吡啶、DMF、三氯乙酸、邻二氮菲、硫酸亚铁、氯化钡、硫酸钾、明胶、磷酸氢二钠、双氧水、无水乙醇、磷酸二氢钠、氢氧化钠、均为分析纯。
1.2 仪器与设备
FA2004B电子天平:上海天美;FZ102微型植物粉碎机:北京中兴伟业;S10-3恒温磁力搅拌器:北京松源华兴科技发展有限公司;N-1001旋转蒸发仪:上海跃进;FD-1C-55型冻干机:北京医用离心机厂;GL-21M型高速冷冻离心机:长沙湘仪;UV-1800紫外分光光度计:上海精密科学仪器有限公司;UV-2802PC紫外扫描仪:龙尼柯;Spectrum Two红外光谱仪:PerkinElmer公司。
1.3 方法
1.3.1 裂褶菌多糖的提取[5]
裂褶菌干粉→粉碎→过筛(40目)→去离子水浸泡→过滤→蒸发浓缩→氯仿-正丁醇(体积比4∶1)混合溶液去蛋白→乙醇沉淀→冷冻干燥→裂褶菌多糖。
1.3.2 磺酰化试剂的制备[6]
在冰盐浴冷却和搅拌条件下,将8 mL无水吡啶加入带有冷凝管和磁力搅拌装置的50 mL干燥三颈烧瓶中,用滴液漏斗慢慢加入氯磺酸3 mL,控制滴加速度为10滴/min,反应1 h,得淡黄色固体,即磺酰化试剂。
1.3.3 硫酸化裂褶菌多糖的制备[7]
准确称取0.2 g裂褶菌多糖溶解于15 mL N,N-二甲基甲酰胺(DMF)中,加入20 mL磺酰化试剂,控制温度,在搅拌下反应一定时间,反应产物于冰浴中冷却,用3 moL/L NaOH中和至pH=7,加入3倍体积95%乙醇使多糖沉淀,于4℃静置过夜,离心分离收集沉淀,用水复溶,流水透析48 h,蒸馏水透析12 h,冷冻干燥,得硫酸酯化裂褶菌多糖。
1.3.4 裂褶菌硫酸酯的鉴定(硫酸基的定性)
红外光谱法:常规溴化钾混合压片法1.3.4.2硫酸酯化裂褶菌多糖硫酸根离子含量的测定。
1)标准曲线的绘制
精确称取105℃干燥恒重的K2SO40.217 5 g,以1 mol/L盐酸定容至50 mL得25 mmol/L SO42-标准溶液,再配制3%三氯乙酸溶液和BaCl2-明胶溶液(BaCl21.0%,明胶0.5%),按表1实验条件和数据加入具塞试管,室温静置15 min,在360nm处测定其吸光值A1;再以相同体积的0.5%明胶溶液代替BaCl2-明胶溶液按照上述操作方法在360 nm处测定其吸光度A2,以(A1-A2)对硫酸根浓度作标准曲线[8]。
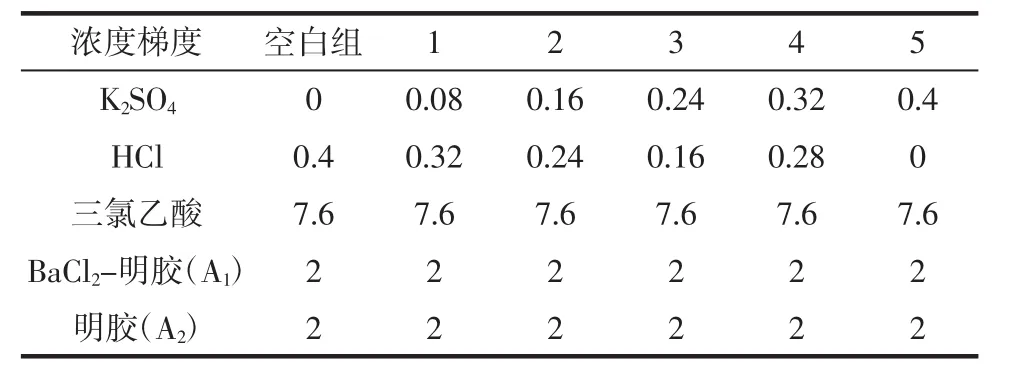
表1 氯化钡-明胶比浊法标准曲线的绘制Table 1 Standard curve of the barium chloride-gelation turbidimetry mL
2)试样中硫酸根含量的测定[9]
称取硫酸酯化裂褶菌多糖试样20 mg于安瓿瓶中,加入2 mL 1 mol/L HCl溶液,N2保护下封管。沸水浴加热水解1 h,取0.2 mL进行试样溶液进行分析,按照绘制标准曲线的方法,测定其吸光度A1。
根据标准曲线得到试样中SO42-的百分含量,硫酸酯化裂褶菌多糖中硫酸基的取代度(DS)按下式计算:

式中:DS为硫酸基取代度;S%为样品中硫酸根的百分含量。
1.3.5 裂褶菌多糖对羟自由基的清除作用
采用邻二氮菲-Fe2+/H2O2氧化法[10]测定试验体系中羟自由基的氧化作用。分别按表2加入试剂及多糖样品,将上述试管同时置于37℃的恒温水槽中,保温60 min,测定其在波长536 nm处的吸光度(A值),取3次实验数据平均值,按下式计算羟自由基清除率:
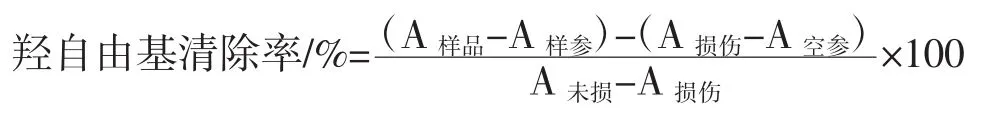

表2 邻二氮菲-H2O2/Fe2+体系加样表/总体积为10 mLTable 2 Sample list of phenanthroline-H2O2/Fe2+/volume for 10 mLmL
2 结果与分析
2.1 裂褶菌多糖的分离纯化
SephadexG-200凝胶柱层析谱图如图1。

图1 SephadexG-200凝胶柱层析谱图Fig.1 The chromatography spectrogram of SephadexG-200 gel column
冷冻干燥的裂褶菌多糖粗品经SephadexG-200凝胶柱分离,主要分离得到了一种多糖,命名为SPG,分离图谱见图1,层析结果为单一峰,说明裂褶菌多糖为均一组分。
2.2 裂褶菌多糖及硫酸酯化裂褶菌多糖的红外光谱分析
裂褶菌多糖的红外光谱图如图2,硫酸酯化裂褶菌多糖的红外光谱图如图3。

图2 裂褶菌多糖(SPG)的红外图谱图Fig.2 The infrared spectrogram of SPG

图3 硫酸化裂褶菌多糖(SSPG)的红外图谱图Fig.3 The infrared spectrogram of SSPG
为了进一步裂褶菌糖多糖和硫酸酯化裂褶菌多糖在糖键上的变化,本实验采用KBr压片法用红外光谱仪对裂褶菌多糖(SPG)及其硫酸酯化裂褶菌多糖(SSPG)进行红外光谱扫描,分别所得到红外图谱见图2和图3。裂褶菌多糖(SPG)红外光谱如图2所示,裂褶菌多糖在3 200 cm-1~3 500 cm-1的宽峰是O-H伸缩振动;2 995.44 cm-1的峰为糖类C-H伸缩振动,在这个区域的吸收峰是糖类的特征吸收峰;1 428.54 cm-1的不太尖的吸收峰是C-H的变角振动;1 000 cm-1~1 200 cm-1的比较大的吸收峰是由两种C-O伸缩振动所引起的;885.87 cm-1处的吸收峰为吡喃糖β型C-H的变角振动的特征吸收峰,呋喃糖是不会有这种吸收峰的,故可知糖苷键为β型,糖环形态为吡喃糖环[11-12]。
硫酸酯化裂褶菌多糖(SSPG)如谱图3中3200cm-1~ 3 500 cm-1的吸收峰为多糖中-OH的吸收峰的变窄,说明羟基数量有所减少;在1 310 cm-1附近有一明显的吸收峰该峰为-OSO3的S=O伸缩振动吸收峰;845.87 cm-1有一明显的吸收峰,该峰为-C-O-S的伸缩振动峰;这表明硫酸中的硫酸基被转移到了裂褶菌多糖样上,形成了新的化学键。
裂褶菌多糖经硫酸化前后,在吸收波形,波数,吸收峰等指标上十分接近,这表明了两者的化学组成十分相近。
2.3 硫酸酯化裂褶菌多糖中硫酸根的定量分析
采用硫酸钡比浊法,测定不同浓度下硫酸基标准液在360 nm处的吸光度,得硫酸基含量的标准曲线如图4所示,线性关系良好,线性回归方程为:y=1.113x+ 0.001 4;R2=0.999 7。
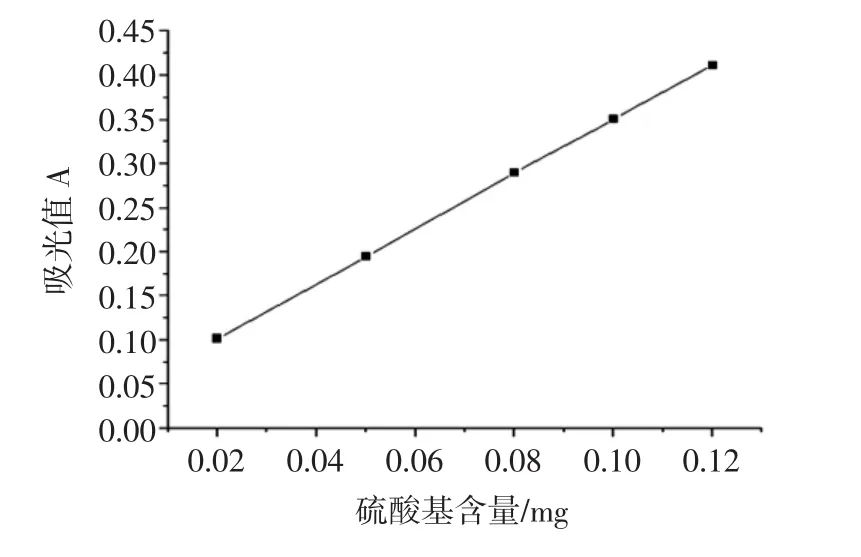
图4 硫酸基含量测定标准曲线Fig.4 Calibration curve for the determination of sulfate conten
对裂褶菌多糖采用磺酰化法进行硫酸酯化,反应完毕后,反应液为黄褐色,有少量沉淀物。离心取上清液,透析,5倍95%乙醇沉淀,沉淀物溶解后再次透析,透析液冷冻干燥,得到淡黄偏白色产物,即为裂褶菌多糖硫酸酯。对其硫酸基的吸光度同样进行3组检测,其结果见表3。
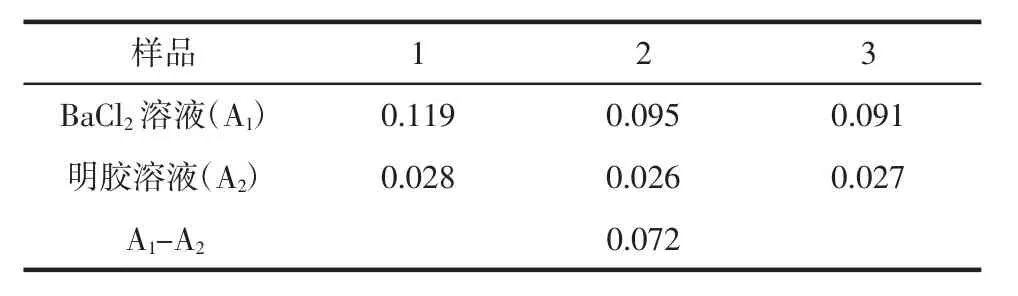
表3 样品的吸光度值Table 3 The absorbance values of the sample
由回归方程得出:0.2 mL样品中硫酸根的含量为0.069 9 mg,得出裂褶菌多糖硫酸酯中硫酸基的含量为13.9%。
即可算出硫酸基的取代度:DS=1.62×%S(32-1.02×%S)=1.26
2.4 SSPG的抗氧化活性
分别配置浓度为100、200、300、400、500 μg/mL的SSPG和SPG溶液,这两种多糖对羟自由基的清除作用如图5所示。
由图5可知:两种多糖溶液对羟自由基都有一定的清除作用,且随着多糖含量的增加,对羟自由基的清除作用在增强。经硫酸化后的裂褶菌多糖对羟自由基清除能力大幅提升,多糖浓度为500 μg/mL时清除率约为原多糖的2.6倍,高达42%。在低浓度下也表现出较高清除能力,并明显高于SPG的清除作用。

图5 不同浓度的多糖溶液对羟自由基的清除率Fig.5 Hydroxyl radical scavenging effect of polysaccharide solution in different concentration
分析结果可能是由于裂褶菌多糖中的部分羟基被硫酸基取代后使吡喃型糖环的构象发生一定的扭曲或转变,可能会有利于硫酸基和糖环上的羟基形成氢键,另外,这些阴离子基团间的相互排斥作用使糖苷链链段适当伸长[13],因而在糖链局部可能形成螺旋结构,糖链延伸,有序性增加,降低了多糖的黏度,增强了与自由基的结合能力[14]的原因。
3 结论
3.1 组分分析
经SephadexG-200凝胶柱层析结果为单一峰,说明裂褶菌多糖为吡喃型葡聚糖单一组分。
3.2 红外谱图
对得到的裂褶菌多糖进行硫酸酯化,得到淡黄偏白色产物SSPG,对其进行鉴定,通过与SPG的红外光谱对比分析,SPG在3 355.20、2 995.44、1 638.44、1 075.99、885.87 cm-1处出现吸收峰;SSPG在3 355.20、2 995.44、1 638.4、1 240.45、1 075.99、845.87、570.40 cm-1处形成吸收峰。
通过对SPG和SSPG的红外谱图的对比可知,在吸收波形、波数、吸收峰等特征指标上十分接近,这表明了两者的化学组成基本一致。但是在3 382.16、1 240.45、845.87 cm-1处SSPG与SPG形成的吸收峰有明显差异。根据相关资料表明,多糖中3 600 cm-1~ 3 200 cm-1的-OH的吸收峰明显变窄,说明多糖中部分羟基已被取代;在1 240.45 cm-1处形成的吸收峰,是由-OSO3的不对称的S=O键伸缩振动形成的特征峰;在845.87 cm-1处的吸收峰是C-O-S键振动引起的特征吸收峰,这表明硫磺酰中的硫酸基已被转移到了裂褶菌多糖上,形成了新的化学键。
最后,通过硫酸比浊法测定裂褶菌多糖修饰物硫酸基的含量为13.9%,取代度为1.26。
3.3 抗氧化性分析
裂褶菌多糖和裂褶菌多糖硫酸酯对羟自由基具有一定的清除作用,其清除率随着多糖浓度的增大而增强,且经过修饰后的裂褶菌多糖硫酸酯的清除能力明显高于裂褶菌多糖,这表明裂褶菌多糖经硫酸化分子修饰后,由于引入硫酸根,导致分析的极性增加、水溶性提高和黏度降低等理化性质变化,从而使其生物活性明显增强。
[1] 胡德群,胡鸣.裂褶菌多糖的研究[J].四川中草药研究,1994(36): 21-32
[2]张虽栓,李延垒,高诚伟.相应曲面法优化裂褶菌多糖的微波辅助提取工艺研究[J].河南农业大学学报,2014,48(4):449-455
[3]赛福丁-阿不拉,王君敏,米克热木·沙衣布扎提.多糖及其硫酸化衍生物的抗病毒及免疫增强活性研究进展[J].天然产物研究与开发,2013,25(4):572-575,529
[4]Athukorala Y,Ahn G N,Jee Y-H.Antiproliferative activity of sulfated polysaccharide isolated from an enzymatic digest of ecklonia cava on the U-937 cell line[J].Journal of Applied Phycology,2009,21(3): 307-314
[5]张虽栓,蔡花真.高分子量裂褶多糖发酵培养工艺的正交优化[J].食品研究与开发,2013,34(11):42-45
[6] 郭晓强,何钢,刘嵬,等.硫酸酯化银耳多糖的制备及抗氧化性活性研究[J].天然产物研究与开发,2013,25(6):747-751
[7] 彭永华,金征宇,王元凤,等.优选荼多糖硫酸酯化工艺的研究[J].食品与机械,2006,22(6):45-46
[8] Xie J,Zhang J,Liu H.Preparation and antioxidant research of pumpkin polysaccharide sulfate[J].Sci Technol Food Ind,2008,29(9):60-62
[9]张惟杰.糖复合物生化研究技术[M].2版.杭州:浙江大学出版社, 2006:193-292
[10]陈畅,罗珊珊,张长铠,等.3种虫草抗氧化活性的研究[J].中国升华药物杂志,2004,25(4):212-214
[11]雷德柱,于淑娟,曹珍年.灰树花胞外多糖的结构分析[J].菌物系统,2002,21(2):280-282
[12]李兆兰,李学信.裂褶菌胞内多糖的分离纯化鉴定及其性质[J].真菌学报,1994,13(4):267-272
[13]Vollmert Bruno.高分子化学基础[M].黄家贤,唐慰慈译.北京:化学工业出版社,1996:395
[14]李国荣,刘娜,张静等.鸡腿菇多糖硫酸酯化条件的优化及抗氧化活性研究[J].西北农林科技大学学报(自然科学版),2010(11): 127-133
Preparation and Antioxidative Activities of the Sulfated Schizophyllan Polysaccharide
ZHANG Sui-shuan,CAI Hua-zhen
(Henan Vocational College of Quality Engineering,Pingdingshan 467000,Henan,China)
The Schizophyllan polysaccharide was extracted by water extraction and ethanol precipitation method.The polysaccharide esterification were synthetized by chlorosulfonic acid method and was confirmed by infrared spectroscopy.The content of sulfate radical was determined by barium sulfate turbidity.The effects of polysaccharides scavenging hydroxyl were determined by phenanthroline-metal iron-H2O2system.The results showed that:when sulfate replaced was 13.9%,sulfation rate of 1.26 sulfated Schizophyllan polysaccharide antioxidant activity increased by 2.6 times than the unmodified polysaccharide.The antioxidant activity of Schizophyllan polysaccharide can be improved through sulfation.
Schizophyllan polysaccharide;sulfation;sulfuric acid-based identification;antioxidant
10.3969/j.issn.1005-6521.2017.08.004
2016-06-08
河南省科技攻关项目(142102210222c)
张虽栓(1970—),男(汉),副教授,硕士,主要从事食品与药物化学的研究。

