香蕉低聚糖对小鼠脏器的影响研究
汪雨亭,陈挺强,王娟
(华南理工大学食品科学与工程学院,广东广州510641)
香蕉低聚糖对小鼠脏器的影响研究
汪雨亭,陈挺强,王娟*
(华南理工大学食品科学与工程学院,广东广州510641)
选取皇帝蕉(Musa AA Pisang Mas)和粉蕉(Musa ABB Pisang Awak),提取低聚糖后分别设置2种浓度[高剂量组2.5 g/(kg·BW·d)和低剂量组1.25 g/(kg·BW·d)],通过测定灌胃4周的小鼠脏器质量(包括心、肝、脾、肺、肾、胃)和脏器系数,结合扫描电镜技术观察小鼠肝脏、脾脏器官的细胞结构,考察香蕉低聚糖对受试小鼠脏器的影响。脏器质量和脏器系数结果表明,空白组与四组剂量组之间、4组剂量组内的各脏器间的差异均不具有显著性(P>0.05);同时肝脏和脾脏的扫描电镜观察亦未发现明显区别,说明2种香蕉在两种浓度下未对受试小鼠的脏器造成明显的变化或不良的影响。
香蕉;低聚糖;脏器系数;扫描电镜
香蕉(Masa parasdisiac),又名甘蕉、芭蕉等,属芭蕉科(Musaceae)芭蕉属(Musa),多年生单子叶大型草木[1]。香蕉是全球贸易量最大、鲜果消费量最大的水果,栽培区域遍及全球超过100个国家和地区,主要集中在南北纬20°区间的热带、亚热带地区[2]。作为一款老少咸宜的水果,香蕉果实营养丰富[3],且具有良好的保健功能[4]。
目前国内外针对香蕉低聚糖的的研究相对匮乏,除Wang等[5]曾设计动物实验证实大蕉低聚糖具有促进肠道蠕动的效果外鲜见报道。本文通过测定灌胃四周的小鼠的脏器系数(包括心、肝、脾、肺、肾、胃),结合扫描电镜技术观察小鼠肝脏、脾脏器官的细胞结构,考察香蕉低聚糖对受试小鼠脏器的影响,以期丰富香蕉低聚糖研究领域的研究资料。
1 材料与设备
1.1 材料
昆明种小白鼠:无特定病原体(Specific pathogen Free,SPF)级别,雄性,初始体重为12 g~15 g,由广东省医学实验动物中心提供,许可证号:SCXK(粤)2013-0002。动物实验已获华南农业大学实验动物伦理审查委员会批准。按要求喂养受试动物,脱颈处死后取其脏器作为研究对象。
1.2 试剂
香蕉低聚糖:华南理工大学食品科学与工程学院自制[6];0.1 mol/L PBS缓冲液(pH7.4),2.5%戊二醛(体积分数,0.1 mol/L PBS缓冲液配制,pH=7.4)、1%(体积分数)锇酸、50%~100%(体积分数)乙醇、醋酸异戊酯:华南农业大学测试中心提供。
1.3 仪器设备
JA-1003电子天平:上海精密科学仪器有限公司;FEI-XL 30:环境扫描电子显微镜:荷兰FEI有限公司;SCD500型离子溅射仪:瑞士Bal-Tec有限公司;HCP-2型临界点干燥仪:瑞士Bal-Tec有限公司。
1.4 动物分组
在实验条件下,经3 d~5 d适应性喂养后,随机对受试小鼠进行分组。选取皇帝蕉(Musa AA Pisang Mas)和粉蕉(Musa ABB Pisang Awak),分别设置2种浓度[高剂量组2.5 g/(kg·BW·d)和低剂量组1.25 g/(kg· BW·d)]开展实验。共设置5个实验组(每组10只小鼠):空白对照组、皇帝蕉高剂量组、皇帝蕉低剂量组、粉蕉高剂量组和粉蕉低剂量组。
1.5 饲养方法
香蕉低聚糖均经口灌胃给予受试小鼠,空白对照组同样途径给予蒸馏水,全部小鼠均以SPF级饲料喂饲。于华南农业大学实验动物中心饲养,屏障环境[恒温(23±3)℃,恒湿50%~70%,安静洁净,昼夜各12 h交替]。连续正常培养四周后,脱颈处死取其新鲜脏器,按要求处理得到待测样品。
2 方法
2.1 脏器质量及脏器系数的测定
连续给予受试样品四周,称重后立即脱颈椎处死动物,剖腹取小鼠心脏、肝脏、脾脏、肾脏、胃、小肠并称重。各项脏器系数由下列公式计算得到[7]:
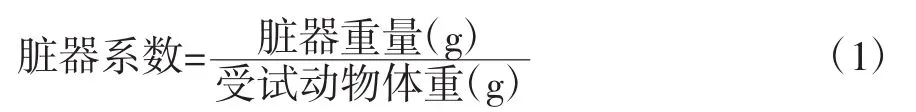
使用SPSS Statistics 20统计软件分析所得实验数据,方差分析(Analysis of variance,ANOVA)前先进行方差同质性检验(Homogeneity of variance);选择Duncan多范围检验(Duncan’s multiple range test)进行两两比较;显著性水平选择0.01和0.05;数据以x+s表示。
2.2 扫描电镜实验
连续给予受试样品4周,称重后立即脱颈椎处死动物,剖腹取新鲜的小鼠肝脏、脾脏。
样品的处理方式为双固定临界点干燥[8],主要流程为:取样→前固定→后固定→脱水→过渡→干燥→镀金→观察。
3 结果与分析
3.1 脏器指标的测定结果
脏器系数又称为脏体比系数,指实验动物脏器与其体重的质量之比。健康正常的动物的脏器系数是相对恒定的数值,因此该系数可用来衡量动物的脏器是否受到不良影响,是动物毒理学研究中一项重要指标[9]。
实验期间各组受试动物的精神状态和健康状态良好,各项生理活动正常。解剖观察发现,所有受试小鼠的脏器形态健康,未发生明显病变。两种香蕉低聚糖对受试小鼠的脏器重量和脏器系数的影响结果分别如表1和表2所示。
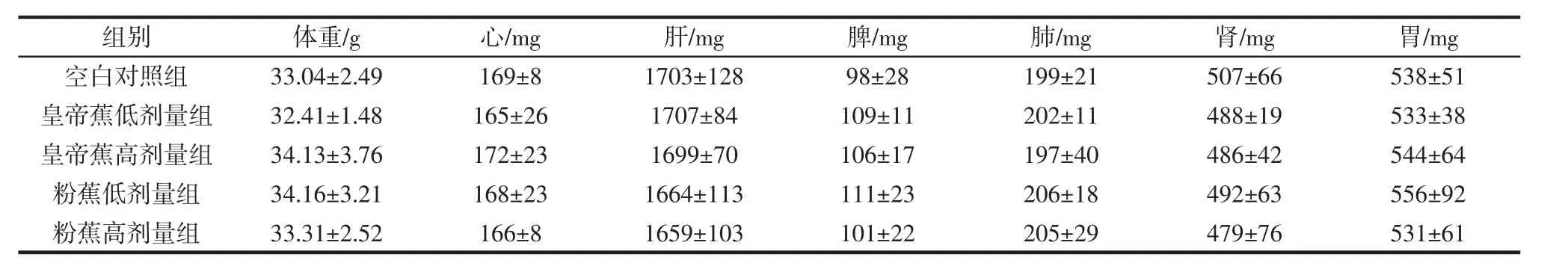
表1 低聚糖对小鼠脏器重量的影响Table 1 Organ weight of the experimental mice

表2 受试小鼠脏器系数值Table 2 Organ coefficient of the experiment mice
由表1和表2可知,在脏器重量和脏器系数两个考察项目上,空白对照组与四组剂量组之间、四组剂量组内的各脏器(心、肝、脾、肺、肾、胃)间的差异均不具有显著性(P>0.05),说明在实验期间,受试样品对受试小鼠未造成明显的脏器变化。
夏介英等[10]对28日龄、56日龄和114日龄的正常健康生长的SPF级昆明小鼠的主要脏器重量和系数作了测定,取其与本实验相近日龄的雄性小鼠数据相比较发现,本实验中各组受试小鼠主要脏器重量和系数数据与其接近,说明本实验中各组受试小鼠的生长发育状况良好,受试样品未对受试小鼠造成不良影响。
3.2 扫描电镜观察肝脏和脾脏结果
肝脏是哺乳动物机体内非常重要的代谢器官,有“解毒排毒”的功能,因此对生物染毒或病变有一定的指向功能;脾脏是哺乳动物机体内非常重要的免疫器官,含有大量的淋巴细胞,是机体发挥免疫作用的中心。因此,选取这两种器官作为观察对象。作为一类获取生物样品表面微观形态的重要手段,扫描电镜技术(Scanning Electron Microscope,SEM)已广泛用于生物学研究中,具有制样简单、分辨率高、立体感强等优点,在动物脏器观察上的应用颇多[11-14],因此,该方法的可靠性较高。
3.2.1 肝脏
肝小叶是肝脏的基本结构和功能单位,由中央静脉串起的一块块单层肝细胞组成,称为肝板(或肝索),周家兴等[15]曾形容这单层细胞结构为海绵骨架,细胞缝隙则是肝血窦。利用扫描电镜在800倍放大倍数下可清晰观察肝细胞板结构,如图1所示。

图1 扫描电镜下实验小鼠肝脏结构(SEM,800×)Fig.1 Microstructure of liver organ of the experimental mice under scanning electron microscope 800×
由图可见肝细胞板切面整齐,纹理清晰,细胞排列紧密有序,单位面积内细胞数量相当,同时未见明显特异肝血窦或突变区域。比较五组受试肝脏切片,未发现明显差异。
肝细胞是构成肝脏的主要细胞,主要由DNA和组蛋白构成,内含丰富的细胞器。利用扫描电镜在3 200倍下观察肝细胞超微结构如图2。
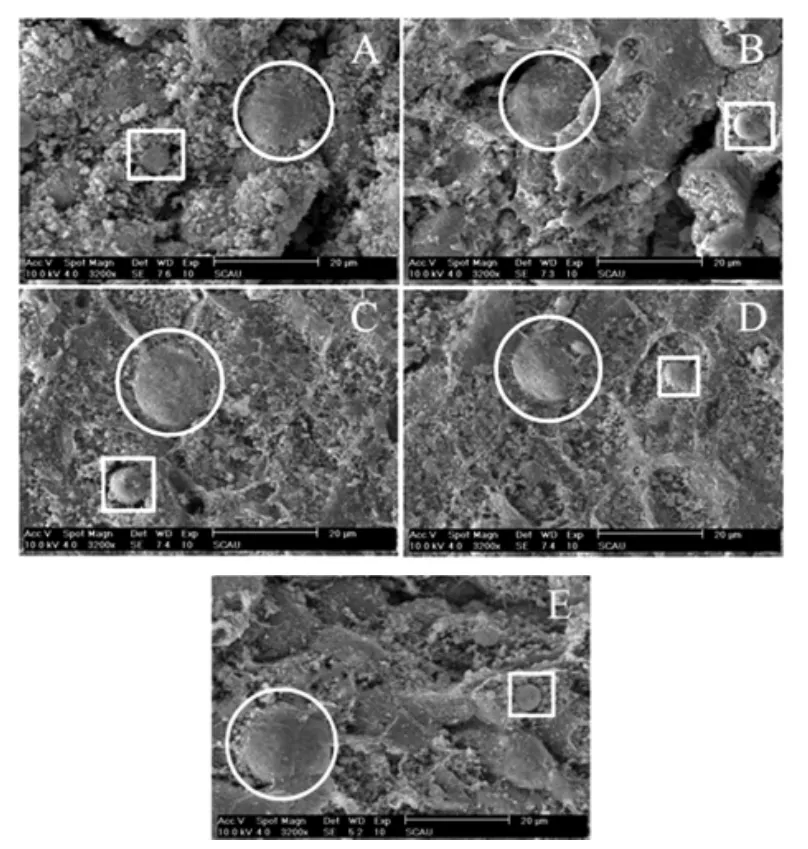
图2 扫描电镜下实验小鼠肝细胞超微结构(SEM,3 200×)Fig.2 Microstructure of liver cell of the experimental mice under scanning electron microscope 3 200×
由图可清晰观察到单个肝细胞的形态多呈椭圆(图中圆框所示),形态饱满;可清晰分辨暴露的细胞核(图中方框所示)和众多散落的线粒体等细胞器。比较五组受试肝脏切片,在单个细胞层面,皇帝蕉两剂量组相比其余三组,暴露的细胞器更多,但差别不大;但整体而言,五组受试肝脏切片细胞皆饱满,细胞核未见萎缩,拥有数量众多的线粒体等细胞器。
3.2.2 脾脏
脾脏是哺乳动物机体内非常重要的免疫器官,其组成可分为白髓(由大量的密集的淋巴细胞组成,特异性免疫应答的主要发生场所)、红髓(由脾血窦和脾索组成,吞噬作用的主要发生场所)和边缘区(白髓和红髓的交界处,捕获、识别抗原并诱发应答的主要场所)三部分[16]。
利用扫描电镜在800倍放大倍数下观察脾脏细胞,如图3所示。由图可见,5组受试脾脏切片结构相似:都是由交织成网的脾索内“包裹”着数量巨大的淋巴细胞。比较五组受试脾脏切片,未发现明显差异。

图3 扫描电镜下实验小鼠脾脏微结构(SEM,800×)Fig.3 Microstructure of spleen organ of the experimental mice under scanning electron microscope 800×

图4 扫描电镜下实验小鼠脾脏细胞超微结构(SEM,6 400×)Fig.4 Ultrastructure of spleen cell of the experimental mice under scanning electron microscope 6 400×
利用扫描电镜在6 400倍放大倍数下观察脾脏细胞,如图4所示。由图可见,5组受试脾脏内部结构和组成均相当复杂,充满了各类数量巨大的淋巴细胞,大小不一,形态各异,表面光滑程度不一;粗细不一的微血管交错成网;该放大倍数下可观察到部分脾脏细胞表面存在褶皱。比较五组受试脾脏切片,从单张切片结果上看,皇帝蕉低剂量组相比其余4组,其微血管分布相对更繁杂;但整体而言,从细胞表面结构、细胞形态、细胞数量等方面看,5组受试脾脏切片差异不明显。
4 结论
本实验测定了受试小鼠的脏器质量和脏器系数两个指标,结果表明空白组与四组剂量组之间、四组剂量组内的各脏器(心、肝、脾、肺、肾、胃)间的差异均不具有显著性(P>0.05),说明两种香蕉(皇帝蕉和粉蕉)在设置的两个浓度下未对受试小鼠的脏器造成明显的变化;同时与已发表文献里的数据相比较,本实验中各组受试小鼠数据与其接近,说明各组受试小鼠的生长发育状况良好,受试样品未对受试小鼠造成不良影响。
同时利用扫描电镜技术观察受试小鼠的肝脏和脾脏的超微结构,结果表明:总体而言,五组受试小鼠间的肝脏和脾脏切片的扫面电镜结果趋于一致,无论是从结构组成(组织的复杂程度、单位面积上的细胞密度等)还是从单个细胞(细胞的饱满程度、细胞器的丰富程度、表面微观结构等)考察,五组之间呈现高度相似的结果,同时未观察到明显的病变情况,说明2种香蕉(皇帝蕉和粉蕉)在设置的2个浓度下对小鼠肝脏和脾脏未造成不良的影响。
[1]朱瑜安.香蕉及其保健功能[J].中国食物与营养,2006(3):51-52
[2]吴雪珍,周灿芳,万忠,等.2010年广东香蕉产业发展现状分析[J].广东农业科学,2011(5):18-20
[3]李洪运.香蕉的营养与保健[J].中国科技信息,2005(17):105
[4] Kelly L M,Koutsoumpas J L B,Hedin C R H,et al.Dietary fructooligosaccharide intakes in patients with active Crohn's disease[J].Journal of Human Nutrition&Dietetics,2010,23(3):323
[5] J W,H H H,F C Y,et al.Structure analysis and laxative effects of oligosaccharides isolated from bananas[J].Journal of Medicinal Food,2012,15(10):930-935
[6]唐雪娟.香蕉低聚糖的分离、结构鉴定及品种比较[D].广州:华南理工大学,2014
[7]詹纯列,肖育华,许达,等.无特异病原KM小鼠脏器重量脏器系数的测定与比较[J].畜牧兽医科技信息,2010(11):31-32
[8]陈新芳,刘春玲,杨秉耀.五指毛桃花粉扫描电镜样品的制备[J].仲恺农业技术学院学报,2004,17(4):55-58
[9]袁本利.药物安全评价中脏器系数的意义及不足[J].中国新药杂志,2003(11):960-963
[10]夏介英,雷培琪,曾晓兰,等.SPF级KM小鼠主要脏器重量和血液生化值的测定[J].四川生理科学杂志,2009(3):104-107
[11]王占彬,王亚锴,赵德明,等.毛泡桐花黄酮对小鼠脾和胸腺超微结构及免疫功能的影响[J].畜牧兽医学报,2013(6):952-959
[12]张育辉,刘加坤.七种啮齿动物视觉器官形态结构的比较研究[J].兽类学报,1994(3):189-194
[13]黄慧.壳聚糖胰岛素微球在糖尿病大鼠中的降糖作用研究[D].成都:四川大学,2002
[14]顾云娣,周方成,杨山麦,等.甘草次酸和甘草酸对离体大鼠肝细胞膜效应的电镜观察[J].上海医科大学学报,2000(4):270-273
[15]周家兴,夏民,朱命炜,等.肝剖面标本的制备和扫描电镜观察[J].河南师范大学学报(自然科学版),1992(3):84-88
[16]李宗芳,张澍.脾脏的基础研究进展与展望[J].西安交通大学学报(医学版),2008(1):1-6
Effects of Banana Oligosaccharides on the Mice Organs
WANG Yu-ting,CHEN Ting-qiang,WANG Juan*
(School of Food Science and Engineering,South China University of Technology,Guangzhou 510641,Guangdong,China)
Oligosaccharides were extracted from two cultivars of bananas(Musa AA Pisang Mas and Musa ABB Pisang Awak)separately,and 2 dose groups 2.5 g(/kg·BW·d)and 1.25 g(/kg·BW·d)were set up for each variety.The weight and coefficient of major organs(including heart,liver,spleen,lung,kidney,stomach)of mice were measured;the liver and spleen were extra observed using scanning electron microscopy(SEM)to evaluate effects of banana oligosaccharides(BOS)on the mice organs.Results showed that neither the difference between the control group and the dose groups,nor the difference between the four BOS-dose groups were found significant,indicating that BOS had no negative effects on the major organs of mice.
banana;oligosaccharides;organ coefficient;scanning electron microscopy(SEM)
10.3969/j.issn.1005-6521.2017.08.001
2016-07-31
国家自然科学基金资助项目(31301530);中央高校基本科研业务费专项资金(2015ZZ122)
汪雨亭(1993—),女(汉),硕士研究生,研究方向:食品科学与工程。
*通信作者:王娟(1981—),女,副研究员,硕士生导师,博士,研究方向:食品科学与工程。

