肝细胞生长因子/转化生长因子-β1对人心房成纤维细胞增殖的作用
陈建泉,张建成,陈林,林亚洲
(1福建省立医院心血管内科,福州 350001;2福建医科大学省立临床医学院,福州 350000)
心房颤动的发病率高,是风湿性心脏病(rheumatic heart disease,RHD)患者常见的心律失常。心房颤动与心房纤维化有关[1]。心房纤维化是心房重塑的突出表现,是以胶原为主要组成的细胞外基质(extracellular matrix,ECM)的病理积累[2]。心肌成纤维细胞(cardiac fibroblasts,CFs)是心肌纤维化的效应细胞。CFs增殖、分泌胶原增多引起心肌纤维化。病理情况下,CFs增殖并转化为肌成纤维细胞(myofibroblast,Mfb)在心肌重塑中起关键作用[3]。α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)是肌成纤维细胞的标志。细胞因子和生长因子与心肌纤维化相关研究较热。转化生长因子-β1(transforming growth factor-beta 1,TGF-β1)介导CFs转化为Mfb,促进ECM过度生产和生长因子分泌,在心肌纤维化中起重要作用[4];但对CFs转化过程的抑制因素知之甚少。肝细胞生长因子(hepatocyte growth factor,HGF)可有效抗纤维化,然而,很少有关于HGF如何影响心房成纤维细胞增殖及TGF-β1刺激CFs激活的信息。本实验以RHD患者心房成纤维细胞为靶细胞,研究HGF/TGF-β1对人心房成纤维细胞增殖的作用,探讨HGF对人心房成纤维细胞TGF-β1分泌的影响,从而为心房颤动患者心房纤维化的分子机制研究及防治措施提供新的思路和依据。
1 对象与方法
1.1 研究对象
入选福建省立医院心血管外科接受换瓣手术的RHD患者20例,年龄37~62岁,其中窦性心律(sinus rhythm,SR)者和慢性心房颤动(chronic atrial fibrillation,CAF)者[心房颤动持续时间(55.74±35.27)个月)]各10例,分别作为SR组和CAF组。入选标准:(1)研究经过患者知情同意及我院伦理委员会批准(K2010-08-05);(2)术前需停用抗心律失常药物至少5个半衰期。排除合并其他器质性心脏病、严重肝肾功能衰竭、明显心力衰竭及高血压和甲亢症患者。
1.2 方法
收集所有患者术前心电图、动态心电图及超声心动图等临床资料,记录左心房内径(left atrial diameter,LAD)。
1.2.1 实验材料与仪器 胰蛋白酶(Amersco,美国),Ⅱ型胶原酶(Sigma,美国),DMEM高糖培养基(Gibico,美国),胎牛血清(Hyclone,美国),免疫荧光染色试剂盒-抗小鼠cy3、水溶性磷酸化四唑盐-1(WST-1)细胞增殖及细胞毒性检测试剂盒(碧云天生物技术研究所),小鼠波形蛋白及α-SMA单克隆抗体(Sigma,美国),逆转录-聚合酶链反应(reverse transcription-PCR,RT-PCR)A3500试剂盒(Promega,美国),Trizol(Invitrogen,美国),人重组HGF、TGFβ1(Peprotech,美国)。酶联免疫检测仪(BIO-TEK EL-311,美国)。
1.2.2 人心房(肌)成纤维细胞培养及鉴定 患者接受换瓣术时,体外循环建立之前,严格无菌操作,取新鲜右心耳约200 mg,采用胰蛋白酶和Ⅱ型胶原酶消化法及差速贴壁法体外分离心房成纤维细胞[5],接种于培养瓶(含20%胎牛血清的DMEM培养液),在37℃、5% CO2培养箱内培养,按1∶2传代,采用第2代细胞。倒置显微镜下观察细胞生长情况。免疫荧光法检测细胞α-SMA,波形蛋白染色,阳性鉴定为心房Mfb。
1.2.3 WST-1比色法检测 收集第2~3代对数生长期的心房成纤维细胞,用0.25%胰蛋白酶消化,活细胞计数,调整细胞悬液浓度后接种在96孔板,每孔5×103个细胞,每孔200 μl,CO2培养箱中继续孵育24 h,弃培养液,改用无血清DMEM培养液培养24 h,细胞同步进入静止生长期。(1)检测不同浓度HGF和TGF-β1对人心房成纤维细胞增殖的影响。实验组分别换用含不同浓度的TGF-β1(浓度分别为0.1,1,10,100 ng/ml)和HGF(浓度分别为25,50,100,200 ng/ml)的培养基,单纯培养基为含2%胎牛血清的DMEM培养液,即设为空白对照组。每孔200 μl,每组3复孔,重复3次。继续孵育48 h,然后各孔加入WST-1溶液20 μl,作用4 h。酶联免疫检测仪测定光密度(optical density,OD)值,滤光片波长450 nm。(2)检测不同时间HGF和TGF-β1对人心房成纤维细胞增殖的影响。实验组分别给予含TGF-β1(10 ng/ml)和HGF(100 ng/ml)的培养基干预。实验组和对照组细胞分别接种于4块 96孔板,每板8复孔。分别培养12,24,48,72 h后,随机抽取实验组和对照组96孔板各1块。酶标仪测定吸光度值(A450 nm)。(3)检测HGF/TGF-β1对人心房成纤维细胞增殖的影响。实验组心房成纤维细胞分别加入含TGF-β1(10 ng/ml)、HGF(100 ng/ml)和TGF-β1(10 ng/ml)+HGF(100 ng/ml)的培养基,同样设空白对照组,测定A450 nm值。
1.2.4 RT-PCR检测TGF-β1mRNA水平 消化收集第2~3代的心房成纤维细胞,以1×106/ml的密度接种于6孔板培养板中。分为3组:SR组、CAF组和HGF干预组(CAF组中再加入100 ng/ml HGF干预48 h)。以Trizol及逆转录试剂盒说明书提取各实验组细胞总RNA,并逆转录成cDNA,PCR扩增,引物序列及扩增片段如下。(1)GAPDH:上游5’-ACCACAGTCCATGCCATCAC-3’,下游5’-TCCACCACCCTGTTGCTGTA-3’,长度452 bp。(2)TGF-β1:上游5’-CAGAAATACAGCAACAATTCCTGG-3’,下游5’-TTGCAGTGTGTTATCCCTGCTGTC-3’,长度186 bp。PCR反应共30个循环。产物经2%琼脂糖凝胶电泳,利用凝胶成像系统扫描分析目标条带,各组TGF-β1基因与内参照GAPDH片段的条带灰度比值,即为各实验组细胞TGF-β1mRNA的相对表达水平。
1.3 统计学处理

2 结 果
2.1 两组患者LAD比较
SR组和CAF组的LAD分别为(4.43±0.77)和(5.76±1.37)cm,两组比较,差异具有统计学意义(P<0.05),CAF组患者LAD显著扩大。
2.2 人心房成纤维细胞的培养与鉴定
显微镜下可见原代培养的人心房成纤维细胞贴壁生长,呈梭形,细胞核椭圆形,常见2~3个核(图1A)。波形蛋白及α-SMA免疫荧光染色显示,心房成纤维细胞胞浆均染成红色(图1B和C),阳性鉴定为所需的Mfb。
2.3不同浓度HGF和TGF-β1对人心房成纤维细胞增殖的影响
不同浓度的HGF(0,25,50,100,200 ng/ml)干预人心房成纤维细胞后所测得的A450 nm值分别为0.464±0.070,0.403±0.058,0.365±0.070,0.294±0.052,0.282±0.047。各浓度组A450 nm值与空白对照组相比差异均具有统计学意义(P<0.05),HGF对心房成纤维细胞增殖的抑制作用呈剂量相关性(r=-0.686,P<0.05),相关方程为y=0.426-0.001x。但100 ng/ml和200 ng/ml的HGF间,抑制增殖作用差异无统计学意义(P>0.05),说明HGF浓度为100 ng/ml时,其抑制心房成纤维细胞增殖作用可达最强。
不同浓度的TGF-β1(0,0.1,1,10,100 ng/ml)干预人心房成纤维细胞后所测得的A450 nm值分别为0.460±0.041,0.483±0.037,0.644±0.050,0.988±0.065,0.995±0.060。各浓度组A450 nm值与空白对照组相比差异均具有统计学意义(P<0.05),TGF-β1对心房成纤维细胞增殖的促进作用呈剂量相关性(r=0.655,P<0.05),相关方程为y=0.004x+0.625。但10 ng/ml和100 ng/ml的TGF-β1间, 促增殖作用差异无统计学意义(P>0.05),说明TGF-β1浓度为10 ng/ml时,其促进人心房成纤维细胞增殖作用可达最强。
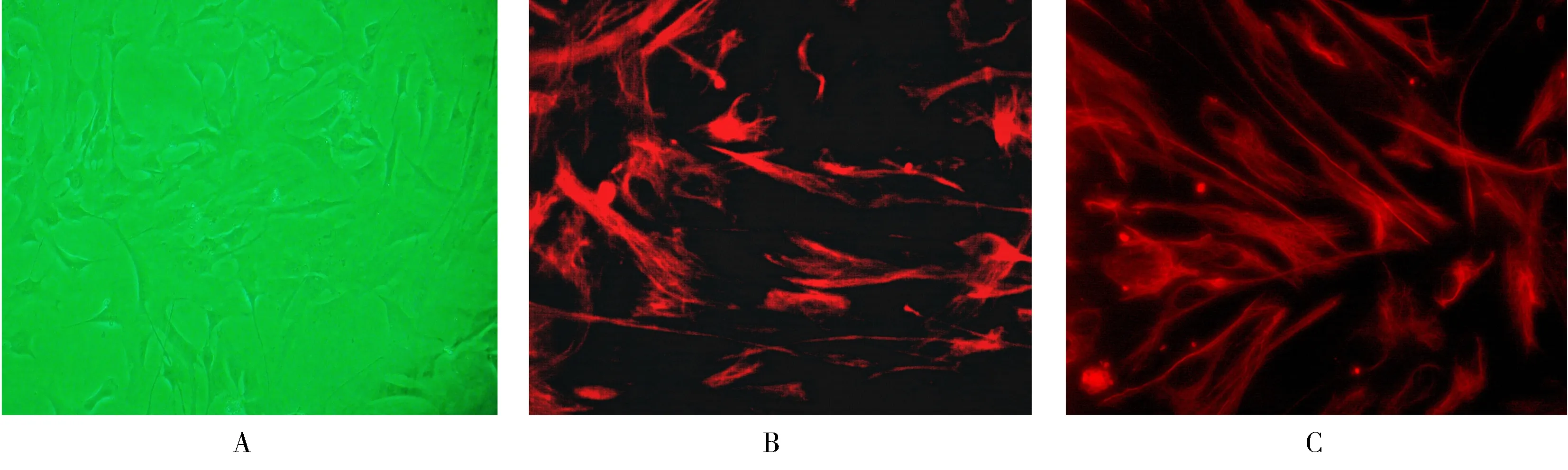
图1 原代培养细胞的形态学观察及免疫荧光鉴定
2.4不同时间HGF和TGF-β1对人心房成纤维细胞增殖的影响
除12 h外,各时间点A450 nm值与同期对照组相比差异均具有统计学意义(P<0.05)。HGF抑制心房成纤维细胞增殖作用呈时间相关性(r=0.557,P<0.05),相关方程为y=0.270+0.002x;48 h和 72 h 时的A450 nm值差异无统计学意义(P>0.05),说明48 h时HGF对人心房成纤维细胞增殖的抑制作用最明显。TGF-β1促进心房成纤维细胞增殖作用呈时间相关性(r=0.840,P<0.05),相关方程为y=0.01x+0.297;48 h和72 h时的A450 nm值差异无统计学意义(P>0.05),说明48 h时TGF-β1对人心房成纤维细胞增殖的促进作用最明显(表1)。
2.5HGF/TGF-β1对人心房成纤维细胞增殖的交互作用
空白对照组、TGF-β1组、HGF组和TGF-β1+HGF组的A450 nm值分别为0.519±0.069,0.910±0.122,0.263±0.069,0.393±0.068。与空白对照组相比,TGF-β1组的A450 nm值显著增高,而HGF组和TGF-β1+HGF组的A450 nm值均显著降低,差异均具有统计学性意义(P<0.05)。与TGF-β1+HGF组相比,HGF组A450 nm值显著降低,TGF-β1组A450 nm值显著增加,差异均具有统计学性意义(P<0.05)。表明TGF-β1和HGF可分别促进和抑制人心房成纤维细胞增殖,且HGF能够部分拮抗TGF-β1的促增殖作用。
2.6HGF对人心房成纤维细胞TGFβ1mRNA表达的影响
电泳结果显示,TGF-β1和GAPDH扩增后的电泳条带位置与设定的片段长度186 bp和452 bp一致(图2)。SR组、CAF组和HGF干预组的TGF-β1mRNA相对表达水平分别为0.92±0.66,1.78±0.98,0.67±0.64。与CAF组相比,SR组和HGF干预组的TGF-β1mRNA表达水平均显著减少,差异具有统计学意义(P<0.01),说明HGF能够抑制人心房成纤维细胞TGF-β1的分泌。
3 讨 论
心肌纤维化是许多心血管疾病的病因,包括心肌梗死、心肌病、高血压和心房颤动。心肌损伤导致不良心脏重塑和心肌纤维化。心房重塑包括电重塑和结构重塑,前者可逆,可采用肺静脉隔离和辅助消融心房颤动治疗[6],后者常不可逆,表现为心房扩大和心房纤维化,这可能是心房颤动触发和持续的基础[7]。本研究结果也表明CAF患者的LAD明显扩大。
表1不同时间HGF和TGF-β1对人心房成纤维细胞增殖的影响
Table 1 Effect of HGF and TGF-β1intervention on proliferation of human atrial fibroblasts at different times

Group 12h24h48h72hHGF Test0.230±0.0750.305±0.060*0.378±0.070*0.398±0.072* Control0.242±0.0780.383±0.0710.551±0.0590.596±0.073TGF-β1 Test0.249±0.0550.687±0.049#0.859±0.067#0.907±0.080# Control0.243±0.0510.375±0.0280.566±0.0340.589±0.051
HGF: hepatocyte growth factor; TGF-β1: transforming growth factor-beta 1. Compared with HGF control group,*P<0.05; compared with TGF-β1control group,#P<0.05
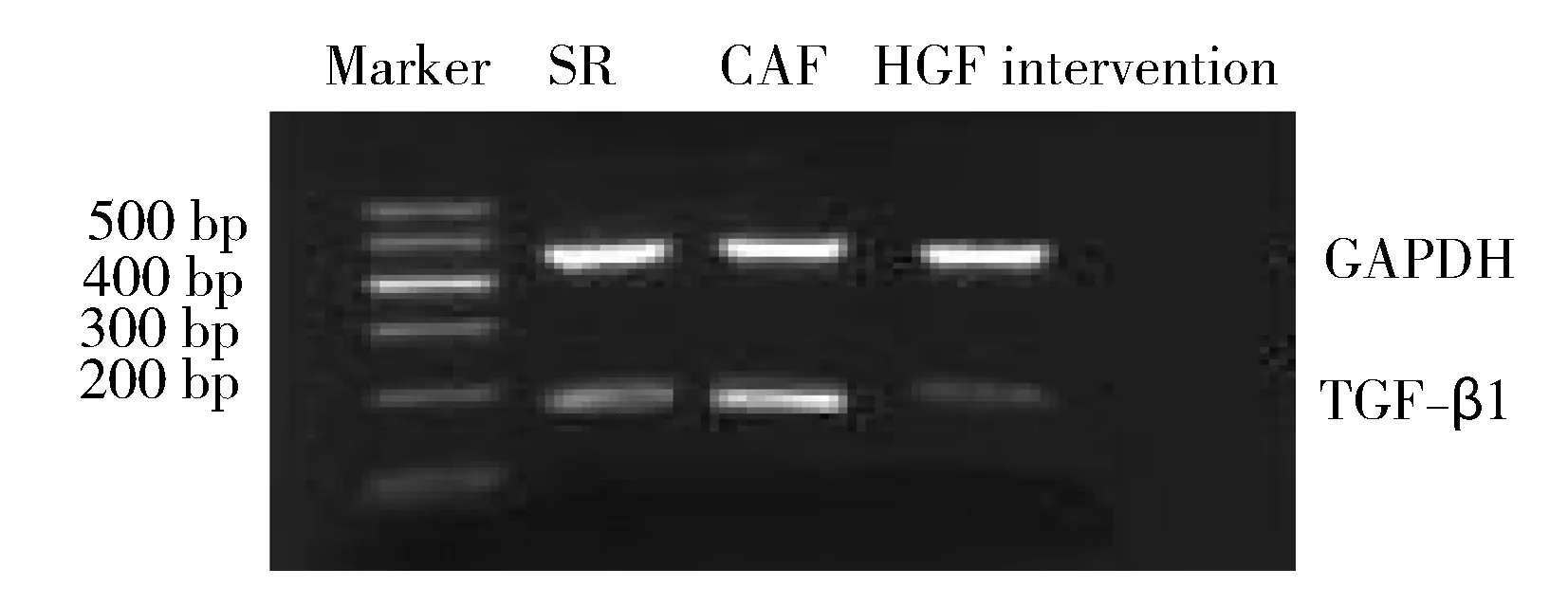
图2 TGF-β1 mRNA表达的电泳图
CFs占心脏细胞总数的30%,起源于间充质的扁平梭形细胞,负责ECM代谢的动态平衡。心肌组织损伤后,CFs增殖、分化成Mfb,合成和分泌胶原等ECM蛋白能力增强,对瘢痕形成和伤口愈合至关重要[8]。α-SMA是分化的标记。ECM过度沉积,增加心肌组织刚度,导致心脏组织病理重构。因此,CFs的异常增殖和转化是心肌纤维化的标志[9]。限制CFs增殖和转化可能是心肌纤维化的潜在治疗靶点。波形蛋白是CFs的主要结构蛋白,α-SMA是Mfb的标志蛋白,本实验结果显示,显微镜下细胞形态良好,波形蛋白和α-SMA免疫荧光染色阳性,证实为人心房Mfb。
TGF-β1在CFs的增殖、转化和心肌纤维化过程中起关键作用。研究发现,心肌梗死后大鼠心脏TGF-β1升高,从而促进了CFs增殖、转化成Mfb,同时可激活Smad信号通路,导致胶原纤维不恰当沉积、心脏功能受损[10]。过表达和基因敲除的模型中显示,TGF-β1可诱发心肌纤维化。Nakai等[11]发现,TGF-β1与LAD呈正相关,这可能是心房颤动的后果。Choi等[12]认为,TGF-β1介导的Mfb大量增殖与心房颤动中心肌纤维化相关。Yi等[13]探讨了TGF-β1诱导大鼠CFs增殖转化为Mfb的合适浓度和刺激时间,研究发现TGF-β1在5 ng/ml的诱导浓度时,α-SMA表达最高;TGF-β1诱导α-SMA的表达呈时间依赖性;5 ng/ml的 TGF-β1刺激48 h可获得最大的α-SMA蛋白表达。Ghavami等[14]研究结果表明,10 ng/ml的TGF-β1诱导可显著增加心肌梗死患者心房成纤维细胞Ⅰ型胶原和纤维连接蛋白的合成,在72 h和120 h时有明显的诱导细胞增殖作用。国内少有关于TGF-β1对人心房成纤维细胞增殖作用的研究。本研究结果提示,TGF-β1可促进人心房成纤维细胞增殖,且呈剂量和时间相关性。10 ng/ml质量浓度和48 h作用时间的TGF-β1促增殖作用最强,这可能与此时TGF-β1结合受体已接近饱和有关。峰值与上述文献差异可能与细胞来源、疾病种类和实验条件不同有关。本课题组先期研究发现,CAF患者左心房明显扩大,心房组织及成纤维细胞的α-SMA及Ⅰ型胶原表达明显增多[15]。结合文献报道,推测TGF-β1可能通过促进人心房成纤维细胞增殖,使Mfb进一步活化,增加分泌α-SMA及Ⅰ型胶原,促进心房纤维化及心房结构重塑,从而触发心房颤动。
TGF-β1是HGF的下游因子之一,在肺、肝、肾纤维化等病理条件下,HGF具有抗纤维化的作用。关于HGF在心肌纤维化中的作用机制研究较少。Lu等[16]在猪模型中研究发现,HGF抑制CFs的增殖和分化,降低胶原合成分泌。Okayama等[17]研究表明,HGF对TGF-β1或血管紧张素Ⅱ诱导内在的CFs转化成Mfb起抑制作用,说明HGF具有负向调节CFs的功能。HGF生产过剩,与ECM的降解、抑制TGF-β1有关。其他器官纤维化的大量证据表明,在HGF和TGF-β1之间有一个反调节轴。Ghavami等[14]证实5 ng/ml TGF-β1刺激48 h后,CFs的HGF mRNA和蛋白水平显著下调。TGF-β1中断HGF自分泌/旁分泌,可能导致ECM的调节失衡,这反过来又导致心脏和脉管系统的病理过程。本实验结果显示,HGF抑制人心房成纤维细胞增殖,且呈剂量和时间相关性。100 ng/ml质量浓度和48 h作用时间的HGF抑制增殖作用达峰值,这可能与此时HGF结合受体已接近饱和有关。结合文献,推测HGF可能通过抑制人心房成纤维细胞增殖与转化,抑制心房纤维化及心房结构重塑,从而拮抗心房颤动的发生,而且HGF可部分拮抗TGF-β1的促增殖作用。RT-PCR结果表明,CAF患者心房成纤维细胞TGF-β1表达明显增加,HGF能够抑制人心房成纤维细胞转化因子分泌,从而拮抗其促心房纤维化作用。
总之,CAF患者的LAD增大,TGF-β1分泌增多。HGF能够抑制人心房成纤维细胞TGF-β1的生成,部分拮抗TGF-β1促增殖作用,有望为心房颤动的分子机制研究提供新的思路。对于HGF诱导细胞的凋亡是否参与CFs增殖的抑制过程,需要进一步实验研究。另外,本实验仅采用了WST-1法检测细胞增殖,其他较为精确的方法(如BrdU法)仍需进一步研究。
【参考文献】
[1] Adam O, Lohfelm B, Thum T,etal. Role of miR-21 in the patho-genesis of atrial fibrosis[J]. Basic Res Cardiol, 2012, 107(5): 278. DOI: 10.1007/s00395-012-0278-0.
[2] Engebretsen KV, Lunde IG, Strand ME,etal. Lumican is increased in experimental and clinical heart failure, and its production by cardiac fibroblasts is induced by mechanical and proinflammatory stimuli[J]. FEBS J, 2013, 280(10): 2382-2398. DOI: 10.1111/febs.12235.
[3] Lu D, Soleymani S, Madakshire R,etal. ATP released from cardiac fibroblastsviaconnexin hemichannels activates profibrotic P2Y2 receptors[J]. FASEB J, 2012, 26(6): 2580-2591. DOI: 10.1096/fj.12-204677.
[4] Zhou JP, Tang W, Feng Y,etal. Angiotensin-(1-7) decreases the expression of collagen ⅠviaTGF-beta1/Smad2/3 and subsequently inhibits fibroblast-myofibroblast transition[J]. Clin Sci (Lond), 2016, 130(21): 1983-1991. DOI: 10.1042/CS20160193.
[5] 陈建泉, 张建成, 许春萱, 等. 风湿性心脏病患者心房成纤维细胞的原代培养[J]. 中国心脏起搏与心电生理杂志, 2011, 25(6): 522-524. DOI: 10.13333/j.cnki.cjcpe.2011.06.029.
Chen JQ, Zhang JC, Xu CX,etal. The primary culture of atrial fibroblasts in rheumatic heart disease patients[J]. Chin J Card Pacing Electrophysiol, 2011, 25(6): 522-524. DOI: 10.13333/j.cnki.cjcpe.2011.06.029.
[6] 郭文杰, 徐伟豪, 张玉霄, 等. 持续性心房纤颤的辅助消融策略[J]. 中华老年多器官疾病杂志, 2015, 14(9): 716-720. DOI: 10.11915/j.issn.1671-5403.2015.09.163.
Guo WJ, Xu WH, Zhang YX,etal. Adjunct ablation strategies for persistent atrial fibrillation[J]. Chin J Mult Organ Dis Elderly, 2015, 14(9): 716-720. DOI: 10.11915/j.issn.1671-5403.2015.09.163.
[7] Tan AY, Zimetbaum P. Atrial fibrillation and atrial fibrosis[J]. J Cardiovasc Pharmacol, 2011, 57(6): 625-629. DOI: 10.1097/FJC.0b013e3182073c78.
[8] Lighthouse JK, Small EM. Transcriptional control of cardiac fibroblast plasticity[J]. J Mol Cell Cardiol, 2016, 91: 52-60. DOI: 10.1016/j.yjmcc.2015.12.016.
[9] Weber KT, Sun Y, Bhattacharya SK,etal. Myofibroblast-mediated mechanisms of pathological remodelling of the heart[J]. Nat Rev Cardiol, 2013, 10(1): 15-26. DOI: 10.1038/nrcardio.2012.158.
[10] Brown L. Cardiac extracellular matrix: a dynamic entity[J]. Am J Physiol Heart Circ Physiol, 2005, 289(3): 973-974. DOI: 10.1152/ajpheart.00443.2005.
[11] Nakai T, Chandy J, Nakai K,etal. Histologic assessment of right atrial appendage myocardium in patients with atrial fibrillation after coronary artery bypass graft surgery[J]. Cardiology, 2007, 108(2): 90-96. DOI: 10.1159/000095936.
[12] Choi EK, Chang PC, Lee YS,etal. Triggered firing and atrial fibrillation in transgenic mice with selective atrial fibrosis induced by overexpression of TGF-beta1[J]. Circ J, 2012, 76(6): 1354-1362. DOI: 10.1253/circj.CJ-11-1301.
[13] Yi X, Li XY, Zhou YL,etal. Hepatocyte growth factor regulates the TGF-β1-induced proliferation, differentiation and secretory function of cardiac fibroblasts[J]. Int J Mol Med, 2014, 34(2): 381-390. DOI: 10.3892/ijmm.2014.1782.
[14] Ghavami S, Cunnington RH, Gupta S,etal. Autophagy is a regulator of TGF-β1-induced fibrogenesis in primary human atrial myofibroblasts[J]. Cell Death Dis, 2015, 19(6): e1696. DOI: 10.1038/cddis.2015.36.
[15] 张建成, 陈建泉, 许春萱, 等. 肝细胞生长因子和转化生长因子β1对人心房肌成纤维细胞纤维化的影响[J]. 中华心血管病杂志, 2012, 40(10): 834-839. DOI: 10.3760/cma.j.issn.0253-3758.2012.10.007.
Zhang JC, Chen JQ, Xu CX,etal. Effect of hepatocyte growth factor and transforming growth factor-β1 on atrial fibroblasts fibrosis[J]. Chin J Cardiol, 2012, 40(10): 834-839. DOI: 10.3760/cma.j.issn.0253-3758.2012.10.007.
[16] Lu F, Zhao X, Wu J,etal. MSCs transfected with hepatocyte growth factor or vascular endothelial growth factor improve cardiac function in the infarcted porcine heart by increasing angiogenesis and reducing fibrosis[J]. Int J Cardiol, 2013, 167(6): 2524-2532. DOI: 10.1016/j.ijcard.2012.06.052.
[17] Okayama K, Azuma J, Dosaka N,etal. Hepatocyte growth factor reduces cardiac fibrosis by inhibiting endothelial-mesenchymal transition[J]. Hypertension, 2012, 59(5): 958-965. DOI: 10.1161/HYPERTENSIONAHA.111.183905.

