邻苯二甲酸二丁酯的毒性作用及机制*
纪红蕊, 杜 霞, 宋永彬, 刘 欣
(哈尔滨理工大学 化学与环境工程学院, 哈尔滨 150040)
化学工程
邻苯二甲酸二丁酯的毒性作用及机制*
纪红蕊, 杜 霞, 宋永彬, 刘 欣
(哈尔滨理工大学 化学与环境工程学院, 哈尔滨 150040)


邻苯二甲酸酯(PAEs)是指邻苯二甲酸的酯化衍生物.作为塑化剂,PAEs广泛应用于塑料、涂料、油墨的生产中,同时也可添加于驱虫剂、发胶喷雾剂、指甲油和火箭燃料中,但PAEs对人类健康具有严重危害.PAEs与塑料之间的结合并不紧密,很容易脱离塑料本体进入环境中,因而PAEs已被很多国家限制使用,美国国家环保局将其列为环境优先污染物,同时PAEs也被人们称为“第二个全球性PCB污染物”.邻苯二甲酸二丁酯(DBP)是应用最为广泛的PAEs之一,主要用于制造塑料制品增塑剂、染料溶剂、橡胶助剂等[1].本文以DBP为研究对象,研究其对小鼠的肝脏和睾丸的毒性作用,从自由基损伤和生殖毒性角度探讨了DBP的详细致毒机制.
1 实 验
1.1 实验材料与仪器
主要实验材料包括产自天津市富宇精细化工有限公司的DBP(化学纯),产自上海华联制药有限公司的注射用环磷酰胺,产自南京建成生物制品公司的超氧化物歧化酶(SOD)、丙二醛(MDA)、谷丙转氨酶(GPT)、谷草转氨酶(GOT)、碱性磷酸酶(AKP)与水合氯醛(分析纯),产自中粮北海粮油工业(天津)有限公司的色拉油,以及购于哈尔滨医科大学动物中心的昆明种小鼠.
主要实验仪器包括德国弗鲁克F6/10型超细匀浆器、T6新世纪紫外可见分光光度计、产自上海博停经贸有限公司的QL-861型涡旋混合振荡器、产自北京医用离心机厂的LD4-2A型台式低速离心机、HH-S恒温水浴锅、日本Olympus BS60型万能显微镜、中国爱华TSJ-1型全自动组织脱水包埋机、德国莱卡2135型轮转式生物切片机与日本JEM-1220型透射电子显微镜.
1.2 实验方法
1.2.1 DBP染毒与分组
选用体重为(30±5) g的雄性昆明种小鼠,通过灌胃进行染毒,共设4个实验组,包括1个空白对照组与3个染毒剂量组.不同染毒组的染毒剂量分别相当于1/2LD50、1/4LD50和1/8LD50.每组连续染毒14 d,染毒期间各组均正常进食和进水.末次染毒结束后,禁食禁水,于第15 d处死小鼠.
1.2.2 脏器系数与关键酶的测定
于第15 d对小鼠进行眼眶取血,经离心处理10 min后吸出上层血浆,分别检测血浆中AKP、GOT和GPT的活力.摘取小鼠的甲状腺、肺、脾、胸腺、肝脏、睾丸、附睾、前列腺、心脏和肾脏组织,吸去多余的血液和组织液,称其湿重,计算脏器系数(脏器的湿重与体重的比值).随后摘取小鼠的部分肝脏组织,利用低温生理盐水进行漂洗,再利用pH为7.4的磷酸盐缓冲液(PBS)制备质量分数为10%的肝脏组织匀浆,测定其MDA与蛋白含量,以及CAT、SOD活力.
1.2.3 小鼠精子畸形实验
选用体重为30 g的性成熟雄性昆明种小鼠进行精子畸形实验.在DBP染毒处理过程中将小鼠随机分成5组,包括1个空白对照组、1个CP阳性对照组与3个染毒剂量组,不同染毒组的染毒剂量分别相当于1/2LD50、1/4LD50和1/8LD50.每天染毒1次,连续灌胃染毒5 d,于末次染毒后的第30 d处死小鼠.摘取小鼠的一侧附睾进行制片与伊红染色,在高倍显微镜下每只小鼠计数500只完整精子,计算其精子畸形率.
1.2.4 HE染色
将各实验组小鼠的肝脏和睾丸迅速取出后,利用生理盐水冲洗组织块上的血液和黏液,并将其固定在甲醛溶液中.一段时间后将固定后的组织脏器取出,按照需要改刀成1 cm×2 cm×0.2 cm的组织块后,投入甲醛固定液中.室温下保持4 h后取出组织块.首先利用流水对组织块进行为时30 min的冲洗,随后对其进行脱水处理.在脱水处理过程中乙醇的体积分数分别为75%、85%、95%和100%,相应的脱水时间均为2 h.之后对组织块进行二甲苯透明处理和石蜡包埋处理.将切片用具备好,修正并固定好包埋蜡块后,即可进行切片.切片厚度一般约为6 μm.将石蜡切片放入水浴锅中,然后利用粘片剂将其粘贴在已用酒精处理后的载玻片上.在37.5 ℃恒温箱中烤片2 h后,对切片进行苏木素(H)伊红(E)染色[2].
1.2.5 组织观察

2 结果与分析
2.1 小鼠脏器系数的测定
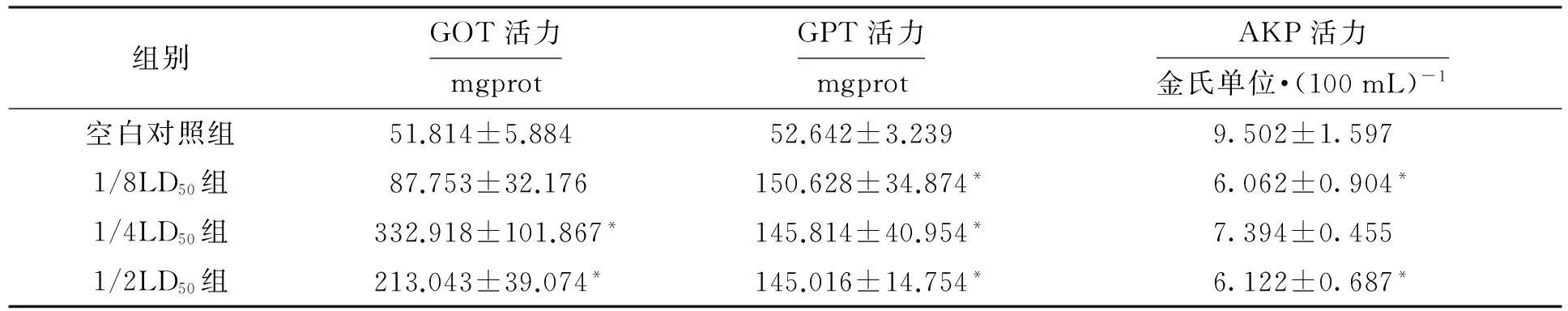
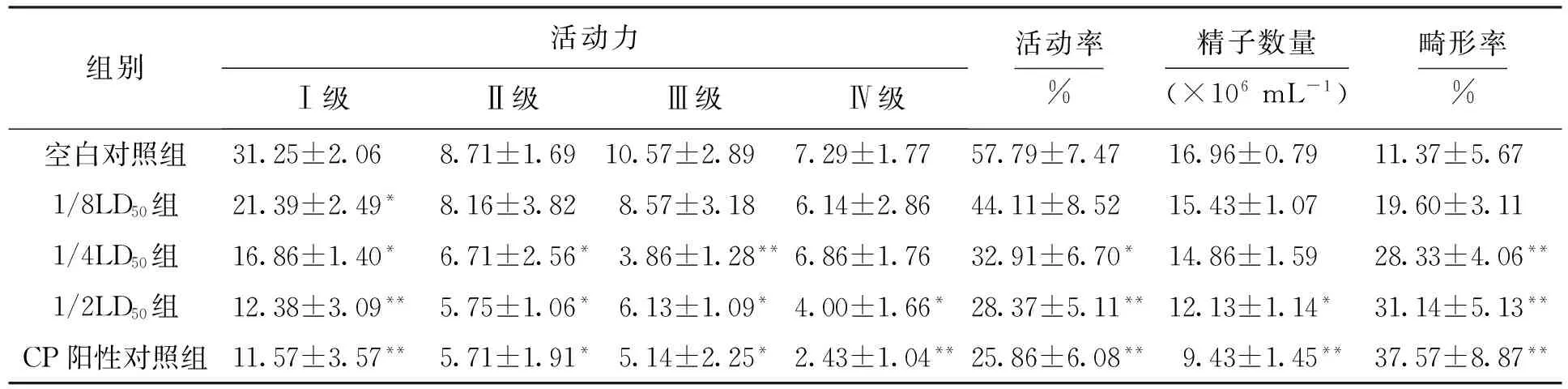
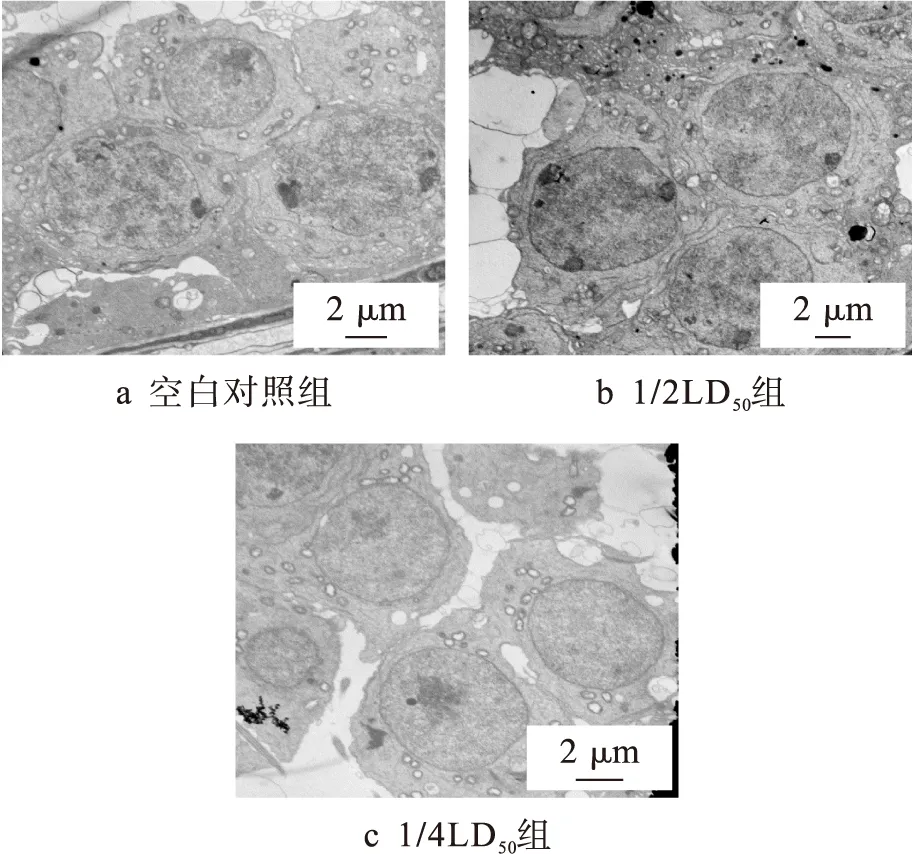
经过不同剂量DBP染毒后获得的小鼠脏器系数如表1所示.由表1可见,与空白对照组相比,1/2LD50组的胸腺、肝脏、肾脏和前列腺具有显著性改变;1/4LD50组的肾脏具有显著性改变;1/8LD50组的甲状腺、脾脏、胸腺、肝脏和肾脏具有显著性改变.需要注意的是图注中P代表概率,且P 表1 DBP染毒后脏器系数的变化Tab.1 Change of organ coefficient after DBP contamination ×10-2 注:与空白对照组相比,*代表P<0.05,**代表P<0.005. 2.2 小鼠血浆、肝脏关键酶的测定 经过不同剂量DBP染毒后小鼠血浆中关键酶的测定结果如表2所示.由表2可见,与空白对照组相比,1/2LD50组和1/4LD50组的GOT活力显著升高;1/2LD50组、1/4LD50组和1/8LD50组的GPT活力显著升高;1/2LD50组和1/8LD50组的AKP活力显著下降. 表2 DBP对小鼠血浆中GOT、GPT和AKP的影响Tab.2 Effect of DBP on GOT,GPT and AKP in blood plasma of mice 注:与空白对照组相比,*代表P<0.05. 经过不同剂量DBP染毒后肝脏中SOD、MDA与CAT的测定结果如表3所示.由表3可见,与空白对照组相比,1/2LD50组的SOD、CAT活力显著下降,而MDA含量显著升高. 表3 DBP对小鼠肝脏CAT、MDA与SOD的影响Tab.3 Effect of DBP on CAT,MDA and SOD in liver of mice 注:与空白组对照组相比,*代表P<0.05. 2.3 DBP对小鼠精子活动力与畸形率的影响 DBP对小鼠精子活动力与畸形率的影响结果如表4所示.由表4可见,与空白对照组相比,1/2LD50组、1/4LD50组与CP阳性对照组中小鼠精子活动率显著下降;1/2LD50组与CP阳性对照组中小鼠精子数量显著下降;1/2LD50组、1/4LD50组与CP阳性对照组中小鼠精子畸变率显著升高. 2.4 DBP对肝脏病理的影响 图1为光学显微镜下DBP染毒后肝脏的变化.空白对照组中小鼠肝脏组织结构清晰(见图1a).经过不同剂量DBP染毒后小鼠的肝脏发生了病理变化.1/2LD50组中小鼠的肝脏组织出现了一定的损伤,发现了坏死灶,坏死灶中心为碎片坏死的肝细胞与少量炎细胞,周围具有增生纤维细胞及大量炎细胞(见图1b);同时组织左下方小叶中央静脉周围的肝细胞发生红染,细胞核消失,而左上方可见部分肝细胞发生细胞核浓缩现象,且胞浆内含有空泡(见图1c).1/4LD50组中组织右侧为坏死的肝细胞,左侧可见大量的炎细胞和增生的纤维细胞(见图1d);同时中央静脉周围的肝细胞发生膨胀,胞浆透亮,发生红染,细胞核消失,胞浆内含有空泡(见图1e).1/8LD50组中组织上方为肝细胞坏死灶,下方可见肝细胞点状坏死灶(见图1f);部分组织可以观察到两个坏死灶(见图1g). 表4 DBP对小鼠精子活动力与畸形率的影响Tab.4 Effect of DBP on sperm viability and abnormality rate of mice 注:与空白对照组相比,*代表P<0.05,**代表P<0.01. 图1 光学显微镜下DBP染毒后肝脏的变化Fig.1 Changes of liver after DBP contamination under optical microscope 图2为电子显微镜下DBP染毒后肝脏的变化.1/2LD50组中小鼠肝脏出现了胞核萎缩、线粒体肿胀现象(见图2b);同时肝脏的毛细胆管绒毛减少,糖原聚积,细胞核严重变形(见图2c).1/4LD50组中细胞核萎缩,线粒体基本正常(见图2d).1/8LD50组中细胞核正常,线粒体肿胀(见图2e). 图2 电子显微镜下DBP染毒后肝脏的变化Fig.2 Changes of liver after DBP contamination under electron microscope 2.5 DBP对睾丸病理的影响 图3为光学显微镜下DBP染毒后睾丸的变化.空白对照组中小鼠睾丸组织结构清晰(见图3a).经过不同剂量DBP染毒后,小鼠的睾丸组织发生了改变.1/2LD50组中曲细精管细胞排列紊乱,结构不再完整(见图3b).1/4LD50组中曲细精管精原细胞紊乱,精原细胞内有空泡,腔内可见精子(见图3c);部分组织精原细胞发生变性,曲细精管内可见少量精子(见图3d).1/8LD50组中曲细精管管腔大小不一,左上方可见曲细精管管腔内含有变性的细胞(见图3e). 图3 光学显微镜下DBP染毒后睾丸的变化Fig.3 Changes of testis after DBP contamination under optical microscope 图4为电子显微镜下DBP染毒后睾丸的变化.空白对照组中小鼠睾丸曲细精管内的各级支持细胞、生精细胞排列整齐,曲细精管的管腔大小一致,基膜完整,管内各级生精细胞依次为精原细胞、精母细胞和精子细胞,且管腔内可见精子细胞,同时支持细胞排列整齐、结构完整(见图4a).1/2LD50组中线粒体肿大,精原细胞脱离(见图4b).1/4LD50组中初级和次级精母细胞并无变化,线粒体肿大,细胞核减少(见图4c). 3.1 肝脏毒性作用分析 肝脏是人体的重要器官,也是体内新陈代谢的中心站,参与蛋白质、激素、维生素、脂肪和凝血因子等重要物质的合成,是机体内重要的解毒部位[4].DBP是肝脏毒性物质,DBP进入人体后可以迅速溶入血液,最终引起肝脏组织形态的改变.由肝脏组织观察结果可见,DBP对肝脏造成的损伤尤以高剂量组为重.光学显微镜观察结果表明,1/2LD50组中肝脏组织出现坏死灶,周围含有增生纤维细胞与大量炎细胞,部分肝细胞发生了细胞核浓缩现象,胞浆内含有空泡.电子显微镜观察结果表明,1/2LD50组中肝脏结构细胞核萎缩,线粒体发生肿胀.就超微结构而言,DBP引起肝脏损伤的作用靶点是细胞内的线粒体. 图4 电子显微镜下DBP染毒后睾丸的变化Fig.4 Changes of testis after DBP contamination under electron microscope 肝脏中GOT分布于细胞浆的水溶性部分和线粒体中,而GPT主要分布于细胞浆的水溶性部分.当肝脏等脏器组织受损时,细胞内的酶被释放出来并进入血液中,导致血清酶活力升高,最终酶的总活力约升高100~1 000倍,反映了肝细胞损害和坏死的程度[5].本文1/2LD50和1/4LD50组中的GPT和GOT均明显升高,此时肝细胞内的酶渗漏到血液中又通过血清肝酶谱的改变表现出来,表明肝细胞受到了损害. AKP广泛存在于各种组织中,尤以肠上皮、骨骼、肝脏、胎盘与白细胞中含量为多.正常人血清中AKP主要来自骨骼和肝脏,并经胆道排出体外,故AKP的显著改变可以用来诊断肝胆系统疾病.血清中AKP升高的机制较为复杂[6],胆汁排泄障碍并非主要原因,而血清中AKP降低主要见于重症慢性肾炎并伴有肾衰、营养不良和甲状腺功能不全、镁缺乏、乳糜泻、严重贫血等病症.本文1/2LD50组和1/8LD50组的AKP显著下降,可见该结果与肝脏的损伤与病理改变机制相吻合. 氧自由基可以启动膜脂质过氧化的链式反应,在机体的新陈代谢过程中发挥重要作用,可以造成膜的流动性与通透性的改变,导致异常生理生化反应与免疫反应的产生.MDA是自由基脂质过氧化过程中生成的醛类物质,能够促进核酸、蛋白质与磷脂的交联,改变体内重要生物大分子的功能.SOD是一种可以清除H2O2和OH·的物质,SOD可以保护细胞不受毒性氧自由基的损伤,是人体防御内、外环境中超氧离子损伤的重要保护酶.当MDA含量升高、SOD活力降低时,可以引发氧化应激反应,从而损伤细胞甚至导致某些细胞的死亡[7].1/2LD50组中SOD、CAT活力均显著下降,MDA含量显著升高,表明DBP确实能够引起小鼠肝脏发生脂质过氧化过程,因而加速了早期肝损伤的形成. 3.2 生殖毒性作用分析 睾丸具有生精与分泌睾酮两大功能,睾丸细胞由生殖细胞和间质细胞组成,睾丸小叶内含有盘曲的精曲小管,精曲小管上皮能够产生精子[8].小管之间的结缔组织内含有分泌雄性激素的间质细胞.精曲小管结合成精直小管,并进入睾丸纵隔交织形成睾丸网.本文中经过DBP染毒后睾丸组织形态发生了改变,表明不同染毒剂量的DBP能够进入睾丸细胞内部,损害睾丸间质细胞和支持细胞. 精子活力是指精液中表现为前进运动的精子所占的百分比[9].具有前进运动的精子才可能具有正常的生存能力和受精能力,因而精子活力是目前评定精液品质优劣的常规检查中的主要指标之一.精子活率是指存活精子的数量,可以定量评估活精子与死精子的数量.精子活动力反映的是活动精子的质量优劣,可以定性评估精子的活力.本文中较高染毒剂量的DBP可使精子活动率显著下降,并使精子数量显著减少,表明该物质对各级生精细胞的生长和发育均可以产生毒性作用. [1]Du J B,Tang Y L,Long Z W,et al.Theoretical calculation of spectra of dibutyl phthalate and dioctyl phthalate [J].Russian Journal of Physical Chemistry A,2014,88(5):819-822. [2]George A,Elliot L,Ronald P,et al.Pathologic response to preoperative chemotherapy in colorectal liver metastases:fibrosis,not necrosis,predicts outcome [J].Annals of Surgical Oncology,2012,19(9):2797-2804. [3]纪红蕊,陈家驹,张茜,等.双酚A的毒性作用机制 [J].沈阳工业大学学报,2015,37(6):710-715. (JI Hong-rui,CHEN Jia-ju,ZHANG Qian,et al.Toxic effect mechanisms of bisphenol A [J].Shenyang University of Technology,2015,37(6):710-715.) [4]Johan F L,Maciej M,Daniel S,et al.Function and volume recovery after partial hepatectomy:influence of preoperative liver function,residual liver volume,and obesity [J].Langenbeck’s Archives of Surgery,2012,397(8):1297-1304. [5]Papadimitriou E,Loumbourdis N S.Glycogen,proteins,and aminotransferase (GOT,GPT) changes in the frog rana ridibunda exposed to high concentrations of copper [J].Bulletin of Environmental Contamination and Toxicology,2005,74(1):120-125. [6]Yuan X,Wang J G,Zhu X Y,et al.Effect of copper on levels of collagen and alkaline phosphatase activity from chondrocytes in newborn piglets in vitro [J].Bio-logical Trace Element Research,2011,144(1):597-605. [7]Liu M,Chang X R,Yan J.Effects of moxibustion pretreatment on GSH-Px,SOD and MDA in gastric mucosa of rats with stress ulcer [J].Journal of Acupuncture and Tuina Science,2011,9(1):17-20. [8]Kang H J,Moon M J,Lee H Y,et al.Testosterone alters testis function through regulation of piRNA expression in rats [J].Molecular Biology Reports,2014,41(10):6729-6735. [9]Nudmamud-Thanoi S,Thanoi S.Pseudoephedrine induces sperm abnormalities,lower sperm counts and increased apoptosis in rat testis [J].Cell and Tissue Research,2012,349(2):625-630. [10]Sivanarayana T,Ravi-Krishna G,Jaya-Prakash K,et al.CASA derived human sperm abnormalities:correlation with chromatin packing and DNA fragmenta-tion [J].Journal of Assisted Reproduction and Genetics,2012,29(12):1327-1334. (责任编辑:尹淑英 英文审校:尹淑英) Toxic effect and mechanisms of dibutyl phthalate JI Hong-rui,DU Xia,SONG Yong-bin,LIU Xin (College of Chemical and Environmental Engineering,Harbin University of Science and Technology,Harbin 150040,China) Aiming at the current situation that the environmental pollution has become increasingly serious,the effect of dibutyl phthalate (DBP) on the hepatotoxicity and reproductive toxicity was studied.The key enzymes,sperm viability and sperm abnormality rate were tested,and the pathological changes of liver and testis were observed.The results show that DBP can significantly raise the glutamic-pyruvic transaminase (GPT),glutamic-oxaloacetic transaminase (GOT),alkaline phosphatase (AKP) and malonaldehyde (MDA),and remarkably reduce the superoxide dismutase (SOD) and catalase (CAT).It means that DBP can induce the lipid peroxidation of liver for mice and early hepatic injury.BPA can penetrate blood-testis barrier,and interfere the growth and development process of sperms.Therefore,DBP is a genotoxic compound which has latent mutagenic damage to the malesex cells. dibutyl phthalate(DBP);hepatotoxicity;reproductive toxicity;lipid peroxidation injury;blood-testis barrier;sperm viability;sperm abnormality rate;pathological change 2016-06-23. 国家自然科学基金资助项目(21476054). 纪红蕊(1978-),女,黑龙江哈尔滨人,副教授,博士,主要从事毒理学与药理学等方面的研究. 02 17∶27在中国知网优先数字出版. http:∥www.cnki.net/kcms/detail/21.1189.T.20170302.1727.002.html 10.7688/j.issn.1000-1646.2017.02.20 TQ 450.2 A 1000-1646(2017)02-0230-06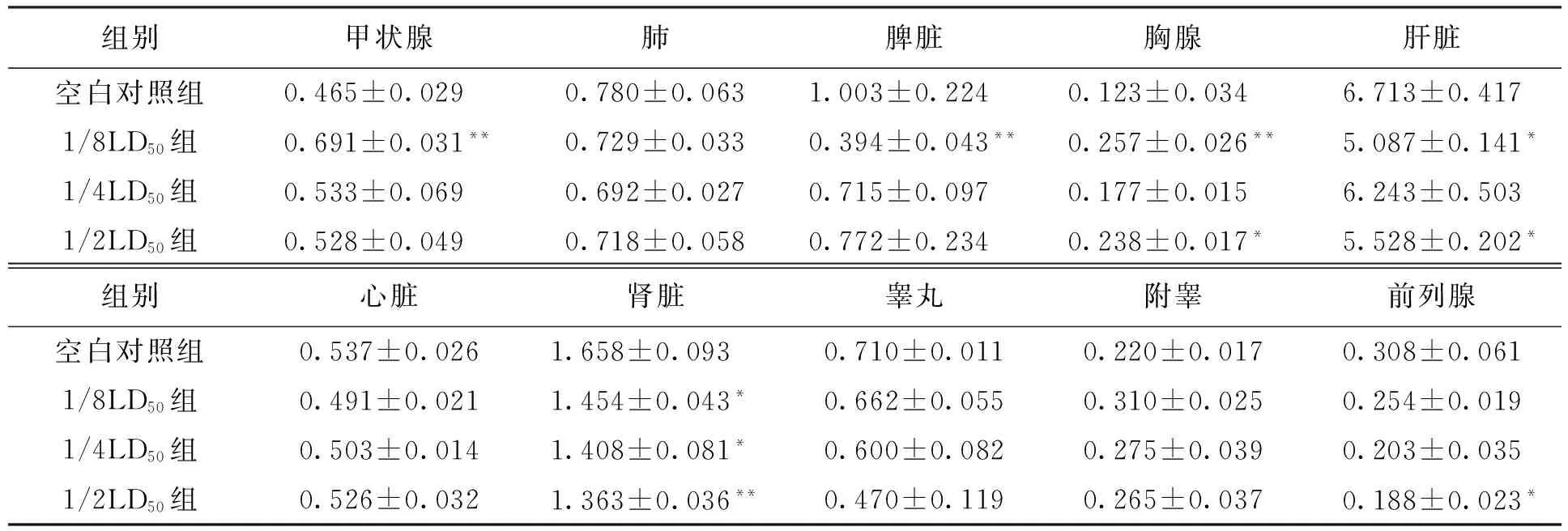




3 毒性作用分析

4 结 论


