橡胶树红根病菌Fip-gpo基因的克隆及启动子分析
[KH-3D]刘文波,秦春秀,薛文华,梁鹏,邬国良,林春花,缪卫国,郑服丛
(海南省热带生物资源可持续利用重点实验室/海南大学环境与植物保护学院,海南海口570228)
橡胶树红根病菌Fip-gpo基因的克隆及启动子分析
[KH-*3D]刘文波,秦春秀,薛文华,梁鹏,邬国良,林春花,缪卫国*,郑服丛*
(海南省热带生物资源可持续利用重点实验室/海南大学环境与植物保护学院,海南海口570228)
为预测橡胶树红根病菌(Ganoderma pseudoferreum)真菌免疫调节蛋白基因的序列特点和表达模式,采用同源克隆获得Fipgpo的cDNA和DNA的全长序列。结果表明:该基因编码区全长934 bp,编码111个氨基酸残基,分子量为12.54 kD,等电点4.66,有4个ATM磷酸化位点,与赤灵芝(G.lucidum)的Fip序列相似性为91%;其启动子区域含有59 bp的内含子,除了含有TATA-box、CAAT-box基本元件外,还含有参与光应答/调控元件、赤霉素响应元件、茉莉酸甲酯应答元件、厌氧诱导作用元件、调控在胚乳中特异表达的顺式作用元件、分生组织特异激活顺式元件及生长素反应元件。推测Fip-gpo基因的表达受激素、非生物诱导、光照等的调控。
橡胶树红根病菌;真菌免疫调节蛋白;Fip-gpo基因;启动子分析
真菌免疫调节蛋白(Fungal immunomodulatory proteins,Fips)是一类具有免疫调节活性的小分子蛋白,Fips能有效促进淋巴细胞和脾脏细胞的增生,并诱导动物和人的巨噬细胞多分泌白细胞介素、肿瘤坏死因子及干扰素等[1],维护生物体的健康,完成免疫调节功能。Kino等首次从赤灵芝(Ganoderma lucidum)中分离到这种蛋白,并命名为LZ-8(Lingzhi-8)[2]。天然的免疫调节蛋白一般分子量为13 kDa左右,富含天冬氨酸Asp(D)和缬氨酸Val(V),但缺乏组氨酸His(H),半胱氨酸Cys(C)和甲硫氨酸Met(M),其N端氨基酸均为乙酞化阻断氨基酸。Fips基因编码区大约有330~350 bp左右[3]。并证明其具有促进细胞有丝分裂及免疫调节的作用[4]。在我国传统医学中,大型真菌(主要是食用)一直具有很高的药用和营养价值,到目前为止,己从许多大型真菌或者担子菌克隆到Fips基因,如赤灵芝(G.lucidum)[2]、松杉灵芝(G.tsugae)[5]、金针菇(Flammulina velutipes)[6]、紫灵芝(G.japoncium) (AAX98241)[7]、小孢灵芝(G.microsporum)[8]、紫芝(G.sinensis)[9]及草菇(Volvaiella volvacea)[10]等。这些真菌免疫调节蛋白的结构和功能与人的免疫球蛋白家族具有很大的相似性,除了赤灵芝(G.lucidum)的Fip含有1.3%糖蛋白外,其他的Fips均不是糖蛋白[2,11-13]。不同物种间Fips的氨基酸相似性很高,可达50%~90%,Fips具有很高的药用价值,此蛋白在灵芝中含量少且纯化率极低,在商业制药中很难进行[3]。从灵芝及其他大型真菌中提取天然Fips,成本高且产量少,3 kg的草菇子实体中获得了94 mg的Fip-vvo[10]。到目前为止,研究真菌免疫调节蛋白的作用机制较少,启动子在基因的表达调控中起重要的作用,而Fips表达调控研究也非常少[14]。研究Fips的启动子,可以为以后研究其启动子打下基础。
目前尚未有从作为植物病原的担子菌中克隆Fips基因的报道。橡胶树红根病菌[Ganoderma pseudoferreum(Wakef)overet Steinm]是对橡胶生产具有较大威胁的橡胶树红根病的病原,属于担子菌,是一类分布较广的病原菌。本文探索从植物病原真菌中克隆Fips基因,为Fips提供一个新的资源,研究其序列特点及表达模式,为改造和提高产量,促进生产者开发新型的免疫蛋白药物提供理论基础[14]。
1 材料与方法
1.1 材料及主要试剂
橡胶树红根病菌(G.pseudoferreum)GP-1菌株由海南大学环境与植物保护学院分子植病实验室分离鉴定保存。Fungal DNA Kit 50(OMEGA);琼脂糖凝胶DNA/PCR产物小量回收试剂盒(OMIGA); pMDTM18-T Vector试剂盒(宝生物工程(大连)有限公司);Tryptone(OXOID);Yeast Extract(OXOID);NaCl(广化);反转录试剂盒、TaqDNA聚合酶、dNTPs、DNA标准分子量DL2000均为全式金生物有限公司产品。
1.2 橡胶树红根病菌GP-1菌株基因组DNA提取(OMEGA)
取100 mg新鲜样品液氮研磨成粉末,提取方法按照OMEGA试剂盒(DNA)的方法提取,用蛋白核酸测定仪(Bio-rab)检测DNA浓度,经1%琼脂糖凝胶电泳验证;-20℃保存备用。
1.3 橡胶树红根病菌GP-1菌株基因组RNA提取(OMEGA)
称取50~100 mg经液氮研磨成粉末状的样品至2 mL离心管,按照OMEGA试剂盒(RNA)的方法提取,用蛋白核酸测定仪(Bio-rab)检测RNA浓度,经1%琼脂糖凝胶电泳验证,-80℃保存备用。
1.4 真菌免疫调节蛋白基因的克隆
以提取的橡胶树红根病菌GP-1菌株基因组DNA作为模板进行PCR扩增,根据转录组数据设计包括启动子区域在内的引物,华大基因公司合成如下引物:
Gpfip1-F:5'-TCCTAGTTGACACGATGACGGCG-3';Gpfip1-R:-5'-GACACACCACGAAGGTTGAATGC-3'。
PCR反应体系为:模板1 μl,dNTPs 25 mmol/L 2.5 μl;引物(1 mmol/L)各1 μl;10×Buffer 2.5 μl;Taq DNA聚合酶(5 U/μl)0.25 μl;ddH2O 17 μl。PCR反应条件:94℃预变性5 min,94℃,30 s; 56℃,40 s;72℃,40 s;循环35次,72延伸10 min。PCR产物经1%琼脂糖凝胶电泳后。验证产物并拍照,用胶回收试剂盒回收PCR产物,连接到pMDTM18-T Vector载体,并转化到感受态细胞DH5α。随机挑选4个阳性克隆送深圳华大基因公司进行测序。
以提取的橡胶树红根病菌GP-1菌株的总RNA反转录为cDNA(TaKaRa Bio)为模板进行PCR扩增,根据转录组数据设计包括启动子区域在内的引物,华大基因公司合成如下引物:Gpfip1-F:5'-TCCTAGTTGACACGATGACGGCG-3';Gpfip1-R:5'-GACACACCACGAAGGTTGAATGC-3'。PCR反应体系为:模板1μl,dNTPs 25 mmol/L 2.5 μl;引物(1 mmol/L)各1 μl;10×Buffer 2.5 μl;Taq DNA聚合酶(5 U/μl)0.25 μl;ddH2O 17 μl。PCR反应条件: 94℃预变性5 min,94℃,30 s;56℃,40 s;72℃,40 s;循环35次,72延伸10 min。PCR产物经1%琼脂糖凝胶电泳后。验证产物并拍照,胶回收试剂盒回收PCR产物,连接到pMDTM18-T Vector载体,并转化到感受态细胞DH5α。随机挑选4个阳性克隆送深圳华大基因公司进行测序。
1.5 橡胶树红根病菌菌GP-1菌株FIP基因的生物信息学分析
基因和蛋白质同源性利用NCBI软件分析,启动子区域通过PlantCARE在线软件预测,转录起始位点通过http://www.fruitfly.org/seq_tools/promoter.html预测,蛋白质的理化性质及疏水性分析利用ExPASy中的相关工具预测;磷酸化位点预测软件(http://kinasephos2.mbc.nctu.edu.tw/index.html);蛋白质的二级机构通过https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_ server.html在线预测;三级结构通过ExPASy中的相关工具预测;蛋白质的结构作图通过http://prodes.toulouse.inra.fr/multalin[15]and ESPript[16]进行;分子系统进化树在软件MEGA5.03上进行,采用NJ (neighbor jioning)方法重复运行1000次。
2 结果与分析
2.1 Fip-gpo基因的克隆
以橡胶树红根病菌菌丝为材料,提取橡胶树红根病菌基因组DNA和RNA,Gpfip1为引物进行PCR扩增,电泳图谱显示大小为1200 bp左右(图1)和1100 bp左右条带(图2),与目的片段大小相符合,将片段克隆后,经菌落PCR检测为阳性克隆(图3)。通过NCBI的blastx在线比对,表明Fip-gpo基因长度为336 bp,编码111个氨基酸残基的ORF框(图4);基因的上游启动子区域经NCBI上的nucleotide blast在线比对,和赤灵芝(G.lucidum)免疫调节蛋白LZ-8(M58032.1)基因的上游启动子区域相似性为75%,具有59 bp的内含子。确定该基因的全长为934 bp。
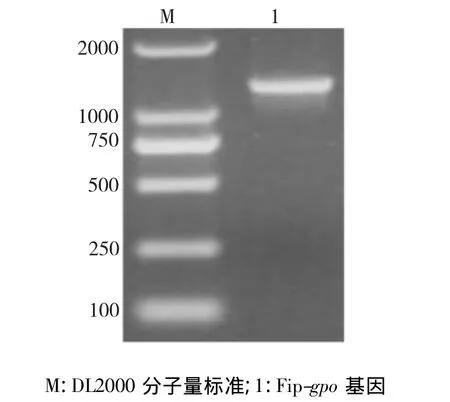
图1 FIP-gpo基因PCR扩增电泳图Fig.1Electrophoresis of PCR product of Fip-gpo
图2 FIP-gpo基因cDNA的PCR扩增电泳图Fig.2Electrophoresis of PCR product ofFip-gpo
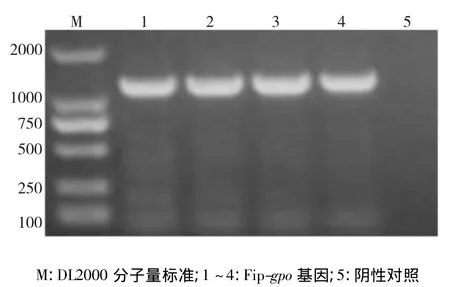
图3 FIP-gpo基因T-克隆的PCR扩增电泳图Fig.3Electrophoresis of colony PCR product of Fip-gpo

图4 Fip-gpo核酸序列和推导的氨基酸序列Fig.4Nucleotide sequence and deduced amina acid sequence of Fip-gpo
2.2 Fip-gpo和其他Fips的相似性分析
经Blast比对发现,该基因的氨基酸序列和LZ-8(AAA33350.1)、Fip-gts[5]和Fip-gja(AAX98241.1)的相似性分别为为91%、91%和83%,但和虫拟蜡菌Geriporiopsis subvermispora B(EMD41188.1)亲缘性较远,相似性为48%。将Fip-gpo和其他14种己知的Fips用MEGA 5.1软件,构建系统进化树,从图中可以看出(图5),Fip-gpo与赤灵芝(G.lucidum)LZ-8(AAA33350.1)和Fip-gts(G.tsugae)[5]聚在一簇,虫拟蜡菌G.subvermispora B (EMD41188)单独成一簇。
2.3 Fip-gpo的结构分析
经Eepasy相关软件对Fip-gpo氨基酸进行预测,得到该氨基酸的理论分子量为12.54 kD,等电点pI为4.66。天冬氨酸Asp(D)和缬氨酸Val(V)各11个。无半胱氨酸Cys(C)、组氨酸His(H)和甲硫氨酸Met(M),分子式C573H859N143O172S1;不稳定系数为0.99,该蛋白在溶液中稳定;脂肪系数为79.82;亲水系数为-0.192,具亲水的特性(图6),无跨膜结构域。这与Fips蛋白具有13 Kd,111~114氨基酸相吻合,符合Fips的特性[17],可以归为Fips家族。
2.3.1 Fip-gpo激酶磷酸化修饰位点预测经过磷酸化位点预测软件进行Fip-gpo磷酸化位点预测,结果表明可能发生磷酸化的氨基酸为丝氨酸(S),磷酸化位点分别位于32、64、69、72位,具有保守的结构域(图7)。SVM score为0.98,他的motif是ATM _67_L4R4。
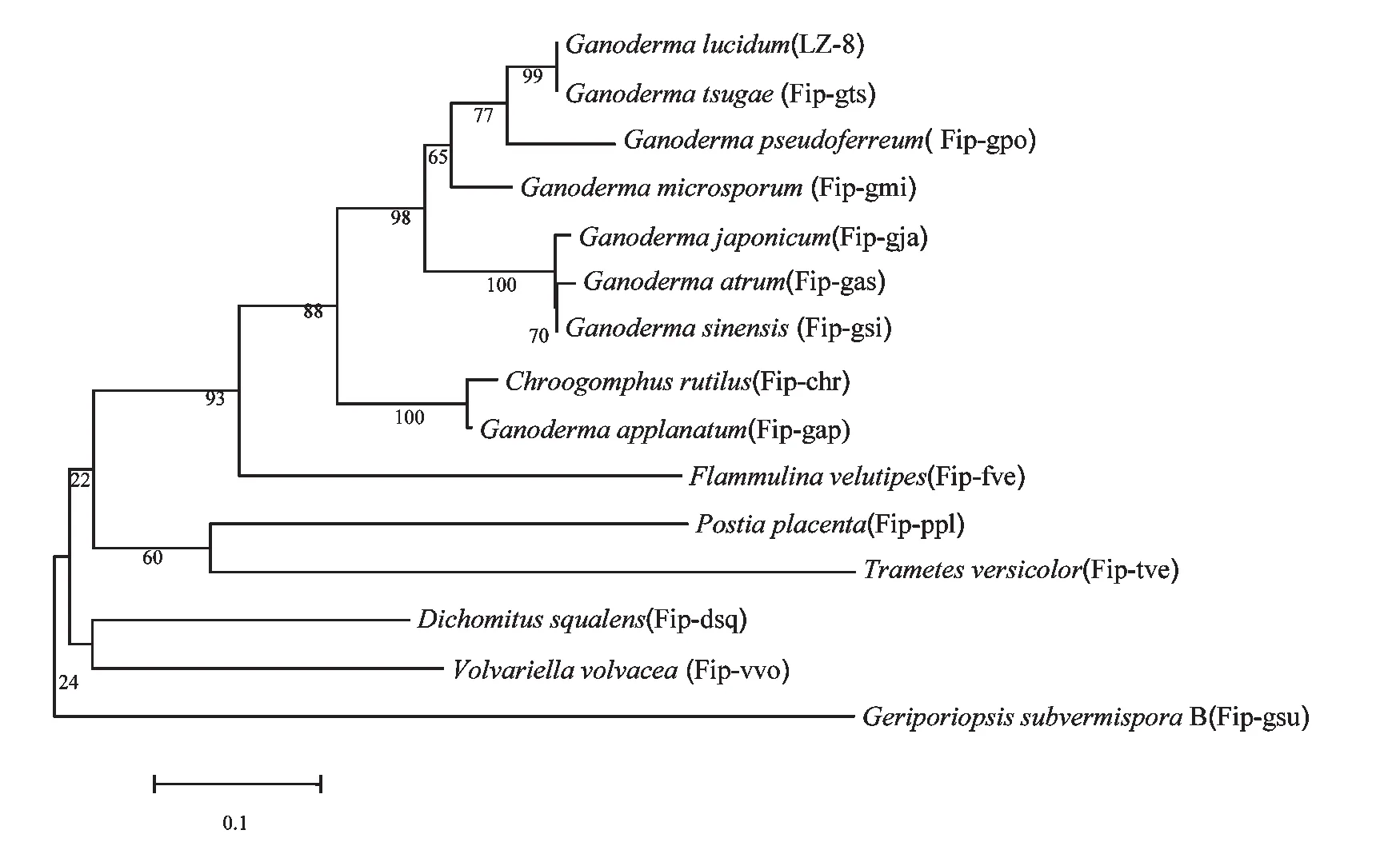
图5 Fip-gpo的系统发育树Fig.5Phylogenetic tree of Fip-gpo
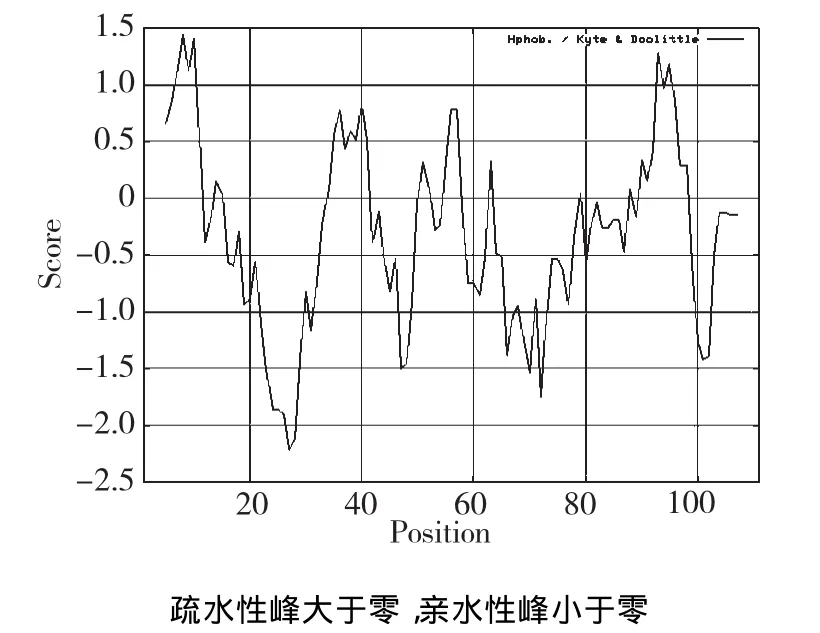
图6 Fip-gpo蛋白质序列疏水区域分布预测Fig.6Hydrophobic area forecast map of Fip-gpo protein
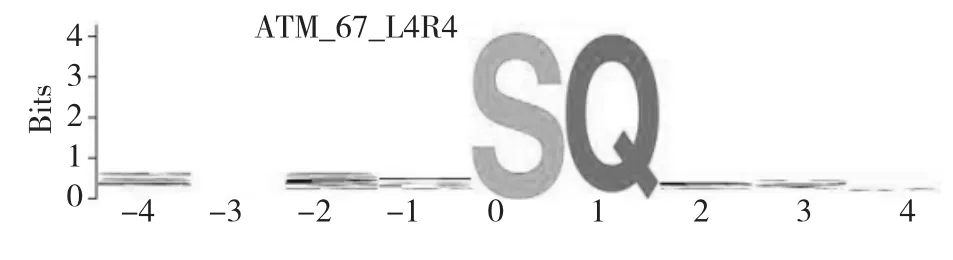
图7 Fip-gpo的磷酸化位点预测Fig.7Phosphorylation sites prediction of Fip-gpo
2.3.2 Fip-gpo结构预测通过Sopma的方法预测了Fip-gpo的二级结构,Fip-gpo的二级构包括4.5 %的α螺旋、13.51%的β转角、37.84%的延伸链及44.14%无规则卷曲。α螺旋主要在于N端,β转角主要位于C端,无规则卷曲贯穿整个Fip-gpo序列,延伸链分散在序列中。蛋白质的二级结构作图通过http://prodes.toulouse.inra.fr/multalin[15]and ESPript[16]预测后,主要成分是β转角(β1-β9)(图8-A)。蛋白质的三级结构通过swissmodel在线预测进行Fip-gpo三级结构预测,结构预测表明空间结构与LingZhi-8(3f3h)[18]结晶体结构相似,相似性为0.99(图8-B)。
2.4 橡胶树红根病菌免疫调节蛋白基因启动子序列分析
通过PlantCARE[19]软件在线分析Fip-gpo基因上游启动子区域的转录因子结合位点及其功能,结果见表1。与启动子活性相关的基本顺式作用元件有2种:TATA box和CAAT box分别位于-197和-281、-417、-472等位置;除此之外,还发现2个与非生物诱导相关的顺式作用元件:甲基茉莉酸应答顺式作用元件CGTCA-motif和厌氧诱导必要的顺式作用元件ARE;1个分生组织特异激活顺式元件A-box(CCGTCC-box);1个调控在胚乳中特异表达的顺式作用元件Skn-1_motif;2个与激素有关的顺式作用元件:生长素反应元件TGA-element和赤霉素响应元件P-box;1个光调控的顺式作用元件G-box;1个光响应元件Sp1。转录起始位点通过fruitfly在线预测,转录起始位点在-172处(图9)。
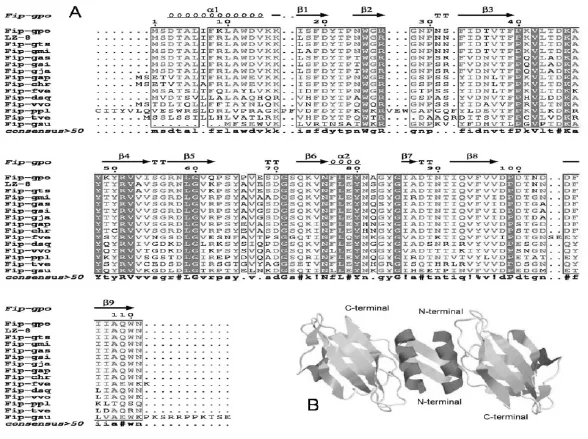
图8 Fip-gpo蛋白的结构特征Fig.8Fip-gpo protein of architectural feature
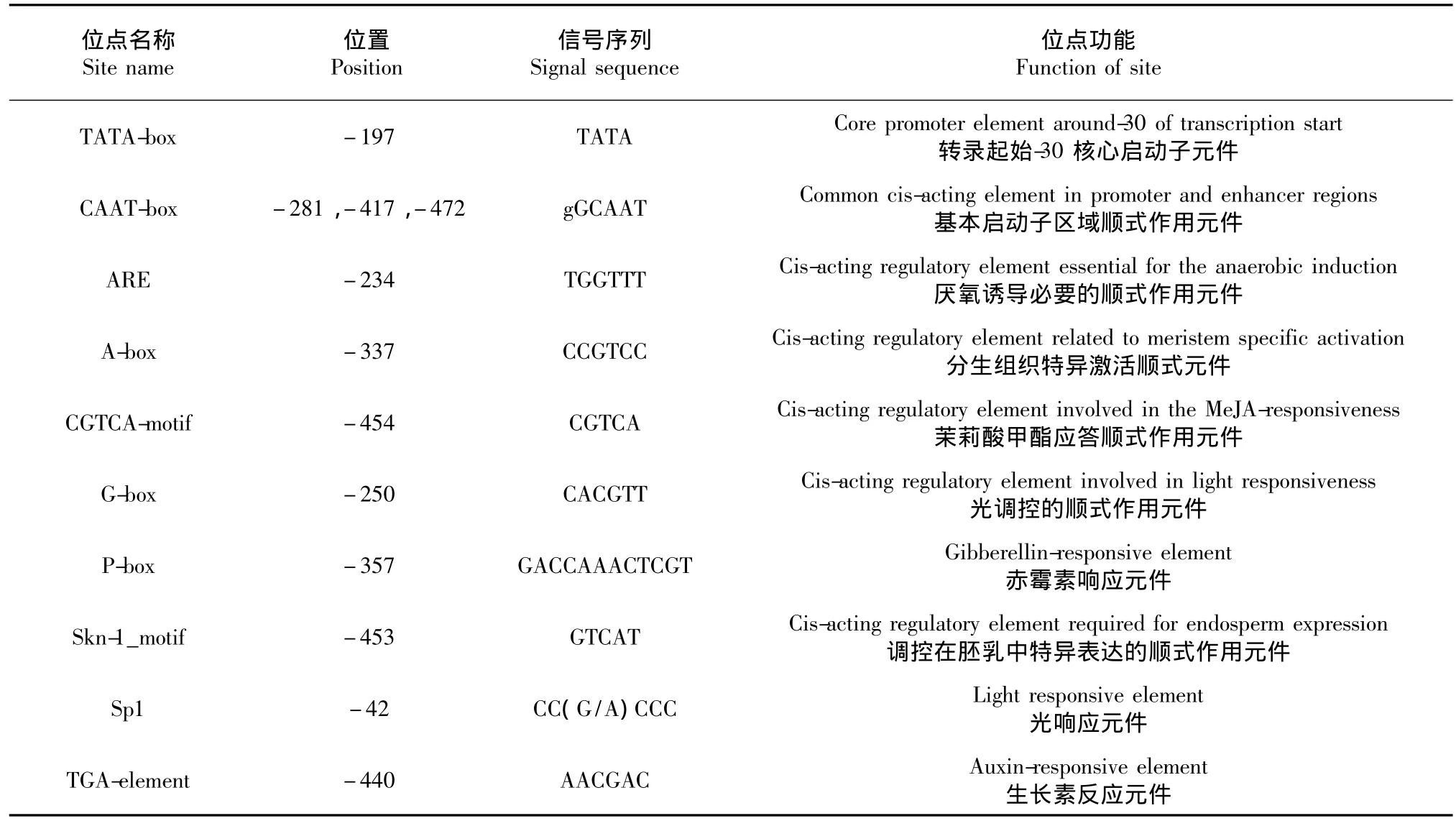
表1 应用PlantCARE预测FIP-gpo启动子顺式作用元件Table 1Cis-acting regulatory element analysis of FIP-gpo promoter sequence by plant CARE
3 讨论与结论
本实验根据已经报道的真菌免疫调节蛋白基因,从橡胶树红根病菌转录组中筛选到真菌免疫调节蛋白基因序列,设计引物克隆Fip-gpo基因,在DNA和RNA水平上克隆了Fip-gpo基因,该基因编码序列无内含子,氨基酸的理论分子量为12.54kD,等电点pI=4.66。富含天冬氨酸Asp(D)和缬氨酸Val(V)各11个。无半胱氨酸Cys(C)、组氨酸His (H)和甲硫氨酸Met(M),分子式C573H859N143O172S1;不稳定系数为0.99,小于于阂值40,说明该蛋白在溶液中稳定;脂肪系数为79.82;亲水系数为-0.192,具亲水的特性。这与Fip蛋白具有13Kd,111~114氨基酸相吻合[17];磷酸化位点预测表明,具有4个磷酸化位点,SVM score为0.98,具保守的结构域(ATM_67_L4R4),ATM蛋白激酶参与了DNA损伤的修复、防止畸变甚至癌变的作用;Fip-gpo蛋白质结构分析表明,Fip-gpo的二级构包括4.5%的α螺旋、13.51%的β转角、37.84%的延伸链及44.14%无规则卷曲。α螺旋主要在于N端,β转角主要位于C端,无规则卷曲贯穿整个Fip-gpo序列;Fip-gpo的三级结构与LZ-8(3f3h)结晶体结构相似,为0.99;具Fips的特性[17],可以归为Fips家族。进化分析表明,该基因的氨基酸序列和LZ-8 (AAA33350)、Fip-gts[5]和Fip-gja(AAX98241)的相似性分别为为91%、91%和83%,但和虫拟蜡菌G.subvermispora B(EMD41188)亲缘性较远,相似性为48%,不同真菌属种间,免疫调节蛋白相差较大。橡胶树红根病菌(G.pseudoferreum)经本实验室ITS鉴定,和赤灵芝(G.lucidum)和松杉灵芝(G.tsugae)的相似性分别为95%和96%。也验证了橡胶树红根病菌(G.pseudoferreum)的Fip和赤灵芝(G.lucidum)、松杉灵芝(G.tsugae)的Fip亲缘关系较近。探索从植物病原真菌中克隆Fips基因,为Fips提供一个新的资源;促进真菌免疫调节蛋白的开发与利用。

图9 橡胶树红根病菌真菌免疫调节蛋白基因启动子序列分析Fig.9Analysis of promoter sequence of Fip-gpo
启动子是基因的重要组成部分,可以被RNA聚合酶识别并结合,控制着基因的转录,启动子的组成类型,可以控制基因表达的起始时间和表达的程度[20]。是目的基因在转录水平上的重要调控元件,对生物的生长发育起着重要的作用。以橡胶树红根病菌的菌丝体提取DNA和RNA中分别克隆了Fips基因的上游503 bp的启动子区域,该区域含有59 bp的内含子,和赤灵芝(G.lucidum)[2]及紫芝(G.sinensis)[21]的61 bp相差了2 bp,经过分析表明,与启动子基本活性相关的顺式作用元件有TATA-box、CAAT-box和G-box。TATA-box是RNA聚合酶II识别位点;CAAT-box控制着转录起始的频率[22];G-box需要特异的结合SP1才能促进基因的转录[23];与诱导相关的顺式作用元件有甲基茉莉酸应答顺式作用元件CGTCA-motif、厌氧诱导必要的顺式作用元件ARE;1个分生组织特异激活顺式元件A-box (CCGTCC-box);1个调控在胚乳中特异表达的顺式作用元件Skn-1_motif;2个与激素有关的顺式作用元件:生长素反应元件TGA-element和赤霉素响应元件P-box,推测Fip-gpo基因的表达受激素、非生物诱导、光照等的调控。但是在赤灵芝(G.lucidum)的启动子序列中含有一个脱落酸应答顺式作用元件[24]而该基因的启动子区域无脱落酸应答顺式作用元件,表明Fip-gpo基因在表达调控功能上的分化,为进一步研究Fip-gpo基因的表达和功能奠定基础,对深入了解病原真菌的真菌免疫调节蛋白基因,结构和功能直接的关系有重要的意义。
[1]Ko J L,Lin S J,Hsu C I,et al.Molecular cloning and expression of a fungal immunomodulatory protein,FIP-fve,from Flammulina velutipes[J].Journal of The Formosan Medical Association,1997,96: 517.
[2]Kino K,Yamashita A,Yalnaoka,et al.Isolation and characterization of a new immunomodulatory potein,LingZhi-8(LZ-8)from Ganoderma lucidum[J].Journal of Biological Chemistry,1989,264:472-478.
[3]李泓睿.rlz-8诱导SGC7901细胞自噬性死亡机制的研究[D].吉林:吉林大学,2011.
[4]Yin G J,Ardo L,Thompson K D,et al.Chinese herbs(Astragalus radix and Ganoderma lucidum)enhance immune response of carp,Cyprinus carpio,and protection against Aeromonas hydrophila[J].Fish&Shellfish Immunology,2009,26:140-145.
[5]Lin W H,Hung C H,Hsu C I,et al.Dimerization of the N-terminal amphipathica-helix domain of the fungal immunomodulatory protein from Ganoderma tsugae(fip-gts)defined by a yeast two-hybrid system and site-directed mutagenesis[J].Journal Biological Chemistry,1997,272(32):20044-20048.
[6]Wu C M,Wu T Y,Kao S S,et al.Expression and purification of a recombinant Fip-fve protein from Flammulina velutipes in baculovirus-infected insect cells[J].Journal of Applied Microbiology,2008,104:1354-1362.
[7]Li F,Wen H A,Liu X Z,et al.Gene cloning and recombinant expression of a novel fungal immunomodulatory protein from Trametes versicolor[J].Protein Expression and Purification,2012,82:339-344.
[8]Wu M Y,Hsu M F,Huang C S,et al.A 2.0 Structure of GM I,a Member of the Fungal Immunomodulatory Protein Family from Ganoderma Microsporum[J].Protein Crystallography,2007(Ⅱ):132.
[9]Li Q Z,Wang X F,Chen Y Y,et al.Cytokines expression induced by Ganoderma sinensis fungal immunomodulatory proteins(FIP-gsi)in mouse spleen cells[J].Applied Biochemistry and Biotechnology,2009,162(5):1403-1413.
[10]Hsu H C,HSU C I,Lin R H,et al.Fip-vvo,a new fungal immunomodulatory protein isolated from Volvariella volvacea[J].Journal of Biological Chemistry,1997,323(2):557-565.
[11]Ou C C,Hsiao Y M,Wang W H,et al.Stability of fungal immunomodulatory protein,FIP-gts and FIP-fve,in IFN-γproduction[J].Food and Agricultural Immunology,2009,20(4):319-322.
[12]孔祥辉,孙宇峰,任永春,等.金针菇免疫调节蛋白的研发与应用[J].生物技术,2006,16(4):84-88.
[13]Wang W H Hsu C I,Tang S C,et al.Fungal Immunomodulatory Protein from Flammulina velutipes Induces Interferon-γ Production through p38 Mitogen-Activated Protein Kinase Signaling Pathway[J].Agricultural and Food Chemistry,2004,52(9):272-2725.
[14]李奇璋.真菌免疫调节蛋白基因的克隆、优化、功能及多克隆抗体制备[D].上海:上海交通大学硕士论文,2009.
[15]Corpet F.Multiple sequence alignment with hierarchical clustering[J].Nucleic Acids Res,1988,16:10881-10890.
[16]Gouet P,Robert X,Courcelle E,et al.ESPript/ENDscript:extracting andrendering sequence and 3D information from atomic structures ofproteins[J].Nucleic Acids Res,2003,31:3320-3323.
[17]林忠平,白杰英,李彦舫.真菌免疫调节蛋白(FIP)结构与功能研究[J].辽宁师范大学学报(自然科学版),2006(1):83-87.
[18]Huang L,Sun F,Liang C Y,et al.Crystal structure of LZ-8 from the medicinal fungus Ganoderma lucidium[J].Applied Biochemistry and Biotechnology,2009,162(5):1403-1413.
[19]http://bioinformatics.psb.ugent.be/webtools/plantcare/html/
[20]Cong W R,Liu Y,Li Q Z,et al.Cloning and analysis of a functional promoter of fungal immunomodulatory protein from Flammulina velutipes[J].Molecular Biology Reports,2014,41:4381-4387.
[21]Zhou X W,Xie M Q,Hong F,et al.Genomic cloning and characterization of a FIP-gsi gene encoding a fungal immunomodulatory protein from Ganoderma sinensis zhao et al(Aphyllophoromycetideae)[J].International Journal of Medicinal Mushrooms,2009,11:77-86.
[22]Shirsat A,Wilford N,Croy R,et al.Sequences responsible for the tissue Specific promoter activity of apea legumin gene in tobacco[J].Molecular Genetics and Genomics,1989,215(2):326-331.
[23]Kuwahara J,Yonezawa A,Futamura M,et al.Binding of transcription factor Sp1 to GCbox DNA revealed by foot printing analys is:Different contact of three zinc fingers and sequence recognition mode[J].Biochemistry,1993,32(23):5994-6001.
[24]苏恺琪.真菌免疫调节蛋白表达调控研究[D].上海:上海交通大学,2013.
(责任编辑 陈虹)
Cloning and Promoter Sequence Analysis of Fip-gpo Gene from Ganoderma pseudoferreum
LIU Wen-bo,QIN Chun-xiu,XUE Wen-hua,LIANG Peng,WU Guo-liang,LIN Chun-hua,MIAO Wei-guo*,ZHENG Fu-cong*
(Hainan Key Laboratory for Sustainable Utilization of Tropical Bioresource/College of Environment and Plant Protection,Hainan University,Hainan Haikou 570228,China)
This experiment was conducted to investigate the sequence characteristics and expression pattern of fungal immunomodulatory protein gene in Ganoderma pseudoferreum.The cDNA,DNA and promoter sequences of a Fip-gpo gene by homologous cloning from G.Pseudoferreum were isolated and analyzed.The result showed that the fragment contained a full encoding region of 934 bp encoding 111 amino acid residues with a molecular mass of 12.54 kD,this deduced protein had a pI of 4.66,four ATM Phosphorylation sites prediction,and similarity with Fip sequence of G.lucidum in 91%;Its DNA promoter sequence had 59 bp intron,in addition to the TATA/CAATbox,its promoter contains some specific regulatory elements such as light responsive element and cis-acting regulatory element involved in light responsiveness,gibberellin-responsive element,cis-acting regulatory element involved in the MeJA-responsiveness,cis-acting regulatory element essential for the anaerobic induction,cis-acting regulatory element required for endosperm expression,cis-acting regulatory element related to meristem specific activation and auxin-responsive element.It was supposed that the expression of Fip-gpo gene was regulated by circadian,abiotic elicitor,light et al.
Ganoderma pseudoferreum;Fungal immunomodulatory proteins;Fip-gpo gene;Promoter sequence analysis
S435.76
A
1001-4829(2017)1-0122-07
10.16213/j.cnki.scjas.2017.1.022
2016-01-20
2015年海南省自然科学基金(20153131);农业部2013年热作农技推广与体系建设项目(13RZNJ-20);国家农业产业技术体系建设(CARS-34-GW8);农业部2012年热作农技推广与体系建设项目(12RZNJ-19)
刘文波(1978-),男,云南曲靖人,硕士,主要从事热带植物病理研究,E-mail:saucher@163.com,*为通讯作者:缪卫国(1969-),男,江苏南通人,博士,教授,从事分子植物病理等研究,E-mail:weiguomiao1105@126.com;郑服丛(1956-),男,教授,从事植物病理学研究,E-mail:zhengfucong@126.com。

