EMA-qPCR方法快速检测番茄溃疡病菌活菌研究
[KH-*3D]周大祥,熊书
(1.重庆三峡学院生命科学与工程学院,重庆404100;2.重庆大学生命科学学院,重庆400300;3.重庆三峡医药高等专科学校基础医学部,重庆404120)
EMA-qPCR方法快速检测番茄溃疡病菌活菌研究
[KH-*3D]周大祥1,2,熊书3*
(1.重庆三峡学院生命科学与工程学院,重庆404100;2.重庆大学生命科学学院,重庆400300;3.重庆三峡医药高等专科学校基础医学部,重庆404120)
将叠氮溴乙锭(EMA)与实时荧光定量PCR技术相结合(EMA-qPCR),建立一种有效快速检测番茄溃疡病活菌的方法。以番茄溃疡病菌Pat-1基因为检测靶标,菌体经EMA渗透处理,再进行qPCR特异性扩增。结果显示,qPCR检测灵敏度为1.0×101CFU/mL;当EMA的浓度为2.0 μg/mL时,能有效抑制1.0×107CFU/mL灭活死菌的扩增,对活菌的扩增没有影响。当活菌数在1.0×101~1.0×105CFU内,每个qPCR反应体系中活菌CFU数与Ct值呈线性相关(R2=0.987)。不同温度处理后EMA-qPCR检测番茄溃疡病菌的存活情况并与平板计数法进行比较,表明待检样品可在4和20℃短期保存。对疑似带病番茄种子样品进行EMA-qPCR检测,发现EMA-qPCR方法能减少番茄溃疡病菌PCR检测的假阳性结果。本研究建立的EMA-qPCR方法是一种能有效检测番茄溃疡病活菌的方法,并能有效避免PCR检测实际样品可能造成的假阳性结果。
番茄溃疡病菌;叠氮溴乙锭(Ethidium monoazide bromide,EMA);实时荧光定量PCR(qPCR)
番茄溃疡病作为番茄生产中最严重的病害之一,Clavibactermichiganensissubsp.michiganensis (CMM)是其病原菌[1]。目前,番茄疡病菌的检测主要通过PCR技术,常规PCR技术既能对活菌的DNA进行扩增,还能将自由状态的DNA或死菌的DNA扩增[2],导致检测出现假阳性,因此急需建立一种快速有效检测待检样品中番茄溃疡病菌的方法。
叠氮溴乙锭(Ethidium monoazide bromide,EMA)是一种染料,能够与核酸结合,当光解后生成的氮宾化合物能够穿过死菌的细胞膜,与菌体DNA发生不可逆共价结合,PCR扩增被抑制,但不会抑制细胞膜完整的活菌PCR扩增[3-5]。EMA-PCR方法仅以活菌DNA分子为检测靶标,克服了传统PCR检测假阳性较高的缺点,使结果更加有效、可靠。因此,本研究拟通过EMA-qPCR对番茄溃疡病菌进行快速检测,分析EMA对PCR检测番茄溃疡病菌死活细菌的影响;同时,初步优化了番茄种子中溃疡病菌活菌的EMA-qPCR检测体系。
1 材料与方法
1.1 材料
菌株:番茄溃疡病菌由西南大学植保学院提供,本实验室保存。
试剂:叠氮溴乙锭(Ethidium monoazide bromide,EMA,Invitrogen),SYBRPremix Ex Taq TMⅡMix(TaKaRa),523固体培养基,LB液体培养基。
1.2 方法
1.2.1 番茄溃疡病菌活菌和死菌的制备挑取523培养基上的番茄溃疡病菌,接种到20 mL LB液体培养基中,28℃,250 r/min培养10 h,调整菌悬液浓度为1.0×107CFU/mL。将一半活菌悬液100℃水浴加热10 min,获得死菌悬液。
1.2.2 DNA模板制备将番茄溃疡病菌接种至LB液体培养基,28℃,250 r/min培养10 h,使OD600值在0.4~0.8,按照《新编分子生物学实验指南》的操作提取DNA[6]。
1.2.3 番茄溃疡病菌检测特异性引物及荧光定量PCR条件参考Dreier等[7]的报道,根据番茄溃疡病菌Pat-1基因设计特异引物PadF(5'-GGTTCTCTATTTCCTCGGTTCCAC-3')和PadR(5'-CCATCCAGCACTTCCCTATGTCT-3'),引物由北京华大基因公司合成。qPCR检测使用仪器为CFX96 Real-Time PCR System(BIO-RAD,USA),荧光染料SYBR GreenⅠ染色。反应体系25 μl:12.5 μl SYBR Premix Ex Taq mix(TaKaRa),引物PadF/PadR(10 μM)各0.75 μl,模板2 μl,加超纯水补至25 μl。PCR反应程序为:95℃预变性10 s(95℃15 s,60℃1 min,循环40次),qPCR扩增完成后随即分析熔解曲线,扩增特异性验证。
1.2.4 荧光定量PCR灵敏度实验将新鲜培养的番茄溃疡病菌连续10倍进行稀释,取稀释后的菌液各1 mL进行荧光定量PCR扩增,同时取对应稀释的菌液各1 mL涂布平板,28℃培养48~72 h计数,重复3次。
1.2.5 EMA-qPCR条件优化(1)死、活细菌的EMA用量优化:黑暗中,分别取1 mL番茄溃疡病菌的活菌和死菌悬液(1.0×107CFU/mL),避光加入不同终浓度的EMA,避光室温静置5 min,将离心管置于冰上,打开管盖,距离650 W卤钨灯15 cm,持续曝光8 min[8-9],EMA激活。
(2)EMA渗透处理死、活混合菌悬液:将5.0× 106CFU的死菌分别与5×108、2.5×108、5×107、2.5×107、5×106、2.5×106、5×105、2.5×105、5× 104、2.5×104、5×103CFU的活菌混合,形成相应的死、活菌混悬液,将优化出的EMA测定浓度分别按1.2.5(1)的条件进行处理。
1.2.6 EMA-qPCR法和平板计数法比较不同温度处理后番茄溃疡病菌的存活情况取1 mL浓度为1.0×107CFU/mL的新鲜番茄溃疡病菌活菌悬液,10 000 r/min离心5 min,然后加1 mL的超纯水混匀,分别进行-20℃冷冻、4℃冷藏和20℃常温各处理24、48和72 h,避光添加EMA,使终浓度为3.0 μg/mL,按1.2.5(1)的条件进行处理,提取模板DNA,进行qPCR扩增。取对应的菌液涂板,28℃培养48~72 h计数。
1.2.7 EMA-qPCR检测方法的假阳性验证按1.2.1制备的浓度为107、106、105CFU/mL的番茄溃疡病菌死菌溶液,比较常规qPCR法、EMA-qPCR法和平板培养计数对灭活死菌的检测差异,验证EMA-qPCR方法检测的假阳性。
1.2.8 番茄种子样品中番茄溃疡病菌的EMA-qPCR扩增将重庆、四川等地采集的11份疑似番茄溃疡病症状的种子去皮,无菌操作取0.1 g种子,充分吹打搅拌,分别添加无菌Milli-Q水800 μl静置2 h,取上层液进行后续实验(保留部分上层液经6 h富集培养备用)。没有富集培养的上层液加入终浓度为4.0 μg/mL的EMA(比纯菌条件下稍高),以相应的上层液热致死处理后再加入EMA为对照。按1.2.5(1)的条件进行EMA静置曝光处理。
1.2.9 数据分析应用SPSS19.0对实验数据进行t检验,P<0.05表示具有显著性差异。
2 结果与分析
2.1 荧光定量PCR灵敏度
当番茄溃疡病菌浓度降低,Ct值逐渐增大,通过平板计数的菌浓度为1×100CFU/mL时,荧光定量PCR检测结果为阴性,因此,荧光定量PCR检测灵敏度为1×101CFU/mL(图1)。
2.2 抑制纯培养死菌DNA扩增的最适EMA浓度
对死菌的EMA-qPCR检测结果显示,添加EMA的各组Ct值与未添加EMA的对照组相比均显著增加(P<0.05),当EMA终浓度≥2.0 μg/mL时,死菌的PCR扩增被彻底抑制(图2A)。低浓度的EMA(≤10 μg/mL)对活菌PCR扩增抑制不显著(P>0.05)。但是,当EMA≥20 μg/mL时,可显著抑制活菌的PCR扩增(P<0.05)(图2B)。可见,抑制死菌DNA扩增的最低EMA浓度(2.0 μg/mL)远远小于影响活菌DNA扩增的最小EMA浓度(20 μg/mL)。因此,使用终浓度为3.0 μg/mL的EMA作为纯菌培养后续实验的最佳浓度。
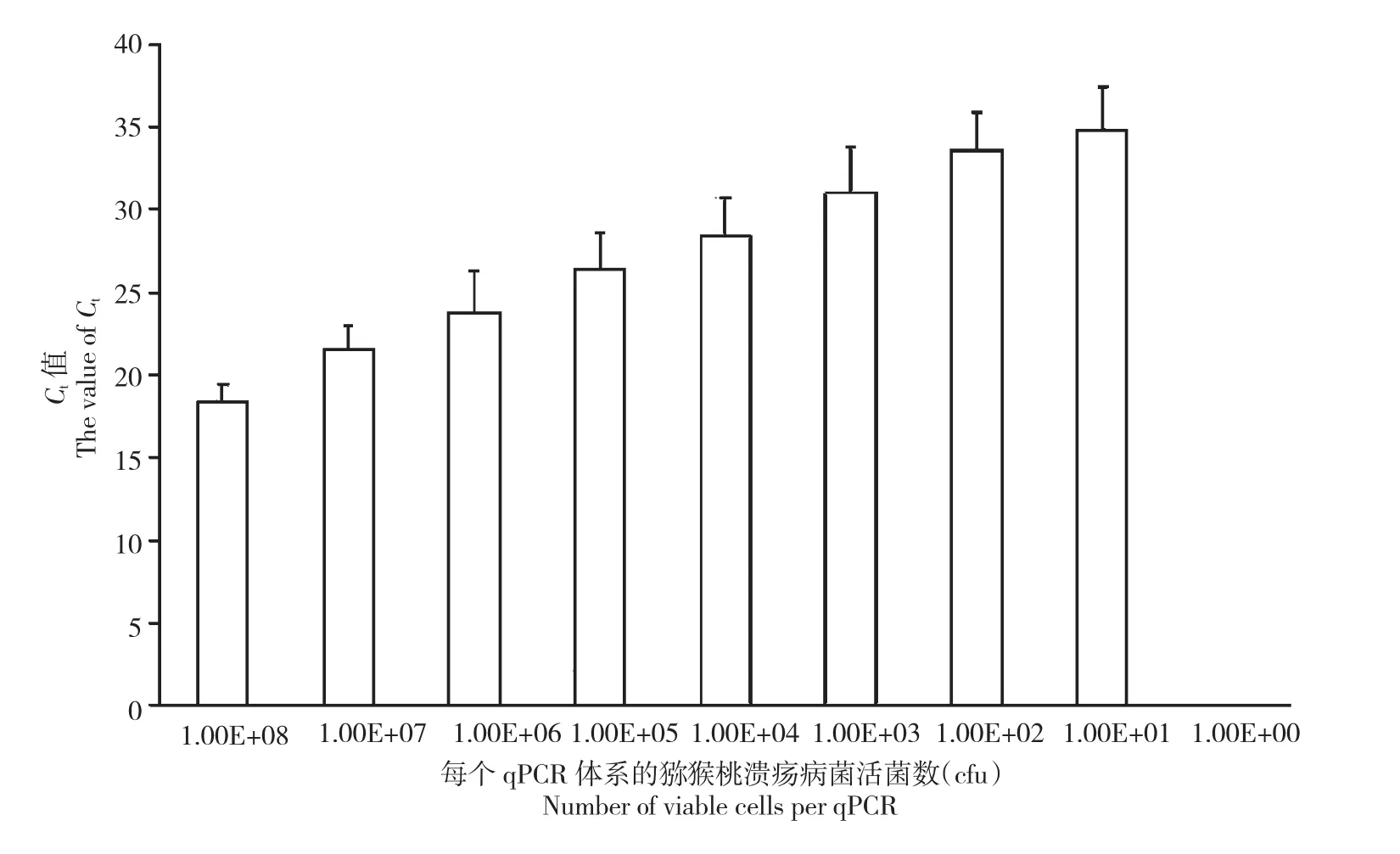
图1 荧光定量PCR检测番茄溃疡病菌的灵敏度Fig.1The detection limit of qPCR for CMM
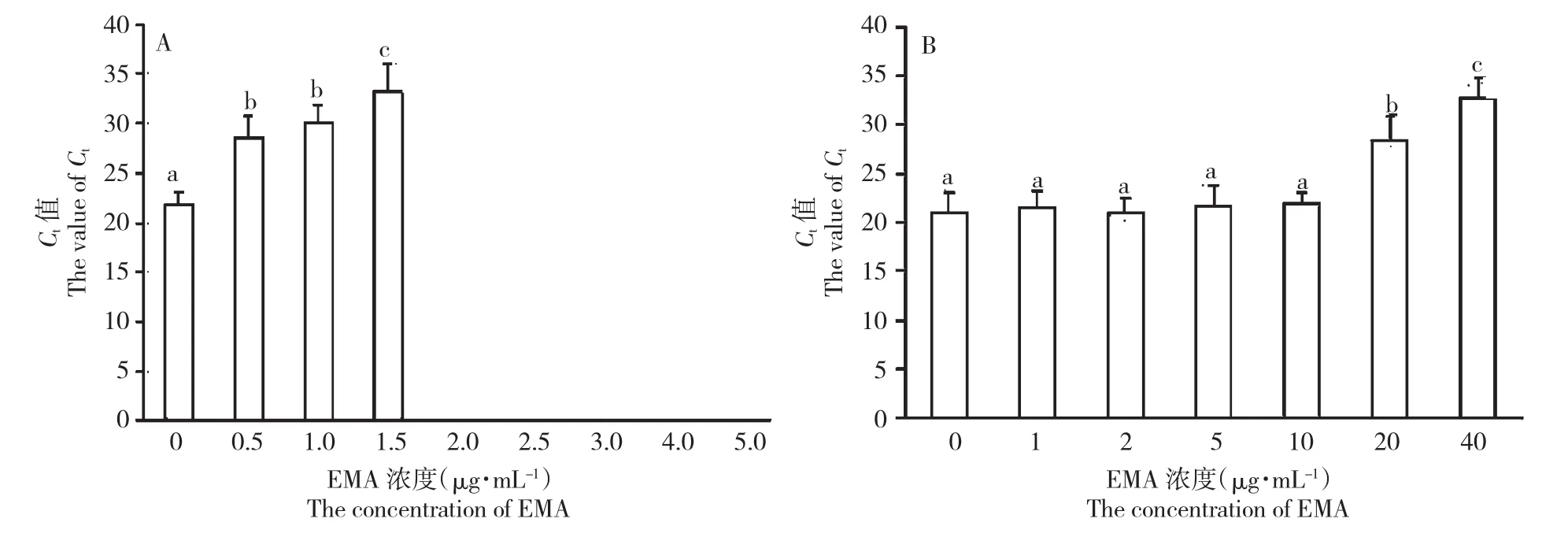
图2 番茄溃疡病菌EMA-qPCR检测体系中最适EMA浓度Fig.2Optimization of the EMA concentration in EMA-qPCR
2.3 死活菌混合体系中EMA-qPCR选择性扩增活菌
用5.0×106CFU的死菌与不同数目的活菌混匀后,加入EMA(终浓度3.0 μg/mL)。发现死菌DNA的扩增被彻底抑制,随着活菌数目降低,Ct值逐渐增加,检测最低限度达到1.0×101(Ct为34.03)个活菌(图3A)。在活菌为1.0×101~1.0× 105CFU内,其CFU数与Ct值呈线性相关,相关系数为R2=0.987(图3B)。此时,以Ct值对qPCR中活菌CFU数可进行快速定量测定。
2.4 EMA-qPCR检测不同温度处理后番茄溃疡病菌的存活情况
在-20、4和20℃3个常规温度分别保存24、48和72 h,EMA-qPCR测定番茄溃疡病菌的存活情况并与平板培养计数法进行比较。结果表明,当1.0×107CFU的活菌经-20℃冷冻处理72 h后,通过EMA-qPCR检测活菌数为4.1×105CFU,平板培养计数法检测活菌数为4.5×103CFU,2种结果显著差异(P<0.05),显示番茄溃疡病菌低温处理会部分死亡。4℃冷藏和20℃常温放置72 h后,2种方法的活菌测定结果无显著差异(P>0.05),且接近对照活菌数,表明待检样品可在4和20℃短时间保存(表1)。
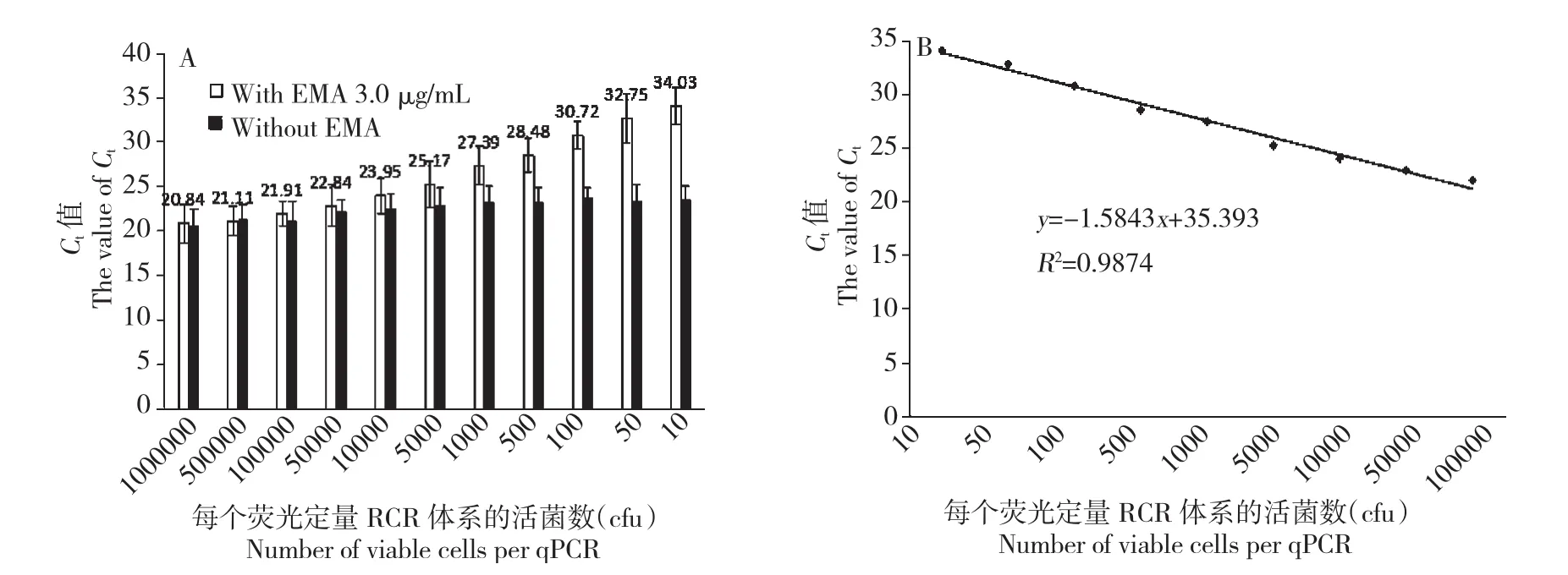
图3 EMA-qPCR扩增死活细胞混合体系Fig.3The amplication of mixed bacteria by EMA-qPCR

表1 EMA-qPCR法和平板计数法比较不同温度处理后番茄溃疡病菌的存活Table 1Use of EMA-qPCR method to determine CtCMM compared with the method of plate counting
2.5 EMA-qPCR检测方法的假阳性验证
从表2可知,除了常规qPCR法测定到存在番茄溃疡病菌外,平板计数法和EMA-qPCR法的测定结果皆为阴性。表明番茄溃疡病死菌DNA在短时间内也可作为PCR扩增的模板,常规qPCR法不能有效区分番茄溃疡病死活菌。而EMA-qPCR法只以活菌DNA为测定靶标,不会扩增死菌DNA,没有出现假阳性结果,本实验利用平板培养计数法进一步证明了EMA-qPCR法的可靠性。
2.6 EMA-qPCR检测疑似番茄溃疡病种子样品
对重庆、四川等地采集的11份疑似番茄溃疡病种子样品(浸泡液未经富集培养)进行测定,结果发现对照EMA-qPCR测定结果均为阴性,说明种子样品中番茄溃疡病死菌DNA的扩增被完全抑制。3份来自重庆(03)、福建(06)和江西(08)的样品EMA-qPCR测定结果为阴性,与平板培养结果一致,富集后的3份样品EMA-qPCR检测结果还是阴性(未列出数据),而qPCR检测结果为阳性。表明EMA-qPCR法可以代替平板培养法快速检验番茄溃疡病种子。

表2 常规qPCR方法、EMA-qPCR方法和平板计数法测定灭活番茄溃疡病菌数Table 2Comparison of bacterial counts determined by EMA-qPCR and plate counting methods

表3 番茄实际样品的检测Table 3Detection of tomato samples
3 讨论
普通PCR技术可以快速鉴定细菌,但不能区分细菌的死活。由于EMA作用具有选择性[8-9],它只能进入细胞壁(膜)不完整的死细胞内,不能进入细胞壁(膜)完整的活细胞。因此,将EMA与qPCR方法相结合,能快速、准确地区分实际样品中的死活菌,有效降低传统PCR检测的假阳性,目前已经广泛应用于食源致病微生物和临床医学的检测中[10-13],但在植物病原菌的检测上报道极少[5,14]。
当EMA终浓度≥2.0 μg/mL时,1.0×107CFU/mL浓度死菌的DNA扩增被完全抑制。死活菌混合实验表明,检测最低限度达到1.0×101个活菌,在活菌数为1.0×101~1.0×105CFU内,其CFU数与Ct值呈线性相关。此时,以Ct值对qPCR中活菌CFU数可进行快速定量测定。
活菌经过-20℃保存72 h后,EMA-qPCR法检出的活菌数高于比平板计数法,原因可能是低温短期处理后的死亡菌体仍能保持细胞壁(膜)完整,使EMA染料无法渗透进入[15-16]。4和20℃保存72 h,2种方法的活菌检测结果一致,且接近对照活菌数,但EMA-qPCR法耗时更短,大大节约了测定时间。综合实验结果表明,番茄溃疡病待检样品可在4℃冷藏和20℃常温短期保存,不会影响检测结果,但不能在-20℃冷冻短期保存。
目前,EMA结合PCR技术检测实际样品中的病原菌报道极少[14]。EMA-qPCR检测疑似番茄溃疡病种子样品时,因为番茄种子中未经富集培养的浸泡液细菌总浓度不会超过1.0×107CFU/mL,同时番茄种子中的非靶标死菌可能会消耗一部分EMA,因此选择EMA浓度为4.0 μg/mL。结果表明,11份种子对照样品的EMA-qPCR检测结果都是阴性,说明EMA在番茄种子检测中抑制溃疡病菌的效果比较理想。其中3份样品的EMA-qPCR测定结果与qPCR测定结果不同,与平板培养结果相同,表明EMA-qPCR方法比qPCR法更能克服假阳性的出现,准确反映实际样品的带菌情况,并且比平板培养法检测时间更短。
有时,种子中存在的活菌数可能非常少,低于qPCR的最低检测下限,这样将会出现EMA-qPCR检测假阴性结果。因此当未经富集培养的浸泡液检测结果为阴性时,必须通过富集培养后再进行EMA-qPCR检测,才能确定实际样品中是否有活菌存在。
[1]Chang R J,Ries S M,Pataky J K.Dissemination of Clavibacter michiganensis subsp.michiganensis by practices used to produce tomato transplants[J].Phytopathololgy,1991,81:1276-1281.
[2]Wang S S,Levin R E.Discrimination of viable vibrio vulnificus cells from dead cells in real-time PCR[J].Journal of Microbiological Methods,2006,64:1-8.
[3]Boltont P H,Kearns D R.Spectroscopic properties of ethidium monoazide:a fluorescent photoaffinity label for nucleic acids[J].Nucleic Acids Research,1978,5(12):4891-4904.
[4]Nogva H K,Dromtorp S M,Nissen H,et al.Ethidium monoazide for DNA-based differentiation of viable and dead bacteria by 5'-nuclease PCR[J].BioTechniques,2003,34(4):804-813.
[5]熊书,殷幼平,王芳,等.基于EMA-qPCR的茄科青枯菌活体检测技术的建立[J].微生物学通报,2013,40(9):1723-1732.
[6]奥斯伯F,布伦特R,金斯顿R E,等.新编分子生物学实验指南[M].颜子颖,王海林译.北京:科学出版社,1998:78-79.
[7]Dreier J,Bermpohl A,Eichenlaub R.Southern hybridization and PCR for specific detection of phytopathogenic Clavibacter michiganensis subsp.michiganensis[J].Phytopatohology,1995,85:462-468.
[8]Wagner A O,Malin C,Knapp B,et al.Removal of free extracellular DNA from environmental samples by ethidium monoazide and propidium monoazide[J].Applied and Environmental Microbiology,2008,74(8):2537-2539.
[9]Lee J L,Levin R E.Discrimination of viable and dead vibrio vulnificus after refrigerated and frozen storage using EMA,sodium deoxycholate and real-time PCR[J].Journal of Microbiological Methods,2009,79(2):184-188.
[10]Rudi K,Moen B,Drmtorp S M,et al.Use of ethidium monoazide and PCR in combination for quantification of viable and dead cells in complex samples[J].Applied and Environmental Microbiology,2005,71(12):1018-1024.
[11]Lee J L,Levin R E.A comparative study of the ability of EMA and PMA to distinguish viable from heat killed mixed bacterial flora from fish fillets[J].Journal of Microbiological Methods,2009,76(1):93-96.
[12]伦镜盛,夏常艳,罗鹏,等.副溶血弧菌EMA-PCR检测技术的建立[J].微生物学通报,2011,38(6):952-956.
[13]黄偌颖,方梅,罗影殊,等.EMA-PCR技术检测肠出血性大肠杆菌O157:H7[J].四川大学学报:医学版,2014,45(1):152-155.
[14]熊书,王中康,卢小林,等.柑橘溃疡病菌EMA-PCR快速活体检测技术的建立[J].植物保护,2013,39(4):78-84.
[15]Kell D B,Keprelyants A S,Weichart D H,et al.Viability and activity in readily culturable bacteria:a review and discussion of the practical issues[J].Antonie van Leeuwenhoek,1998,73(2):169-187.
[16]Novak J S,Juneja V K.Detection of heat injury in Listeria monocyto-genes Scott A[J].Journal of Food Protection,2001,64(11): 1739-1743.
(责任编辑 李洁)
Study on Rapid Detecting of Live Clavibacter michiganensis subsp.michiganensis by EMA-qPCR
ZHOU Da-xiang1,2,XIONG Shu3*
(1.College of Life Science and Engineering,Chongqing Three Gorges University,Chonqqing 404100,China;2.College of Life Science,Chongqing University,Chongqing Key Lab of Genetic Function and Regulation,Chongqing 400030,China;3.Department of Basic Medicine,Chongqing Three Gorges Medical College,Chongqing 404120,China)
A novel method to rapidly detect only viable cells of Clavibacter michiganensis subsp.michiganensis(CMM)was established by using the EMA-qPCR.The Pat-1 was used as the target gene for qPCR detection of CMM.Samples were treated with EMA prior to DNA extraction.DNA was then amplified by qPCR to detect only viable CMM cells.The sensitivity of qPCR detection was 1.0×101CFU/mL.2.0 μg/mL EMA could completely inhibit the PCR amplification of DNA derived from dead cells with the concentration of 1.0×107CFU/mL,but without inhibition to viable cells.A standard curve was generated relating the number of genomic targets per PCR to the Ctvalues of the EMA-qPCR.A linear range of DNA amplification was observed from 1.0×101-1.0×105genomic targets per PCR.EMA-qPCR method was used to evaluate the survival rate of CMM treated with different temperatures for a short time,compared with the method of plate count.The results indicate that samples can be stored for a short time under 4 and 20℃The data of EMA-qPCR detection on tomato seed samples indicated that 4.0μg/mL EMA could successfully inhibit PCR amplification of DNA from dead bacteria in the samples.The EMA-qPCR method established in this work can effectively avoid false positive results of CMM detection.
Clavibacter michiganensis subsp.michiganensis;Ethidium monoazide bromide;Real-time PCR
Q93-33
A
1001-4829(2017)1-0099-06
10.16213/j.cnki.scjas.2017.1.018
2016-02-16
重庆市自然科学基金(cstc2016jcyjA2132);重庆市教委科学技术研究项目(KJ1502601);重庆三峡医药高等专科学校科研苗圃工程项目(2014mpxz4)
周大祥(1979-),男,副教授,博士,研究方向为微生物检测新技术;*为通讯作者:熊书(1987-),女,讲师,硕士,研究方向为微生物检测新技术,Tel:13594772168,E-mail: dqzhou79@163.com。

