气相色谱-串联质谱法测定大米及其灌溉水中嘧菌环胺的残留量
刘芯成,黄 亮,朱萌萌,陈卢涛,周 强,王川丕
(1.绿城农科检测技术有限公司,浙江 杭州 310000; 2.安徽农业大学 茶与食品科技学院,安徽 合肥 230036)
气相色谱-串联质谱法测定大米及其灌溉水中嘧菌环胺的残留量
刘芯成1,黄 亮1,朱萌萌1,陈卢涛1,周 强2,王川丕1
(1.绿城农科检测技术有限公司,浙江 杭州 310000; 2.安徽农业大学 茶与食品科技学院,安徽 合肥 230036)
建立了大米及灌溉水中嘧菌环胺残留量的气相色谱- 串联质谱(GC- MS/MS)检测方法,并模拟实际生产环境,对嘧菌环胺的稳定性进行研究。大米样品经乙腈提取,氨基固相萃取柱(NH2- SPE)净化;大米灌溉水经二氯甲烷提取,在GC- MS/MS上进行检测分析,采用外标法定量。结果表明,嘧菌环胺在0.01~0.50 mg·L-1内相关系数可达0.999以上,具有良好的线性关系;共选择3个离子对,其中1组用于定量m/z224.10/208.10,另外2组用于定性确证m/z224.10/197.10、224.10/131.10。样品中添加0.01、0.1、1.0 mg·kg-1的标准品,其回收率为85%~102%,相对标准偏差小于5%。研究表明,该方法提取效果好,具有良好的灵敏度、回收率和重复性;嘧菌环胺在灌溉水中半衰期为3.12 d,在室温、正常光照条件下,1 d内稳定,2 d后降解速度加快,4 d后降解速度减慢并趋于稳定,为实际生产中如何施药提供了一定的参考依据。
嘧菌环胺; GC- MS/MS; 稳定性
嘧菌环胺属于嘧啶胺类化合物,20世纪90年代由瑞士先正达作物保护有限公司开发成功,主要用于防治灰霉病、白粉病、黑星病、网斑病、颖枯病和小麦眼纹病等[1],其作用机理是通过抑制蛋氨酸的生物合成和水解酶的生物活性而导致病菌死亡[2]。而纹枯病、灰霉病和稻瘟病等真菌性病害是限制水稻稳产、高产的主要限制因子之一。嘧菌环胺具有较广的杀菌活性。艾爽等[3]研究嘧菌环胺对水稻纹枯病具有一定的抑制效果;徐桂芳等[4]研究表明,30%嘧菌环胺悬浮剂对稻瘟病防治效果明显,可有效抑制叶稻瘟病和穗颈瘟的流行。
目前我国尚未制定嘧菌环胺在大米中最大残留限量,但规定其在小麦和杏仁中的限量分别为0.5和0.02 mg·kg-1。2014年日本修订嘧菌环胺在多种食品中的残留限量。大麦由3.0 mg·kg-1调整为2.0 mg·kg-1,洋葱由0.6 mg·kg-1调整为0.05 mg·kg-1。欧盟对嘧菌环胺在大米中最大残留限量规定为0.02 mg·kg-1[5]。目前,对嘧菌环胺的检测主要集中在气相色谱、液相色谱及液相色谱质谱联用上。Otero等[6]采用SPME- GC- MS对白葡萄酒中的嘧菌环胺进行检测,LOD和LOQ分别为0.1和0.2 μg·L-1。Luis等[7]采用高效液相色谱结合二极管阵列检测器对葡萄中的嘧菌环胺进行检测,回收率达到97%左右。而三重四级杆串联质谱通过对适当的母离子进行二次质谱分析,能有效去除基质离子的干扰,定性更加准确,并具有较高的灵敏度[8]。本研究建立了大米及其灌溉水中嘧菌环胺的气相色谱- 串联质谱测定方法,并对该药在水中的稳定性进行了探讨,为指导该药在水稻种植中的合理使用提供了一定的参考依据。
1 材料与方法
1.1 材料与仪器
气相色谱- 串联质谱仪(GC- 2010 plus气相色谱仪配TQ8040质谱仪,ZB- 5MS色谱柱(30 m×0.25 mm×0.25 μm),日本Shimadzu公司);ST- 16R离心机(美国Thermo Fisher公司);BSA2202S电子天平(德国Sartorius公司);漩涡混合器(美国Henry Troemner公司);旋转蒸发仪(瑞士Buchi 公司);NH2- SPE氨丙基固相萃取柱(500 mg,6 mL天津博纳艾杰尔科技有限公司);KQ5200E超声波清洗器(昆山市超声仪器有限公司);MTN- 5800氮吹仪(天津奥特赛恩斯仪器有限公司)。
嘧菌环胺标准品(纯度98.5%,德国Dr.Ehrenstorfer公司);乙腈、丙酮(HPLC级,美国J.T.Baker公司);其他试剂为分析纯,实验室所用水均为去离子水;微孔有机滤膜(0.22 μm)。
1.2 供试样品
大米及其灌溉水样品由蓝城农业科技有限公司提供。大米样品经粉碎机粉碎,过40目筛,混匀,于常温下保存。
1.3 试验步骤
1.3.1 大米样品
称取10 g(精确至0.01 g)于100 mL烧杯中,加入5 mL水浸泡0.5 h,加入50 mL乙腈,用均质器在15 000 r·min-1匀浆提取1 min,抽滤并转移提取液至100 mL具塞量筒中(内加5~7 g氯化钠),剧烈振摇2 min,静置30 min,取上清液10 mL待净化;用5 mL乙腈预淋洗NH2柱,将NH2柱放置在固定架上,下接鸡心瓶,移入上述10 mL待净化液,用15 mL乙腈+甲苯(3+1)分3次洗涤小柱,收集所有流出物,旋转浓缩至近干,用2 mL正己烷定容,涡旋溶解,用0.22 μm有机滤膜过滤,收集滤液待测定。
1.3.2 灌溉水
量取10 mL于125 mL分液漏斗中,加入20 mL二氯甲烷,剧烈振摇1 min,取二氯甲烷层于鸡心瓶中;残渣分别用10 mL二氯甲烷重复提取2次,合并3次提取液,旋转蒸发浓缩至净干,用10 mL正己烷定容,涡旋溶解,用0.22 μm有机滤膜过滤,收集滤液待测定。
1.3.3 嘧菌环胺在灌溉水中稳定性试验
取灌溉水10.0 mL于50 mL离心管中,加入浓度为1.00 mg·L-1的嘧菌环胺标准溶液1.00 mL,混匀后加盖密闭,共配制待测样品24个,置于恒温(25±1)℃、光照与黑暗时间为15 h∶9 h的培养箱中,分别于0,1,2,3,4,5,6,7 d后依次取出3个样品进行检测,检测方法同1.3.2节。
1.3.4 标准溶液的配制
称取嘧菌环胺0.009 6 g,用色谱纯丙酮定容至25.0 mL,得到约378 mg·L-1嘧菌环胺标准储备溶液,用正己烷稀释为40.0 mg·L-1的嘧菌环胺标准工作溶液,于0~4 ℃保存。
1.3.5 基质工作液的配制
试验中根据需要,取1.3.1节所述提取的样品液对标准储备液进行稀释,现配现用。
1.4 试验条件
1.4.1 色谱条件
进样口温度250 ℃,载气为高纯氦气,碰撞气为高纯氩气,纯度≥99.999%,柱流量为1.6 mL·min-1;不分流进样,1.0 min后开阀;进样量1 μL;定量方法外标法。
1.4.2 质谱条件
色谱- 质谱接口温度280 ℃,电离方式EI,电离能量70 eV,离子源温度230 ℃,检测器电压0.99 kV (+0.4 kV),测定方式为MRM多重反应监测模式。定性、定量离子、碰撞能量等参数见表1。

表1 嘧菌环胺质谱检测参数
注:*表示定量离子。
2 结果与分析
2.1 气相色谱- 质谱条件的优化
在电子轰击离子源(EI)检测模式下对嘧菌环胺进行一级质谱分析(Q3 Scan),在质谱图中选择分子量较高,离子强度较大的离子为前体离子。设定3~45 eV(每3 eV为1个间隔)的碰撞能量,对得到的前体离子峰进行二级质谱分析(产物离子扫描),根据二级质谱图,选择离子强度最大的为定量离子(224.10>208.10),离子强度次之的为定性离子(224.10>197.10,224.10>131.10)。图1为使用优化后的气相色谱质谱条件对嘧菌环胺标准品及试验回收的MRM质谱图。

图1 嘧菌环胺MRM色谱图
2.2 灌溉水中嘧菌环胺提取溶剂的选择
本研究针对灌溉水中嘧菌环胺的萃取,分别比较二氯甲烷、石油醚和乙腈3种提取溶剂对该药回收率的影响。由图2可知,3种溶剂中的回收率均达到75%以上,其中乙腈、二氯甲烷溶液回收率达到85%以上,考虑到二氯甲烷的沸点更低,有利于后续的浓缩及净化过程,因此选择二氯甲烷作为提取溶剂。在萃取体积的选择上,使用20 mL二氯甲烷萃取1次得到的回收率为66.1%,而使用20、10和10 mL分次萃取,回收率在90.0%以上,说明分批萃取可从样品中有效萃取嘧菌环胺。因此本试验选择用20、10和10 mL二氯甲烷的体积分3次萃取嘧菌环胺。
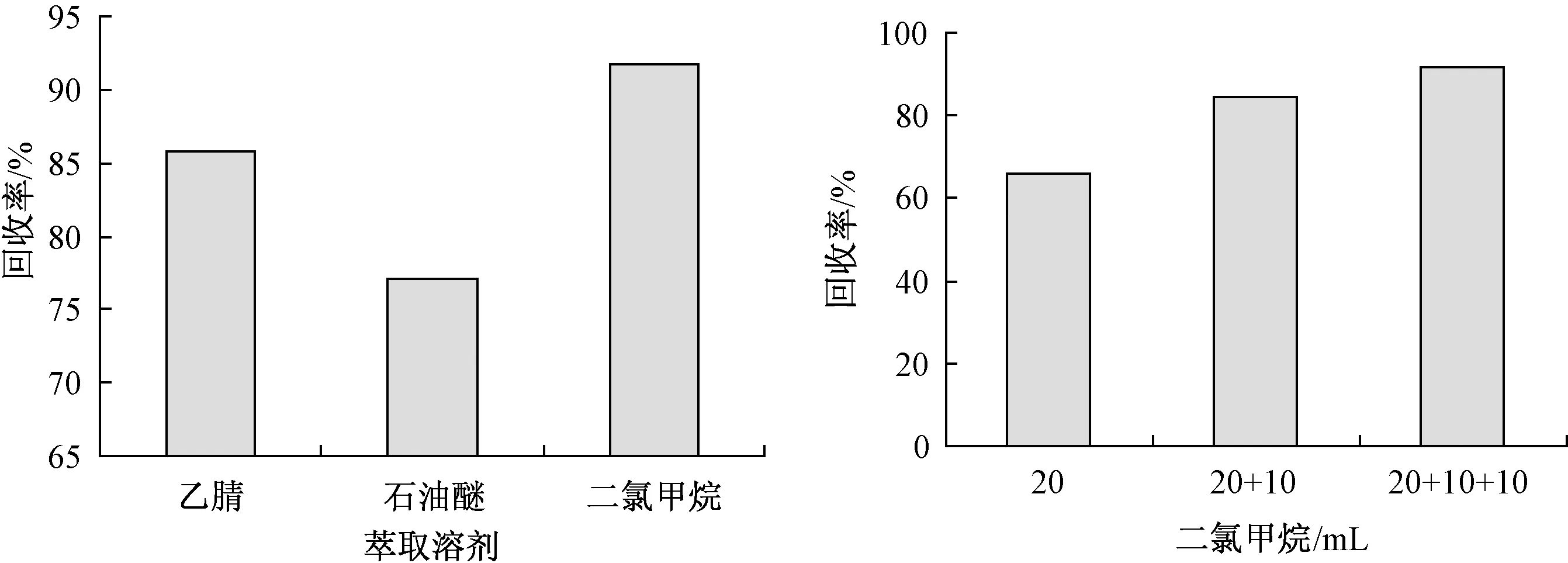
图2 不同溶剂及不同体积二氯甲烷萃取嘧菌环胺的回收率
研究过程发现,使用标准工作溶液和基质工作溶液定量对回收率的影响较大,且基质工作溶液定量比标准工作溶液的回收率高10%~15%,表明基质效应对嘧菌环胺杀菌剂的影响较大。研究中均采用基质工作溶液进行定量。
2.3 嘧菌环胺在灌溉水中稳定性的测定
农药残留的贮存稳定性不仅与其本身的性质(如化学结构、蒸汽压、水溶性等),还与贮存条件(光照、温度、湿度等)等因素有关[9]。本研究在试验室模拟了大田中正常温度和光照条件下喷施农药后嘧菌环胺在水中的降解情况。嘧菌环胺在灌溉水中的降解计算采用一级动力学方程式(Ct=C0e-kt)[10]。
图3显示,嘧菌环胺在灌溉水中的消解趋势符合一级反应动力学方程,半衰期为3.12 d。随着时间的延长,嘧菌环胺含量降低,在1和3 d时的浓度分别较0 d降低5.48%和47.3%,在5、6和7 d时浓度仅为0 d时的6.31%、3.55%和2.33%。表明嘧菌环胺在室温、正常光照条件下,1 d内稳定,在2 d后降解速度加快,4 d后降解速度减慢并趋于稳定。揭示了嘧菌环胺在正常环境条件下的降解规律,为实际生产中如何施药提供了一定的参考依据。
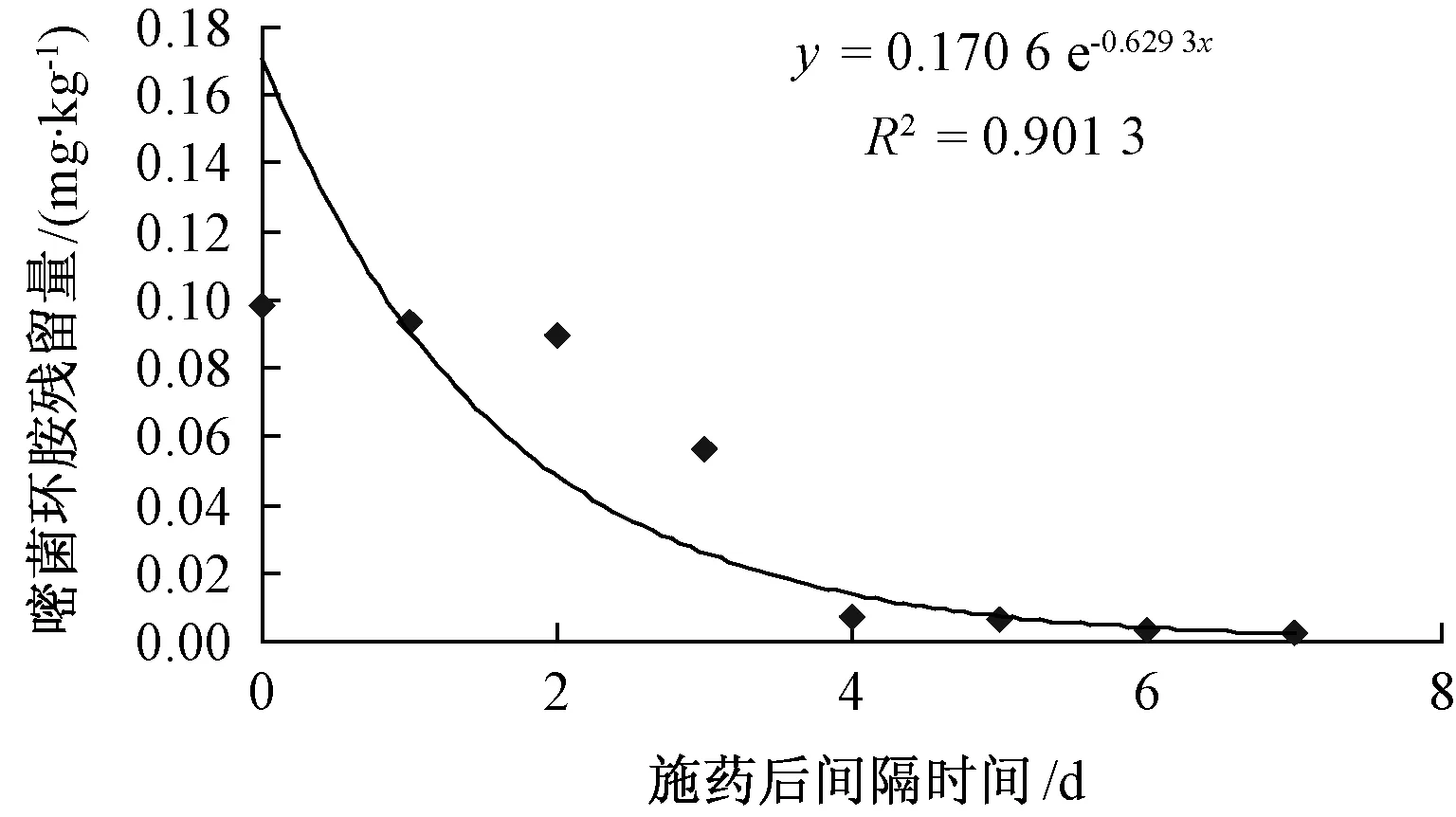
图3 嘧菌环胺在灌溉水中残留量消解动态
2.4 方法的线性范围、加标回收率、精密度和定量限
取0.010 0、0.020 0、0.050 0、0.100、0.200、0.500 mg·L-1质量浓度的嘧菌环胺农药,按优化色谱条件进样1 μL,以峰面积为纵坐标,标准样品的质量浓度为横坐标绘制标准曲线,其线性回归方程为Y=3 057.4X-14 731,相关系数为0.999 1,以信噪比S/N≥3估算仪器的检出限(LOD),S/N≥10估算仪器的定量下限(LOQ)分别为0.083和0.270 μg·kg-1。
称取不含农药的空白大米及灌溉水样品,分别添加0.010 0、0.100和1.00 mg·kg-1不同水平的嘧菌环胺标准溶液进行回收率试验,每个添加水平重复3次,添加回收试验结果见表2,空白基质及加标回收气质色谱结果见图1。
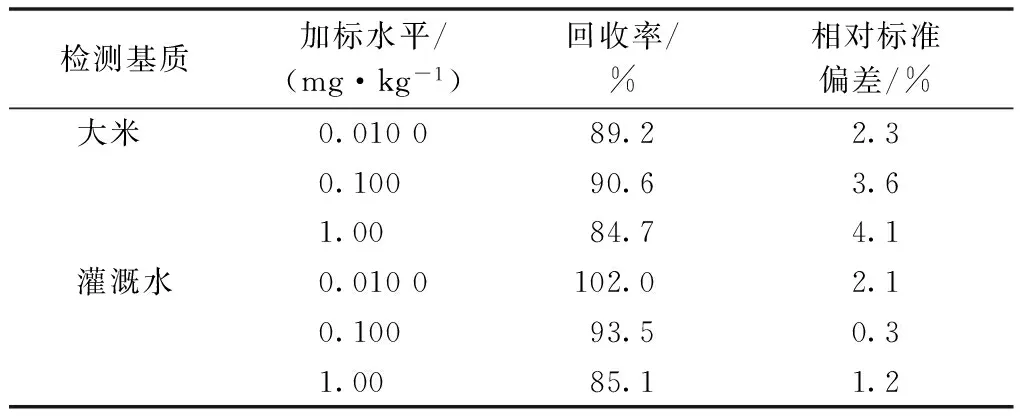
表2 嘧菌环胺加标回收率及相对标准偏差
3 小结
本文建立了气相色谱- 串联质谱分析大米及其灌溉水中嘧菌环胺杀菌剂的农药残留方法,大米、灌溉水样品分别用乙腈和二氯甲烷萃取,大米样品用NH2- SPE固相萃取柱净化后,进入GC- MS/MS检测分析,利用外标法进行定量。结果表明,该方法灵敏度高、回收率好,可以用于嘧菌环胺的检测分析;模拟大田实际环境,对嘧菌环胺在水中的稳定性进行分析,结果表明,该药在室温、正常光照条件下,24 h内稳定,在48 h后降解速度加快,96 h后降解速度减慢并趋于稳定。揭示了嘧菌环胺在正常环境条件下的降解规律,为实际水稻生产如何施药提供了一定的参考依据。
[1] 潘东,杨红,刘贤进. 葡萄中嘧菌环胺的气相色谱分析[J].江苏农业学报,2009,25(5):1199- 1200.
[2] 何永梅,贾世宏. 内吸性杀菌剂—嘧菌环胺[J].农化市场十日讯,2011(28):32.
[3] 艾爽,侯昌亮,胡寒哲,等. 8种杀菌剂对水稻纹枯病菌的室内毒力比较[J].长江大学学报自然科学版(石油/农学),2014,11(2):4- 5.
[4] 徐桂方,陈二龙,姜国庆,等. 早稻稻瘟病田间药效试验[J].植物医生,2015,28(4):32- 33.
[5] European pesticides database of maximum residue levels(Last update:2016- 02- 17). http://ec.europa.eu/food/plant/pesticides/max_residue_ levels/index_en.htm.
[6] OTERO R R,RUIZ C Y,GRANDE B C,et al. Solid- phase microextraction- gas chromatographic- mass spectrometric method for the determination of the fungicides cyprodinil and fludioxonil in white wines[J]. Journal of Chromatography A,2002,942(1/2):41- 52.
[7] LUIS V F,ANA S,JESS S A,et al. Determination of cyprodinil and fludioxonil in the fermentative process of must by high- performance liquid chromatography- diode array detection[J]. Journal of the Science of Food and Agriculture,2008,88(11):1943- 1948.
[9] 王素利,陈振山,江树人,等. 农药残留样本贮存稳定性概述[C]//农药与环境安全国际会议论文集. 北京:中国农业大学出版社,2005.
[10] GAO J,GARRISON A W,HOEHAMER C,et al. Uptake and phytotransformation of organophosphorus pesticides by axenically cultivated aquatic plants[J]. Journal of Agricultural & Food Chemistry,2000,48(12):6114- 6120.
(责任编辑:张瑞麟)
2016- 10- 24
刘芯成(1987—),助理工程师,大专,从事农兽药残留检测工作,E- mail:15185227@qq.com。
10.16178/j.issn.0528- 9017.20170335
S511
B
0528- 9017(2017)03- 0472- 04
文献著录格式:刘芯成,黄亮,朱萌萌,等. 气相色谱- 串联质谱法测定大米及其灌溉水中嘧菌环胺的残留量[J].浙江农业科学,2017,58(3):472- 475.

