化学能量变化之“重”“难”“热”
内蒙古赤峰市巴林左旗林东一中(025450)
刘志龙● 王晓波●
化学能量变化之“重”“难”“热”
内蒙古赤峰市巴林左旗林东一中(025450)
刘志龙● 王晓波●
一个确定的化学反应在发生过程中是吸收能量还是放出能量与反应条件没有必然的联系,决定于反应物总能量与生成物总能量的相对大小.这个总能量让很多师生难以释怀.本文就此将能量变化的重难热点加以梳理,以备师生借鉴和参考.
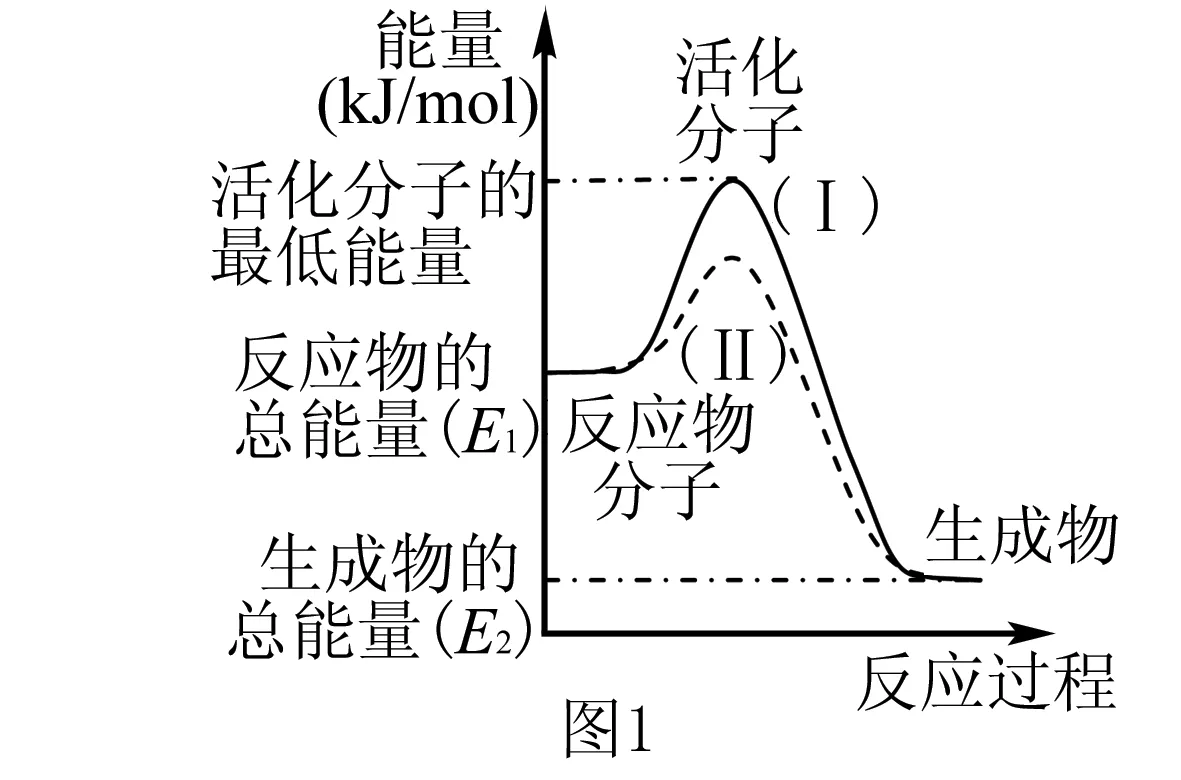
解析 图中曲线(Ⅰ)未使用催化剂(Ⅱ)使用了催化剂,催化剂的使用只是降低了反应所需要的活化能.
由Ea=E活-E反Ea′=E活-E生
二者相减得到:Ea-Ea′=E生-E反=ΔH
即由图所示ΔH=E2-E1
根据反应热的定义,可逆反应的ΔH与反应的条件、可逆反应的程度和反应物的转化率等无关,ΔH不变.然而可逆反应不可能进行完全,所以在密闭容器中若按方程式中化学计量数完全反应时,反应体系的热效应Q<|ΔH|=|E2-E1|
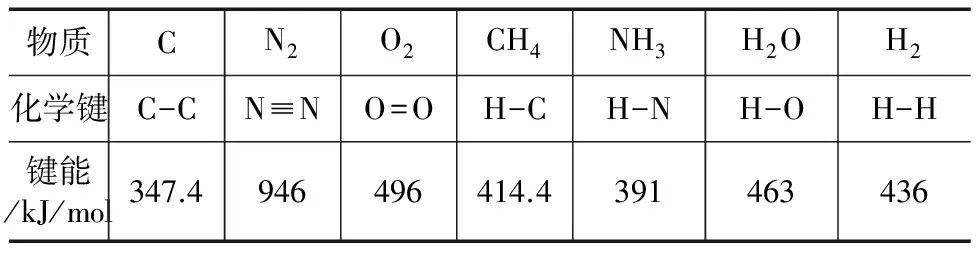
答案:Q 点评 由图所示,推导出ΔH的计算公式,再根据可逆反应的特点,从而确定出Q和|ΔH|的大小关系. 例2 下表中的数据为各物质的键能. 物质CN2O2CH4NH3H2OH2化学键C-CN≡NO=OH-CH-NH-OH-H键能/kJ/mol347.4946496414.4391463436 完成下列两个小题: (1)上述物质中能量最低的是____,形成氢化物最不稳定的是____. (2)相同条件下,N2、H2、O2分别和H2反应,当消耗等量的H2时,吸收或放出的热量最多的是____. 解析 从非金属性角度来说,元素的非金属性越弱,单质的活泼性就越弱,单质越不易与H2化合,形成的氢化物越不稳定.等量的单质与H2化合产生的热效应就越小. 从能量角度而言,物质的键能表示破坏1 mol物质中的共价键所消耗的能量,因此共价键的键能越大,物质本身所具有的能量越低,物质需要更多的能量解离,物质就越稳定.等量的单质与H2化合产生的热效应就越小. 答案:(1)N2CH4(2)H2O 点评 一个确定的化学反应在发生过程中吸收能量或放出能量ΔH=反应物的化学键键能之和-生成物的化学键键能之和=生成物能量之和-反应物能量之和. ΔH1=Q1kJ/mol ① ΔH2=Q2kJ/mol ② ΔH3=Q3kJ/mol ③ 室温下使16g纯甲醇充分燃烧,再恢复到室温放出的热量为多少? 将①/2+2×②-③即可得到室温下酒精燃烧热的方程式: 1 0.5 CO2(g)+2H2O(l) ΔH=0.5ΔH1+2ΔH2-ΔH3 0.5Q1+2Q2-Q3 Q 答案:Q=0.5(0.5Q1+2Q2-Q3)kJ 点评 利用盖斯定律解题必须首先确定目标反应,然后根据已知反应,通过四则混合运算的方法确定换算的最佳结果.同时在运算时ΔH的“+”、“—”也按照相同的方式进行计算. 重难点阐释:化学反应中的总能量变化包括:物质化学能的变化和化学键键能的变化.这两种能量变化不是割离的而是有必然联系的.由ΔH两个互为相反数的计算公式以及化学反应的总能量与总键能的反比关系.不难得出:反应物化学能之和+反应物中化学键键能之和=生成物化学能之和+生成物中化学键键能之和. 热点预测:高考对盖斯定律的考查仅局限于定律的简单应用,考查程度不深.以后的复习备考中务必倾向于将盖斯定律与原电池和电解池的知识点结合起来,这样有利于考查学生的综合应用和理解能力,也可能成为高考出题的亮点. 总结归纳: (1)对于任意一个化学反应而言: 反应物总能量之和+反应物总键能之和=生成物总能量之和+生成物总键能之和. ΔH=反应物中化学键键能之和-生成物中化学键键能之和=生成物化学能之和-反应物化学能之和. ΔH=Ea-Ea′(Ea为反应物的活化能;Ea′为生成物的活化能) (2)同一主族元素的单质和H2化合时:元素的非金属性越弱,单质越不活泼,与H2就越不容易化合,生成的氢化物就越不稳定,形成化合物的共价键键能越小.物质本身具有的能量越高.等量的单质和H2化合,放出的热量就越少. G632 B 1008-0333(2017)07-0075-01