重组拟南芥细胞色素P450 707A3在大肠杆菌中的原核表达
吴云华, 肖 虔
(中南民族大学 生命科学学院, 生物技术国家民委重点实验室,武汉 430074)
重组拟南芥细胞色素P450 707A3在大肠杆菌中的原核表达
吴云华, 肖 虔
(中南民族大学 生命科学学院, 生物技术国家民委重点实验室,武汉 430074)
拟南芥细胞色素P450 707a基因是编辑脱落酸8-羟化酶的基因, 克隆其中的cyp707a3基因并构建表达载体pCWori(+)-cyp707a3, 在E.coliRosseta菌株中原核表达并得到了具有活性的酶蛋白.结果显示:大部分酶蛋白定位于大肠杆菌细胞膜.
拟南芥细胞色素P450 707A3;原核表达;重组大肠杆菌;膜蛋白
植物激素的检测是目前植物激素作用机理研究中的瓶颈问题之一[1].已经有文献报道了利用生物传感器来检测植物激素的方法[2,3],同时文献报道了利用细胞色素P450酶蛋白作为材料制作生物传感器以检测其底物的技术[4].细胞色素P450(cytochrome P450, CYP)是植物中最大的酶蛋白家族, 在植物体内担当着重要的功能[5].拟南芥cyp707a是编辑脱落酸代谢过程关键酶8′-羟化酶(ABA 8′-hydroxylase)的基因.该基因一共有4个家族成员[6-8], 对于种子的萌发起到了重要作用.Cyp707a3是该家族中的重要一员, 其研究还较少.
本研究探索拟南芥细胞色素CYP707A3酶在大肠杆菌中的表达并优化表达条件[9], 为后续研究酶蛋白对脱落酸等植物激素的催化检测提供可能的实验基础.
1 材料和方法
1.1 材料和试剂
表达载体pCWori(+)由美国Vanderbilt大学医学中心提供, 拟南芥(ArabidopsisThaliana)的种子、大肠杆菌E.coliDH5α和E.coliRosseta均由中南民族大学武陵山区特色资源植物种质保护与利用湖北省重点实验室提供.
T4 DNA连接酶和限制性内切酶NdeI、Hind Ⅲ (Takara),Trizol Reagent (Ambion),Revert Aid First Strand cDNA Synthesis Kit (Thermo scientific),KOD-plus(Toyobo),DNA凝胶回收试剂盒、DNA清洁回收试剂盒(Axygen公司),氨苄青霉素(Amp)和氯霉素(上海生工公司),异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、δ-氨基-γ-酮戊酸(ALA)及二硫苏糖醇(DTT)(Alfa Aesar),苯甲基硫酰氟(PMSF)(Beyotime Biotechnology),引物合成与基因测序(武汉擎科生物有限公司),其他试剂均为天津市广成化学试剂有限公司和国药集团化学分析级试剂.
2×TSE Buffer(200 mL):称取34.22 g蔗糖和0.0372 g EDTA·2Na于1 L烧杯中, 加入20 mL 1 mol/L的Tris Buffer (pH 7.6), 用ddH2O定容至200 mL, 过滤除菌.
Spheroplast buffer(100 mL):称取0.1286 g乙酸镁于烧杯中加少许水溶解;加20 mL甘油;再加1 mol/L的K2HPO4和1 mol/L的KH2PO4共10 mL, 调pH为7.6, 定容至100 mL.使用前加入DTT至1 mmol/L.
1.2 CYP450 707A3原核表达载体的构建
对CYP707A3进行生物信息学分析, 发现其为N端疏水的可溶性蛋白, 推测其为N端单次跨膜的膜蛋白.
拟南芥于光照培养箱中培养, 取新鲜叶片用Trizol法提取总RNA.用寡核苷酸引物进行逆转录, 所得到的拟南芥cDNA文库用GAPDH检测.设计引物F(5′- GGAATTCCATATGGCTTTCTCCGGTTTGTTTCTC-3′)和引物R (5′-CCCAAGCTTTTAGTGATGGTGATGGTGATGGTTTTCGTTCCAAGGCAAT-3′), 从拟南芥cDNA文库中扩增出cyp707a3目的基因片段.用NdeⅠ和Hind Ⅲ 分别酶切目的片段和pCWori(+)载体, 然后连接载体和片段, 转化DH5α菌株.
1.3 CYP450 707A3蛋白诱导表达
将pCWori(+)空载体质粒和重组表达质粒pCW-cyp707a3转化到表达菌株E.coliRosseta中.于平板上挑取长势良好的单菌落接种到2 mL LB液体培养基, 37 ℃培养过夜.然后取1 mL菌液加入至50 mL的新鲜且含50 ng/L Amp、20 ng/L氯霉素、1 mmol/L VB1和12.5 μL微量元素改良的TB培养基中, 37 ℃培养约3 h, 使其OD600值达到0.7~1.0范围.加入IPTG, 同时加入终浓度为1 mmol/L 的ALA, 诱导表达.
IPTG终浓度选择了0.7,1,1.5 mmol/L 3个梯度;表达温度选择了23, 26, 29 ℃ 3个梯度;表达时间选择了20, 24, 28 h 3个梯度[9].最终发现, 1 mmol/L IPTG、26 ℃、24 h为最佳表达条件.
1.4 CYP450 707A3膜蛋白的提取
将50 mL培养菌液转至100 mL的离心管, 冰上放置30 min以停止表达.2800 r/min于4 ℃离心15 min, 弃上清, 沉淀的菌体可-70 ℃冻存数小时;沉淀用3 mL 2×TSE Buffer加等体积无菌水打散重悬, 加入约3 mg的溶菌酶, 冰上轻摇40~90 min至悬浊液变得较为粘稠, 2800 r/min于4 ℃离心25 min;弃粘稠的上清, 菌体沉淀加入4 mL冰冷的spheroplast buffer重悬(已加入DTT至1 mmol/L), 置-70 ℃冻存数小时;冻存样品经流动水融化后加入PMSF,于冰浴中超声破碎, 每破碎约0.5 s间隔1.5 s.总破碎时间视前一步溶菌酶溶菌程度而定, 一般不应少于90 s.破碎后的混合液于4 ℃、1.2×104r/min的转速离心12 min, 结果分为上清层、中间浑浊层、沉淀;沉淀用2 mL spheroplast buffer重悬.
用SDS-PAGE检测上清层、中间层的蛋白;用CO差示光谱法测量上清层、中间浑浊层、沉淀中CYP的含量.然后将上清层和中间层一起在4 ℃下1.0×105r/min的转速超速离心90 min, 使得溶液中的膜组分沉淀下来;膜沉淀用3 mL spheroplast buffer重悬并用Triton X-100溶解处理[10].
1.5 CYP450 707A3的CO差示光谱测定
CYP6A1含量按Omura和Sato分光光度法测定[11].在石英比色皿中加入1.5 mL P450测定液和50 μL连二亚硫酸钠, 混匀, 1 min后紫外分光光度仪上扫描基线.加入待测样品60~300 μL后混匀, 通入CO约2 min, 稳定1 min后于400~500 nm内扫描, 得还原型细胞色素P450-CO复合物的吸收光谱图.记录450 nm和490 nm处吸收值, 按以下公式计算P450含量.
2 结果及分析
2.1 cDNA文库的构建
Trizol法提取得到2管总RNA样品, 利用微量分光光度计测定其浓度和纯度, 结果如表1.提取的样品A260/A280在1.7~2.0范围内, 说明其纯度较高, 230 nm、260 nm和280 nm吸光值的比值接近1∶2∶1.RNA反转录扩增得到cDNA作为模板, 用内参3-磷酸甘油醛脱氢酶GAPDH引物扩增检测(图1), 500 bp处的条带即为GAPDH, 表明所得cDNA可用于后续实验.

表1 RNA浓度的测定Tab.1 The concentration of RNA
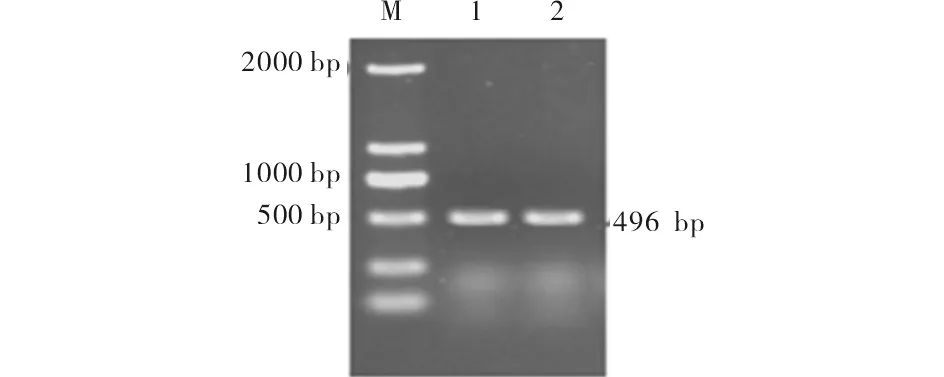
M) DL2000 marker;1,2) 内参GAPDH PCR扩增检测结果
2.2 pCW-cyp707a3载体构建
构建的pCW-cyp707a3载体用引物F和R做PCR鉴定, 然后用NdeⅠ内切酶和Hind Ⅲ内切酶做双酶切鉴定(图2), 其中Hind Ⅲ为部分酶切.cyp707a3基因为1392 bp.测序结果经比对显示正确无突变.
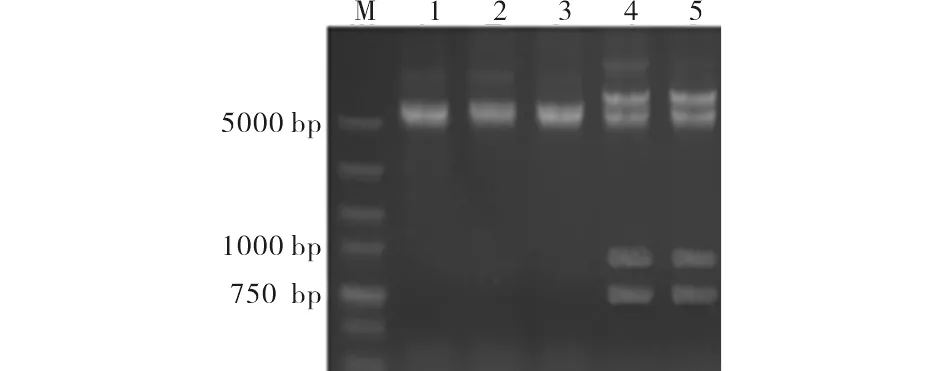
M)DL5000;1~3) 为PCW空载体双酶切;4~5) pCW-cyp707a3重组质粒双酶切鉴定图
2.3 原核蛋白诱导表达
在1 mmol/L IPTG、26 ℃、24 h条件下诱导蛋白CYP707A3的表达,通过SDS-PAGE电泳检测,转基因大肠杆菌表达的蛋白与对照组 (空载体) 蛋白相比, 可明显看到目的蛋白CYP707A3的表达.与目的蛋白理论预测52 kDa大小相符(图3).
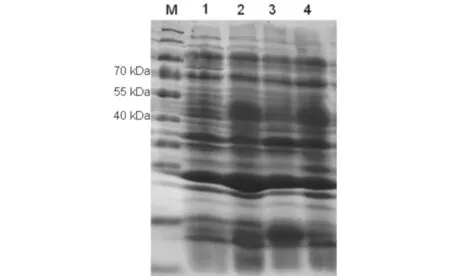
M) 蛋白质marker;1) 重组菌沉淀;2) 重组菌中间浑浊层;3) 空载体菌体破碎上清;4) 重组菌上清层
用CO差异光谱法测定CYP707A3蛋白含量(图4).在400~500 nm扫描其最大吸收波长.空载体的差示光谱存在OD416的吸收峰, 这是大肠杆菌内源蛋白cytochrome-O蛋白;变性后的CYP吸收峰会移至OD420, 且完全遮蔽OD416峰[12].由图4可见, 目的蛋白多数定位于中间浑浊层, 即大肠杆菌膜结构区.通过计算可知, 每1 L培养基可以得到0.427 nmol的CYP707A3, 且其中82.3%即0.352 nmol的蛋白位于膜结构区(表2).

表2 每升培养基中CYP707A3的产量Tab.2 The yield of CYP707A3 harvested from medium
3 结语
本实验成功将拟南芥叶片提取得到的cyp707a3基因转入到大肠杆菌Rosseta菌株并大量表达CYP707A3蛋白.实验结果表明, 目的蛋白成功地进行了原核表达并得到了有活性的酶蛋白.本实验发现CYP707A3蛋白非常容易变性或降解, 因而其表达对于温度的要求非常高.CYP707A3蛋白变性在CO差示光谱上显示为峰从OD446移至OD420, 使用DTT/β-ME/半胱氨酸等进行复性确实会使OD420有所下降[12], 但OD446几乎没有上升.生物信息学分析表明此蛋白本身定位于拟南芥膜结构上;去除N端25个氨基酸会导致蛋白破碎上清和沉淀中均无法检测到细胞色素P450成分, 因而可以判断N端信号肽序列和膜结构对于该蛋白的表达是必须的, 其具体机制还有待探索.
本实验所得到的CYP707A3蛋白将来可以用于制作生物传感器以用于检测脱落酸.

A) 重组菌上清;B) 重组菌中间浑浊层;C) 重组菌沉淀;D)空载上清
[1] 白 玉, 杜甫佑, 刘虎威.植物激素检测技术研究进展[J].生命科学, 2010(1):36-44.
[2] 李 巍, 莫 瑾, 萧浪涛.生物传感器在植物激素测定中的研究进展[J].生物技术通报, 2010(8):24-28.
[3] 穆琳瑛, 王满苹, 王 顺, 等.光学表面等离子共振生物传感器检测脱落酸的试验研究[J].河南农业大学学报, 2014(1):75-79.
[4] Wu Y, Liu X, Zhang L, et al.An amperometric biosensor based on rat cytochrome p450 1A1 for benzo[a]pyrene determination [J].Biosensors &Bioelectronics, 2011, 26(5):2177-82.
[5] 贺丽虹, 赵淑娟, 胡之璧.植物细胞色素P450基因与功能研究进展[J].药物生物技术, 2008, 15(2): 142-147.
[6] Ohigashi H.ArabidopsisCYP707AsEncode (+)-Abscisic Acid 8′-Hydroxylase, a Key Enzyme in the Oxidative Catabolism of Abscisic Acid [J].Plant Physiology, 2004, 134(134):1439-1449.
[7] Zheng Y, Huang Y, Xian W, et al.Identification and expression analysis of the Glycine maxCYP707Agene family in response to drought and salt stresses [J].Annals of Botany, 2012, 110(3):743-756.
[8] 李茜茜, 汪晓峰.ABA分解代谢及其代谢关键酶-8'-羟化酶[J].广西植物, 2009, 29(3):353-359.
[9] 吴云华, 杨 帆.重组家蝇细胞色素P450 6A1的大肠杆菌对艾氏剂的生物降解作用[J].中南民族大学学报(自然科学版), 2012, 31(2):29-32.
[10] Phillips I R, Shephard E A, Montellano P R O D.Cytochrome P450 Protocols [M].Totowa,New Jersey : Humana Press, 2013.
[11] Omura T, Sato R.The carbon monoxide-binding pigment of liver microsomes.I.Evidence for its hemoprotein nature [J].Journal of Biological Chemistry, 1964, 239(7):2370-2378.
[12] Yu C, Gunsalus I C, Katagiri M, et al.Cytochrome P-450cam [J].Journal of Biological Chemistry, 1974, 249(2):94-101.
Studies on the Expression ofArabidopsisThalianaCytochrome P450 707A3 inEscherichiacoli
WuYunhua,XiaoQian
(Key Laboratory for Biotechnology of National Commission for Nationalities, College of Life Science, South-Central University for Nationalities, Wuhan 430074, China)
ABA 8-hydroxylase,the metabolic enzyme of abscisic acid, are encoded by cytochromeP450 707a3 (cyp707a3) inArabidopsisThaliana.Cyp707a3 gene was cloned from the cDNA library, and then the expression vector of pCWori-Cyp707a3 was constructed.The prokaryotic expression of CYP707A3 protein was successfully achieved inE.coliRosseta, and active enzyme protein CYP707A3 was obtained.The experimental results showed that most of the enzyme protein was located on the membrane ofE.coli.
ArabidopsisThalianacytochrome P450 707A3;abscisic acid;prokaryotic expression;membrane protein
2017-02-02
吴云华(1971-),女,教授,博士,研究方向:生化分析与生物传感, Email: wuyunhua@mail.scuec.edu.cn
国家自然科学基金资助项目(31670372)
Q943.2
A
1672-4321(2017)01-0028-04

