一株产脲酶菌株的分离及其固化土壤中Cd2+的研究
王继勇,杨子陆,陈加立,江英杰
(武汉理工大学 化学化工与生命科学学院,武汉 430070)
一株产脲酶菌株的分离及其固化土壤中Cd2+的研究
王继勇,杨子陆,陈加立,江英杰
(武汉理工大学 化学化工与生命科学学院,武汉 430070)
指出了微生物诱导碳酸盐成矿(MICP)技术可有效修复镉污染土壤.从土壤中分离出了一株高效产脲酶菌株,该菌株对10 mg Cd2+/kg模拟污染土壤的Cd2+固化率为67.7 %.X射线衍射(XRD)、能谱分析(EDS)、扫描电子显微镜(SEM) 和红外光谱(IR)等分析显示:产物为碳酸镉和碳酸钙,碳酸盐结晶方式为晶格掺杂.
碳酸盐矿化菌株;碳酸镉
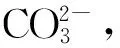
1 材料及方法
1.1 仪器和试剂
SM-IT300型扫描电子显微镜(日本电子株式会社),Nicolet6-700型傅里叶变换红外光谱仪(美国Thermo),MD3X射线能谱仪(上海沃埃得),A360型紫外-可见分光光度计(上海翱艺仪器),PH10S-E笔式酸度计(上海精密仪器仪表),GGX-100火焰原子吸收分光光度计(北京海光仪器).
将1 mg干燥样品与100 mg KBr(光谱纯)磨细混匀,压制成片检测.CdCl2·2.5H2O、KH2PO4、NaCl、苯酚红(酚红)、无水乙醇、蛋白胨、葡萄糖、尿素均为AR级,蛋白胨和酵母浸出粉BR级,试剂均购自国药集团化学试剂有限公司.
1.2 实验材料
采集武汉理工大学花木种植园深度5~20 cm处的土壤样本,富集培养后从富集液中分离具有产脲酶能力的菌株,培养24 h后检测菌浓度(OD600)和氨氮含量,选取产脲酶能力最强的菌株.
使用产脲酶菌株筛选分离培养基、生长培养基和LB培养基(配方略).取土壤试样5 kg,去除大颗粒杂质后自然风干,向风干后土壤中加入适量0.5 mo1/L的CdCl2溶液,使土壤中镉含量为10 mg/kg.
1.3 菌株培养与检测
将产脲酶菌株生长培养基在121℃灭菌30 min,从保存产脲酶菌株的LB斜面上挑取部分菌苔,接种到灭菌后的150 mL培养液中,置于150 r/min、37℃的恒温摇床中培养72 h,测量培养液的OD600和pH值,采用二甲氨基苯甲醛显色分光光度法检测培养液中尿素含量[9].菌株产脲酶能力以培养液中氨氮含量计,氨氮含量检测选用苯酚钠-次氯酸钠比色法[10,11].
称取1 g土壤,加入10 mL去离子水,搅拌均匀后放置5 min,检测浸提液的pH值.参照王瑞兴等[12]的实验方法检测土壤中Cd2+含量.
1.4 细菌诱导土壤中Cd2+矿化
在5 kg镉含量为10 mg/kg的模拟污染土壤中,每天加入100 mL 5 mo1/L尿素溶液和100 mL 培养48 h的菌液,每12 h检测1次土壤pH值和Cd2+含量,直至土壤的pH值稳定.选取实验土壤中板结土壤颗粒于60℃干燥2 h后备用.
1.5 土壤中矿化产物的分析
使用SEM、XRD、IR、EDS等技术分析土壤中矿化产物.
2 结果与分析
2.1 产脲酶菌株的生长特性及产酶活性

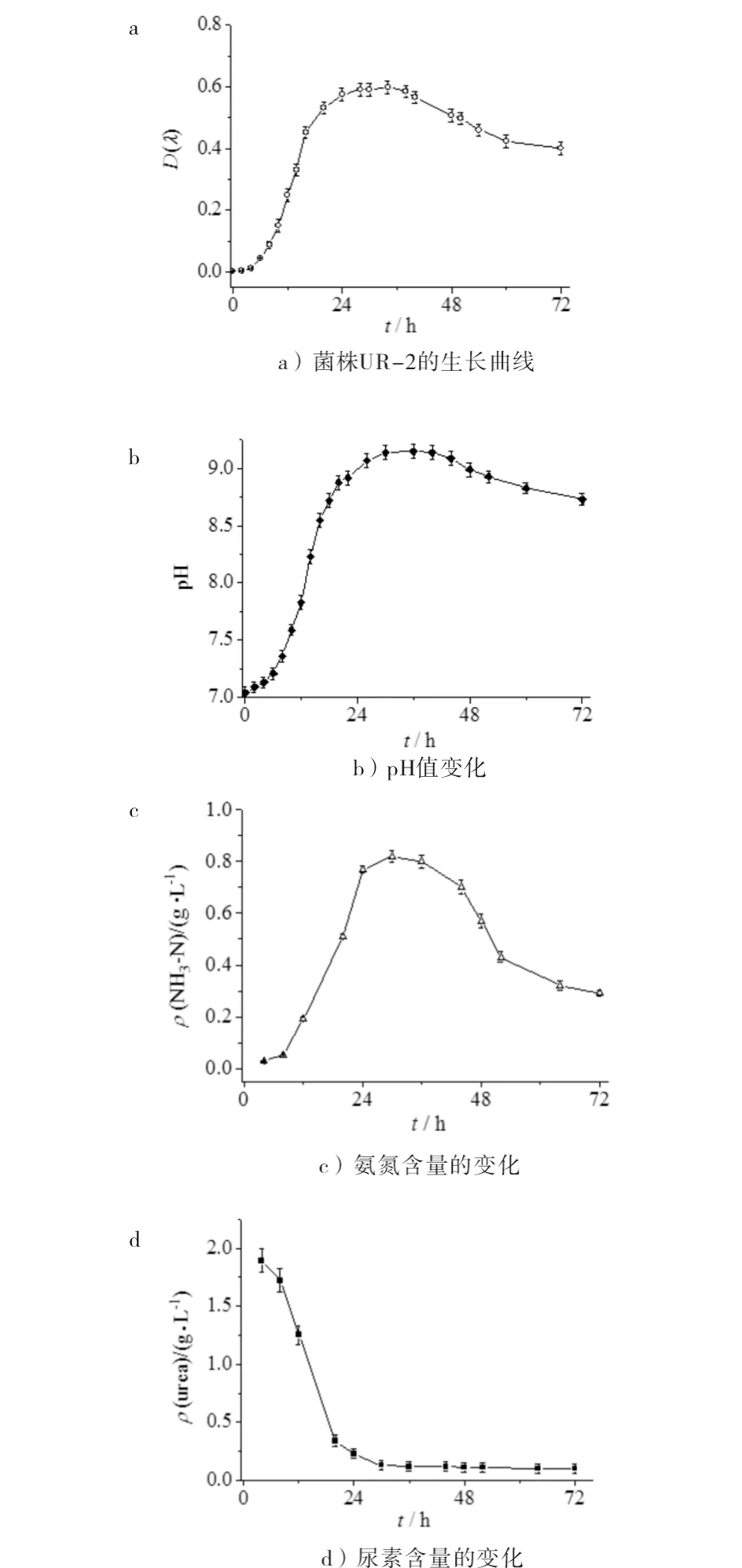
图1 菌株UR-2的生长曲线及培养中各参数变化Fig.1 Growth curve and various parameter changes of UR-2 strain during cultivation
2.2 产脲酶菌株矿化土壤中Cd2+进程
实验土壤pH值和Cd2+含量的变化见图2.1 d后细菌适应土壤环境并大量繁殖,开始水解尿素,土壤pH值在5 d 内迅速从7.02增至8.35,随着营养物质的消耗,土壤pH值稳定在约8.61(图2a).土壤中Cd2+含量随土壤pH值上升逐渐减小.0~1 d内Cd2+含量基本无变化;1~5 d内,由于尿素的快速水解和土壤pH值升高,Cd2+含量迅速下降并稳定在3.23 mg/kg;10 d后Cd2+固化率为67.7%,说明UR-2对土壤Cd2+具有较强的固化能力(图2b).许燕波等[8]的碳酸盐矿化菌对污染土壤Cd去除率为51%,修复周期为7 d;王瑞兴等[12]的碳酸盐矿化菌A对土壤Cd去除率为75.5 %,修复周期为10 d;故菌株UR-2在镉污染土壤治理中具有一定潜能.

图2 菌株UR-2固化进程中土壤pH及其Cd2+含量变化Fig.2 Content changes of Cd2+ ion and pH changes during soil curing process by urease-producing bacteria UR-2
2.3 矿化产物XRD分析


2θ/(°)1) CdCO3;2) CdCO3/CaCO3;3) CaCO3
2.4 矿化产物SEM分析
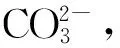

a)×50,000倍矿化产物;b)×200,000矿化产物
2.5 矿化产物IR分析
矿化产物的红外光谱分析(IR)谱图见图5.图5中1639 cm-1处和1034 cm-1处分别为蛋白酰胺I带和II带的CO基振动吸收峰,证明细菌细胞壁通过CO基团吸附了Cd2+、Ca2+.797 cm-1处出现的双峰吸收峰为Si—O—Si的振动,是土壤石英的特征峰;537 cm-1处的吸收峰为Si—O—Al、Si—O—Mg的弯曲振动[13],显示细菌吸附在了土壤颗粒中的SiO2上.721 cm-1处吸收峰为Cd—O和Ca—O振动叠加,两处为矿化产物的特征峰,1395 cm-1、860 cm-1处吸收峰为CaCO3和CdCO3晶体中C—O基团的弯曲振动,两处吸收峰明显,说明矿化产物中碳酸盐含量较多,与XRD谱图结果一致.


σ/cm-1
2.6 矿化产物EDS分析
分析图4a细菌周围矿化产物的EDS谱图见图6.由图6可见,矿化产物中含有Cd、Ca、Al、Si、Fe、K等金属元素.实验土壤为红棕壤, Ca2+含量较少,Fe3+含量较高;Fe含量为3.32%(以下均为原子百分比),Ca为0.62%,验证了实验土壤的种类.同时,矿化产物中Ca含量为0.62%,Cd为3.94%,说明Cd含量高于Ca,除了土壤中Cd含量为10 mg/kg外,相比于离子半径为9.9×10-9cm的Ca2+,离子半径为9.7×10-7cm 的Cd2+与细菌的络合强度更大,Cd2+在细菌细胞壁上的有效结合位点更多,因而矿化产物中Cd元素含量较高.

图6 矿化产物的EDS图谱Fig.6 The EDS patterns of mineralized products
Kumari等[14]提出:在产脲酶微生物作用下,镉污染土壤过程中的Cd2+与Ca2+一般以晶格掺杂或单一相CdCO3沉积在单一相CdCO3表面的方式形成共沉淀.为确定CdCO3和CaCO3的结晶方式,使用X射线能谱仪元素分布(EDS-mapping)对矿化产物进行分析,结果见图7.由图7可见,矿化产物中Cd、Ca元素互相掺杂,Cd2+与Ca2+以晶格掺杂的方式形成了共沉淀,由于CdCO3和CaCO3的结晶均以细菌细胞壁上的Cd2+、Ca2+吸附位点展开,但细菌对两种金属阳离子的吸附无选择性,导致Cd2+、Ca2+的结晶位点相邻、相对甚至重叠,形成的CdCO3和CaCO3晶体互相掺杂.

a) 电子图像;b) EDS分层图像;c) Ca Kα1;d) Cd Lα1
3 结论
(1)从湖北省红棕壤中分离出一株高效产脲酶菌株UR-2,生长周期为64 h.该菌株生长过程中分泌的脲酶,对尿素水解率为95.4%,培养液pH达9.15.
(2)投加菌株UR-2可有效提高土壤pH,Cd2+的固化去除率为67.7%,该菌株在镉污染土壤治理中具有一定的潜能.
(3)矿化产物主要为CdCO3和CaCO3,分布在细菌周围,CdCO3和CaCO3为粒径不均匀的椭球形颗粒,细菌细胞壁部分基团络合吸附了Ca2+、Cd2+.

[1] 吴桂萍,黄 慧,唐太平,等.武汉市某工业用地土壤重金属污染状况分析与评价[J].中南民族大学学报(自然科学版),2012,31(3):25-25,55.
[2] 王艳娜.土壤重金属污染现状与防治方法[J].价值工程,2014(35):311-312.
[3] 孙 杰,刘骏龙,胡晶晶,等.广西锰矿区土壤重金属垂直分布和赋存形态分析[J].中南民族大学学报(自然科学版),2016,35(1):12-16.
[4] Helmi F M, Eimitwalli H R, Elnagdy S M, et al.Calcium carbonate precipitation induced by ureolytic bacteria Bacillus licheniformis[J].Ecol Eng, 2016, 90: 367-371.
[5] 成 亮,钱春香,王瑞兴,等.碳酸盐矿化菌株A固结土壤Cd2+的生物矿化过程[J].硅酸盐学报,2008, 36(S1):215-221.
[6] Krajewska B.Ureases I: functional, catalytic and kinetic properties: a review[J].J MolCatal B: Enzym, 2009, 59(1/3): 9-21.
[7] Li M, Cheng X, Guo H.Heavy metal removal by biomine- ralization of urease producing bacteria isolated from soil[J].IntBiodeter Biodegr, 2013, 76(1): 81-85.
[8] 许燕波,钱春香,陆兆文.微生物矿化修复重金属污染土壤[J].环境工程学报,2013,7(7):2763-2768.
[9] 周 佳,孙 勇,唐传球,等.对二甲氨基苯甲醛比色法测定溶液中的尿素[J].化学与生物工程,2014, 31(2):75-78.
[10] 周礼恺,张志明.土壤酶活性的测定方法[J].土壤通报,1980(5):37-38,49.
[11] 耿玉清,王冬梅.土壤水解酶活性测定方法的研究进展[J].中国生态农业学报,2012, 20(4):387-394.
[12] 王瑞兴,钱春香,吴 淼,等.微生物矿化固结土壤中重金属研究[J].功能材料,2007, 38(9):1523-1526,1530.
[13] 甘化民,张一平.陕西五种土壤红外光谱特征的初步研究[J].土壤学报,1992, 29(2):232-236.
[14] 安晓雯,孙道玮,孙明星,等.纳氏试剂光度法测定中小氨氮实验条件的优化[J].中南民族大学学报(自然科学版),2005,24(4):15-17.
Isolation of A Urease-producing Bacterium and Its Curing Function of Cd2+in Soil
WangJiyong,YangZilu,ChenJiali,JiangYingjie
(School of Chemistry and Life Science,Wuhan University of Technology, Wuhan 430070)
Microbial induced carbonate mineralization (MICP) is an effective way to repair cadmium polluted soil.A highly efficient urease-producing bacterium was isolated from soil and the curing rate of 10 mg/kg soil Cd2+ion was determined as 67.7%.XRD, EDS, SEM and IR results showed that the sediments were cadmium carbonate and calcium carbonate, which were formed through lattice doping crystallization.
carbonate mineralization bacteria;cadmium carbonate
2016-12-03
王继勇(1966-),男,副教授,博士,研究方向:土壤重金属污染复,E-mail:wangjiyong66@sina.com
国家自然科学基金资助项目(46120511)
X131.3;S154.3
A
1672-4321(2017)01-0017-04

