金磁复合纳米球的制备及其在检测肌红蛋白中的应用
孙宏浩, 王甜甜, 廖天作, 王 怡, 柯 鹏, 周凤珍, 孙红梅, 郭惠玲
(湖北工业大学 生物工程与食品学院,湖北省工业发酵协同创新中心,武汉 430068)
金磁复合纳米球的制备及其在检测肌红蛋白中的应用
孙宏浩, 王甜甜, 廖天作, 王 怡, 柯 鹏, 周凤珍, 孙红梅, 郭惠玲
(湖北工业大学 生物工程与食品学院,湖北省工业发酵协同创新中心,武汉 430068)
以粒径约为120 nm的Fe3O4磁性纳米球为内核,经过SiO2包埋,BSA修饰并吸附金纳米球三步后得到一种组装型金磁复合纳米球MNP@SiO2@BSA@Au NPs,并以此纳米球为载体,建立了检测心梗标志物之一的肌红蛋白的新方法.金磁复合纳米球偶联肌红蛋白抗体4E2后,可快速分离和富集样品中的肌红蛋白,加入偶联有肌红蛋白抗体7C3的荧光硅纳米球后形成三明治夹心结构,通过检测荧光强度实现了对肌红蛋白的定量检测.结果表明:该检测方法在肌红蛋白浓度为0 ~ 250 ng·mL-1的范围内荧光强度与肌红蛋白浓度具有良好的线性关系(R2=0.993),选择性高,重复性好,快速检测肌红蛋白时间不超过30 min.
金磁纳米球;肌红蛋白;荧光硅纳米球;POCT技术
生物分子(DNA,RNA和蛋白)的分析检测在临床诊断、环境检测和食品安全等多个领域有着至关重要的作用[1,2].ELISA、West blot、凝胶电泳等[3]现检测手段步骤繁琐,需要精密的仪器,限制其快速检测的应用.有些疾病(如心梗)需要快速检测,为医生提供实时准确的疾病信息,为患者赢得最佳治疗时机.随着POCT(point-of-care tests )技术的快速发展,急需建立快速定量检测疾病标志物的新方法.因此,本文拟建立一种新的免疫荧光快速检测方法,以金磁复合纳米球为载体,以荧光硅纳米球为标记物,实现对全血中心梗标志物之一的肌红蛋白的快速检测.
金磁复合纳米球由于兼有磁分离(磁性纳米材料)和快速固定生物分子的特点(金纳米材料),已在生物分子检测中获得了广泛应用[4].崔亚丽等[5]对人体IgG抗体进行固定化研究,质量控制较好,并将其应用于免疫学检测.Pham等[6]利用金磁复合纳米球的磁性和易于固定生物分子的特点,用磁分离将IgG抗体从样品中快速分离出来.Min等[7]基于金磁复合纳米球实现了对乙酰胆碱(AChe)的生物快速检测.硅纳米球化学稳定性和热稳定性好,比表面积大及改性后水溶性良好,常被用作生物分子载体[8].当荧光分子以一定的方式与硅纳米球偶联形成荧光硅纳米球后,荧光强度较单个荧光分子提高了几个数量级,荧光分子标记在硅纳米球上还能避免直接标记在活性生物分子上影响其生物活性.
本文以层层组装的方法制备的金磁复合纳米球具有良好的分散性和生物相容性,该方法简单且重复性好,对肌红蛋白捕捉和分离后,加入免疫荧光硅纳米球形成夹心结构,能通过检测荧光强度对肌红蛋白实现定量检测.
1 实验部分
1.1 材料和仪器
六水三氯化铁、乙二醇、醋酸铵、柠檬酸三钠、乙醇、马来酸酐、正硅酸四乙酯(TEOS)、磷酸氢二钠、磷酸二氢钠、盐酸羟胺、叠氮化钠、吐温-20(Tween-20)均为市售分析纯,N-羟基琥珀酰亚胺(NHS)纯度为97%(国药集团试剂),3-氨丙基三乙氧基硅烷(APTES)纯度为97%(上海阿拉丁试剂),1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC)纯度99%,氯金酸纯度99%(上海化学试剂),牛血清白蛋白(BSA)纯度为99%(上海自如吉),吗啉乙磺酸(MES)纯度99%(Biosharp),罗丹明红X(Rh X, Molecular Probes).4E2肌红蛋白抗体、7C3肌红蛋白抗体、肌红蛋白标准品(HyTest),人体Ig G(Abcam).
集热式恒温磁力搅拌器(DF-101S型,上海科尔仪器),水热合成反应釜(上海科兴仪器),紫外可见光分光光度计(UV-1800型,津岛企业管理)傅里叶红外光谱仪(Nicilet6700型,美国赛默飞),透射电镜(Tecnai G2 S-TWIN型,FEI),荧光分度计(LS-55型,美国PE),荧光干式定量分析仪(RAMP200,北京康思润业).
1.2 血液样品的制备
荧光干式定量分析仪测得健康人的血样Myo的浓度为20 ng/mL, 加入Myo纯品,配成50,100,250,500,1000,2000 ng/mL,低浓度的样品采用稀释全血得到0.1,1,10 ng/mL等不同浓度,结果用仪器行校正.
1.3 免疫金磁复合纳米球的制备
1.3.1 溶剂热法制备Fe3O4磁性纳米球
将0.578 g FeCl3·6H2O,1.65 g 醋酸铵,0.171 g 柠檬酸三钠溶解于30 mL乙二醇中,溶液加热至170℃恒温1 h,冷却至室温,将溶液转移至反应釜中加热至200 ℃,保温反应8 h,反应完成后磁分离,用超纯水和乙醇交替洗涤4次,最后分散在超纯水中,配制成浓度为10 mg/mL的溶液.
1.3.2 Fe3O4磁性纳米球的硅包埋和羧基功能化
为了实现羧基功能化,对硅烷偶联剂APTES进行羧基改性:在10 mL的圆底烧瓶中加入1.96 g马来酸酐,冰浴下逐滴加入3.4 mL的APTES,固体完全溶解后开始搅拌,直至反应物变成白色固体后停止反应,制得APTES-COOH(图1).
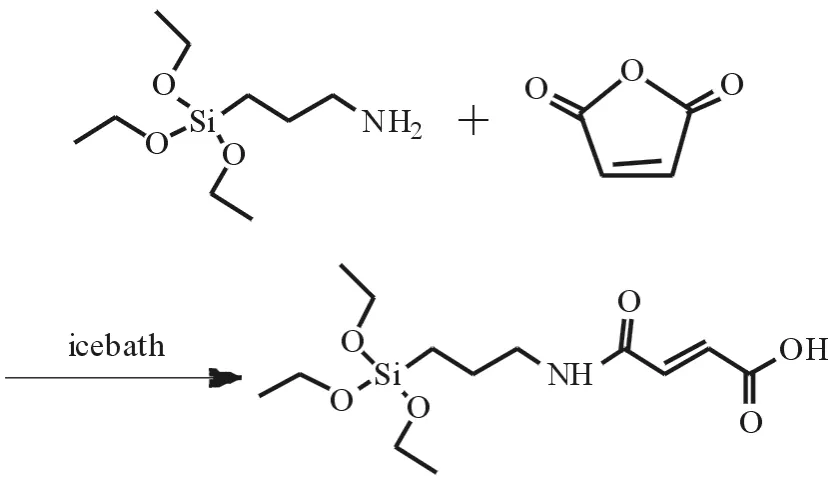
图1 羧基化APTES的的合成步骤Fig.1 Syntesis procedure of carboxyl APTES
制备羧基功能化的Fe3O4@SiO2复合纳米球:在250 mL单口烧瓶中加入3 mL 10 mg/mL的Fe3O4磁性纳米球和100 mL乙醇,超声分散均匀后40℃水浴反应,先加入2 mL氨水,每隔30 min加入15 μL TEOS,共3次,反应2 h,加入30 mg APTES-COOH,继续反应7 h,用超纯水磁分离洗涤4次后,分散于超纯水中,配制成10 mg/mL溶液.
1.3.3 胶体金的制备
取质量分数为0.01% HAuCl4溶液加至250 mL王水清洗过的三口烧瓶中,在冷凝回流下将溶液加热至沸腾;迅速加入2 mL新配置的质量分数1%柠檬酸三钠溶液,反应10 min室温冷却回流搅拌15 min,得到酒红色的溶液即为胶体金溶液,4℃保存待用.
1.3.4 金磁复合纳米球的制备
取1 mL羧基功能化的Fe3O4@SiO2复合纳米球,用PB缓冲液(10 mmol/L, pH 7.4)磁分离洗涤3次,分散在10 mL PB缓冲液中,加入50 μL EDC溶液(0.1 mol/L),75 μL NHS溶液(0.1 mol/L)和20 mg BSA,室温下反应2 h.加入 75 μL盐酸羟胺溶液(0.1 mol/L),反应40 min用于封闭多余的活化官能团,用PB缓冲液磁分离洗涤3次,收集沉淀然后分散在1 mL溶液中,向磁性纳米球悬浮液中加入10 mL胶体金溶液,室温搅拌40 min;用超纯水磁分离洗涤4次,将金磁复合纳米球重新分在10 mL的超纯水中,4℃保存待用[9].
1.3.5 免疫金磁复合纳米球的制备
取1 mL Fe3O4@SiO2@BSA@Au复合纳米球,用PB缓冲液(10 mmol/L, pH 7.4)磁分离洗涤3次,复溶于1 mL的PB缓冲液中;加入1.5 μL 4E2肌红蛋白抗体(7.5 mg/mL),室温反应1 h,磁分离后,收集金磁纳米球,再加入2 mL封闭液,室温反应2 h,用PB缓冲液磁分离洗涤3次后,加入1 mL的保存液(含0.1% BSA,0.02% Tween-20,0.05%NaN3,10mmol/L PB缓冲液),4℃保存待用.
1.4 免疫荧光硅纳米球的制备
1.4.1 硅纳米球的制备
采用Stöber法制备硅纳米球,方法如下:在50 mL单口烧瓶中加入1 mL TEOS,1.2 mL氨水,1mL超纯水和25 mL乙醇,室温搅拌10 h,离心分离(10000 r/min,15 min),再用超纯水和乙醇反复离心洗涤4次,最后分散于乙醇中,配制成10 mg/mL溶液.
1.4.2 荧光硅纳米球的制备
荧光分子的偶联步骤如下:取1 mg Rh X加至1 mL乙醇中,混合均匀后加入1 μL APTES,避光搅拌2 h,制得APTES-Rh X;取10 mL制备的硅纳米球,加入0.5 mL氨水和0.1mL超纯水,加入APTES-Rh X,避光搅拌 2 h,制得荧光氨基修饰的硅纳米球;加入25 mg APTES-COOH和30 μL的TEOS避光搅拌7 h,离心分离(10000 r/min, 15 min),沉淀物用超纯水和乙醇离心洗涤6次,分散在超纯水中,配制成10 mg/mL的荧光硅纳米球分散液.
1.4.3 免疫荧光硅纳米球的制备
取1 mL SNP@Rh X纳米球,用MES缓冲液(10 mmol/L pH 5.0)磁分离洗涤3次,复溶于1 mL的MES缓冲液;加入50 μL EDC溶液(0.1 mol/L), 75 μL NHS溶液(0.1 mol/L),室温搅拌30 min后,用PB缓冲液(10 mmol/L pH 7.4)磁分离洗涤2次,复溶于1 mL的PB缓冲液中,加入1.5 μL7C3肌红蛋白抗体(7.5 mg/mL),室温反应2 h,用PB缓冲液磁分离洗涤2次,复溶于1 mL的PB缓冲液中,加入75 μL盐酸羟胺溶液(0.1 mol/L),室温反应1 h,用PB磁分离洗涤两次后,加入2 mL的封闭液,室温反应2 h,用PB缓冲液磁分离洗涤3次后,加入1 mL的保存液,制得SNP@RhX@antibody纳米球,4℃保存待用(见图2).

图2 免疫荧光硅纳米球的制备Fig.2 Preparation of immune fluorescent silica nanoparticles
1.5 肌红蛋白的检测
取400 μL样品用PB缓冲液(10 mmol/L pH 7.4)稀释至1 mL,加入100 μL免疫金磁纳米球MNP@SiO2@BSA@Au振荡10 min后磁分离,复溶于1 mL PB缓冲液,分散均匀后再加入100 μL SNP@RhX@antibody纳米球,振荡10 min后,用PB磁分离洗涤3次,复溶于200 μL的PB缓冲液后,用荧光分光光度计对其进行荧光检测.
1.6 加标回收率及准确度
这些方案随着研究进一步发展,可以应用于临床SCI患者的治疗。同时可以对SCI与胶质瘢痕引起的炎症过程的内在相关因素进行深入研究。目前,研究多是建立在轻中度脑损伤模型上,锐性损伤为主,但通过临床发现,多为钝性重度脑损伤给治疗及预后带来一定的困难。在后期的研究中如何建立具备临床相关性的动物损伤模型,研究SCI后胶质化反应对神经功能恢复作用具有很大的意义。
将2份同样浓度的Myo样本以1︰9的摩尔比加入全血中,测定样本结果,计算加标回收率和准确度.
2 结果与讨论
2.1 免疫金磁复合纳米球的表征
Fe3O4纳米球和Fe3O4@SiO2复合纳米球的红外图谱见图3.图3中1620 cm-1,3380 cm-1为水中O—H的弯曲和伸缩振动峰,1400 cm-1为C—H的弯曲振动峰,570 cm-1为Fe—O伸缩振动峰;对比Fe3O4纳米球,Fe3O4@SiO2复合纳米球795 cm-1和460 cm-1为Si—O和Si—O—Si的弯曲振动峰,1100 cm-1为Si—O—Si的不对称伸缩振动吸收峰,950 cm-1为Si—OH的弯曲振动吸收峰,证明Fe3O4纳米球的硅包埋成功.
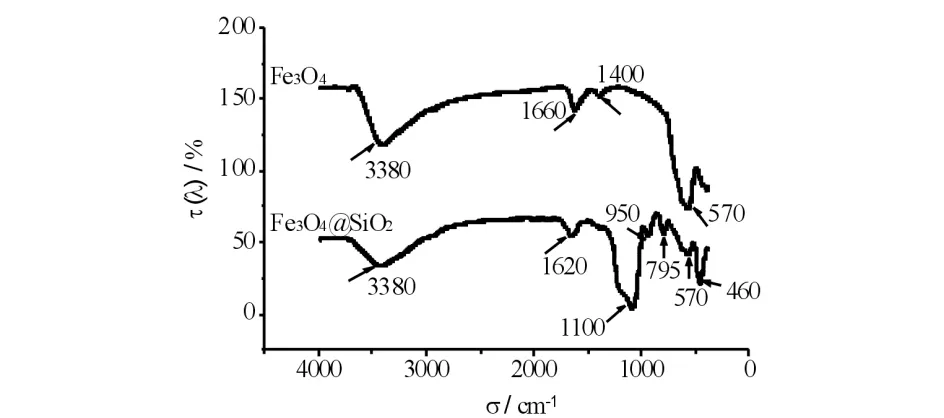
图3 纳米球的红外图谱Fig.3 Infrared spectrum of nanoparticles
免疫金磁复合球的TEM结果见图4.由图4可见,金磁复合纳米球由粒径约120 nm的Fe3O4磁性纳米球为核,包埋了硅层后,表面覆盖了粒径约15 nm的金纳米球,说明金磁复合纳米球的制备成功.

图4 免疫金磁复合纳米球的TEM图Fig.4 TEM image of immune gold magnetic nanoparticles
2.2 免疫荧光硅纳米球的表征
免疫荧光硅纳米球的表征结果见图5.图5a为FI-IR图谱,1105 cm-1为Si—O—Si的不对称伸缩振动吸收峰,950 cm-1为Si—OH的弯曲振动吸收峰,790 cm-1为Si—O弯曲振动吸收峰,470 cm-1的Si—O—Si的弯曲振动吸收峰为硅纳米球的特征吸收峰.对比硅纳米球,在荧光硅纳米球的FT-IR图谱中,2360,1850,1400 cm-1分别为CO2的伸缩振动吸收峰,酸酐中CO的伸缩振动吸收峰和C—H的弯曲振动吸收峰,均说明荧光硅纳米球羧基功能化成功.图5b的UV-Vis图谱可见荧光硅纳米球相较于硅纳米球,其在560 nm附近有紫外吸收,进一步证明Rh X已经成功偶联到了硅纳米球上.
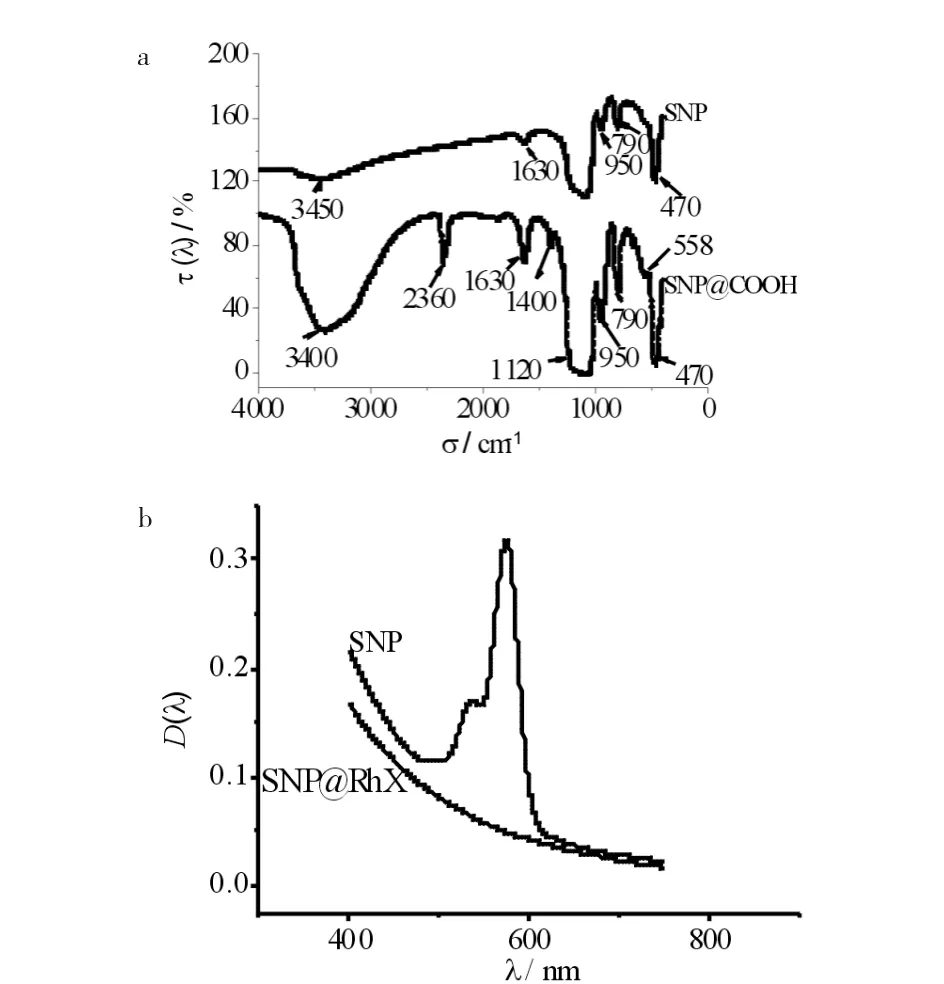
图5 荧光硅纳米球羧基化的FI-IR(a)和UV-Vis(b)表征Fig.5 FI-IR(a) and UV-Vis(b) of fluorescent silica nanoparticles modified with carboxyl group
图6为免疫荧光硅纳米球的TEM图,图中可见制备的免疫荧光纳米球其形态为规则的球形,平均粒径约为80 nm.

图6 免疫荧光硅纳米球的TEM图Fig.6 TEM image of Immuno fluorescence silica nanoparticles
对肌红蛋白标准品在全血浓度为0,1,10,50,100,250,500,1000,2000 ng/mL的样品,用本文构建的方法对其进行检测,建立标准曲线,结果如图7所示.图7中浓度0~250 ng/mL内标准曲线为y=2.531x-2.534,R2=0.993,荧光强度与肌红蛋白的浓度线性关系良好.肌红蛋白作为心肌梗死早期诊断的标记物之一,在人体中的正常浓度为10 ~100 ng/mL,超过100 ng/mL 就有心梗的风险[10-12],因此本文建立的检测方法能够实现人全血中肌红蛋白的检测.

图7 检测人全血中肌红蛋白的标准曲线Fig.7 Standard curve of detection of myoglobin in human whole blood
2.4 加标回收率及准确度分析
将2份浓度约为100 ng/mL Myo样本,以1︰9的摩尔比加入全血中进行混合,并进行回收率实验,其加标回收率为101.56%和101.51%,说明本研究建立的MyO检测方法准确度良好,基本无基质效应.
2.5 检测方法的选择性分析
用肌红蛋白标准品在全血样中配置成75 ng/mL的浓度,之后分别加入0,1,10,50,100,250 ng/mL的人源IgG,检测其荧光强度,结果如图8.图8中可见加入不同浓度IgG后检测结果的RSD值为4.55%,说明该检测方法具有很好的选择性.
1)75 ng/mL MyO+0 ng/mL IgG ;2) 75 ng/mL MyO+1 ng/mL IgG;3) 75 ng/mL MyO+10 ng/mL IgG; 4) 75 ng/mL MyO+50 ng/mL IgG;5) 75 ng/mL MyO+100 ng/mL IgG;6) 75 ng/mL MyO+250 ng/mL IgG
3 结论
(1)采用简便方法制备了组装型金磁复合纳米球,结构稳定且粒径均一,稳定性和分散性好,方法重复性好;
(2)采用荧光纳米小球标记抗体,相比于荧光分子直接标记抗体,既避免了荧光分子对抗体生物活性的影响,又提高标记抗体的荧光强度;
(3)建立了一种检测人全血中疾病标志物的新方法:以金磁复合纳米球为固相载体,在修饰抗体后通过磁分离快速从全血中捕捉和分离肌红蛋白,加入免疫荧光纳米球后实现了对肌红蛋白的定量检测,检测方法操作简单,时间不超过30 min,灵敏度高、选择性好,可用于心梗和其他生物分子的快速诊断.
[1] Nam J M,Thaxton C S,Mirkin C A.Nanoparticle-based bio-bar codes for the ultrasensitive detection of proteins.[J].Science,2003,301(5641): 1884-1886.
[2] Jing W,Cao Y,Xu Y,et al.Colorimetric multiplexed immunoassay for sequential detection of tumor markers[J].Biosens Bioelectron,2009,25(2):532-536.
[3] Mabey D,Peeling R W,Ustianowski A,et al.Tropical infectious diseases: Diagnostics for the developing world[J].Nat Rev Microbiol,2004,2:231-240.
[4] 刘 冰,童朝阳,郝兰群,等.一种基于金磁微粒的电化学发光免疫检测方法[J].分析测试学报,2013,32(8):998-1002.
[5] 崔亚丽,张连营,苏 婧,等.组装型金磁微粒的制备及其在免疫学检测中的应用[J].中国科学:化学,2006,36(2):159-165.
[6] Pham T T H,Cao C,Sang J S.Application of citrate-stabilized gold-coated ferric oxide composite nanoparticles for biological separations[J].J Magn Magn Mater,2008,320(15):2049-2055.
[7] 闵 红,曲云鹤,李晓华,等.Au掺杂Fe3O4纳米粒子酶传感器的制备及其应用于有机磷农药检测的研究[J].化学学报,2007,65(20):2303-2308.
[8] Lian W,Litherland S A,Badrane H,et al.Ultrasensitive detection of biomolecules with fluorescent dye-doped nanoparticles[J].Anal Biochem,2004,334(1):135-44.
[9] 胡 征.功能化材料对痕量金属离子预富集和分离性能的研究[D].兰州:兰州大学,2012.
[10] 彭 莉.金包覆的磁性纳米微粒的制备与表征[D].武汉:华中科技大学,2004.
[11] Caruntu D,Cushing B L,Gabriel Caruntu A,et al.Attach- ment of gold nanograins onto colloidal magnetite nanocrystals[J].Chem Mater,2005,17(13):3398-3402.
[12] 张书广,李庆敏.四种心肌标志物在急性心肌梗死诊断中的应用[J].山东医药,2006,46(23): 76-77.
Preparation of Gold Magnetic Nanoparticles and its Application in the Detection of Myoglobin
SunHonghao,WangTiantian,LiaoTianzuo,WangYi,KePeng,ZhouFengzhen,SunHongmei,GuoHuiling
( Hubei University of Technology Institute of Bioengineering and Food, Industrial Fermentation of Collaborative Innovation Center in Hubei Province, Wuhan 430068,China )
Fe3O4magnetic nanoparticles(MNPs) with diameter of about 120 nm were used as cores, followed by a three-step synthesis process involving silica oxide(SiO2) coating, BSA decoration, and gold NPs deposition to produce the MNP@SiO2@BSA@Au NPs composite nanoparticle.Based on MNP@SiO2@BSA@Au NPs, a new method for myocardial infarction markers myoglobin(Myo) detection was established.In the presence of Myo, magnetic NPs coupled 4E2 antibody and fluorescent NPs coupled 7C3 antibody formed a sandwich structure, which could be separated from blood under magnetic field.The concentration of Myo was then quantified by the fluorescence intensity of SNP@RhX NPs in the sandwich structure.The calibration curve for the Myo showed a linear range between 0-250 ng·mL-1(R2=0.993).This method also had good selectivity and reproducibility, and offered quick determination of Myo in less than 30 min .
gold magnetic nanoparticles;myoglobin;fluorescent silica nanoparticles;POCT
2016-06-24
孙宏浩(1973-),男,教授,博士,湖北省“楚天学者计划”和“百人计划”入选者,研究方向:靶向纳米药物和快速检测,纳米微球的表面修饰,微球和生物分子之间的相互作用机理研究,E-mail:1048923282@qq.com
国家自然科学基金资助项目(21501054, 21401051), 湖北省自然科学基金重点资助项目(2014CFA080), 湖北省大学生创新创业训练计划资助项目(201410500021)
O657.3;TB383.1
A
1672-4321(2017)01-0008-05

