槲皮素纳米胶囊制备研究
洪宗国, 钟阿琴, 陈 思, 宋庭宁, 赵 丹
(中南民族大学 药学院,武汉 430074)
槲皮素纳米胶囊制备研究
洪宗国, 钟阿琴, 陈 思, 宋庭宁, 赵 丹
(中南民族大学 药学院,武汉 430074)
目的:制备槲皮素纳米胶囊,研究其正交设计优化合成条件、形貌与体外释放作用。方法:以槲皮素为囊芯材料,明胶为囊壁材料,通过初生态微晶法制备槲皮素纳米胶囊,用动态散射仪和透射电子显微镜观察纳米胶囊的形貌,用紫外-分光光度法测定其缓释性能。结果:最佳条件为明胶0.2 g,槲皮素4 mg,甲醛1 mL,成囊搅拌时间30 min。粒径分布在100 nm左右,在pH 9.0时具有显著的缓释作用。意义:槲皮素纳米胶囊可提高药物的水溶性与生物利用度,并可控制药物的释放,适合多途径给药。
槲皮素纳米胶囊;初生态微晶法;缓释作用
槲皮素是一种天然的黄酮类化合物,广泛分布于植物的花、叶、果实之中,具有抗癌、抗自由基、抗贫血、抗炎、抗过敏等多种生物活性及药理作用[1,2].近年来槲皮素对肿瘤的化学预防和治疗作用格外引人瞩目,其可以全面地作用于癌发生的始发、促癌和演进3个阶段,兼有抗致癌、抗促癌和诱导分化的作用,国外已将其作为抗癌药物应用于临床[3].槲皮素溶于热乙醇(1∶23)、冷乙醇(1∶300),可溶于甲醇、乙酸乙酯、冰醋酸、吡啶等,不溶于石油醚、苯、乙醚、氯仿,几乎不溶于水[4].因此,提高槲皮素在水中的溶解度,提高生物利用度,拓展给药途径是槲皮素应用中亟待解决的问题.本工作拟将槲皮素制成纳米胶囊,以解决上述问题.槲皮素分子式为C15H10O7,结构式如图1所示.

图1 槲皮素的结构示意图Fig.1 Schematic diagram of quercetin
实验采用初生态微晶法[5]制备槲皮素纳米胶囊,该方法是由洪宗国教授发明的制备纳米胶囊的方法.将天然高分子材料明胶作为壁材,利用药物在不同溶剂中溶解度不同,将槲皮素包裹于其中,制成纳米级的微胶囊.该体系的生物相容性好,可提高生物利用度,利于多途径给药[6-11].图2为纳米囊制备过程示意图.
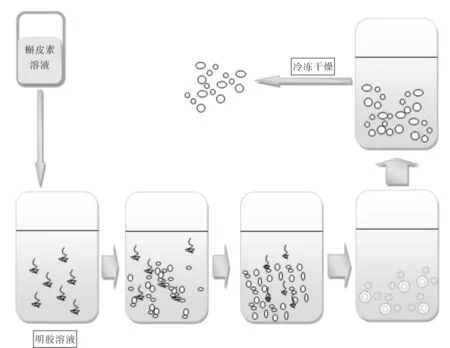
图2. 初生态微晶法制备槲皮素纳米囊的示意图Fig.2 Diagram of QT-nanocapsules prepared by firstborn microcrystallization method
1 实验部分
1.1 试剂与仪器
槲皮素(含量98.00%,阿拉丁公司),明胶、无水乙醇、氢氧化钠、氯化钾、磷酸二氢钠、磷酸氢二钠、甲醛(国药集团化学试剂有限公司),所有试剂均为分析纯.冰醋酸(分析纯,武汉市联碱厂),超纯水(电导率18.2 MΩ.cm)
电子天平(BS110S型,北京赛多利斯公司),磁力恒温搅拌器(85-2型,上海司乐仪器厂),智能集热式恒温加热磁力搅拌器(DF-101S型,河南省予华仪器有限公司),精密pH计(上海仪电科学仪器股份有限公司),傅里叶变换近红外光谱仪(Antaris Ⅱ,美国Thermo Nicolet公司),高速离心机(TGI-20M型,长沙平凡仪器仪表有限公司),紫外可见分光光度仪(PAMADA公司),动静态激光散射仪(BI-200SM,美国布鲁克海文),透射电子显微镜(TECNAI G2 20 S-Twin型,捷克FEI公司).
1.2 初生态微晶法制备槲皮素纳米囊
采用初生态微晶法制备纳米胶囊.将2.00 g明胶溶于100 mL纯化水中,在40 ℃下溶胀12 h形成胶状体,得到明胶质量浓度为20 mg/mL,真空抽滤除去杂质备用,称取固体粉末状槲皮素4.00 mg溶于5.00 mL无水乙醇溶液中,超声使其完全溶解.取已制备的明胶溶液10.00 mL,置于40 ℃恒温水浴中搅拌加热,将槲皮素无水乙醇溶液缓慢匀速滴加至其中,搅拌至完全混匀,加入适量醋酸溶液调节pH值为4,冷却至室温,在冰浴条件下加入1.0 mL甲醛,控制温度在0~5 ℃,继续搅拌30 min,使槲皮素纳米囊囊膜固化得到能稳定存在的纳米囊.
1.3 槲皮素纳米囊的后处理
取上述制成的槲皮素纳米囊溶液,4 ℃,12000 r/min离心20 min,收集上层溶液,在-20 ℃冷冻干燥得到纳米囊干粉.
1.4 实验条件的优化
选用L9(34)正交试验设计方案进行实验,方案见表1.依照4因素3水平共进行9组试验,其中每次试验各取槲皮素无水乙醇溶液5 mL(0.8 mg/mL),即槲皮素4 mg.再将各处方样品经冷冻干燥成冻干粉剂后,以冻干粉剂的色泽、外观和再分散性为指标,考察得出最佳实验条件.

表1 试验的因素和水平Tab.1 Test factors and levels
注:假定上述因素间无交互作用
1.5 纳米胶囊物化指标的测定
1.5.1 纳米胶囊的平均粒径测定
取纳米胶囊溶液适量加入检测瓶中,放入动态光散射仪中进行测量,波长为532 nm,测定温度为25 ℃.
1.5.2 透射电镜扫描分析
用毛细管取适量纳米槲皮素胶囊样品,滴加至铜网上,晾干后滴加1% 磷钨酸于铜网上,晾干后置于透射电镜下进行扫描分析,观察成像.
1.5.3 纳米胶囊的红外光谱图
取槲皮素和槲皮素纳米胶囊冻干样,加入高纯氯化钾粉末进行充分研磨,用压片机压成透明片状,置于傅立叶变换红外光谱仪上,扫描波数在4000~500 cm-1范围内.
1.5.4 紫外分光光度法测定药物体外释放能力
依据《中国药典》[12]配制pH值分别为5.0, 6.0, 7.0, 8.0, 9.0, 10.0的磷酸缓冲液,用精密pH计测定,若有偏差,用HCl和NaOH校正至所需数值.将已制备的纳米胶囊溶液在不同的pH缓冲液中离心取上清液,利用紫外分光光度法考察槲皮素纳米胶囊的体外释放能力[13].
2 结果与讨论
2.1 最佳条件的确认
正交试验结果见表2.由表2可知,实验最佳条件为明胶0.2 g,槲皮素4 mg,甲醛1 mL,搅拌时间30 min,搅拌过程控温40 ℃左右,冷却温度0~5 ℃,对包裹和团聚影响最大的因素是明胶用量,其次是甲醛用量,再次是搅拌时间,最后是pH调节.

表2 正交试验结果分析Tab.2 The orthogonal experiment results
2.2 槲皮素纳米囊的平均粒径
将最佳条件制备得到的槲皮素纳米胶囊水溶液进行粒径的检测,从图3中可看出,槲皮素纳米囊的平均粒径为100 nm,粒径大小在纳米范围内,且颗粒分布均匀.

图3 槲皮素纳米囊粒径分布图Fig.3 Particle size distribution of QT-nanoparticles
2.3 透射电镜扫描结果
槲皮素纳米囊的透射电镜扫描形态图和扫描局部图见图4.电镜图片显示该纳米囊囊壁颜色较浅而中心颜色较深,这足以证明该纳米粒子即为囊泡结构,在图中也可以看出纳米囊的粒径在100 nm左右,与动态光散射测定的该纳米囊的粒径相近.
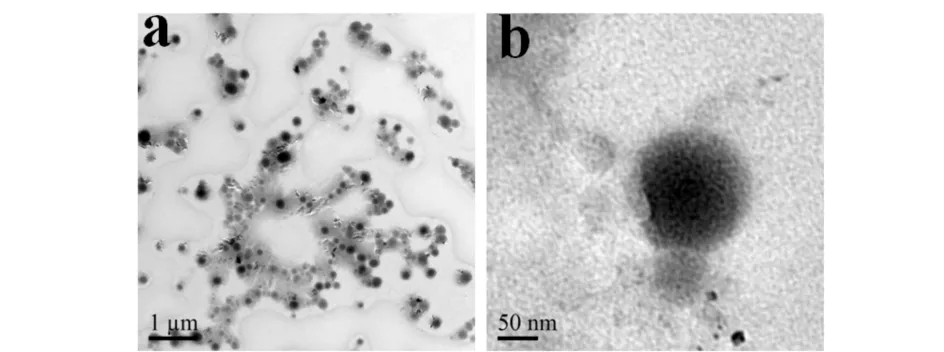
a) 形态图;b) 局部图
2.4 槲皮素纳米囊的红外光谱
分别对槲皮素和槲皮素纳米囊进行红外光谱分析,从图5中可以看出槲皮素与文献中典型的结构特征一致:在3200~3400 cm-1附近是O-H的伸缩振动,1644 cm-1处是C=O的伸缩振动,在1612 cm-1处是C=C的伸缩振动,在1261 cm-1处是C-O-C的伸缩振动.通过比较槲皮素与槲皮素纳米囊可以看出,槲皮素的特征峰在槲皮素纳米囊的红外图谱中接近消失,这意味着槲皮素被壁材明胶包埋.

图5 槲皮素与槲皮素纳米囊的红外光谱图Fig.5 FTIR spectra of QT and QT-nanocapsules
2.5 槲皮素纳米胶囊的体外释放能力
2.5.1 槲皮素的UV-Vis吸收光谱
槲皮素在磷酸缓冲液中的吸收光谱,如图6可以看出槲皮素在272 nm和381 nm处有吸收,据此可以选定381 nm左右作为测定槲皮素浓度的紫外吸收波长.

图6 槲皮素的紫外-可见吸收图谱Fig.6 UV-Vis absorption spectra of QT
2.5.2 不同时间不同pH缓冲液对槲皮素纳米胶囊体外释放的影响
利用紫外分光光度法考察槲皮素纳米囊的体外释放能力,图7为pH在6.0~10.0之间时槲皮素纳米囊水溶液在波长为381 nm处吸光度在1~5 h之内的变化,结果表明,随着时间的延长,纳米囊不断释放,pH值为5.0,6.0,7.0,8.0,10.0时1 h后趋向平稳,不再释放,而pH值为9时到2 h才趋向稳定.由图8可知,当槲皮素纳米胶囊与缓冲液作用2 h时吸光度的变化,结果表明在此区间,吸光度随pH值升高而增加,在pH值为7以后有一明显抬升,到pH值为9以后再趋向平稳,说明弱碱性条件有利于纳米囊的破囊释放.图9表明槲皮素纳米囊在pH 9.0时的缓释作用,0~2 h阶段加速释放,2 h后稳定.图10为不同pH时槲皮素纳米囊水溶液在释放2 h后的UV-Vis光谱图.人体内血液的正常pH为7.41±0.024[14],在此pH条件下,槲皮素在水溶液中能加速破囊释放.

图7 槲皮素纳米囊吸光度在不同pH缓冲液随着时间变化Fig.7 Abs change of QT-nanoparticles in different pH buffers with time
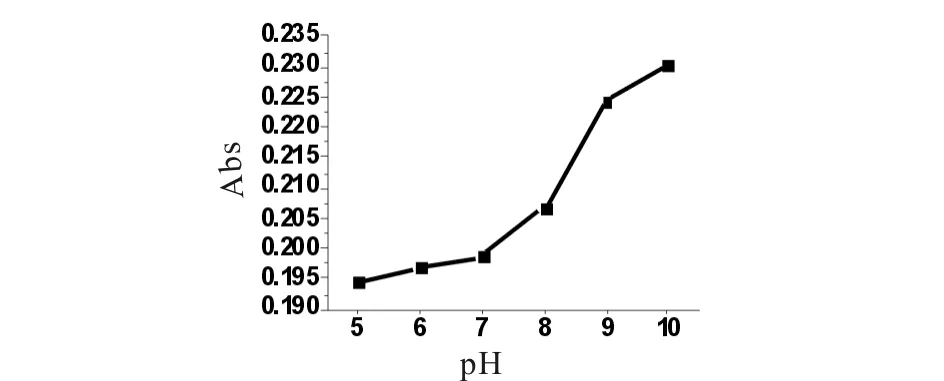
图8 槲皮素纳米囊在2 h时不同pH的吸光度变化Fig.8 Abs change of QT-nanoparticles at different pH values at 2 h

图9 pH 9.0时槲皮素纳米囊的变化Fig.9 The change of QT-nanocapsules at pH 9.0

图10 不同pH值槲皮素纳米囊的UV-Vis光谱Fig.10 UV-Vis spectra of QT-nanocapsules at different pH
3 结语
制成纳米胶囊可提高药物的水溶性与生物利用度,并可控制药物的释放,适合多种途径给药.采用初生态微晶法制备出纳米槲皮素胶囊,最佳条件为明胶0.2 g,槲皮素4 mg,甲醛1 mL,搅拌时间30 min,搅拌过程控温40 ℃左右,冷却温度0~5 ℃.检测的产品表面光滑,形态圆整,分布均匀,平均囊径在100 nm左右.通过对不同时间,不同pH槲皮素纳米胶囊的体外释放能力的考察分析,在碱性条件pH值9.0时缓释效果较为显著.
[1] Hollman P C, Kata M B.Dietary flavonoids: intake,health effects and bioavailability [J].Food Chem Toxicol, 1999,37(9-10):937-942.
[2] Yanoshita R, Chang H W, Son K H, et al.Inhibition of lysoPAF acetyltransferase activity by flavonoids [J].Inflammation Research, 1996,45(11):546-549.
[3] Ferry D R, Smith A, Malkhandi J, et a1.Phase I clinical trial of the flavonoid quercetin: Pharmacokinetics and evidence for in vivo tyrosine kinase inhibition [J].Clinical Cancer Research, 1996, 2(4):659-668.
[4] 李 强,夏晓晖.新编常用中药有效成分手册[M].北京:中国协和医科大学出版社,2007:671.
[5] Xiao X C, Hong Z G.Firstborn microcrystallization method to prepare nanocapsules containing artesunate [J].International Journal of Nanomedicine, 2010, 5(1):483-486.
[6] 洪宗国.纳米青蒿琥酯胶囊及其制备工艺[P].中国,200910062882.3, 2010.
[7] 洪宗国, 赵 丹.含CdTe量子点的纳米青蒿琥酯胶囊及其制备方法[P].中国,201110281330.9, 2013.
[8] 洪宗国,邓小莲,童惠娟.纳米龙血竭胶囊及其制备工艺[P].中国,200510019818.9, 2006.
[9] 洪宗国,童惠娟,钟益声,等.初生态微晶法制备纳米龙血竭微胶囊研究[J].化学与生物工程, 2006,23(10):40-41.
[10] 洪宗国, 王 东, 吴林玉.蒿甲醚的纳米包装[J].中南民族大学学报(自然科学版), 2012, 31(1):55-57.
[11] 涂青林, 陈 芬, 洪宗国.纳米紫杉醇胶囊的制备研究[J].纳米科技, 2013(4):22-25.
[12] 国家药典委员会编.中华人民共和国药典(第二部)[S].北京:中国医药科技出版社,2010.
[13] 刘星星, 陈志远, 姜兴茂.药物纳米胶囊的制备及其缓释研究[J].现代化工, 2016(7):68-70.
[14] Martin S A, Tomescu V, Voidǎzan S.Secondary elements of blood pH variation can influence the effort effectiveness based on adaptive changes within a group of elite athletes [J].Clujul Medical, 2016, 89(4):506-512.
Preparation of Quercetin Nanocapsules
HongZongguo,ZhongAqin,ChenSi,SongTingning,ZhaoDan
(College of Pharmacy, South-Central University for Nationalities, Wuhan 430074,China)
Objective: To study the synthetic conditions of quercetin nanocapsules with orthogonal design, the morphology andinvitroreleasing effect of the nanocapsules.Methods: Quercetin was used as the core material, along with gelatin as the wall material.The quercetin nanocapsules were prepared by firstborn microcrystallization method.The morphology of the nanocapsules was observed by dynamic scatterometer and transmission electron microscope.The sustained-release properties were determined by ultraviolet-spectrophotometry.Results:The optimized synthetic conditions were identified as : 0.2 g of gelatin, 4 mg of quercetin, 1 mL of formaldehyde, and 30 min of agitation time.The particle size distribution is about 100 nm, and it has a significant sustained releasing effect at pH 9.0.Significance: Quercetin nanocapsules can improve the water solubility and bioavailability of drugs, and can control the release of drugs, suitable for a variety of ways of administration.
quercetin nanocapsules;firstborn microcrystallization method;sustained release
2017-01-19
洪宗国(1958-),男,教授,研究方向:新型给药系统,E-mail: hongzongguo@aliyun.com
湖北省自然科学基金资助项目(2016CFB615)
TQ460.1;R944.5
A
1672-4321(2017)01-0032-05

