UV-B辐射对孔石莼孢子生长发育的影响
张智华, 蔡恒江,2, 张俊新,2, 陈官滨
(1. 大连海洋大学 海洋科技与环境学院, 大连 116023;2. 辽宁省高校近岸海洋环境科学与技术重点实验室, 大连 116023)
UV-B辐射对孔石莼孢子生长发育的影响
张智华1, 蔡恒江1,2, 张俊新1,2, 陈官滨1
(1. 大连海洋大学 海洋科技与环境学院, 大连 116023;2. 辽宁省高校近岸海洋环境科学与技术重点实验室, 大连 116023)
运用实验生态学的方法,研究了UV-B辐射对孔石莼孢子生长发育的影响,结果表明:孔石莼孢子发育早期外形主要呈现棒状和蝌蚪状,其中棒状占90.68%±2.50%。UV-B辐射对孔石莼孢子生长发育有明显的抑制作用,而且随着辐射剂量的增加,抑制作用愈加明显。在30 d时,受到不同剂量UV-B辐射的孔石莼幼苗均出现了死亡,死亡率随着UV-B辐射剂量的增加而升高。UV-B辐射会使孔石莼幼苗叶绿素a含量明显下降,而丙二醛含量会有不同程度的升高,因此细胞分裂受阻,叶绿素和细胞膜系统受到破坏是孢子生长发育受到抑制和幼苗死亡的原因之一。
UV-B辐射;孔石莼;孢子;生长发育
由于大量的氯氟烷烃(CFCs)、氢氯氟烷烃(HCFCs)和氢溴氟烷烃(HBFCs)等物质的应用导致臭氧层不断侵蚀,进而使到达地球表面的UV-B辐射(280~320 nm)强度不断增加。研究表明,UV-B辐射增强会对陆地生态系统和水生生态系统产生复杂的影响,会改变生物的生长、光合作用和有机物含量等[1-4],但生物也可以通过自身的形态变化、抗氧化机制、光修复和合成防护化合物质等防御机制来抵御UV-B辐射带来的伤害[5-6]。海洋大型藻类主要生活在海洋的潮间带地区,是最具有经济价值的藻类植物,它们生活的水域较浅,有些种类在低潮时直接暴露于空气中,所以大型海藻的生长会直接受到UV-B辐射增强的影响。
孔石莼(UlvapertusaKjellman)在我国野生藻类中资源极为丰富,是黄渤海产量最大的一种绿藻[7]。它不仅是海洋生态系统中重要的初级生产者,能够为许多海洋生物提供食物的来源,而且对海水的水质净化和赤潮防控等方面也起到了非常重要的作用[8-10]。已有研究表明UV-B 辐射可以抑制孔石莼的生长,破坏光系统和降低叶绿素的含量,并产生大量的活性氧自由基,破坏细胞的膜结构,对抗氧化防御系统的酶活性产生影响[11]。Han等研究发现,UV-B辐射还会使孔石莼产生孢子的数量降低,从而对其繁殖产生影响[12]。目前国内外研究主要集中在于孔石莼成体和产孢子量的研究,而有关UV-B辐射对孔石莼孢子生长发育影响的研究尚未见报道。本文选取大型海藻-孔石莼的孢子为实验材料,研究了UV-B辐射对其生长发育的影响,为进一步阐明UV-B辐射对海洋生态系统的影响提供依据。
1 材料和方法
1.1 藻种来源
孔石莼(UlvapertusaKjellman)采自大连市黑石礁潮间带,藻体采回后立即用灭菌海水洗净,去掉其表面的杂物和杂藻。
1.2 培养方法和条件
培养液采用f/2营养盐配方[13],挑选一株成熟的孔石莼藻体放入盛有500 mL培养液的1 L烧杯中,使每个烧杯中孔石莼的量达到(5.000±0.100)g/L,每个烧杯中放置4个载玻片。培养温度(20±1)℃,光照强度3000 Lx,光暗周期12 h∶12 h。每组实验同时设3个平行样。
1.3 UV-B辐射体系
UV-B光源采用UV-B灯管(Philips, TL 40W/12RS),使用UV-B型紫外辐射强度仪(北京师范大学光电仪器厂)测定辐射强度。UV-B灯管外用乙酸纤维素薄膜包裹,以除去280 nm的短波辐射。为了减小薄膜滤过作用的不稳定性,整个辐射体系在正式实验前需连续照射72 h。薄膜每2周更换1次,防止薄膜的老化。
1.4 UV-B辐射处理
通过调整辐射时间控制辐射剂量。在预备实验的基础上设置0.00(对照)、30.96、61.92和123.84 J/m2·d辐射剂量组。
1.5 UV-B辐射对孔石莼孢子生长发育的影响
每天取出载玻片用显微镜观察孔石莼孢子释放和附着情况,当观察到载玻片上有大量孢子附着时,取出载玻片,更换f/2营养液后进行孔石莼孢子生长发育实验。每天进行UV-B辐射照射,用显微镜观察孔石莼孢子的生长发育变化。当实验进行第3天时观察每片载玻片上全部孢子发育的形态,统计棒状幼苗所占百分率,以后每天观察载玻片上幼苗的死亡情况,当实验进行30 d时统计幼苗的累计总死亡率。实验每隔10 d用Motic Images Advanced 3.2软件测量孔石莼幼苗的长度。
1.6 叶绿素a(Chlorophyll a,Chl-a)和丙二醛(Malondine, MDA)含量的测定
30 d后把附着在载玻片上生长的幼苗取下进行Chl-a和MDA含量的测定。
取吸干水分的孔石莼幼苗(0.050±0.005)g,加入1 mL 90%丙酮研磨成匀浆,用90%丙酮定容至10 mL,避光抽提24 h,然后以3500 r/min离心10 min,取上清液,用分光光度计测定750 nm、663 nm、645 nm、630 nm波长的吸光度,根据公式Chl-a(μg/g)=〔11.64(D663-D750)-2.16(D645-D750)+0.10(D630-D750)〕/G×104计算Chl-a的含量[14],式中D代表对应波长下的吸光值,G代表孔石莼幼苗的重量。
取吸干水分的孔石莼幼苗(0.100±0.010)g ,加5%三氯乙酸3 mL,研磨后所得匀浆3000 r/min下离心10 min,取上清液2 mL,加0.67%硫代巴比妥酸2 mL,混合后100℃水浴上煮沸30 min,冷却后再离心一次,取上清液,用分光光度计测定450 nm、532 nm、600 nm波长的吸光度,根据C(μmol/g)=6.45(D532-D600)-0.56D450计算出测定液中MDA浓度,再换算出幼苗中MDA含量[15],式中D代表对应波长下的吸光值。
1.7 数据处理
UV-B辐射对孔石莼孢子生长发育的情况通过幼苗的相对生长率表示,通过下列公式计算:Pt/P0×100%,Pt代表不同剂量的UV-B照射下孔石莼孢子发育的幼苗平均长度,P0代表对照组孔石莼孢子发育的幼苗平均长度。所有数据用Origin7.5统计软件进行统计分析。
2 结果与分析
2.1 孔石莼孢子生长早期的形态
图1为孔石莼孢子生长发育各时期的形态。附着的孔石莼孢子为一绿色的单细胞(图1-A),实验的第2至第3天单细胞一端开始凸起(图1-B),分裂成两细胞(图1-C),有的似蝌蚪状(图1-D),有的呈棒状(图1-E),棒状占90.68%±2.50%,两细胞幼体大约3d后分裂成三细胞的幼体(图1-E),前期都是进行的横向分裂,分裂成的多细胞幼苗细胞体积比较小(图1-F),随后细胞体积开始增大,长度也不断增加(图1-G),当幼苗增长到一定程度后开始进行纵向分裂,长成两列细胞的幼苗(图1-H),最终发育成肉眼可见的幼苗(图1-I)。
2.2 UV-B辐射对孔石莼孢子生长发育的影响
由图2可以看出UV-B辐射对孔石莼孢子的生长发育有明显的抑制作用,而且随着辐射剂量的增加,抑制作用愈加明显。第10天时,不同剂量的UV-B辐射(30.96、61.92和123.84 J/m2·d)的孔石莼幼苗的长度受到明显的抑制(P<0.01),相对生长率分别为52.99%、48.17%和31.60%。20 d和30 d时,较高剂量的UV-B辐射(61.92、123.84 J/m2·d)孔石莼幼苗的长度明显低于对照组(P<0.01),生长受到了抑制。较高剂量的UV-B辐射(61.92、123.84 J/m2·d)在20 d时相对生长率分别为74.35%和55.34%, 在30 d时的相对生长率分别为75.02%和60.96%。

图1 孔石莼孢子生长发育各时期的形态
A: 单细胞; B: 单细胞一段凸起; C: 单细胞分裂成两细胞; D: 蝌蚪状两细胞; E: 三细胞幼体; F: 多细胞幼体; G: 横向分裂的幼体; H: 纵向分裂的幼体; I: 30 d时的幼苗
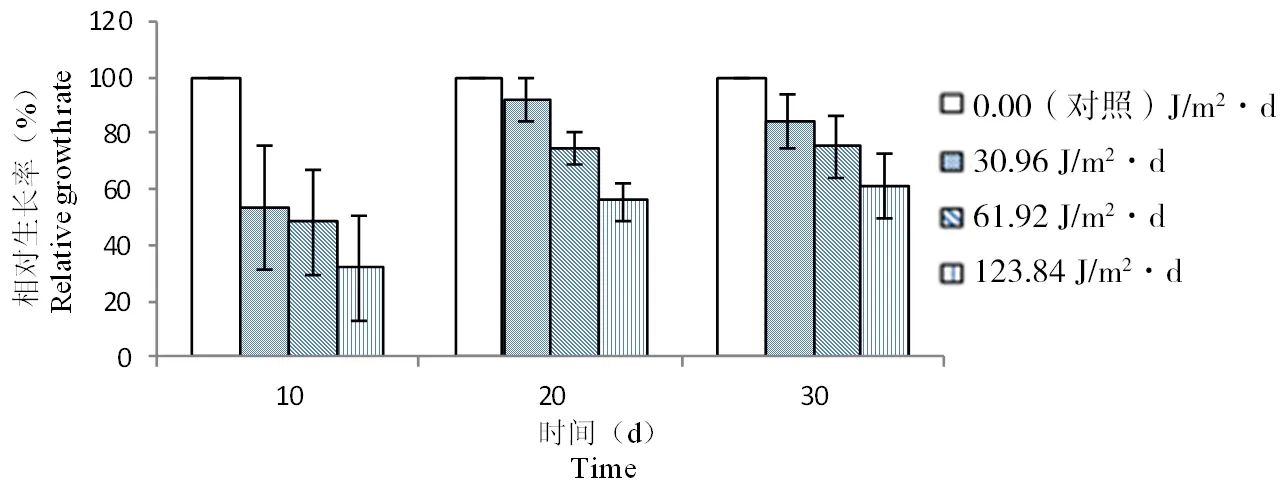
图 2 UV-B辐射对孔石莼孢子相对生长率的影响
图3为孔石莼幼苗的衰亡过程,死亡的幼苗主要表现为苗体失去绿色,细胞膜破裂。受到不同剂量UV-B辐射的孔石莼幼苗在30 d时均出现了死亡,死亡率随辐射剂量的加大而增大(图4)。第30天时,受到不同剂量UV-B辐射(0、30.96、61.92和123.84 J/m2·d)的孔石莼幼苗的死亡率分别为1.9%、4.0%、7.8%和14.1%。受到较高剂量UV-B辐射(61.92、123.84 J/m2·d)的孔石莼幼苗死亡率与对照相比差异显著(P<0.01)。
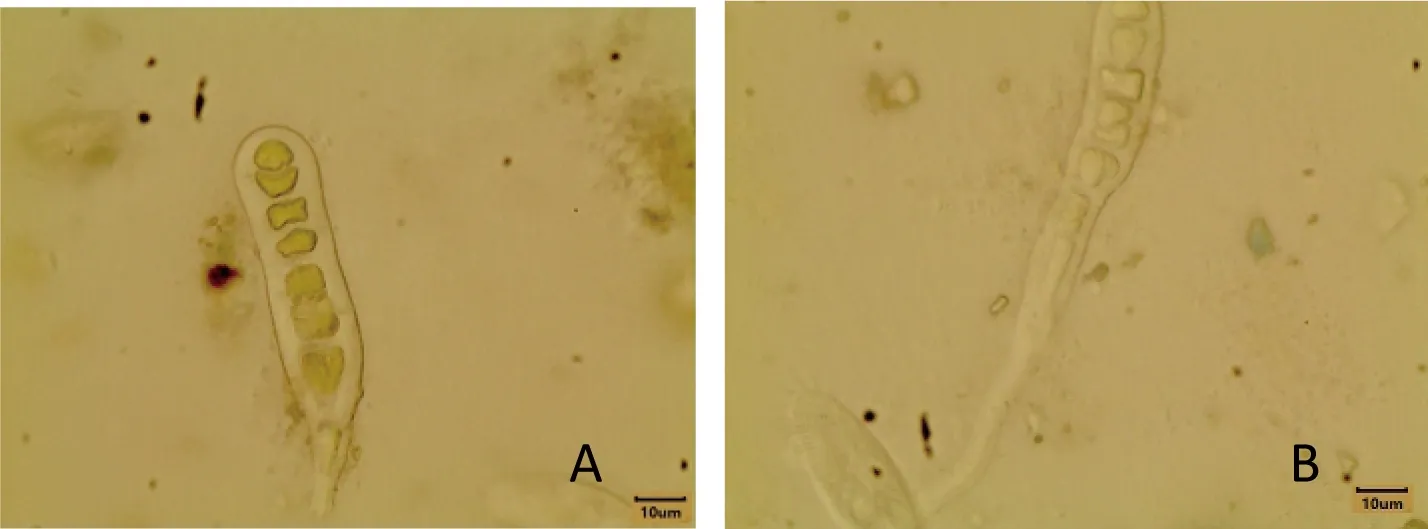
图3 孔石莼幼苗衰亡过程(A:健康的幼苗;B:死亡的幼苗)
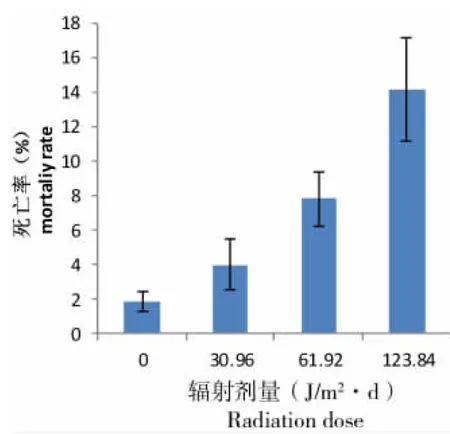
图4 第30天孔石莼幼苗的总死亡率
Fig 4 Mortaliy rate ofUlvapertusaKjellman seedlings on the 30th day
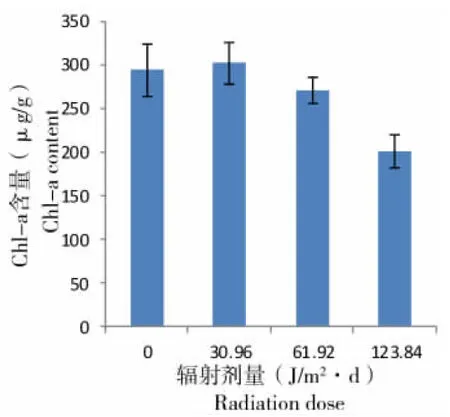
图5 UV-B辐射对孔石莼幼苗Chl-a含量的影响
Fig 5 Effects of UV-B radiation on the Chl-a contents ofUlvapertusaKjellman seedlings

图6 UV-B辐射对孔石莼幼苗MDA含量的影响
2.3 孔石莼幼苗Chl-a含量的变化
UV-B辐射对孔石莼幼苗Chl-a含量有明显的影响(图5)。受到较低剂量UV-B辐射(30.96 J/m2·d)的幼苗Chl-a含量有所增加,但差异不显著(P>0.05);受到较高剂量UV-B辐射(123.84 J/m2·d)的幼苗Chl-a含量受到明显的抑制(P<0.01),其含量降低了31.63%。
2.4 孔石莼幼苗MDA含量的变化
图6为UV-B辐射对孔石莼幼苗MDA含量的影响,受到UV-B辐射的幼苗MDA含量明显升高(P<0.01)。受到不同剂量UV-B辐射(30.96、61.92和123.84 J/m2·d)的幼苗MDA含量分别升高了102.35%、124.16%和267.69%。
3 讨论
3.1 UV-B辐射对孔石莼孢子生长发育的抑制作用
本研究表明,UV-B辐射对孔石莼孢子的生长发育有抑制作用,并且随着辐射剂量的增加幼苗相对生长率受到的抑制作用愈加明显。Grobe等[16]认为UV-B辐射诱导的生长抑制可能是由于干扰细胞周期的G1或G2期的蛋白合成而影响细胞分裂导致的。而实验中受到较高剂量UV-B辐射(123.84 J/m2·d)的孔石莼幼苗Chl-a含量也会受到明显的抑制,这可能也是孔石莼幼苗相对生长率受到抑制的主要原因。叶绿素是藻类生物体进行光合作用的物质基础,Chl-a含量在很大程度上决定了其光合效率和能力[17],孔石莼幼苗Chl-a含量下降必将会导致其光合的效率和能力下降,进而生长受到了抑制。Chl-a含量下降的原因可能是由于UV-B辐射会抑制叶绿素的合成,破坏叶绿体原有的结构和膜系统,导致叶绿素分解所致[18]。研究表明UV-B辐射还会干扰PSⅠ和PSⅡ,破坏PSⅡ中的D1和D2蛋白,使叶绿素吸收光而激发的高能电子传递受阻,导致卟啉环发生氧化开环[19]。而受到较低剂量UV-B辐射(30.96 J/m2·d)的孔石莼幼苗Chl-a含量会有所升高,但差异并不显著,这与研究UV-B 辐射对海洋微藻-青岛大扁藻Chl-a含量影响的报道相似,青岛大扁藻在受到低剂量UV-B辐射时,叶绿素含量也会出现增加的现象,这主要是由于“毒物的兴奋效应”引起的[20]。所以可以推测孔石莼幼苗相对生长率受到抑制是由于细胞分裂受阻和叶绿素含量发生变化进而影响光合作用这两种因素共同作用的结果。
3.2 UV-B辐射造成幼苗死亡的原因
UV-B辐射不仅能抑制孔石莼孢子的生长发育,而且还会造成幼苗的死亡,受到UV-B辐射的孔石莼幼苗MDA含量还会有不同程度的升高。MDA是生物膜脂过氧化过程中的主要产物之一,因此MDA含量高低可反映细胞膜脂过氧化作用强弱和质膜破坏程度的重要指标[21],受到UV-B辐射的孔石莼幼苗MDA含量的升高表明其细胞膜和质膜系统受到破坏。实验中受到较高剂量UV-B辐射(123.84 J/m2·d)处理的孔石莼幼苗Chl-a含量显著降低,而死亡的幼苗也可以观察到苗体失去绿色,细胞膜破裂,因此推测叶绿素和细胞膜系统受到破坏造成了孔石莼苗体的死亡。UV-B辐射具有比可见光更高的能量,照射在植物体上会对其产生一定的损害,当孔石莼幼苗受到UV-B辐射照射时,藻体本身的自由基产生与消除的平衡就会遭到破坏,通过Haber-Weiss反应产生大量的活性和毒性极高的·OH氧化胁迫细胞内的大部分生物大分子[22]。因此,UV-B辐射导致的氧化胁迫使孔石莼幼苗细胞膜系统脂质过氧化,破坏其光合作用,是造成幼苗死亡主要原因。
4 结论
UV-B 辐射会抑制大型海藻-孔石莼孢子的生长发育,造成幼苗的死亡率升高,这将导致孔石莼种群生物量的减少,进而影响整个海洋生态系统。经UV-B辐射的孔石莼幼苗Chl-a含量明显下降,而MDA含量会有不同程度的升高,因此细胞分裂受阻,叶绿素和细胞膜系统受到破坏是其孢子生长发育受到抑制和幼苗死亡的原因之一。
[1]YU J, YANG G P, TIAN J Y. Effects of UV-B radiation on ingestion, fecundity, population dynamics andantioxidant enzyme activities ofSchmackeriainopinus(Copepoda Calanoida)[J]. Journal of Experimental Marine Biology and Ecology, 2009, 381(2):74-81.
[2]XU J, GAO K. UV-A enhanced growth and UV-B induced positive effects in the recovery of photochemical yield inGracilarialemaneiformis(Rhodophyta) [J]. Journal of Photochemistry and Photobiology B: Biology, 2010, 100(3):117-122.
[3]RHEE J S, KIM B M, CHOI B S, et al. Expression pattern analysis of DNA repair-related and DNA damage response genes revealed by 55 K oligomicroarray upon UV-B irradiation in the intertidal copepod,Tigriopusjaponicas[J].Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2012, 155(2): 359-368.
[4]SUBRAMANI P A, HAMEED B, MICHAEL R D. Effect of UV-B radiation on the antibody response of fish-implication on high altitude fish culture [J]. Journal of Photochemistry and Photobiology B: Biology, 2015, 143:1-4.
[5]RIZZINI L, FAVORY J J, CLOIX C, et al. Perception of UV-B by theArabidopsisUVR8 protein[J]. Science, 2011, 332(6025):103-106.
[6]HEIJDE M, ULM R. UV-B photoreceptor-mediated signaling in plants[J]. Trends in Plant Science, 2012, 17(4): 230-237.
[7]苏秀榕,李太武,常少杰. 孔石莼营养成份研究[J].中国海洋药物,1997(1):33-35.
[8]殷旭旺,李文香,白海锋,等. 不同海藻饲料对刺参幼参生长的影响[J].大连海洋大学学报,2015, 30(3):276-280.
[9]吕冬伟,刘 峰,李兴佐. 大型海藻孔石莼在工厂海水养殖中的生物修复及其应用前景[J]. 海洋科学, 2012, 36(12):95-98.
[10]蔡恒江,唐学玺. 孔石莼和赤潮异弯藻相互作用的初步研究[J]. 大连海洋大学学报, 2012, 27(3):255-259.
[11]董开升. 孔石莼和鼠尾藻对UV-B辐射的生理化响应[D]. 青岛:中国海洋大学,2008.
[12]HAN T, HAN Y S, KIM K Y, et al. Influences of light and UV-B on growth and sporulation of the green algaUlvapertusaKjellman [J]. Journal of Experimental Marine Biology and Ecology, 2003, 290(1): 115-131.
[13]GUILLARD R R, RYTHER J H. Studies on marine planktonic diatoms I.Cyclotellanana(Hustedt) andDetonulaconfervanceae(Cleve) Gran[J]. Canadian Journal Microbiology, 1962, 8:229-239.
[14]JEFFERY S W, HUMPHERY G F. New spectrophotometric equations for determining chlorophyll a, b, c1 and c2 in higher plant, algae and natural phytoplankton [J]. Plant Physiology & Biochemistry, 1975, 8:53-59.
[15]DHINDSA R S, MATOWE W. Drought tolerance in two mosses: correlated with enzymatic defense against lipid peroxidation [J]. Journal of Experimental Botany, 1981, 32(1):19-91.
[16]GROBE C W, MURPHY T M. Solar ultraviolet-B radiation effects on growth and pigment composition of the intertidal algaUlvaexpansa(setch) S. & G. (chlorophyta) [J]. Journal of Experimental Marine Biology & Ecology ,1998, 225(1):39-51.
[17]赵天宏,刘轶鸥,王 岩,等. O3浓度升高和UV-B辐射增强对大豆叶片叶绿素含量和活性氧代谢的影响[J]. 应用生态学报, 2013, 24(5):1277-1283.
[18]YAO Y, XUAN Z, LI Y, et al. Effects of ultraviolent-B radiation on crop growth, development, yield and leaf pigment concentration of tartary buckwheat (Fagopyrumtataricum) under field conditions [J]. European Journal of Agronomy, 2006, 25(2):215-222.
[19]KARSTEN U, LEMBCKE S, SCHUMANN R. The effects of ultraviolet radiation on photosynthetic performance, growth and sunscreen compounds in aeroterrestrial biofilm algae isolated from building facades [J]. Planta, 2007, 225(4): 991 1000.
[20]蔡恒江,唐学玺,张培玉,等. UV-B辐射对青岛大扁藻生长及其某些生理特性的影响[J]. 海洋科学进展,2005, 23(4):460-465.
[21]汪月霞,孙国荣,王建波,等. NaCl 胁迫下星星草幼苗MDA含量与膜透性及叶绿素荧光参数之间的关系[J]. 生态学报,2006, 26(1):122-129.
[22]BOWLER C, VAN MONTAGU T, INZE D. Superoxide dismutase and stress tolerance [J]. Annual Review of Plant Physiology & Plant Molecular Biology, 1992, 43:83-116.
Effects of UV-B radiation on the growth of Ulva pertusa Kjellman spores
ZHANG Zhi-hua1, CAI Heng-jiang1,2, ZHANG Jun-xin1,2, CHEN Guan-bin1
(1. College of Marine Technology and Environment; 2. Key Laboratory of Nearshore Marine Environmental Research, Dalian Ocean University, Dalian 116023, China)
The effects of UV-B radiation on the growth ofUlvapertusaKjellman spores were studied by experimental ecological methods. The results showed that the growth morphology ofUlvapertusaKjellman spores was mainly rod shape and tadpole shape. The percentage of rod shape was 90.68%±2.50%. UV-B radiation could inhibit the growth ofUlvapertusaKjellman spores, and the growth inhibition was more significant with the increased doses of UV-B radiation treatment. On the day 30,UlvapertusaKjellman seedling had emerged death under UV-B radiation, and the death rate was increased with the increased doses of UV-B radiation treatment. The chlorophyll a contents ofUlvapertusaKjellman seedling were significantly decreased, while MDA contents were increased by UV-B radiation. Therefore, the reasons ofUlvapertusaKjellman seedling growth inhibition and death were cell division, chlorophyll and cell membrane system damage.
UV-B radiation;UlvapertusaKjellman; spores; growth
2016-05-25;
2016-06-29
国家自然科学基金(41306104);大连海洋大学校列项目(2012HYDX11);红海滩生态修复项目(PHLXZ-2017013-002)
张智华,硕士研究生,研究方向为海洋生态学,E-mail: 810918550@qq.com
蔡恒江,副教授,研究方向为海洋生态学,E-mail:caihj@dlou.edu.cn
Q947
A
2095-1736(2017)02-0068-04
doi∶10.3969/j.issn.2095-1736.2017.02.068

