介质阻挡放电等离子体灭藻过程中藻细胞内含物降解规律的三维荧光光谱研究
李腊梅, 张 宏, 黄 青,2
(1. 中国科学院 合肥物质科学研究院 技术生物与农业工程研究所, 合肥 230031;2. 中国科学技术大学, 合肥 230026)
介质阻挡放电等离子体灭藻过程中藻细胞内含物降解规律的三维荧光光谱研究
李腊梅1, 张 宏1, 黄 青1,2
(1. 中国科学院 合肥物质科学研究院 技术生物与农业工程研究所, 合肥 230031;2. 中国科学技术大学, 合肥 230026)
应用介质阻挡放电(Dielectric barrier discharge,DBD)等离子体处理有毒有害蓝藻,并对蓝藻细胞损伤过程及藻毒素降解效率进行研究。以三维荧光光谱(Three dimensional excitation emission matrix fluorescence spectroscopy,EEM)技术为手段,通过区域荧光体积积分(Fluorescence regional integration,FRI)的方法,考察了介质阻挡放电等离子体损伤铜绿微囊藻(Microcysticaeruginosa)过程中藻细胞荧光类内含物释放降解的规律;此外,还利用高效液相色谱(HPLC)技术,检测了灭藻过程中微囊藻毒素(Microcystin-LR,MC-LR)含量的动态变化过程。结果表明,随着放电等离子体处理时间的延长,藻细胞内含物先释放到细胞外后,然后逐渐被降解;分析了蓝藻毒素MC-LR的变化过程与降解效率,证明它最终可以被等离子体完全氧化降解和去除。研究工作不仅显示了采用低温等离子体可以有效灭藻和降解藻毒素,同时也展示了三维荧光光谱作为一种快速实时的观察分析手段,可以有效应用于藻细胞损伤过程及相关机理研究,这将为发展新的高效灭藻技术及其安全评价方法提供实验基础和依据。
介质阻挡放电(DBD);低温等离子体;三维荧光光谱;铜绿微囊藻;藻毒素;氧化和降解
水体富营养化程度加深导致藻类过度繁殖,形成蓝藻水华,使得水生态系统的平衡和稳定遭到严重破坏[1]。铜绿微囊藻(Microcysticaeruginosa)是夏季蓝藻水华暴发时的优势种群。因此,近年来针对如何杀灭铜绿微囊藻细胞且不造成水体二次污染的研究变成国内外研究的热点和难点[2-3]。研究发现放电等离子体能高效杀灭铜绿微囊藻,并证实羟自由基、双氧水等放电产生的活性物质在灭藻过程中起着重要作用。羟自由基攻击使蓝藻细胞膜破裂,双氧水进入蓝藻细胞造成细胞组分的氧化损伤进而导致细胞死亡[4-5]。等离子体杀灭藻细胞的同时,由于细胞膜受损,细胞内含物不可避免的向水体释放,这些内含物的释放规律如何,被释放的内含物是否也能被有效降解以避免对水体的二次污染,这些都是等离子体灭藻技术开发应用过程中急需解决的问题。
近年来,三维荧光光谱技术因具有检测速度快、灵敏度高、不破坏样品结构、多组分同时检测分析等优点被广泛地应用于湖泊沉积物,水体、土壤中可溶性有机物的组成结构及迁移转化规律等研究。三维荧光光谱通过不断改变激发波长以获取激发波长和发射波长的同步变化信息,对多组分复杂体系中荧光光谱(激发/发射,Ex/Em)重叠的对象进行光谱识别和表征,属于一种光谱指纹技术。对于每一种荧光物质,都有其特有的三维荧光光谱信息,具有较高的选择性,能表征的荧光特性包含与结构、构型、官能团、非均质性、分子内及分子间的动力学特性等有关的信息[6]。国内外报道显示,三维荧光技术结合有效的数据分析可以在线对水体中分布在可见和紫外光谱范围的多种物质进行定性定量分析,如油类、多环芳香化合物、酚类化合物等[7]。研究人员利用水华藻类活体的三维荧光光谱特征,建立水华藻类实时、快速的荧光识别测定技术,监测藻类密度和胞外毒素含量的动态变化[8]。利用三维荧光光谱对蓝藻培养液中提取的腐殖酸进行定性与定量分析,探究水华蓝藻生长周期中腐殖酸的释放特性,为蓝藻暴发时水体中腐殖酸来源的研究提供新思路[9-10]。但是,关于灭藻除藻过程中藻细胞内含物的释放规律以及处理中藻细胞内含物被降解的动态变化过程,这方面的实验及数据还鲜有报道,而这方面的信息对深入研究灭藻作用机理、研发提高灭藻效率的方法和技术是至关重要的。为此,本研究采用三维荧光光谱技术,对介质阻挡放电等离子体在灭活铜绿微囊藻过程中胞内溶解性有机物释放降解的过程进行研究,并采用区域荧光体积积分法对其变化过程进行定量分析,以期对等离子体灭藻实际应用提供指导。
1 材料与方法
1.1 铜绿微囊藻的培养及实验试剂
铜绿微囊藻藻种(Microcysticaeruginosa, FACHB-905)购自中国科学院水生生物研究所国家淡水藻种库,采用BG11培养基进行培养。铜绿微囊藻母液在光照培养箱中(26±1)℃下进行培养,光照强度为5000 Lx,光暗周期为16/8 h。当藻细胞处于对数生长期时,取一定量的藻液离心去培养基后用超纯水重悬进行放电等离子体处理。放电等离子体电源系统及实验装置如图1所示[5]。染料SYBR green I (Sigma,USA),染料Propidium iodide (PI,sigma,USA)为光谱纯;MC-LR标准品(Enzo life science,USA),乙腈和甲醇为色谱纯(Tedia Company, USA);所采用其他试剂均为分析纯,实验用水均为超纯水。
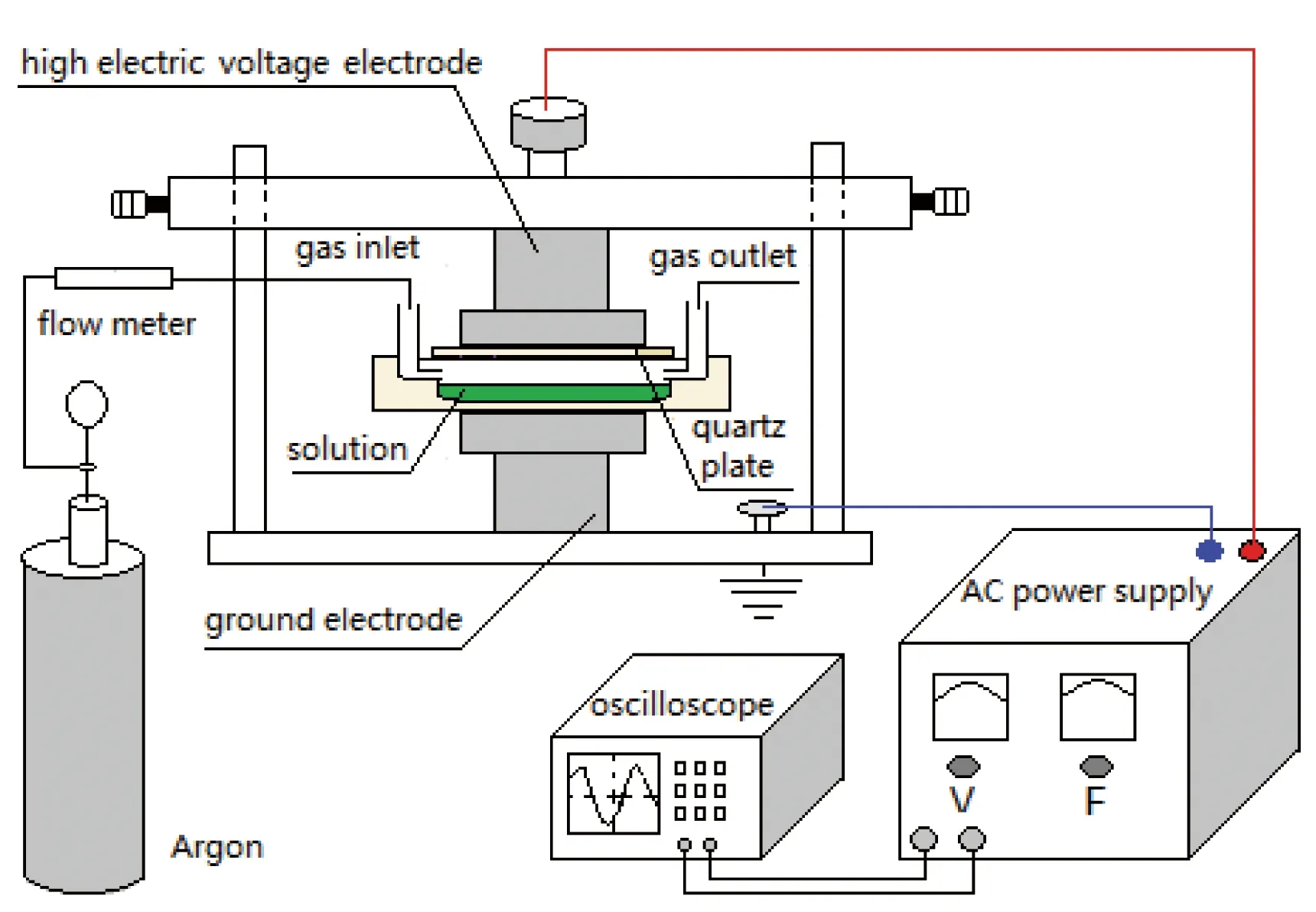
图 1 实验装置示意图[5]
1.2 实验方法
采用处于对数生长期的铜绿微囊藻进行DBD处理,实验前调节藻细胞浓度为107个/mL,离心后用超纯水重悬,取一定量藻细胞悬液置于反应器中,控制一定放电电压,在氩气氛围下进行处理(氩气流速为0.5 L/min)到特定时间后收集样品进行后续实验测定。
1.3 分析方法
1.3.1 灭活率的检测
流式细胞术检测藻细胞灭活率的方法采用两种荧光染料SYBR green I和PI对细胞进行染色,以区分死细胞和活细胞[5]。SYBR green I(1∶10 000)可以透过活细胞的细胞膜,进入细胞内与DNA小沟结合发出绿色荧光,最大发射波长520 nm,FL1通道检测。PI只能透过死细胞的细胞膜,对细胞进行染色发出红色荧光,最大发射波长617 nm,FL3通道检测。SYBR green I工作液的稀释比例为1∶10 000(V∶V),实验时先用超纯水将其稀释成1∶100(V∶V)的储备液,于-20℃保存。将PI配制成2 mg/mL的储备液,于4 ℃保存。染色时,向1 mL藻液中加入10 μL 染料SYBR green I和3 μL染料PI储备液,黑暗条件下室温孵育15 min,流式细胞仪(BD FACS,USA)检测,每次检测收集20 000个藻细胞。铜绿微囊藻灭活率的计算公式为:
灭活率(%)=FL3通道细胞数/(FL3通道细胞数+FL1通道细胞数)×100%
1.3.2 三维荧光光谱(EEM) 测定
EEM测定使用瓦里安荧光分光光度计(Varian Cary Eclipse, USA),石英荧光比色皿的光径为1 cm,PMT的电压设置在700 V,激发光和发射光的狭缝宽度都是10 nm,扫描光谱时进行仪器自动校正,扫描速度9600 nm/min,波长的扫描范围为激发波长:200~710 nm,发射波长:210~800 nm。将一定量DBD处理前后的铜绿微囊藻悬液加入到石英比色皿中进行EEM测定,导出数据对其进行分析处理。
1.3.3 微囊藻毒素MC-LR含量测定
DBD处理前后微囊藻细胞悬液中微囊藻毒素MC-LR含量测定使用高效液相色谱法。将DBD处理前后的藻细胞离心取上清液,过0.45 μm的微孔滤,用高压液相色谱仪(HPLC,Thermo-Finnegan,USA)进行微囊藻毒素MC-LR含量的测定。色谱法条件如下:色谱柱为反相C18柱; 流动相为28%乙腈,72% 磷酸盐缓冲液; 流量:1 mL/min;柱温:37℃;检测波长:238 nm。以不同浓度微囊藻毒素MC-LR标准品的峰面积构建标准曲线,根据标准曲线计算样品中MC-LR含量。
2 结果与讨论
2.1 DBD对铜绿微囊藻的灭活效应
DBD对铜绿微囊藻细胞的灭活率随放电时间的变化如图2所示,随着放电时间的延长,藻细胞的灭活率逐渐增加。氩气条件下,放电电压为16 kV时,放电处理8 min时,藻细胞的灭活率超过80%(图2-a)。控制放电时间2 min不变,改变放电电压的大小,藻细胞灭活率随放电电压的增加持续增加。当放电电压为20 kV时,藻细胞在2 min内几乎全部被杀灭(图2-b)。实验结果提示可以通过改变放电电压和时间,优化DBD对铜绿微囊藻细胞的灭活效应。
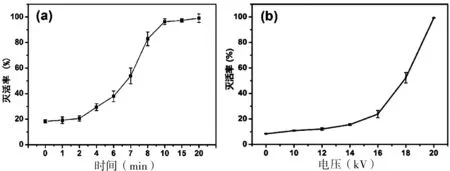
图 2 放电等离子体对铜绿微囊藻的灭活效应
a:放电时间,电压为16 kV;b:放电电压,放电时间为2 min。均为氩气氛围
2.2 EEM 检测分析DBD处理藻细胞过程中内含物释放及降解规律
铜绿微囊藻细胞内的一些蛋白质、色素分子和代谢产物具有荧光特性,EEM具有同时检测多种成分的优点,可以用来深入研究DBD处理前后藻细胞内含物的变化规律。正常铜绿微囊藻(未处理的对照组)的EEM图谱如图3所示,为便于分析统计,将EEM图谱分成A~G 7个区域,常见的分区方法和典型代表物质见表1[4]。A区域(λex/λem=230/330 nm)为类蛋白峰,如芳香族氨基酸、类酪氨酸、类色氨酸、多肽等类物质;B区域(λex/λem=280/330 nm)覆盖的范围包括可溶性微生物代谢产物、酚类物质、类芳香族蛋白等[11];D区域(λex/λem=630/660 nm)包括藻蓝蛋白(λex/λem=615/650 nm)和叶绿素类物质(λex/λem=680/685 nm)[12];C区域(λex/λem=350/450 nm)为类腐殖酸类物质的荧光峰;E区域 (λex/λem=360/660 nm)的荧光峰包含藻蓝蛋白及其它光合色素的降解产物[4]。DBD处理铜绿微囊藻细胞不同时间后检测得到的三维荧光光谱(EEM)如图4所示,随着DBD处理藻细胞时间的延长,D区域的荧光强度逐渐增加,到处理4 min时增加到最大值,说明DBD的氧化作用破坏藻细胞膜,使藻细胞内藻蓝蛋白和叶绿素等物质释放到细胞外,并且当处理时间达到4 min时,释放量达到最大值,在随后的处理时间内(20 min),这些物质逐渐被氧化降解去除。C、E区域的荧光强度随着处理时间延长先逐渐增强后减弱直至消失,说明DBD作用致使释放出的藻蓝蛋白或叶绿素类物质逐渐降解,并生成降解产物以及类腐殖酸类物质,随着处理时间的延长,释放的内含物、降解产物及释放其他可溶性有机物均被逐渐完全氧化降解。
为定量分析各个区域所代表的物质在不同处理时间点的变化,采用区域荧光体积积分法(FRI)对各个区域进行积分统计。FRI的计算公式为:
式中Øi为EEM原始体积积分值,Δλex为激发波长间隔(取10 nm);Δλem为发射波长间隔(取10 nm);I(λex,λem)为每个点的荧光强度。图5显示DBD处理铜绿微囊藻细胞不同时间点各个区域荧光体积积分数值变化情况。从图中可以看出,处理1、2和4 min后,各组分荧光体积积分总和显著高于对照组,说明DBD作用破坏藻细胞膜,使细胞内各类色素类荧光物质释放到细胞外,增加荧光强度。具体到各个组分,以D区域代表的叶绿素a及光合色素类化合物和E区域代表的光合色素降解产物等物质的FRI值增加的最为显著。随着处理时间的延长,各个区域的FRI值逐渐减小直至由瑞利散射峰引起本底FRI值,说明释放到细胞外的内含物被进一步氧化降解失去荧光。FRI数值的变化过程反应DBD作用于铜绿微囊藻细胞,藻细胞先发生细胞膜受损,细胞内含物释放到细胞外,释放的内含物被DBD进一步氧化降解的动态过程。
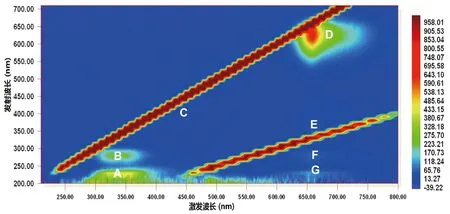
图 3 铜绿微囊藻的三维荧光光谱分区
激发波长为200~710 nm,发射波长为210~800 nm;狭缝为10 nm;分区中大写字母代表的物质种类见表1
图 4 不同放电时间处理后铜绿微囊藻液三维荧光光谱的变化
Fig 4 EEM fluorescence spectra ofM.aeruginosasuspension treated by DBD for different treatment time
2.3 HPLC分析微囊藻毒素MC-LR含量变化
铜绿微囊藻细胞中含有微囊藻毒素,当细胞损伤或破裂时,微囊藻毒素会释放到水体中,MC-LR是微囊藻毒素多个异构体中毒性最强的一种[13]。DBD处理会导致铜绿微囊藻细胞细胞膜受损,使微囊藻毒素MC-LR释放到细胞外,水中MC-LR含量随处理时间的变化情况如图6所示。DBD处理4 min后,MC-LR的含量高达580 μg/L,达到最大值,之后随着放电时间的延长,MC-LR被持续氧化降解,到处理20 min时,几乎检测不出微囊藻毒素MC-LR。培养过程中铜绿微囊藻也会向胞外释放微囊藻毒素,培养30 d后的铜绿微囊藻的培养液中MC-LR含量为250 μg/L,而饮用水标准中MC-LR的最高含量为1 μg /L,远远超过饮用水标准。因此,DBD技术作为高级氧化技术的一种,不仅可以有效杀灭蓝藻细胞,还可以降解水体中的蓝藻毒素,包括DBD杀灭蓝藻细胞过程中向胞外释放的蓝藻毒素,从而保证水体不受该技术处理过程的二次污染,表明该技术具有环境兼容性高的优点。

表1 FRI分区方法及各个区域代表的典型物质
3 结论
低温等离子体能高效杀灭铜绿微囊藻并降解藻毒素。本研究我们采用DBD处理方式,研究了放电时间和放电电压对灭活效率的影响。实验表明,在氩气氛条件下,当放电电压为16 kV,处理8 min后,藻细胞的灭活率可高达80%以上。放电过程中伴随藻细胞膜受损,向水中释放细胞内含物包括微囊藻毒素MC-LR。通过EEM光谱及分析,证明了在DBD处理过程中,藻细胞先向水体释放藻蓝蛋白、叶绿素及光合色素类化合物、类腐殖酸类物质等可溶性有机物,随着放电时间的延长,细胞荧光类内含物全部释放,并且释放的内含物逐渐被氧化降解,由此揭示了DBD处理铜绿微囊藻过程中内含物释放和降解规律。总之,这项研究显示了放电等离子体技术作为一种高效的杀灭有害蓝藻的高级氧化技术,在杀灭藻细胞的同时还能降解去除释放到水体中的蓝藻毒素,具有很好的环境兼容性,这为等离子体灭藻技术的应用开发和安全评价奠定了基础。
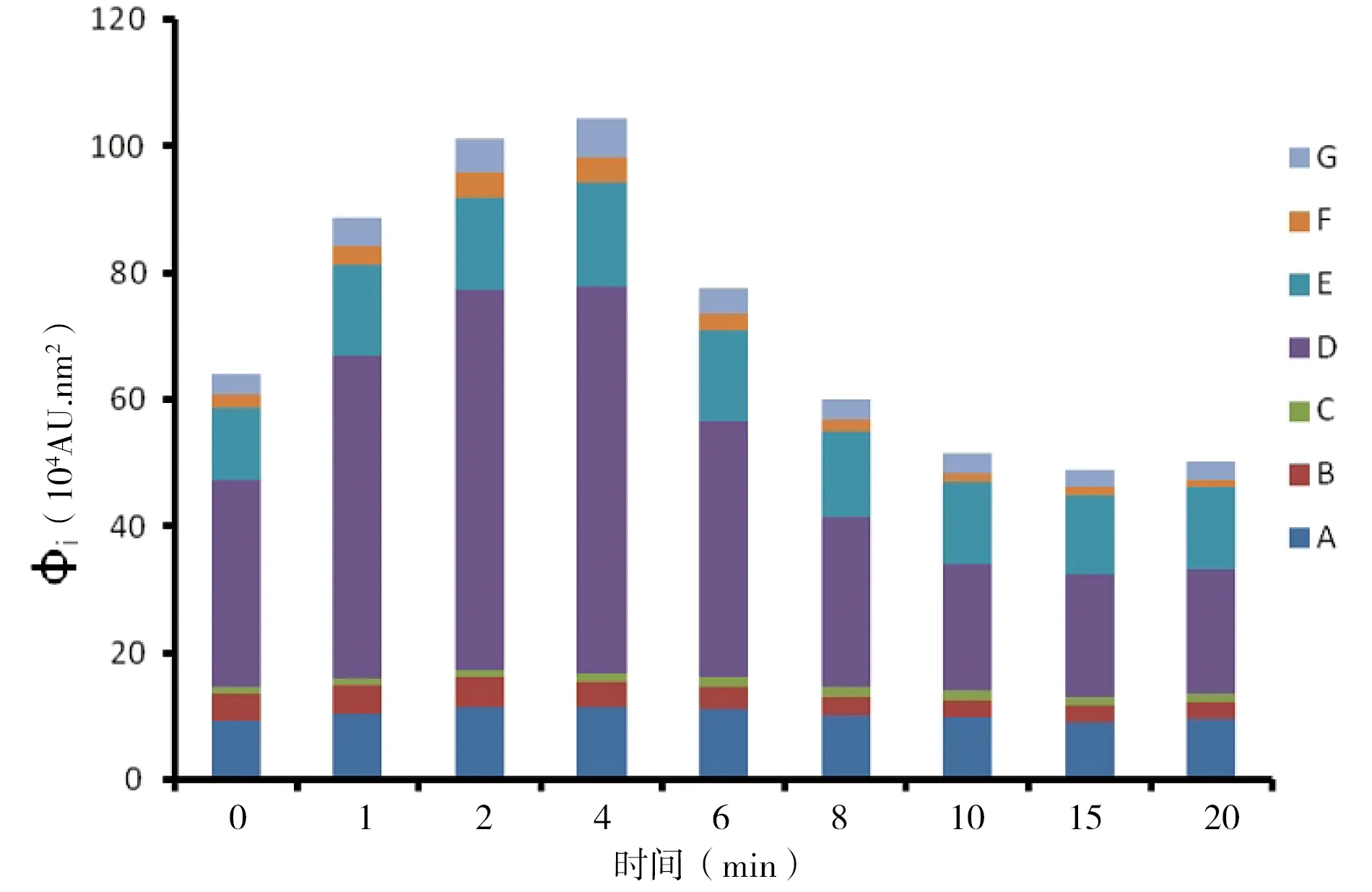
图5 荧光体积积分法(FRI)统计DBD处理前后藻细胞悬液各区域荧光强度变化(字母A~G代表的物质种类见表1)
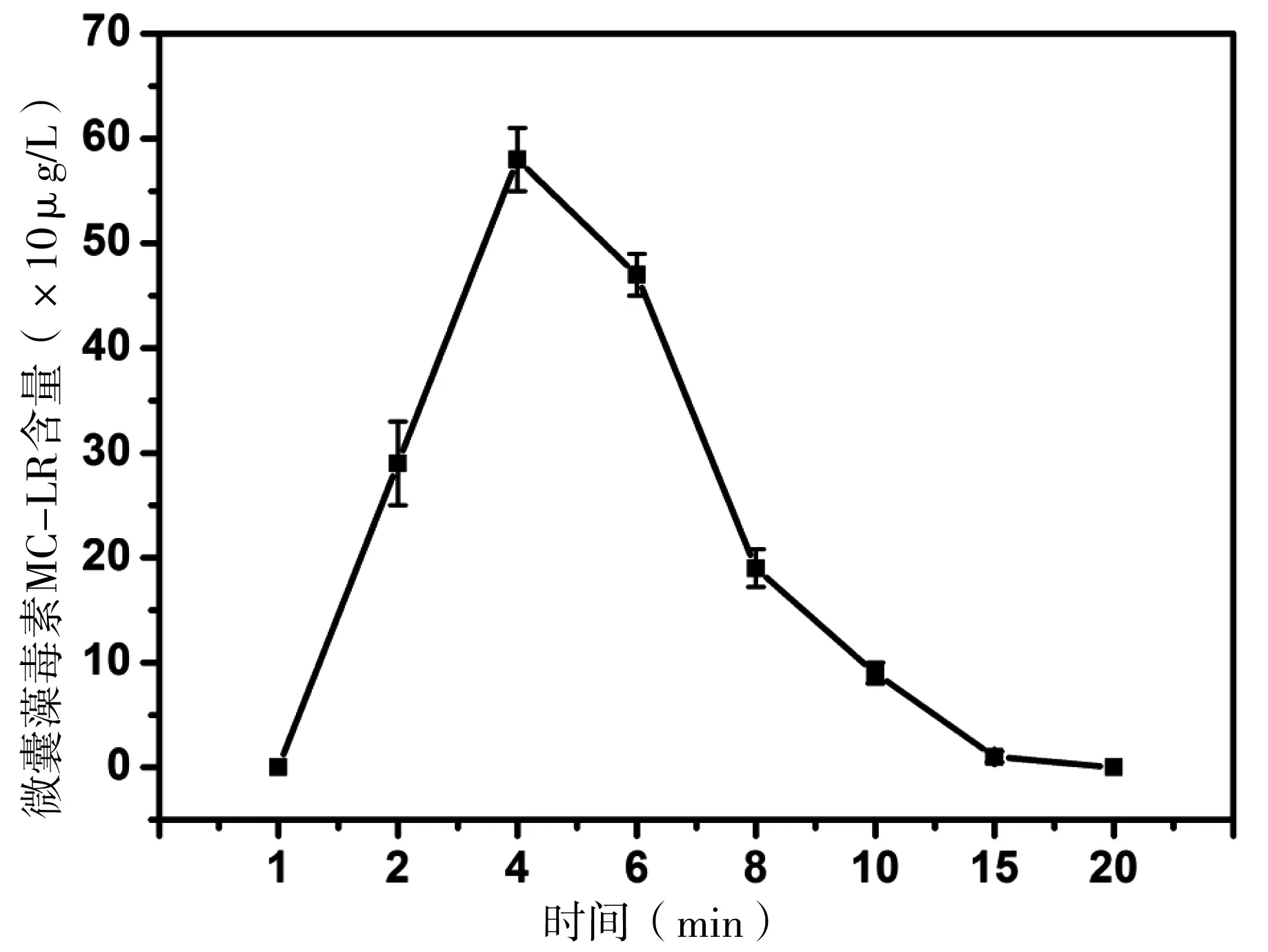
图6 介质阻挡放电处理藻液不同时间后藻毒素含量的变化
[1]ZHANG H, YU Z, HUANG Q, et al. Isolation, identification and characterization of phytoplankton-lytic bacterium CH-22 againstMicrocystisaeruginosa[J]. Limnologica - Ecology and Management of Inland Waters, 2011, 41(1): 70-77.
[2]TANG Y, ZHANG H, LIU X, et al. Flocculation of harmful algal blooms by modified attapulgite and its safety evaluation [J]. Water Res, 2011, 45(9): 2855-2862.
[3]LIU S, ZHAO Y, JIANG W, et al. Inactivation ofMicrocystisaeruginosaby electron beam irradiation [J]. Water, Air, &Soil Pollution, 2014, 225(9): 2093.
[4]ZHANG H, YANG L, YU Z, et al. Inactivation ofMicrocystisaeruginosaby DC glow discharge plasma: Impacts on cell integrity, pigment contents and microcystins degradation [J]. J Hazard Mater, 2014, 268: 33-42.
[5]LI L, ZHANG H, HUANG Q. New insight into the residual inactivation ofMicrocystisaeruginosaby dielectric barrier discharge [J]. Sci Rep, 2015, 5: 13683.
[6]李卫华, 盛国平, 王志刚,等. 废水生物处理反应器出水的三维荧光光谱解析[J]. 中国科学技术大学学报, 2008, 38(6): 601-608.
[7]孔 赟, 朱 亮, 吕梅乐, 等. 三维荧光光谱技术在水环境修复和废水处理中的应用 [J]. 生态环境学报, 2012,21(9): 1647-1654.
[8]ZIEGMANN M, ABERT M, MüLLER M, et al. Use of fluorescence fingerprints for the estimation of bloom formation and toxin production ofMicrocystisaeruginosa[J]. Water Res, 2010, 44(1): 195-204.
[9]谷依露, 高小峰, 李仁辉. 水华微囊藻(Microcystisflos-aquae)生长周期中腐殖酸的释放特性 [J]. 湖泊科学, 2015, 27(4): 623-628.
[10]刘菲菲, 冯慕华, 尚丽霞, 等. 温度对铜绿微囊藻(Microcystisaeruginosa)和鱼腥藻(Anabaenasp.)生长及胞外有机物产生的影响 [J]. 湖泊科学, 2014,26(5): 780-788.
[11]OU H, GAO N, DENG Y, et al. Mechanistic studies ofMicrocysticaeruginosainactivation and degradation by UV-C irradiation and chlorination with poly-synchronous analyses [J]. Desalination, 2011, 272(13): 107-119.
[12]DARTNELL L R, STORRIE-LOMBARDI M C, MULLINEAUX C W, et al. Degradation of cyanobacterial biosignatures by ionizing radiation [J]. Astrobiology, 2011, 11(10): 997-1016.
[13]ZHANG H, HUANG Q, KE Z, et al. Degradation of microcystin-LR in water by glow discharge plasma oxidation at the gas solution interface and its safety evaluation [J]. Water Res, 2012, 46(19): 6554-6562.
EEM fluorescence study of the degradation of Microcystis aeruginosa contents caused by dielectric barrier discharge plasma treatment
LI La-mei1, ZHANG Hong1, HUANG Qing1,2
(1. Institute of Technical Biology and Agriculture Engineering, Hefei Institutes of Physical Science, Chinese Academy of Sciences, Hefei 230031; 2. University of Science and Technology of China, Hefei 230026, China)
Harmful cyanobacterial blooms are now considered to be a common global environmental problem, and the frequency and intensity of cyanobacterial harmful algal blooms are so increasing that they have posed an imminent threat to drinking water sources. In this work, we reported our recent progress in dealing with the toxic and harmfulMicrocysticaeruginosausing dielectric barrier discharge (DBD) non-thermal plasma. We investigated the processes of both algal cellular damage and microcystin-LR (MC-LR) degradation caused by DBD treatment. The excitation-emission matrix (EEM) fluorescence spectroscopy combined with fluorescence regional integration technique (FRI) was employed to monitor the dynamic changes of algal cell inclusion substances including phycocyanin, chlorophyll and metabolites during the treatment, which provided the quantitative evaluation as also checked and confirmed by high performance liquid chromatography (HPLC). The results showed that algal cellular inclusions were first released into the extracellular environment, and then degraded gradually during the DBD treatment; in particular, the cyanobacterial toxin MC-LR released from algae cells during DBD treatment could eventually be completely degraded and removed. This work therefore not only demonstrates that nonthermal DBD plasma can effectively inactivate algae cells with simultaneous removal of microcystins, but also suggests that EEMs as a rapid real-time analysis method can be very useful for revealing the plasma-induced processes of algae cell damage and microcystin degradation as well as their underlying mechanisms.
dielectric barrier discharge (DBD); nonthermal plasma; excitation-emission matrix fluorescence spectroscopy;microcysticaeruginosa; microcystin; oxidation and degradation
2016-10-07;
2017-02-09
国家自然科学基金(No.11635013,No.11475217,No.21207137)
李腊梅,硕士,研究方向为生物物理
黄 青,博士,教授,研究方向为生物物理,E-mail: huangq@ipp.ac.cn
Q942
A
2095-1736(2017)02-0021-05
doi∶10.3969/j.issn.2095-1736.2017.02.021

