微藻育种研究进展
范 勇, 胡光荣, 王丽娟, 李福利
(中国科学院生物燃料重点实验室 青岛市单细胞油脂工程实验室中国科学院青岛生物能源与过程研究所, 青岛 266001)
微藻育种研究进展
范 勇, 胡光荣, 王丽娟, 李福利
(中国科学院生物燃料重点实验室 青岛市单细胞油脂工程实验室中国科学院青岛生物能源与过程研究所, 青岛 266001)
微藻是一种单细胞光合自养生物,作为初级生产者,在自然界中广泛存在。半个世纪以来,微藻已经应用于食品药品、可再生能源生产及生态环境保护等方面。为了得到性状更为优良的藻种,针对微藻育种的相关技术也在加速发展。微藻育种主要包括种质获取和表型检测两个方面,通过3种途径:自然选育,诱变育种和基因工程育种。随着产业开发的需要,多种先进的育种手段引入微藻育种中,包含CRISPR在内的多种基因编辑手段也逐步在微藻中进行了尝试。基于微藻光合系统,天然产物光谱和荧光标记等高通量筛选手段也帮助微藻育种的进一步发展。对上述微藻育种方案和技术路线进行综述,并对今后微藻育种的方向进行探讨。
微藻产业化;诱变育种;高通量筛选;光谱学分析
微藻是地球上最初级的生产者,能够进行光合作用释放氧气,在细胞形态上主要是单细胞或者简单的多细胞形式,在进化上包含有原核的蓝藻细胞,也有真核的绿藻,硅藻等。地球上约有5万种微藻种类[1],其分布广泛,生活环境多种多样,随着漫长的进化过程,微藻具有多样的形态和生理活性,甚至在一些极端环境中也有微藻的存在。因此,微藻资源是巨大的资源宝库,随着对微藻研究的逐步发展,微藻在各个领域均展现出广阔的应用前景[2]。例如,在农业领域微藻是重要的水产饵料和蛋白饲料[3]。多数微藻含有多糖、多不饱和脂肪酸、色素等生物活性成分,这些是目前天然保健食品的来源[4]。在逆境条件下,微藻可以积累中性脂,因此可以作为生物液体燃料的原料,在近几十年掀起了微藻生物能源研究开发的热潮[5]。微藻在水处理和生态修复方面也有着强大的功能[6-7]。另外以蓝藻为底盘生物可以设计合成“细胞工厂”,进行大宗化学品的合成,也取得了显著的进展[8]。微藻的生长速度快,不需要占用耕地,可以实现工业化管理,因此,微藻产业化的潜力巨大,前景广阔。但是,目前以微藻作为产品进行产业化发展,还存在诸多挑战,微藻作为农产品没有享受农业的政策;作为工业产品没有形成规模效应;作为保健食品,目前品种单一且市场竞争无序;作为生物能源其产量不足;作为动物饲料和水产活体饵料目前生产和配送成本过高(图1)。为了解决上述问题,在微藻产业培育的战略层面需要加强重视,期待国家出台对微藻产业的扶持政策,在基础研究方面,加强微藻藻种的育种工作技术创新。

图1 微藻产业化现状与技术挑战
目前的微藻育种主要集中在两个方面,一个是种质获取手段,一个是表型检测手段。种质获取手段:一方面在自然界中筛选以及通过代谢进化获得;另一方面,通过日益先进的技术手段对微藻进行诱变,在优良藻种的基础上进一步提升。另外,随着基因工程突飞猛进的发展,在微藻中实现稳定的遗传改造也在逐步地实现中[9-10]。表型检测手段:传统的检测手段不断地被先进稳定的仪器代替,例如,利用拉曼光谱、红外光谱和流式细胞技术等检测多种微藻中的目标代谢物。微流控技术近年来也被引入微藻细胞的分析和分选方法中来,大大提高了分析的精度[11-13]。另外,随着基因组学、蛋白组学和代谢组学的发展,从组学的数据发掘中能更有针对性地发现和鉴定突变,从而进一步揭示突变性状在分子水平的表达机理,为今后的遗传改造提供理论基础。

图2 微藻育种的研究方向
1 种质获取手段
自然界中微藻的获取主要来自不同环境中的藻种采集、分离、驯化。自然选择育种的育种周期长,且不确定性较大。但是在自然界筛选到的藻株,结合采样当地的地理和气候环境等因素,在进化和物质代谢方面具有较高的研究价值。在应用到生产的过程中,其产品在应用和推广过程中较容易被社会认可。目前,对自然界中进行的微藻筛选主要是对环境胁迫下具有顽强和特殊生存能力的微藻进行分析,在这个过程中常常也会发现具有高附加值产物的株系。Yuan等通过分析中国山东等地的微藻油脂情况,发现了一株微藻MychonastesaferHSO-3-1的脂肪酸组成中,神经酸含量明显高于已知的其他已知微藻的神经酸含量[14]。由于神经酸是一种具有高附加值的长链单不饱和脂肪酸(very long chain monounsaturated fatty acid, VLMFA),市场应用前景广泛,因此该藻获得了研究人员的重视,作为富含高附加值产品的产油微藻投入产业化的开发。
实现微藻产业化生产,其核心在于大规模、高效、低成本培养微藻以获得大量的生物质。目前,微藻的开发主要集中在单细胞微藻,但在室外规模培养时,由于敌害生物(主要是原生动物)对这些尺寸细小的单细胞微藻(通常直径在1~10 μm)的摄食常导致培养失败,而且单细胞微藻的采收困难且成本较高,因此,获得高产、易采收、抗污染能力强等具工业应用性状的藻种是微藻生物产业发展的关键问题之一。针对上述问题,汪辉等将藻种选育转移到以前未受关注的丝状微藻上[15],对国内外多株丝状微藻的性状进行评价,获得了一株高含油的淡水黄丝藻(Tribonema),其丝状体长达0.5~3 μm,利用40 L平板反应器培养21 d,细胞干重3.14 g/L、总脂含量为50.23%,其中中性脂(TAG)占总脂的80%。在不需要添加任何絮凝剂情况下,气浮法采收率达95.57%。同时,由于该藻丝体长,在室外经过长时间的规模化培养,未发现虫害现象,显示其良好的抗虫害特性。目前丝状微藻的规模化生产特性渐渐被人们重视,随后发现在丝状微藻Tribonemaminus中含有特殊ω-7不饱和脂肪酸,棕榈油酸(Palmitoleic acid,C16:1Δ9)[16],因此丝状微藻在易培养的优势下,还具有高附加值产品的生产潜力,除此之外,丝状微藻还可以合成多种色素,如角黄素(canthaxanthin)、虾青素(astaxanthin)等。基于以上特点,丝状微藻选育将是微藻产业化过程中的重要机遇。在目前的微藻育种中,从自然界中筛选微藻的方案虽然工作繁杂、难度较大,但是在自然环境还未被人类完全了解的今天,在自然界中不断地发掘和筛选藻种对开发新的藻种资源和研究藻类的进化具有重要的意义。
诱变育种是当前最主要的藻种获取手段,通过化学诱变以及物理诱变的方法对藻种的遗传过程进行干扰,造成藻种遗传信息的改变,在大样本量的群体中,通过快速的筛选手段得到需要的优良性状,这个过程随着筛选手段的不断丰富,逐渐成为主要的育种方案。诱变育种主要包括物理诱变和化学诱变两种形式,物理因素如各种射线、微波或激光等处理诱变材料,习惯上称之为辐射育种;化学因素是运用能导致遗传物质改变的一些诱变剂对样品进行处理。物理诱变剂主要有紫外线、X-射线、γ-射线、快中子、激光、微波、离子束等。化学诱变剂主要有烷化剂、天然碱基类似物、氯化锂、亚硝基化合物、叠氮化物、碱基类似物、抗生素、羟胺和吖啶等嵌入染料。国内外有大量的文献报道在微藻中使用诱变育种的方法提高了微藻的产业化价值。成本较低的类似于紫外辐照,甲基磺酸乙酯(ethyl methane sulfonate,EMS)和N-甲基-N-硝基-亚硝基胍(N-methyl-N-nitro-N-nitroso-guanidine,NTG)等,在多种微藻中(Phaeodactylumtricornutum,Pavlovalutheri,Nannochloropsisoculata,Haematococcuspluvialis,Schizochytriumsp.,Chlorellasorokiana,Scenedesmusobliquus,Isochrysisgalbana,Dunaliellasalina) 进行了诱变实验并获得很多优良的株系[17-24]。韩国研究人员使用不同剂量的伽马射线辐照不同微藻,获取淀粉和油脂含量突变的藻株[25-26],其中油脂含量提高了1.4倍。近年来重离子辐照(Heavy-ion irradiation),常压室温等离子体(Atmospheric room temperature plasma,ARTP)辐照技术也逐步应用于微藻的突变株获得,Ma等[27]利用重离子辐照对Nannochloropsis进行辐照,突变株的油脂含量较野生型提高了28%;Hu等[28]通过重离子辐照对Desmodesmussp.进行辐照,也获得了较野生型油脂含量显著提高的突变株系[28],Liu等[29]利用低温等离子对雨生红球藻进行诱变处理,并通过剂量、放电时间等参数的优化,获得了诸多高产虾青素的雨生红球藻突变株,其中最高单位虾青素产量是诱导前出发藻株近2倍[29]。各种突变手段在使用过程中各有特点,在一定的剂量和突变筛选方法配合下都可以筛选到阳性突变的株系。不同突变方法在选择上主要偏重的诱变方式需要具有对诱变物种的广谱性,诱变操作技术简单,对环境污染较小,对操作人员的安全有较高的保障。但诱变育种的方法对一些新的优良性状的发现存在盲区。对突变机理的不明确以及表型性状存在不稳定也会对生产造成一定的影响。
基因工程育种方法是目前很多课题组积极展开研究的方向(表1),目前在C.reinhardtii,P.tricornutum[30],C.kessleri[31],Nannochloropsis[32]和D.salina[33]中实现了遗传转化和表达,能够进行基因的沉默和敲除,对微藻进行基因工程的改造,需要对选择标记、载体以及转化方法进行更多的尝试。基因工程藻株具有较高的稳定性,且能够通过定向的改造获得较理想的突变株。在最新的报道中,使用CRISPR/Cas9这种由RNA指导的Cas9核酸酶对靶向基因进行编辑的技术已开始在微藻中实现精确的基因改造[34-35],Wang等[36]通过特定外源Cas9蛋白和指引RNA分子(guide RNA)的设计和共同表达,结合基于二代测序的高通量转化株鉴定方法,实现了对Nannochloropsis硝酸还原酶基因序列上5个碱基的精确删除,并筛选分离出与预测的表型和基因型均完全契合的基因组编辑突变藻株,在微藻中示范了基因组的精准编辑。这一基因组编辑技术的建立,使得对Nannochloropsis基因组上每个编码或非编码位点的功能鉴定成为可能。将来微藻转录组、蛋白质组及代谢组学数据的丰富会有助于微藻遗传改造策略的建立。另外一些针对植物和微藻的生物信息学平台也在逐步发展,例如 Algal Functional Annotation Tool[37],GreenCut2[38],AlgaGEM[39],Bag2D[40]和PredAlgo[41],这些平台在多种微藻的基因组水平上进行了大量的基因和蛋白功能的注释,为今后的微藻遗传改造提供了分析的基础。目前,利用基因工程技术进行的微藻育种在方法上已逐步成熟,但应用的微藻种类仍然有限,在许多微藻中尚无法实现稳定的遗传转化。随着遗传转化技术的发展,以及基因组测序费用的进一步降低,不同微藻数据库的丰富,微藻的基因工程育种将是一个有巨大的发展前景的方向。
2 表型检测手段
传统的表型检测手段一般主要包括对细胞形态、生长速率及耐受温度范围的描述,对于细胞内的油脂、蛋白及生物活性成分主要通过物理压榨,有机溶剂萃取等方法提取后进行分析。有机溶剂提取过程会用到不同熔点的有机溶剂进行分离,在高温下会对一些藻类活性物质产生影响,而且最终降低活性物质的得率。
常规微藻生理信息指标的检测耗时费力,无法满足快速和高通量的信息获取需要。当前在实际过程分析中仍多使用操作繁琐、费时费力的离线化学分析或色谱分析方法。近年来,光学传感器被越来越多地应用于生物制品的品质信息获取,其中红外光谱、拉曼光谱和核磁共振谱是最主要的3大无损分析技术。红外光谱分析(Infrared Spectra Analysis)是介于可见光和中红外之间的电磁辐射波,近红外光谱区与有机分子中含氢基团(O-H, C-H, N-H)振动的合频和各级倍频的吸收区一致。通过扫描样品的近红外光谱,得到样品中有机分子含氢基团的特征信息,并且采用化学计量学方法分析处理实验数据,可以对样品进行定性和(或)定量分析测定。目前在微藻的研究方面已有多个方向的应用,朱红艳等利用浸入式可见/近红外光谱技术对普通小球藻、蛋白核小球藻、微绿球藻、莱茵衣藻进行藻种鉴别,为藻种分类研究提供了新思路[51]。Hirschmugl等采用了傅里叶变换红外光谱技术来研究藻细胞的结构及其营养状况。这种方法无需对样品或者很少需要对样品进行预处理就可以提供藻类的生化细胞组成和营养状况[52]。近年来,利用红外光谱技术鉴别微藻中代谢物结构的研究越来越普遍。傅里叶变换红外光谱技术在分析藻类多糖的主要单糖组成、环状结构、半缩醛羟基构型及取代基类型方面效果显著[53]。薛松等[54]利用FTIR(Fourier transform infrared spectroscopy)对微藻生物质进行测定,以蛋白质酰胺I谱带作为内参比峰,计算油脂及多糖的相对含量。该方法实现了快速同时测定微藻细胞内油脂、蛋白质及多糖的相对含量。在微藻总脂含量测定方面,张敬建等[55]以斜生珊藻为实验对象,利用傅里叶变换红外光谱技术对该藻的细胞内油脂含量进行定量,并且与尼罗红荧光光谱法进行对比,为大规模筛选高油藻株及油脂积累过程奠定了基础。
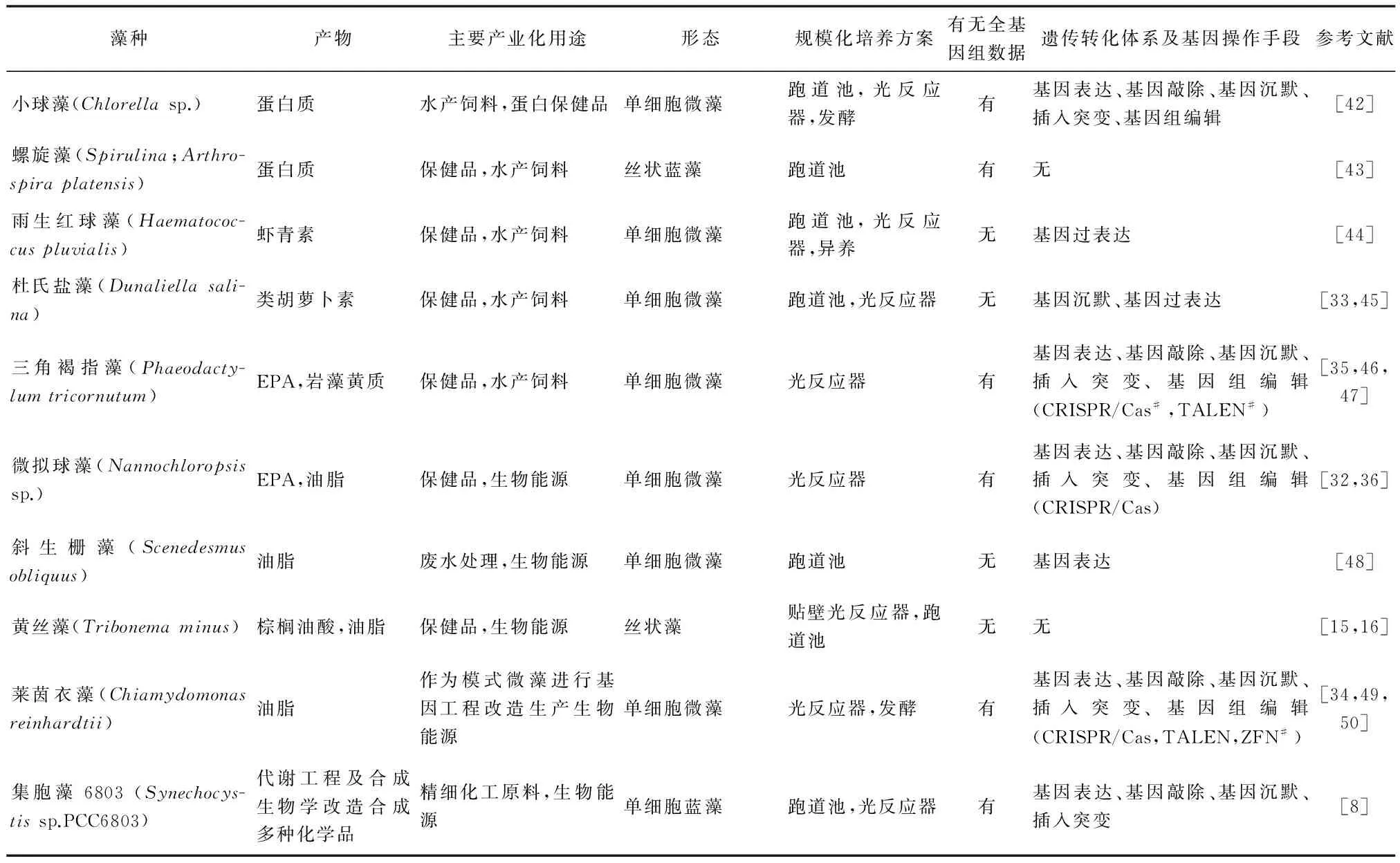
表1 具有代表性的产业化微藻产品、微藻培养方式及基因工程方法介绍
#CRISPR/Cas:成簇的规律间隔的短回文重复序列/核酸酶系统(clustered regularly interspaced short palindromic repeats);TALEN:转录激活子样效应因子核酸酶技术(transcription activator-like effector nuclease);ZFN:锌指核酸酶技术(zinc finger nuclease)
核磁共振(Nuclear magnetic resource, NMR)是一种通过检测原子核磁性的光学检测技术。NMR的检测原理是通过在磁性原子核吸收外加磁场中的射频脉冲然后产生相邻能级的跃迁,形成共振。技术早在20世纪70年代就已经开始用于食品科学研究。由于具有无损、高效、快速、样品需求少和谱峰重现性好等优点,因此越来越受到人们的关注。Guo等[56]利用时域核磁共振(Time-domain nuclear magnetic resonance,TD-NMR)的方法对微藻的油脂含量进行分析,比较了尼罗红染色方法检测油脂含量的准确度,使用TD-NMR的回归曲线R2=0.9973,远好于使用尼罗红染色的准确度(R2=0.9067),并且该方法可以做到对细胞的无损分析。Wang等[57]使用低场核磁共振(Low-filed NMR)建立了一种快速、准确的检测小球藻体内油脂含量的方法。最低检出限为0.002602 g(藻粉中)和0.3202 g/L(藻液中)。在1.12~8.97 g/L浓度范围的油水混合液中,具有较高的检测准确度(R2>0.99)。此外,该方法成功地用于在线监测微藻在异养发酵过程中脂质积累的动态过程。
拉曼光谱的产生原理是当单色光束的入射光子与分子相互作用时会产生非弹性碰撞。碰撞过程中光子改变运行方向,同时分子和光子之间发生能量交换,使得光子频率发生改变,从而发生拉曼散射。拉曼光谱从信号的角度和红外光谱是互补的。这是因为拉曼光谱是散射光谱,反映的是分子极化率变化,而红外光谱是吸收光谱,反映的是分子偶极距的变化。邵永妮等[58]利用激光共聚焦显微拉曼技术对2种不同藻种进行了鉴别研究,结果表明,激光共聚焦显微拉曼技术可以快速准确的将两个藻种鉴别出来;Collins等[59]利用共聚焦显微拉曼技术,研究了类胡萝卜素在雨生红球藻中的分布,同时研究也显示出拉曼显微技术在研究微藻细胞体内色素变化中的巨大价值。在微藻油脂的研究方面,Wu等[60]通过对4种藻14个克隆类型的共振拉曼光谱的差异进行分析,研究了微藻体内油脂含量的不饱和度;Samek等[61]通过拉曼光谱对Trachydiscusminutes,Chlamydomonassp.,Botryococcussudeticus3种微藻藻种的油脂不饱度进行计算发现,拉曼光谱技术得出的结果可以很好地与气相色谱结果相匹配,从而证明了拉曼光谱技术在微藻油脂检测方面的准确性。总而言之,利用光谱信息在微藻的表型检测手段方面已经进行了较多研究,光学传感器检测技术具有方便、快速、高效、准确、无需破坏样品、不消耗化学试剂和不污染环境等优点。目前的劣势主要是仪器维护费用较高,样品对应的数据库较匮乏。
针对微藻和植物,光谱方法还包含植物的光合系统的光谱信号。在藻类培养过程中,藻类的光合作用效率与二氧化碳浓度、光照强度、温度、营养元素等有密切关系,在培养过程中,检测其光合作用效率是一个极其重要的指标;在藻类的选育过程中,相同条件下光合效率的高低关系到微藻生长速率和生物质产量,是重要的筛选指标。
藻类叶绿素分子所吸收的光能有3种去处:1)驱动光合作用(光化学);2)以光的形式重新散发,即叶绿素荧光;3)以热的形式耗散。其中,只有叶绿素荧光是可以直接检测到的数据,根据叶绿素荧光的产量,可以间接计算出微藻的光化学效率和热耗散。虽然叶绿素荧光只占其吸收光的1%~2%,但很容易被检测。使用特定波长的光谱照射微藻细胞,然后在较长的波长范围内可以检测到叶绿素荧光的激发,实现对叶绿素荧光的定量分析[62]。叶绿素荧光分析可以告诉我们关于光合系统II(Photosynthetic system II,PSII)的信息,通过PSII的电子流向实际上反映了光合作用的整体速率,PSII也是光合系统中最容易受到光损伤的部位,对PSII的损伤是微藻细胞受到胁迫的第一个表现,Hu等[28]利用叶绿色荧光仪(Imaging-PAM)对诱变后的微藻进行高通量的筛选,基于最大光量子效率(Fv/Fm)对藻细胞在相同胁迫条件下进行筛选,筛选得到的突变株,其油脂产量同野生型比较显著提高。因此PSII的效率可以作为微藻高通量筛选高活性突变株的标准之一[28]。因此,叶绿素荧光包含丰富的光合作用信息,是快速、灵敏和无损伤的研究和测定逆境对植物光合作用的理想方法。
3 展望
以微藻为载体的产业链在国内正处在一个快速起步的阶段,随着社会上对螺旋藻、雨生红球藻虾青素、小球藻蛋白等微藻产品的逐步认可,各种微藻的研究和培养规模将会不断扩大。因此,在近10年内,在微藻育种领域,有无限的机遇等待着去发掘。目前,确定标准化的微藻育种评价手段和评价机制是近期需要藻类科研工作者思考的重要议题。将各种育种方法结合使用,取长补短,会更有利于微藻产业的发展。在微藻育种方面,吴迪等[63]提出了“数字微藻”的概念,该概念采用现代科学技术对微藻选育和生产全过程进行数字化信息获取、控制、管理和决策,其中微藻育种信息的快速准确获取是实现微藻产业生产与管理的基础和关键。与此相关的研究工作才刚刚起步,相信未来在微藻育种、养殖、收获和产品加工销售等环节,微藻数字信息快速获取将得到快速的发展。另外,在育种的同时,推广通用的中试验证平台,建立合理的评价平台,以及后期基于基因组测序以及DNA Barcoding技术,建立微藻藻种的专利保藏流程和藻种追溯鉴定技术,都是对微藻育种学科发展的重要保护,对微藻产业化的发展具有一定的保障作用。
[1]RICHMOND A, HU Q. Handbook of microalgal culture [M]. Wiley: Wiley Blackwell, 2013.
[2]邹 宁, 李 艳, 孙东红. 几种有经济价值的微藻及其应用 [J]. 鲁东大学学报(自然科学版), 2005, 21(1): 59-63.
[3]陈艳梅, 石 阳, 王明兹, 等. 海产养殖饵料微藻开发利用进展 [J]. 生物技术通报, 2015, 31(9): 60-65.
[4]MICHALAK I, CHOJNACKA K. Algae as production systems of bioactive compounds [J]. Engineering in Life Sciences, 2015, 15(2): 160-176.
[5]STEPHENS E, ROSS I L, MUSSGNUG J H, et al. Future prospects of microalgal biofuel production systems [J]. Trends in Plant Science, 2010, 15(10): 554-564.
[6]李攀荣, 邹长伟, 万金保, 等. 微藻在废水处理中的应用研究 [J]. 工业水处理, 2016, 36(5): 5-9.
[7]唐小红, 常 影, 黄 和, 等. 微藻在CO2生物捕集及废水生态修复领域的研究进展 [J]. 中国生物工程杂志, 2011, 31(9): 124-131.
[8]BERLA B M, SAHA R, IMMETHUN C M, et al. Synthetic biology of cyanobacteria: unique challenges and opportunities [J]. Frontiers in Microbiology, 2013, 4: 246.
[9]林根妹, 杨官品. 基因组编辑技术及其在微藻中的应用 [J]. 海洋科学, 2016, 40(4): 149-155.
[10]GUIHÉNEUF F, KHAN A, TRAN L S. Genetic engineering: a promising tool to engender physiological, biochemical, and molecular stress resilience in green microalgae [J]. Frontiers in Plant Science, 2016, 7: 400.
[11]KIM J Y, KWAK H S, SUNG Y J, et al. Microfluidic high-throughput selection of microalgal strains with superior photosynthetic productivity using competitive phototaxis [J]. Scientific Reports, 2016, 6:21155.
[12]KIM H S, GUZMAN A R, SOBAHI N, et al. High-throughput droplet-based screening system for investigating microalgae library[C]. IEEE, 2015:1-4.
[13]ZHANG P, REN L, ZHANG X, et al. Raman-activated cell sorting based on dielectrophoretic single-cell trap and release [J]. Analytical Chemistry, 2015, 87(4): 2282-2289.
[14]YUAN C, LIU J, FAN Y, et al. Mychonastes afer HSO-3-1 as a potential new source of biodiesel [J]. Biotechnology for Biofuels, 2011, 4(1): 47.
[15]ANG H, GAO L, CHEN L, et al. Integration process of biodiesel production fromfilamentousoleaginous microalgaeTribonemaminus[J]. Bioresource Technology, 2013, 142: 39-44.
[16]WANG H, GAO L, ZHOU W, et al. Growth and palmitoleic acid accumulation of filamentous oleaginous microalgaeTribonemaminusat varying temperatures and light regimes [J]. Bioprocess & Biosystems Engineering, 2016, 39(10): 1589-1595.
[17]CHATURVEDI R, FUJITA Y. Isolation of enhanced eicosapentaenoic acid producing mutants ofNannochloropsisoculataST-6 using ethyl methane sulfonate induced mutagenesis techniques and their characterization at mRNA transcript level [J]. Phycological Research, 2006, 54(3): 208-219.
[18]ANANDARAJAH K, MAHENDRAPERUMAL G, SOMMERFELD M, et al. Characterization of microalgaNannochloropsissp. mutants for improved production of biofuels [J]. Applied Energy, 2012, 96: 371-377.
[19]LIAN M, HUANG H, REN L, et al. Increase of docosahexaenoic acid production bySchizochytriumsp. through mutagenesis and enzyme assay [J]. Applied Biochemistry & Biotechnology, 2010, 162(4): 935-941.
[20]MEIRELES L A, GUEDES A C, MALCATA F X. Increase of the yields of eicosapentaenoic and docosahexaenoic acids by the microalgaPavlovalutherifollowing random mutagenesis [J]. Biotechnology & Bioengineering, 2003, 81(1): 50-55.
[21]SANDESH K B, VIDHYAVATHI R, SARADA R, et al. Enhancement of carotenoids by mutation and stress induced carotenogenic genes inHaematococcuspluvialismutants [J]. Bioresource Technology, 2008, 99(18): 8667-8673.
[22]VIGEOLAS H, DUBY F, KAYMAK E, et al. Isolation and partial characterization of mutants with elevated lipid content inChlorellasorokinianaandScenedesmusobliquus[J]. Journal of Biotechnology, 2012, 162(1): 3-12.
[23]HELD M, HUANG N S, JIANG D, et al. Characterization ofDunaliellasalinastrains by flow cytometry: a new approach to select carotenoid hyperproducing strains [J]. Electronic Journal of Biotechnology, 2008, 11(4): 5-6.
[24]BOUGARAN G, ROUXEL C, DUBOIS N, et al. Enhancement of neutral lipid productivity in the microalgaIsochrysisaffinisGalbana (T-Iso) by a mutation-selection procedure [J]. Biotechnology & Bioengineering, 2012, 109(11): 2737-2745.
[25]YOON M, CHOI J I, KIM G H, et al. Proteomic analysis ofSpirogyravariansmutant with high starch content and growth rate induced by gamma irradiation [J]. Bioprocess & Biosystems Engineering, 2013, 36(6): 765-774.
[26]CHOI J I, YOON M, JOE M, et al. Development of microalgaScenedesmusdimorphusmutant with higher lipid content by radiation breeding [J]. Bioprocess & Biosystems Engineering, 2014, 37(12): 2437-2444.
[27]MA Y, WANG Z, ZHU M, et al. Increased lipid productivity and TAG content inNannochloropsisby heavy-ion irradiation mutagenesis [J]. Bioresource Technology, 2013, 136: 360-367.
[28]HU G, FAN Y, ZHANG L, et al. Enhanced lipid productivity and photosynthesis efficiency in aDesmodesmussp. mutant induced by heavy carbon ions [J]. Plos One, 2013, 8(4): e60700.
[29]LIU J, CHEN J, CHEN Z, et al. Isolation and characterization of astaxanthin-hyperproducing mutants ofHaematococcuspluvialis(Chlorophyceae) produced by dielectric barrier discharge plasma [J]. Phycologia, 2016, 55(6): 650-658.
[30]BOWLER C, ALLEN A E, BADGER J H, et al. The phaeodactylum genome reveals the evolutionary history of diatom genomes [J]. Nature, 2008, 456(7219): 239-244.
[31]EL-SHEEKH M M. stable transformation of the intact cells ofChlorellakessleriwith high velocity microprojectiles [J]. Biologia Plantarum, 1999, 42(2): 209-216.
[32]VIELER A, WU G, TSAI C H, et al. Genome, functional gene annotation, and nuclear transformation of the heterokont oleaginous alga nannochloropsis oceanica CCMP1779 [J]. Plos Genetics, 2012, 8(11): e1003064.
[33]FENG S, XUE L, LIU H, et al. Improvement of efficiency of genetic transformation forDunaliellasalinaby glass beads method [J]. Molecular Biology Reports, 2009, 36(6): 1433-1439.
[34]SHIN S E, LIM J M, KOH H G, et al. CRISPR/Cas9-induced knockout and knock-in mutations inChlamydomonasreinhardtii[J]. Scientific Reports, 2016, 6: 27810
[35]NYMARK M, SHARMA A K, SPARSTAD T, et al. A CRISPR/Cas9 system adapted for gene editing in marine algae [J]. Scientific Reports, 2016, 6: 24951
[36]WANG Q, LU Y, XIN Y, et al. Genome editing of model oleaginous microalgaeNannochloropsisspp. by CRISPR/Cas9 [J]. Plant Journal, 2016, 88(6):1071-1081.
[37]LOPEZ D, CASERO D, COKUS S J, et al. Algal functional annotation tool: a web-based analysis suite to functionally interpret large gene lists using integrated annotation and expression data [J]. BMC Bioinformatics, 2011, 12:282.
[38]KARPOWICZ S J, PROCHNIK S E, GROSSMAN A R, et al. The GreenCut2 resource, a phylogenomically derived inventory of proteins specific to the plant lineage [J]. Journal of Biological Chemistry, 2011, 286: 21427-21439.
[39]DAL′MOLIN C G, QUEK L E, PALFREYMAN R W, et al. AlgaGEM-a genome-scale metabolic reconstruction of algae based on theChlamydomonasreinhardtiigenome [J]. Bmc Genomics, 2011, 12: S5.
[40]YAO L, TAN T W, NG Y K, et al. RNA-Seq transcriptomic analysis with Bag2D software identifies key pathways enhancing lipid yield in a high lipid-producing mutant of the non-model green algaDunaliellatertiolecta[J]. Biotechnology for Biofuels, 2015, 8(1): 191.
[41]TARDIF M, ATTEIA A, SPECHT M, et al. PredAlgo: a new subcellular localization prediction tool dedicated to green algae [J]. Molecular Biology & Evolution, 2012, 29(12): 3625-3629.
[42]GAO C F, WANG Y, SHEN Y, et al. Oil accumulation mechanisms of the oleaginous microalgaChlorellaprotothecoidesrevealed through its genome, transcriptomes, and proteomes [J]. BMC Genomics, 2014, 15: 582.
[43]HEINIS J J. Review of spirulina in human nutrition and health [J]. Journal of Agricultural & Food Information, 2010, 11(1): 59-60.
[44]STEINBRENNER J, SANDMANN G. transformation of the green AlgaHaematococcuspluvialiswith a phytoene desaturase for accelerated astaxanthin biosynthesis [J]. Applied & Environmental Microbiology, 2006, 72(12): 7477-7484.
[45]SUN G, ZHANG X, SUI Z, et al. Inhibition of pds gene expression via the RNA interference approach inDunaliellasalina(Chlorophyta) [J]. Marine Biotechnology, 2008, 10(3): 219-226.
[46]GE F, HUANG W, CHEN Z, et al. Methylcrotonyl-CoA carboxylase regulates triacylglycerol accumulation in the model diatomPhaeodactylumtricornutum[J]. Plant Cell, 2014, 26(4): 1681-1697.
[47]DABOUSSI F, LEDUC S, MARÉCHAL A, et al. Genome engineering empowers the diatomPhaeodactylumtricornutumfor biotechnology [J]. Nature Communications, 2014, 5(5): 3831.
[48]GUO S L, ZHAO X Q, TANG Y, et al. Establishment of an efficient genetic transformation system inScenedesmusobliquus[J]. Journal of Biotechnology, 2012, 163(1): 61-68.
[49]SIZOVA I, GREINER A, AWASTHI M, et al. Nuclear gene targeting inChlamydomonasusing engineered zinc-finger nucleases [J]. Plant Journal for Cell & Molecular Biology, 2013, 73(5): 873-882.
[50]GAO H, WRIGHT D A, LI T, et al. TALE activation of endogenous genes inChlamydomonasreinhardtii[J]. Algal Research, 2014, 5(4): 52-60.
[51]朱红艳, 邵咏妮, 蒋璐璐, 等. 浸入式可见/近红外光谱技术的藻种鉴别研究 [J]. 光谱学与光谱分析, 2016, 36(1): 75-79.
[52]HIRSCHMUGL C J, BAYARRI Z E, BUNTA M, et al. Analysis of the nutritional status of algae by Fourier transform infrared chemical imaging [J]. Infrared Physics & Technology, 2006, 49(1-2): 57-63.
[53]张赛金, 李文权, 邓永智, 等. 海洋微藻多糖的红外光谱分析初探 [J]. 厦门大学学报(自然科学版), 2005, 44: 212-214.
[54]薛 松, 孟迎迎, 姚长洪, 等. 一种傅里叶变换红外光谱测定微藻生物质组成的方法: CN103852440A[P]. 2014.
[55]张敬键, 吕雪娟, 李爱芬, 等. 微藻细胞油脂含量的快速检测方法 [J]. 中国生物工程杂志, 2012, 32(1): 64-72.
[56]GAO C, WEI X, ZHANG Y, et al. Rapid quantitation of lipid in microalgae by time-domain nuclear magnetic resonance [J]. Journal of Microbiological Methods, 2008, 75(3): 437-440.
[57]WANG T, LIU T, WANG Z, et al. A rapid and accurate quantification method for real-time dynamic analysis of cellular lipids during microalgal fermentation processes inChlorellaprotothecoideswith low field nuclear magnetic resonance [J]. Journal of Microbiological Methods, 2016, 124: 13-20.
[58]邵咏妮, 潘 健, 蒋璐璐, 等. 基于激光共聚焦显微拉曼技术的藻种鉴别研究 [J]. 光谱学与光谱分析, 2015, 35(7): 1908-1911.
[59]COLLINS A M, JONES H D, HAN D, et al. Carotenoid distribution in living cells ofHaematococcuspluvialis(Chlorophyceae) [J]. Plos One, 2011, 6(6): e24302.
[60]WU Q, NELSON W H, HARGRAVES P, et al. Differentiation of algae clones on the basis of resonance Raman spectra excited by visible light [J]. Analytical Chemistry, 1998, 70(9): 1782-1787.
[61]SAMEK O, ZEMNEK P, JONA, et al. Characterization of oil-producing microalgae using Raman spectroscopy [J]. Laser Physics Letters, 2011, 8(10): 701-709.
[62]MAXWELL K, JOHNSON G N. Chlorophyll fluorescence-a practical guide [J]. Journal of Experimental Botany, 2000, 51(345): 659-668.
[63]吴 迪. 微藻综合品质信息快速无损获取技术和方法研究 [D]. 杭州:浙江大学, 2011.
Research progress on microalgae breeding
FAN Yong, HU Guang-rong, WANG Li-juan, LI Fu-li
(Key Laboratory of Biofuels, Chinese Acadeing of Sciences, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Aeademy of Sciences(QIBEBT-CAS), Qingdao 266001, China)
Microalgae is a unicellular photosynthetic autotrophic organism that widely distributes in nature as a primary producer. For half a century, microalgae has been used in food and medicine, renewable energy production, environmental protection and so on. In order to improve productivity or robustness, microalgae breeding technology has been developed significantly. The breeding of microalgae mainly includes two aspects: mutant acquisition and phenotypic detection. The mutants can be obtained through three ways: natural breeding, mutation breeding, and genetic engineering breeding. A variety of advanced breeding methods, including gene editing method CRISPR, have been gradually adopted in microalgae. High-throughput screening based on microalgae photosynthetic system, natural product spectra, and fluorescent labelling greatly facilitate the development of microalgae breeding. In this paper, microalgae breeding technologies are reviewed, and the future direction of microalgae breeding is discussed.
microalgae industrialization; mutation breeding; high throughput screening; spectroscopic analysis
2016-10-08;
2017-02-20
国家自然科学基金—大科学装置联合基金(U1232126);国家自然基金—青年科学基金项目(31602154);国家高科技研究发展计划(863计划,2014AA022003)
范 勇,助理研究员,研究方向为微藻生理生化,E-mail:fanyong@qibebt.ac.cn
李福利,研究员,研究方向为微生物生理生化,E-mail:lifil@qibebt.ac.cn
S968.4;Q949.2
A
2095-1736(2017)02-0003-06
doi∶10.3969/j.issn.2095-1736.2017.02.003

