激活脊髓小电导钙离子激活钾通道可抑制小鼠吗啡痛觉过敏
朱骏生,章功良,杜 雷,姬宁宁,黄思婷,张咏梅,花 嵘,3
(1.徐州医科大学江苏省麻醉学重点实验室,江苏省麻醉与镇痛应用技术重点实验室,江苏 徐州 221002;2.安徽医科大学基础医学院,安徽 合肥 230032;3.徐州医科大学附属医院急救中心,江苏 徐州 221002)
激活脊髓小电导钙离子激活钾通道可抑制小鼠吗啡痛觉过敏
朱骏生1,章功良2,杜 雷1,姬宁宁1,黄思婷1,张咏梅1,花 嵘1,3
(1.徐州医科大学江苏省麻醉学重点实验室,江苏省麻醉与镇痛应用技术重点实验室,江苏 徐州 221002;2.安徽医科大学基础医学院,安徽 合肥 230032;3.徐州医科大学附属医院急救中心,江苏 徐州 221002)
SK通道;1-EBIO;吗啡;痛觉过敏;脊髓;小鼠
吗啡作为临床上有效治疗剧烈疼痛的阿片类药物,由于长期使用带来的副作用如耐受现象、痛觉过敏等降低了其镇痛效应,限制了其临床使用,因此,研究吗啡所致痛觉过敏的机制具有重要的临床意义。吗啡所致痛觉过敏不同于它的耐受作用,更与它的镇痛作用相矛盾,表现为伤害性感受的阈值低于正常[1]。目前认为吗啡痛觉过敏的可能机制主要包括初级传入神经元的敏化、NMDA受体活化引起的脊髓水平突触可塑性的改变以及脊髓上水平对脊髓背角的下行易化作用的加强[2]。
钙离子激活钾通道是一种依赖细胞内钙离子浓度升高而激活的钾通道。可根据其电导率的大小分为大电导钙离子激活钾通道(large conductance Ca2+-activated K+channels,BK通道)、中电导钙离子激活钾通道(intermediate conductance Ca2+-activated K+channels,IK通道)、小电导钙离子激活钾通道(small conductance Ca2+-activated K+channels,SK通道)3种[3]。SK通道广泛分布于哺乳动物的神经系统中, SK通道又可以根据其基因编码(KCNN1、KCNN2和KCNN3)产物分成SK1、SK2、SK3三个亚型。每个有功能的SK通道都是1个四聚体,每个亚基都包含6个跨膜结构域和1个P环。胞内区有C末端和N末端,C末端有着钙调素(CaM)结合位点,胞内Ca2+结合CaM,引起SK通道构象发生改变,通道开放,钾离子外流[4]。胞内区N末端的蛋白激酶CK2和C末端的蛋白磷酸化酶PP2A均可以调节通道对Ca2+的敏感性[5]。以往研究表明,SK通道参与癫痫样活动、学习记忆过程、情绪障碍以及精神分裂症,并在疼痛中发挥着重要作用[6],然而,SK通道是否参与吗啡痛敏的形成尚未见相关报道。
本实验针对吗啡痛觉过敏,通过鞘内给药,观察SK通道在脊髓水平被激动剂1-EBIO激活后的吗啡痛敏小鼠痛阈的改变,为深入研究SK通道在疼痛中的作用以及吗啡痛觉过敏的具体机制提供了实验依据。
1 材料与方法
1.1 实验动物 ♂ C57BL6/N小鼠48只,体质量20 g~25 g,由徐州医学院实验动物中心提供[许可证号:SYXK(苏)2015-0030]。小鼠置于昼夜(12/12 h)节律光照条件下,自由进食饮水,室温(23±1)℃,所有小鼠实验前静养1周。
1.2 实验分组 吗啡痛敏模型建立小鼠随机分为4组,每组8只。生理盐水对照(Control)组:0.9% NS(5 mL·kg-1)皮下注射;吗啡(Morphine)组:吗啡(5 mg·kg-1)皮下注射;溶剂(Vehicle)组:1% DMSO(5 μL每只)鞘内注射;和给药(1-EBIO)组:25 μg 1-EBIO(5 μL每只)鞘内注射。鞘内注射方法:左手掌心压住鼠身,拇指中指按压骶骨两侧固定,食指按在两侧骶骨前缘连线正中点皮肤上(可触知棘突)指示进针位点,右手持10 μL微量注射器与水平成30度角于棘突间隙进针,针尖进入棘突与横突间组织后将针压低后缓慢推进,以鼠尾出现突然侧向运动为成功标志,注射5 μL,时间约5 s,然后缓慢拔出。进针深度约4 mm,针头斜面向下。d 1对小鼠进行内脏痛阈值、甩尾阈值和机械性缩足阈值基础值的测定,此后连续给药6 d,每天均需测定甩尾阈值和机械性缩足阈值,在d 7,还需进行内脏痛阈值的测定,且对d 7的内脏痛阈进行AWR评分。以上各组动物平均体重差异无统计学意义。
1.3 仪器及药品 恒温水浴箱购自上海精宏实验设备有限公司。盐酸吗啡注射液购自东北制药集团沈阳第一制药有限公司。1-EBIO购自Tocris公司(Cat.No.1041)。DMSO购自Sigma公司。Anti-KCa2.2(SK2)购自Alomone labs公司(Cat #: APC-028)。
1.4 动物模型 吗啡痛觉过敏模型的制备。20 g~25 g ♂ C57小鼠皮下注射吗啡,5 mg·kg-1(5 mL·kg-1),每天两次,上午8 ∶00,下午6 ∶00,连续注射6 d[7]。
1.5 小鼠疼痛行为学测定
1.5.1 机械性缩足阈值(MWT)测定 将一有机玻璃箱(5 cm×5 cm×10 cm)置于金属筛网上,小鼠放置于玻璃箱中,待小鼠在有机玻璃箱中适应30 min后,用Von-Frey纤维丝垂直刺激小鼠后肢足底中部,持续时间≤5 s,小鼠出现抬足或跑开行为视为阳性反应(以“×”记录),否则为阴性反应(以“O”记录)。测定首先从1.0 g开始,当该力度的刺激不能引起阳性反应,则给予相邻大一级力度的刺激;如出现阳性反应则记录为给予相邻小一级力度的刺激,如此连续进行,直至出现第1次阳性和阴性反应的交叉,再连续测定4次。每次刺激间隔30 s以上,以此向下推算小鼠50%缩足阈值[8]。
50% g threshold=[10(Xf+κδ)]/10 000
Xf=最后一次用的Von-Frey 细丝的数值(以log单位记),κ值查表可得[8],δ=0.224。
1.5.2 热甩尾潜伏期(TWL)测定 设定恒温水浴箱温度,48℃(可根据实际情况调节,使正常小鼠平均甩尾时间控制在10~15 s)。将鼠尾后2/3浸入水中,同时开始计时。当小鼠开始甩尾时立即停止计时,记录用时即为甩尾潜伏期(tail withdrawal latency, TWL)。设置切断时间为25 s,以免烫伤鼠尾。每只小鼠重复测定3次,计算平均值。
1.5.3 内脏痛阈(AWR评分)测定 自制结直肠扩张球囊(简称球囊):一次性保鲜袋用塑封机制成长2 cm,直径0.8 cm,一端封闭的圆柱形球囊,输液导管插入球囊中,导管与开口端用丝线结扎,确保密封不漏气。测量时将球囊插入小鼠肛门,深度为球囊结扎线距肛门括约肌大约0.5 cm处,用胶带轻轻将外端导管固定在小鼠尾巴上,以防球囊在实验过程中滑出。导管通过三通管一端与血压计相连,一端连接注射器。小鼠在实验前12 h禁食不禁水。将小鼠放置在20 cm×6 cm×8 cm的有机玻璃箱内观察,约30 min小鼠完全适应后开始实验。CRD分别采用10 mmHg~70 mmHg,间隔10 mmHg共7个压力,每次扩张持续20 s,刺激间隔4 min,取3次评分的均值。
AWR的评分标准为:无明显行为变化,0分;仅有简单的头部运动,1分;腹部肌肉开始收缩,但腹肌未抬离桌面,2分;腹肌明显收缩变平或下腹壁抬离桌面,3分;腹壁拱起或伴身体、骨盆躬起,4分。
AWR方法测定痛阈值:球囊放置等过程同前,通过注射器持续、缓慢加压,每10 mmHg为一压力梯度,每个压力持续20 s,间隔4 min,以肉眼观察出现明显的下腹壁抬离箱底或明显收缩变平(即AWR 3分)时的最小压力值为痛反应阈。扩张压力范围在10 mmHg~80 mmHg之间;每只小鼠重复3次,取平均值。
1.6 Western blot 行为学测试结束后,10%水合氯醛3 mL·kg-1腹腔注射对小鼠进行麻醉后,断头,取脊髓腰膨大(L4~L5)。将取出的脊髓放入预冷的裂解液中,在冰上使用电动匀浆机进行匀浆,每个样本匀浆4次,每次10 s,间隔10 s冷却,充分裂解后离心。BCA法对裂解后的蛋白浓度进行定量,随后加入5×上样缓冲液(总体积1/4),放入沸水中煮沸5 min促进蛋白变性。配置10%或者12%的胶进行恒压电泳,电压设置为:浓缩胶70 V 35 min,分离胶110 V 90~120 min。电泳结束后,采用PVDF膜冰上进行恒压转膜,100 V 75 min。3% BSA封闭2 h后,4°冰箱孵育一抗过夜:Anti-SK2(1 ∶1 000,Alomone公司,以色列),GAPDH(1 ∶2 000,Bioworld公司,中国)。Washing-buffer清洗3次后孵育碱性磷酸酶二抗羊抗兔或鼠(1 ∶2 000,Abcam公司,英国)2 h,Washing buffer清洗3次,显色,采用Image J软件进行灰度值分析。
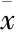
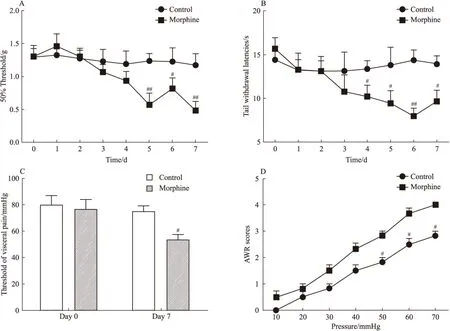
Fig 1 Effects of intrathecal administration of morphine on threshold of mechanical, thermal and visceral pain in mice
(A)(B)(C)(D)the changes of mechanical withdrawal threshold(MWT), tail withdrawal latency(TWL), threshold of visceral pain and AWR score, respectively,1 mmHg=0.133 kPa.#P<0.05,##P<0.01vscontrol group
2 结果
2.1 长期注射吗啡对小鼠痛阈的影响 与NS组相比,小鼠给予吗啡后,出现机械缩足阈值,热甩尾潜伏期,内脏痛阈的降低(Fig 1,P<0.05,P<0.01)。以上结果表明长期使用吗啡,不但可以引起机械和热痛觉过敏,而且能引起内脏痛觉过敏。
2.2 鞘内注射1-EBIO对吗啡痛敏小鼠痛阈的影响 鞘内注射SK通道激活剂1-EBIO每只25 μg(溶于5 μL 1% DMSO),20 min后,小鼠活动被明显抑制,与溶剂组和自身给药前相比,小鼠痛阈明显提高(Fig 2,P<0.05)。以上结果表明1-EBIO可以有效地减轻吗啡引起的痛觉过敏。
2.3 吗啡痛觉过敏模型小鼠脊髓SK2通道表达水平的变化 造模d 7筛选出造模成功的小鼠,取脊髓腰膨大(L4~5节段),发现吗啡模型组小鼠的脊髓SK2膜蛋白表达量较对照组明显降低(Fig 3,P<0.05)。1-EBIO给药后1 h内,脊髓SK2膜蛋白表达量明显升高(Fig 3,P<0.05)。
3 讨论
本实验结果表明:持续低剂量的给予小鼠皮下注射吗啡,可以诱发小鼠机械痛、热痛和内脏痛等痛觉过敏现象,且脊髓SK2通道蛋白表达降低;鞘内注射SK通道激动剂1-EBIO后,可阻断机械痛、热痛和内脏痛敏,且脊髓SK2通道蛋白表达也较吗啡组增高,表明脊髓SK通道参与吗啡痛敏的形成,SK2通道活化可阻断痛敏形成。
吗啡等作用于阿片受体的麻醉性镇痛药所具有的强效镇痛作用,仍是其他镇痛药物所无法比拟和取代的,用于治疗晚期癌症所诱发的慢性重度疼痛和大型手术(如截肢、开胸、器官移植等)所致的剧烈疼痛。然而,长期或不正确地使用吗啡等阿片类药物,会引起中枢神经系统发生适应性改变,从而诱发患者对吗啡的耐受性、痛觉过敏等不良反应。这些不良反应会进一步加重患者的痛苦,严重降低患者的生活质量[9]。然而,关于吗啡所致痛敏的机制并不清楚。
Fig 2 Effects of SK channel agonist 1-EBIO intrathecally on morphine-induced hyperalgesia in mice
(A)(B)(C)The changes of mechanical withdrawal threshold(MWT), tail withdrawal latency(TWL),and the threshold of visceral pain, respectively, 1 mmHg=0.133 kPa.#P<0.05vsbefore drug
SK通道是K+选择性、电压非依赖性、通过细胞内Ca2+浓度升高而激活的一种钾通道,其介导的K+电流是形成神经元动作电位中间后超极化(medium-after hyperpolarization, mAHP)的重要机制。SK通道在动作电位后超极化的作用决定了它是细胞兴奋性的重要调节因子,因此有可能通过改变神经元的兴奋性而参与吗啡痛觉敏化的形成。在体和离体实验研究表明,SK通道在伤害性刺激感觉通路中发挥重要功能,如在外周水平,背根神经节中的SK通道在疼痛中发挥重要作用,并受到NMDA受体的调节[10],而在中枢脊髓水平,给予SK通道激动剂1-EBIO可以减少NMDA受体拮抗剂用于镇痛的剂量[11-12]。

Fig 3 Expressions of spinal membrane SK2 in mice
*P<0.05vscontrol group;#P<0.05vsvehicle group
SK通道在脊髓表达比较丰富,其中SK1和SK3广泛分布在脊髓灰质,包括运动神经元的Ⅷ和Ⅸ板层,而SK2则主要集中在脊髓背角,尤其是Ⅰ、Ⅱ板层[13]。我们选择跟痛觉传递关系密切的脊髓背角作为研究对象,探究脊髓背角在吗啡痛觉过敏形成后SK2蛋白含量表达有所下降,给予1-EBIO后,其表达量升高,同时阻断了机械痛、热痛和内脏痛等痛敏的形成,表现为痛阈升高。以上结果表明,脊髓SK通道激活后,通过改变膜电位的产生,降低脊髓神经元兴奋性,从而影响痛觉的形成。
综上所述,SK2通道在吗啡所致痛敏的形成中发挥了重要的调控作用,其作用可能与改变脊髓痛觉传导神经元的兴奋性,进而影响中枢敏化的形成有关,但具体机制还有待进一步研究,本研究将为临床吗啡镇痛及预防吗啡副作用等提供新的思路和理论依据。
[1] Juni A, Klein G, Kest B. Morphine hyperalgesia in mice is unrelated to opioid activity, analgesia, or tolerance:Evidence for multiple diverse hyperalgesic systems[J].BrainRes, 2006, 1070(1):35-44.
[2] Eisenberg E, Suzan E, Pud D. Opioid-induced hyperalgesia (OIH): A real clinical problem or just an experimental phenomenon?[J]JPainSymptManag, 2015, 49(3):632-6.
[4] Faber E S. Functions and modulation of neuronal SK channels[J].CellBiochemBiophys, 2009, 55(3):127-39.
[5] Adelman J P, Maylie J, Sah P. Small-conductance Ca2+-activated K+channels: form and function[J].Physiology, 2012, 74(74):866-78.
[6] Blank T, Nijholt I, Kye M J, et al. Small conductance Ca2+-activated K+channels as targets of CNS drug development[J].CurrDrugTargCnsNeurolDisord, 2004, 3(3):161-7.
[7] Elhabazi K, Ayachi S, Ilien B, et al. Assessment of morphine-induced hyperalgesia and analgesic tolerance in mice using thermal and mechanical nociceptive modalities[J].Jove, 2014, 29(89):e51264.
[8] Chaplan S R, Bach F W, Pogrel J W, et al. Quantitative assessment of tactile allodynia in the rat paw[J].NeurosciMethods, 1994, 53(1):55-63.
[9] 吴 县,江 勤, 庞 刚,等. 5-羟色胺5-HT2C受体激动剂抑制吗啡依赖小鼠纳洛酮诱导的戒断行为[J]. 中国药理学通报, 2015, 31(4):518-23.
[9] Wu X, Jiang Q, Pang G, et al. Agonist of serotonin 5-HT(2C) receptor suppresses naloxone-precipitated withdrawal symptoms in morphine-dependent mice[J].ChinPharmacolBull, 2015, 31(4):518-23.
[10]Pagadala P, Park C K, Bang S, et al. Loss of NR1 subunit of NMDARs in primary sensory neurons leads to hyperexcitability and pain hypersensitivity: involvement of Ca2+-activated small conductance potassium channels[J].JNeurosci, 2013, 33(33):13425-30.
[11]Hipólito L, Fakira A K, Cabaero D, et al.Invivoactivation of the SK channel in the spinal cord reduces the NMDA receptor antagonist dose needed to produce antinociception in an inflammatory pain model[J].Pain, 2015, 156(5):849-58.
[12]Bahia P K, Suzuki R, Benton D C, et al. A functional role for small-conductance calcium-activated potassium channels in sensory pathways including nociceptive processes[J].JNeurosci, 2005, 25(14):3489-98.
[13]Mongan L C, Hill M J, Chen M X, et al. The distribution of small and intermediate conductance calcium-activated potassium channels in the rat sensory nervous system[J].Neuroscience, 2005, 131(1):161-75.
Activation of small conductance Ca2+activated K+channel in spinal cord could inhibit morphine-induced hyperalgesia in mice
ZHU Jun-sheng1, ZHANG Gong-liang2, DU Lei1, JI Ning-ning1,HUANG Si-ting1,ZHANG Yong-mei1, HUA Rong1,3
(1.JiangsuProvinceKeyLaboratoryofAnesthesiology,CollegeofAnesthesiology,XuzhouMedicalCollege,XuzhouJiangsu221002,China; 2.SchoolofBasicMedicalSciences,AnhuiMedicalUniversity,Hefei230032,China; 3.EmergencyCenteroftheAffiliatedHospitalofXuzhouMedicalUniversity,XuzhouJiangsu221002,China)
Aim To explore the effect of activated SK channels(small conductance Ca2+-activated K+channels) on morphine-induced hyperalgesia in the spinal cord in mice.Methods Adult C57BL6/N male mice were chosen to establish the model of morphine-hyperalgesia. The changes of tail withdrawal latency(TWL), mechanical withdrawal threshold(MWT) and the threshold of visceral pain were observed after intrathecal 1-EBIO, the agonist of SK channels.Results Compared with the control group, TWL, MWT and the threshold of visceral pain were decreased after morphine injection. After intrathecal 1-EBIO, the TWL, MWT and visceral pain threshold were increased. The level of spinal membrane SK2 expression in morphine-treated mice was decreased compared with that of control group. After intrathecal 1-EBIO, the level of spinal membrane SK2 expression was increased.Conclusion SK channels in the spinal cord are involved in morphine-induced hyperalgesia in mice.
SK channels;1-EBIO; morphine;hyperalgesia; spinal; mice
时间:2017-3-13 8:38
http://kns.cnki.net/kcms/detail/34.1086.R.20170324.1247.038.html
2016-12-10,
2017-01-20
国家自然科学基金资助(No 81171041,81271217);江苏省高校自然科学基金重点项目资助(No 13KJA320001);江苏省自然科学基金资助(No BK20161171);江苏省普通高校研究生科研创新计划项目资助(No KYLX16_1139)
朱骏生(1990-),男,硕士生,研究方向:疼痛信号转导及其调控,E-mail: zhujs1990@163.com; 张咏梅(1970 -),女,博士,教授,博士生导师,研究方向:疼痛信号转导及其调控,通讯作者,E-mail:zhangym700@163.com 花 嵘(1969-),男,博士,主任医师,硕士生导师,研究方向:创伤并发症的免疫调节治疗,疼痛信号转导及其调控,通讯作者,E-mail: ilovezq@yeah.net
10.3969/j.issn.1001-1978.2017.04.019
A
1001-1978(2017)04-0547-05
R-322;R322.81;R348.1;R441.1;R741.041;R971.2摘要:目的 探究脊髓小电导钙离子激活钾通道(small conductance Ca2+-activated K+channels,SK通道)激活后对小鼠吗啡所致痛觉过敏的影响。方法 选用♂ C57BL6/N小鼠,建立吗啡痛觉过敏模型,鞘内注射SK通道激活剂1-EBIO后,测量小鼠热甩尾潜伏期(tail withdrawal latency,TWL),机械缩足阈值(mechanical withdrawal threshold,MWT)和内脏痛阈的变化。结果 吗啡痛觉过敏模型小鼠与生理盐水对照组小鼠相比,热甩尾潜伏期、机械缩足阈值和内脏痛阈均降低;而鞘内注射SK通道激活剂1-EBIO后,与给药前相比,小鼠的痛阈热甩尾潜伏期,机械缩足阈值和内脏痛阈均升高;吗啡模型组小鼠的脊髓SK2膜蛋白表达量较对照组明显降低,而给予1-EBIO后,脊髓SK2膜蛋白表达量较模型组明显升高。结论 脊髓SK通道参与小鼠吗啡引起的痛觉过敏。

