高脂血症与Aβ的协同作用促进引发阿尔茨海默症
侯江淇,张 欣,龙 倩,楚世峰,郭 蕾,贺文彬,3,张俊龙,陈乃宏
(1.山东中医药大学中医学院,山东 济南 250355;2.山西中医学院基础医学院,山西 太原 030619;3.中国医学科学院,药物研究所 & 神经科学中心,北京 100500;4.湖南中医药大学药学院,湖南 长沙 410208)
高脂血症与Aβ的协同作用促进引发阿尔茨海默症
侯江淇1,2,张 欣2,龙 倩2,楚世峰3,4,郭 蕾2,贺文彬2,3,张俊龙1,2,陈乃宏3,4
(1.山东中医药大学中医学院,山东 济南 250355;2.山西中医学院基础医学院,山西 太原 030619;3.中国医学科学院,药物研究所 & 神经科学中心,北京 100500;4.湖南中医药大学药学院,湖南 长沙 410208)
目的 探讨高脂血症与β样淀粉蛋白(amyloid-beta peptides,Aβ)在衰老大鼠发生阿尔茨海默病(Alzheimer′s disease, AD)时的相互作用及病理变化。方法 70只♂ SD大鼠按体重随机分为7组,除sham组及Aβ25-35、HLD组外,其余大鼠均给予皮下注射D-半乳糖(D-gal)6周,制备衰老模型;在此基础上给予高脂饲料,制备高脂血症模型,以及双侧海马CA1区定位注射凝聚态Aβ25-35构建衰老期高脂血症伴发AD的复合模型。采用Morris水迷宫、尼氏染色、Western blot、免疫组织化学染色等方法,观察高脂血症对老年AD大鼠学习记忆、海马神经元凋亡以及tau蛋白过度磷酸化特异性位点改变的影响。结果 在Morris水迷宫实验中,与sham组相比,Aβ25-35组、D-gal+Aβ25-35组以及D-gal+Aβ25-35+HLD组大鼠在目标象限停留时间明显减少(P<0.01)、穿越平台的次数也减少(P<0.01),而D-gal组、HLD组、D-gal+HLD组与sham组相比差异无显著性。尼氏染色中,与sham组相比,Aβ25-35组、D-gal+Aβ25-35组以及D-gal+Aβ25-35+HLD组海马神经元凋亡率明显增多(P<0.01);与Aβ25-35组相比,D-gal+Aβ25-35组神经元凋亡率无明显变化,但D-gal+Aβ25-35+HLD组神经元凋亡率明显增加(P<0.01);与D-gal+Aβ25-35组相比,D-gal+Aβ25-35+HLD组神经元凋亡率明显增多(P<0.01)。Western blot中,与sham组、Aβ25-35组、D-gal组、HLD组、D-gal+Aβ25-35组以及D-gal+HLD组相比,D-gal+Aβ25-35+HLD组大鼠tau蛋白Thr181位点的磷酸化明显增加(P<0.01)。结论 高脂血症对老年大鼠的学习记忆能力以及抗氧化能力无明显影响;高脂血症可与Aβ协同作用,加重Aβ对神经元的损伤,并促进tau蛋白Thr181位点的过度磷酸化,是引发AD的危险因素。
高脂血症;Aβ;阿尔茨海默病; tau;过度磷酸化;衰老
阿尔茨海默病(Alzheimer′s disease, AD)俗称老年痴呆,是一种病因未明的、慢性、进行性中枢神经系统退行性疾病,起病隐匿,以记忆力减退和进行性认知功能障碍为主要临床表现[1],是引起老年人认知和行为障碍的主要疾病之一。但是,AD的病因及发病机制目前尚不明确。衰老是唯一确定的AD病因,载脂蛋白E(apolipoprotein E,APOE)基因型突变导致的高脂血症会增加AD的发病风险[2],但高脂血症增加AD发病风险的机制尚未阐明。
AD的特征性病理表现主要有[3]:细胞外大量β样淀粉蛋白(amyloid-beta peptides, Aβ)沉积形成的老年斑(senile plaque,SP),tau蛋白过度磷酸化导致的细胞内神经纤维缠结(neurofibril tangles,NFTs),以及广泛神经元丢失导致的脑萎缩。Bloom[4]认为Aβ是tau的上游,Aβ的聚积可使tau变成有毒的聚积态;同时,毒性tau通过反馈途径加重Aβ的毒性。Lee等[5]认为Aβ扰乱神经元的新陈代谢和离子稳态,进而引起蛋白激酶异常激活或磷酸酶抑制,最终导致tau过度磷酸化,形成NFTs。但因为Pick病、核上性麻痹等tau病变并未伴随Aβ病变,故也有学者认为tau对Aβ病理的发生、发展并无调节作用[6]。高脂血症作为AD的危险因子,可能通过诱导神经炎症、促使突触可塑性的损伤或破坏胆碱能神经系统等[7],进而促进学习记忆能力的损伤,但其在Aβ与tau的病理改变之间发挥了什么样的作用,目前尚不清楚。因此,本研究拟在衰老的动物体内观察高脂血症与Aβ以及tau的病理学变化特征。
我们选用D-半乳糖(D-gal)构建衰老大鼠模型[8],在此基础上给予高脂饮食构建高脂血症模型,并通过脑立体定位技术于大鼠双侧海马CA1区注射凝聚态的Aβ25-35多肽片段,观察高脂血症在Aβ引发的AD病变中的作用,以期为AD的治疗和预防提供新思路。
1 材料与方法
1.1 实验动物 清洁级♂ SD大鼠,体质量(320±20) g,9~10周,70只,由斯倍福(北京)生物技术有限公司提供[合格证号:SCXK(京)2011-0004]。动物饲养于12 h:12 h昼夜周期空调房内(5只/笼),室温23 ℃~25 ℃,湿度50%~60%,自由进食及饮水,所有动物适应性喂养1周后开始实验。本研究所有实验动物操作均参照中国医学科学院药物研究所动物伦理法规进行。
1.2 试剂 Aβ25-35:吉尔生化(上海)有限公司;tau单克隆抗体、tau[pThr181]单克隆抗体、tau[pThr212]单克隆抗体、tau[pThr205]单克隆抗体:Invitrogen公司;β-actin单克隆抗体:Sigma-Aldrich公司;兔抗鼠IgG二抗、羊抗兔IgG二抗:Sigma生物技术公司;Western blot化学发光检测试剂盒:北京普利莱基因技术有限公司;大鼠CAT、T-AOC检测试剂盒:南京建成生物工程研究所。D-半乳糖:Sigma-Aldrich公司;高脂饲料:特洛菲饲料科技有限公司(配方:酪蛋白20%,DL-蛋氨酸0.3%,蔗糖51.45%,奶油15%,玉米油1%,胆固醇1.25%,纤维素1%,矿物质3.5%,维生素1%,胆碱1%,胆酸钠0.5%);注射用青霉素钠:华北制药集团动物保健品有限责任公司[批准文号:兽药字(2011)030201248];尼氏染色液:上海碧云天生物技术有限公司。
1.3 仪器 SR-6R脑立体定位仪:日本,Narishige;2-16P型离心机:德国,Sigma;酶标仪:德国,Thermo;LAS4000型生物分子成像仪:美国,GE;Morris水迷宫:中国医学科学院药物所研制;生物显微镜:日本,Nikon Eclipse e60i。
1.4 药物制备 凝聚态Aβ25-35的制备[9]:将2 mg Aβ25-35溶于400 μL灭菌生理盐水中,制成5 g·L-1的溶液,置于37℃孵箱中孵育7 d,形成凝聚态。
D-gal溶液的制备[10]:0.9%生理盐水溶解D-gal,浓度为25 g·L-1,给药量为50 mg·kg-1·d-1。
1.5 实验设计
1.5.1 动物分组及模型制备 实验大鼠按体重随机分为7组(n=10),分组及处理情况见Tab 1,整个实验周期持续48 d,见Fig 1。从d 1至d 47,各组大鼠分别给予颈背部皮下注射D-gal或生理盐水,投喂高脂饲料;d 35、36各组大鼠双侧海马脑定位注射Aβ25-35或灭菌生理盐水。注射1周后用Morris水迷宫检测各组大鼠的学习记忆能力,d 48取材。
1.5.2 双侧海马定位注射 10%水合氯醛腹腔注射麻醉(300 mg·kg-1)[11]后,备皮,暴露颅骨,于脑立体定位仪固定,参照George等[12]的《The Rat Brain》,确定坐标为前囟后3.0 mm、中线旁1.8 mm、颅骨表面下2.6 mm。经牙科骨钻在颅骨钻孔后,用5 μL微量进样器注射Aβ25-352.5 μL/侧或0.9%灭菌生理盐水2.5 μL/侧,注射持续5 min,留针5 min,缓慢起针后注射另一侧。双侧注射完毕缝合伤口后,给予青霉素钠8万单位肌注,每日1次,连续3 d。

Fig 1 Design of experiments
1.6 行为学检测——Morris水迷宫 Morris水迷宫(morris water maze,MWM)主要用于评估大鼠的空间学习、记忆能力[13],此迷宫由直径120 cm,高80 cm的圆形水池及高40 cm,直径10 cm的可移动圆形平台组成。实验时水迷宫中水的深度需没过平台1~2 cm,并保证在后续检测时平台的位置一致。实验时水温(24±1)℃,全程保持安静。
MWM测试包括定位航行和空间探索两部分,其中前4 d的定位航行实验训练大鼠寻找隐藏在水下的平台。实验时,平台放置于第一象限,大鼠面向池壁从第三象限中点入水,记录大鼠在60 s内寻找平台并在平台停留2 s的轨迹。若寻找平台时间小于60 s,则记录该时间为其逃避潜伏期,若寻找时间大于60 s,按60 s计。于d 5进行空间探索实验,撤去平台,记录60 s内大鼠穿越目标象限的次数及在目标象限停留的时间。
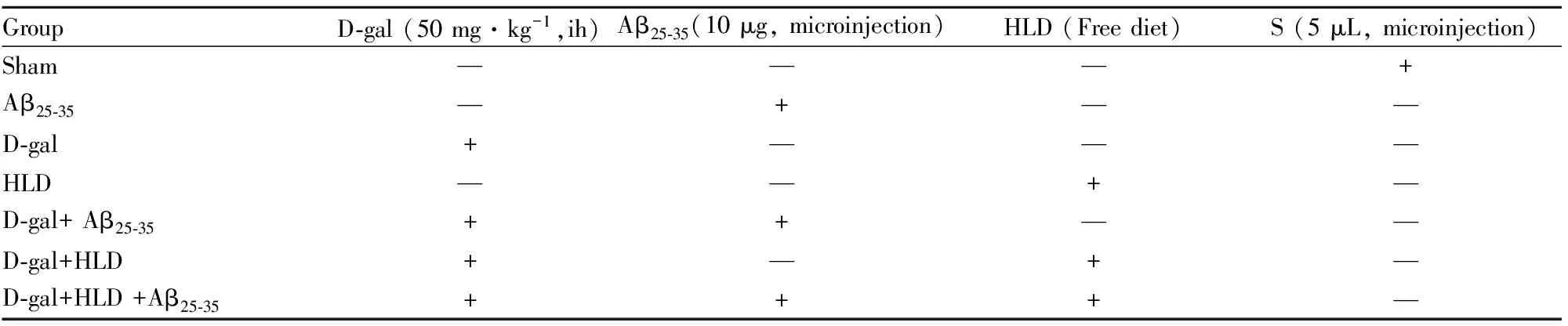
Tab 1 Groups and treatment conditions
saline, abbreviated as S;Hyperlipemia diet,abbreviated as HLD
1.7 尼氏染色 水迷宫检测结束后,各组大鼠随机选5只,用10%水合氯醛(300 mg·kg-1,ip)麻醉后行心脏灌流,之后取全脑,并置于4%多聚甲醛中固定24 h,经常规脱水、透明、浸蜡,包埋成蜡块,行冠状切片,片厚4 μm。
组织切片经常规脱蜡水化后,用尼氏染色液染色5 min,双蒸水洗2次,1 min/次,脱水、透明、中性树脂封片。
1.8 tau蛋白病理变化的检测
1.8.1 免疫蛋白印迹法 各组大鼠随机选取5只剥离海马和皮层,其中海马组织称重后按1 ∶10加入组织裂解液(50 mmol·L-1Tris-HCl pH 7.5,150 mmol·L-1NaCl,蛋白酶抑制剂混合物)制成组织匀浆,12 000 r·min-1,离心30 min,取上清,取部分用于BCA蛋白定量,剩余上清液加入1/4体积的5×loading buffer,煮沸10 min变性,以10% SDS-聚丙烯酰氨凝胶电泳分离,分离后的蛋白转移到PVDF膜上,用3%牛血清室温封闭2 h,之后孵育一抗:抗tau抗体(1 ∶500)、抗tau[pThr181]抗体(1 ∶500)、抗tau[pThr212]抗体(1 ∶500)、抗tau[pThr205]抗体(1 ∶500)、抗β-actin抗体(1 ∶1 000),4℃过夜。TBS-T洗3次,10 min/次;辣根过氧化物酶标记的二抗(1 ∶5 000)室温孵育2 h,用增强化学发光显色系统显示蛋白条带,分析条带的变化趋势。
1.8.2 免疫组织化学染色 组织切片常规脱蜡、酒精梯度水化(100%、100%、95%、85%、75%,双蒸水)后,用PBS冲洗3次,3 min/次;枸橼酸盐缓冲液高温抗原修复10 min,PBS冲洗3次;用免疫组化笔将切片中的组织圈起,3% H2O2阻断内源性过氧化物酶15 min,PBS洗3次,3 min/次;3%山羊血清室温封闭30 min,倒去血清,加一抗:抗tau[pThr181](1 ∶100)、抗tau[pThr212](1 ∶100)、抗tau[pThr205](1 ∶100),4℃孵育过夜;PBS-T冲洗3次,3 min/次;辣根过氧化物酶标记的羊抗兔二抗室温孵育1 h;PBS-T冲洗3次,3 min/次。DAB显色,脱水、透明、中性树脂封片。

Fig 2 Level of blood TC,TG,LDL and HDL(±s)
**P<0.01vssham;##P<0.01vsD-gal;△△P<0.01vsD-gal+Aβ25-35
1.9 抗氧化能力检测 皮层、海马称重后按1 ∶9加入生理盐水制成组织匀浆,2 000 r·min-1,离心10 min,取上清,取部分用于蛋白定量,剩余上清液于-80℃保存备用。严格按照试剂盒说明书操作,检测组织中总抗氧化能力(total antioxidant capacity,T-AOC)、过氧化氢酶活力(activity of catalase,CAT)。
计算公式:组织CAT活力(kU·g-1Pro)=(对照OD-测定OD)×271/60×取样量/待测样本蛋白浓度;
组织T-AOC(kU·g-1Pro)=(测定OD-对照OD)/0.01/30×反应液总体积/取样量/待测样本蛋白浓度。
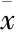
2 结果
2.1 高脂血症本身不能引发老年动物发生学习记忆障碍 如Fig 2所示,经多因素方差分析HLD、Aβ25-35、D-gal对大鼠血脂水平的影响,结果显示:① 与sham组相比,D-gal 组、Aβ25-35组、D-gal+Aβ25-35组大鼠血脂水平未见明显变化;而HLD组、D-gal+HLD组及D-gal+HLD+Aβ25-35组大鼠血液总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)及低密度脂蛋白(low densith lipoprotein,LDL)的水平明显升高(P<0.01);高密度脂蛋白(high densith lipoprotein,HDL)无明显变化;② 与D-gal 组比,D-gal+HLD组血浆TC、TG、LDL水平明显增加(P<0.01);③ 与D-gal+ Aβ25-35组比,D-gal+HLD+Aβ25-35组大鼠血浆TC、TG、LDL水平明显增加(P<0.01)。说明单纯Aβ25-35或D-gal对大鼠血脂无明显影响,而HLD可明显增加血浆TC、TG、LDL的水平。
采用Morris水迷宫进行大鼠学习记忆能力的检测,如Fig 3所示,在定位航行实验中(Fig 3A),随着训练时间的增加,sham组大鼠逃避潜伏期明显缩短;而Aβ25-35组、D-gal+Aβ25-35组以及D-gal+Aβ25-35+HLD组大鼠的逃避潜伏期并未明显缩短;D-gal组、HLD组、D-gal+HLD组与sham组相比差异无显著性,说明Aβ25-35对大鼠的学习能力造成了损伤。从Fig 3B、C可知,在空间探索实验中,与Sham组相比,Aβ25-35组、D-gal+Aβ25-35组、D-gal+Aβ25-35+HLD组大鼠穿越平台次数和目标象限停留时间均明显减少(P<0.01),而D-gal组、HLD组、D-gal+HLD组无变化;与D-gal组相比,D-gal+Aβ25-35组在目标象限停留的时间明显减少(P<0.01)、穿越平台的次数也减少(P<0.01);与D-gal+HLD组相比,D-gal+Aβ25-35+HLD组大鼠在目标象限停留的时间明显减少(P<0.01)、穿越平台的次数也减少(P<0.01),与定位航行实验结果一致。说明Aβ25-35对大鼠的学习记忆能力造成了损伤,而D-gal及高脂饮食不能引发老年大鼠发生学习记忆障碍。结合血脂检查结果可知,高脂饮食可提高大鼠的血脂水平,但其本身并不能引发老年动物发生学习记忆障碍。

Fig 3 Morris Water Maze test
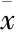
2.2 高脂血症可加重Aβ25-35引发的老年AD动物的神经元损伤 大鼠海马神经元的损伤采用尼氏染色方法进行观察,如Fig 4A所示,200倍镜下见,sham组大鼠海马CA1、CA3区神经元细胞数目较多,分布均匀,形态完整,核仁清晰。与sham组相比,Aβ25-35组、D-gal+Aβ25-35组以及D-gal+Aβ25-35+HLD组神经元形态不规则、细胞皱缩,并可见浓染的细胞,其中以D-gal+Aβ25-35+HLD组浓染细胞最多见。而与sham组相比,D-gal组、HLD组、D-gal+HLD组海马神经元形态及数目没有差异。统计这两个区域的细胞凋亡率(Fig 4D):① 与sham组相比,Aβ25-35组、D-gal+Aβ25-35组以及D-gal+Aβ25-35+HLD组大鼠神经元凋亡率明显增高(P<0.01),而D-gal组、HLD组、D-gal+HLD组无明显变化,说明D-gal及HLD对神经元的损伤不明显;② 与Aβ25-35组相比,D-gal+Aβ25-35组神经元凋亡率无明显变化;但D-gal+Aβ25-35+HLD组神经元凋亡率明显增加(P<0.01);③ 与D-gal+Aβ25-35组相比,D-gal+Aβ25-35+HLD组神经元凋亡率明显增多(P<0.01),说明Aβ25-35对海马神经元造成了损伤,而高脂饮食加重了Aβ25-35对海马神经元的损伤。
2.3 高脂血症加重了Aβ25-35引发老年大鼠脑组织的抗氧化能力损伤 如Fig 5所示,经多因素方差分析显示,D-gal对大鼠皮层组织的CAT、T-AOC有明显影响。与sham组相比,D-gal组、D-gal+Aβ25-35组、D-gal+HLD组、D-gal+Aβ25-35+HLD组大鼠皮层组织T-AOC降低(P<0.05),CAT活力降低(P<0.01),表明各组大鼠组织抗氧化能力降低,机体呈衰老态。海马组织T-AOC呈下降趋势,以D-gal+Aβ25-35+HLD组下降最为明显(P<0.01);CAT活力降低,与sham组相比,D-gal+Aβ25-35+HLD组下降明显(P<0.01)。与D-gal+Aβ25-35组比,D-gal+Aβ25-35+HLD组海马组织T-AOC及CAT活力均降低(P<0.05,P<0.01),说明高脂血症加重了Aβ25-35引发的老年大鼠脑组织的抗氧化能力损伤。
2.4 tau蛋白病理变化的检测结果
2.4.1 高脂血症加重了Aβ25-35引发的老年动物tau蛋白异常磷酸化 通过Western blot检测HLD对衰老的AD大鼠tau蛋白多个磷酸化位点的影响,由Fig 6A可见,与sham组、Aβ25-35组、D-gal组、HLD组、D-gal+HLD组及D-gal+Aβ25-35组相比,D-gal+Aβ25-35+HLD组大鼠tau蛋白Thr181位点的磷酸化明显增加(P<0.01),而Thr212、Thr205位点的磷酸化变化并不明显,故推测HLD促进了Aβ25-35所致AD样病变中tau蛋白Thr181位点的过度磷酸化。

Fig 4 Nissl's stain of Hippocampus
A:Representative Nissl′s staining pictures;B:Cell apoptosis rate in CA1;C:Cell apoptosis rate in CA3;D:Cell apoptosis rate in both CA1 and CA3.1:Sham;2:Aβ25-35;3:D-gal;4:HLD;5:D-gal+HLD;6:D-gal+Aβ25-35;7:D-gal+Aβ25-35+HLD.**P<0.01vssham;##P<0.01vsAβ25-35;△△P<0.01vsD-gal+Aβ25-35

Fig 5 Antioxidant capacity of cerebral cortex and hippocampus(±s)
A,B: Change of T-AOC and CAT in cerebral cortex; C,D: Change of T-AOC and CAT in hippocampus.*P<0.05,**P<0.01vssham;△P<0.05,△△P<0.01vsD-gal+Aβ25-35
2.4.2 高脂血症加重了Aβ25-35引发的老年动物tau蛋白Thr181位点异常磷酸化 如Fig 7所示,与sham组相比,D-gal+Aβ25-35+HLD组大鼠tau蛋白Thr181位点磷酸化阳性染色明显,呈棕黄色粗颗粒,与Western blot结果一致。
3 讨论
本研究采用行为学、生化分析以及分子生物学等方法证明高脂血症本身并不引起老年动物发生学习记忆障碍,但却可加重Aβ25-35引发的AD病理进程,表现为加重Aβ引发的神经元凋亡、氧化损伤、以及tau病理学变化。上述实验结果提示我们,高脂血症可能与Aβ发挥了协同作用,促进了AD的病理进程。
从Morris水迷宫结果看,Aβ25-35海马CA1区定位注射会明显降低大鼠的学习、记忆能力,而单独给予D-gal或高脂饲料,大鼠的学习记忆能力未见明显下降,可知二者均无致AD作用。从抗氧化能力相关酶活力的检测结果看,D-gal长期皮下注射可明显降低大鼠的抗氧化能力,进而更好的模拟衰老状态;从血脂检测结果可知,长期高脂饮食可造成血浆TC、TG、LDL的异常升高,可模拟高脂血症。进一步研究发现,尼氏染片中Aβ25-35定位注射于大鼠海马,会造成海马神经元的损伤,而高脂饮食加重了Aβ25-35对神经元的损伤。Western blot结果显示,高脂饮食联合Aβ25-35促进了衰老大鼠海马中tau蛋白某些位点的磷酸化,其中与D-gal组相比,HLD引起了Thr181位点的异常磷酸化,而Thr205、Thr212位点的磷酸化则无明显改变;免疫组织化学染色结果进一步验证了Western blot结果,并定位该磷酸化蛋白主要位于海马CA3区。因此,我们认为高脂饮食联合Aβ25-35可加重老年大鼠脑中Aβ的神经毒性,并进一步促进tau蛋白的过度磷酸化,且此磷酸化主要表现在Thr181位点。
胆固醇是神经元细胞膜的基本成分之一,与Aβ的正常代谢及异常聚积密切相关[14],若脑中胆固醇水平过高,会使神经元细胞膜脂质的循环减慢,造成Aβ的生成和聚积增多,而清除减少,成为AD发病的危险因素。近年来,随着生活水平的提高,糖尿病、高脂血症等代谢类疾病的患病人数也不断增多,目前已有研究表明糖尿病与AD的关系极为密切[15-16],但对高脂血症与AD关系的研究则较少,相关认识也不统一[17],而伴有高脂血症的AD患者中Aβ与tau的关系更不明确。有学者主张用他汀类药物控制血脂以降低AD发病的风险[18];也有研究认为高胆固醇水平并不会增加AD的发病风险,只有年龄是AD发病的危险因素[19];而Mielke等[20]则认为老年期的高胆固醇水平可降低痴呆风险。Thr181位点位于tau蛋白的脯氨酸富集区,该位点在脑脊液中的磷酸化水平常做为诊断AD的特异性标志物之一[21]。

Fig 6 Wsetern blot test
A:Total tau,p-Thr181,p-Thr 212,p-Thr 205 level in hippocampus determined by Western blot;B:Cartogram of p-Thr181,p-Thr212 and p-Thr205 level.**P<0.01vssham

Fig 7 Representative pictures in immunostaining
本研究认为,高脂饮食所引起的高脂血症仍可能是老年人AD发病的危险因素,高脂血症可与Aβ协同作用,加重Aβ对神经元的损伤,并促进tau蛋白Thr181位点的过度磷酸化。
(致谢:实验在中国医学科学院药物研究所陈乃宏教授课题组完成,苑玉和、宋修云、王真真、张钊等老师均给予了本实验指导性的意见;实验室夏聪媛、高岩、娄钰霞、张帅、王莎莎、罗飘、赵佳奇、宋昕樾、陈琴、杨鹏飞、张秋双、王莹莹、郭斌、韩诚、赵雨薇、陈秀艳、陈姣等同学均在实验过程中给予了重要的帮助,谨此致以诚挚的谢意!)
[1] 董碧蓉.老年病学[M].成都:四川大学出版社,2009:69.
[1] Dong Birong.Gerontology[M].Chengdu:Sichuan University Press, 2009:69.
[2] Hashimoto T, Serrano-Pozo A, Hori Y, et al. Apolipoprotein E, especially apolipoprotein E4, increases the oligomerization of amyloid β peptide[J].JNeurosci,2012,32(43):15181-92.
[3] Blennow K,de Leon M J, Zetterberg H.Alzheimer′s disease[J].Lancet,2006,368(9533):387-403.
[4] Bloom G S. Amyloid-β and tau: the trigger and bullet in Alzheimer disease pathogenesis[J].JAMANeurol,2014,71(4):505-8.
[5] Lee M S, Tsai L H. Cdk5: one of the links between senile plaques and neurofibrillary tangles[J]?AlzheimersDis,2003,5(2):127-37.
[6] Oddo S, Caccamo A, Cheng D. Genetically augmenting tau levels does not modulate the onset or progression of Abeta pathology in transgenic mice[J].Neurochem,2007,102(4):1053-63.
[7] 何 鑫,胡金凤,苑玉和,等.高脂饮食与阿尔采末病之间关系的研究进展[J].中国药理学通报,2012,28(3):297-300.
[7] He X, Hu J F, Yuan Y H, et al. Research progress on the relationship between high-fat diet and Alzheimer′s disease[J].ChinPharmacolBull, 2012,28(3):297-300.
[8] 戎志斌,禤 璇,刘 纯,等.新型阿尔茨海默病大鼠模型的建立及其行为学研究[J].中国中医药科技,2013,20(1):48-9.
[8] Rong Z B, Xuan X, Liu C, et al. A new rat model of Alzheimer′s disease and its behavioral research[J].ChinJTraditMedSciTechnol, 2013,20(1):48-9.
[9] Liang W, Zhao X, Feng J, et al. Ursolic acid attenuates beta-amyloid-induced memory impairment in mice[J].ArqNeurosiquiatr,2016,74(6):482-8.
[10]崔 旭,李文彬,张炳烈,等.D-半乳糖脑老化模型的脂质过氧化机理[J].中国老年学杂志,1998,18(1):38-40.
[10]Cui X, Li W B, Zhang B L, et al. Mechanism of lipid peroxidation in D-galactose-induced brain aging model[J].ChinJGerontol, 1998,18(1):38-40.
[11]Song X Y, Wang Y Y, Chu S F, et al. A new coumarin derivative, IMM-H004, attenuates okadaic acid-induced spatial memory impairment in rats[J].ActaPharmacolSin, 2016,37(4):444-52.
[12]George P, Charles W.TheRatBrain[M].London: Elsevier,2007:166.
[13]方 松,余化霖. Morris水迷宫实验中海马相关空间学习记忆的研究进展[J]. 国际病理科学与临床杂志,2010,30(4):321-6.
[13]Fang S, Yu H L. Advances in the study on hippocampus-related spatial learning and memory in Morris water maze[J].IntPatholClinMed, 2010,30(4):321-6.
[14]Ehehalt R, Keller P, Haass C. Amyloidogenic processing of the Alzheimer β-amyloid precursor protein depends on lipid rafts[J].JCellBiol, 2003,160(1):113-23.
[15]Walker J M, Harrison F E. Shared neuropathological characteristics of obesity, Type 2 diabetes and Alzheimer′s disease: impacts on cognitive decline[J].Nutrients, 2015,7(9):7332-57.
[16]Barbagallo M, Dominguez L J. Type 2 diabetes mellitus and Alzheimer′s disease[J].WorldJDiabetes,2014,5(6):889-93.
[17]Panza F, Solfrizzi V, D′Introno A, et al. Higher total cholesterol, cognitive decline, and dementia[J].NeurobAging,2008, 30(4), 546-48.
[18]Anstey K J, Lipnicki D M, Low L F. Cholesterol as a risk factor for dementia and cognitive decline: a systematic review of prospective studies with meta-analysis[J].AmJGeriatrPsychiatry, 2008, 16(5):343-54.
[19]Li G, Shofer J B, Kukull W A. Serum cholesterol and risk of Alzheimer disease: a community-based cohort study[J].Neurology, 2005,65(7):1045-50.
[20]Mielke M M, Zandi P P, Sjögren M. High total cholesterol levels in late life associated with a reduced risk of dementia[J].Neurology, 2005,64(10):1689-95.
[21]Jaworski J, Psujek M, Bartosik-Psuek H. Total-tau and phospho-tau(181Thr) in cerebrospinal fluid of neurologically intact population increase with age[J].FoliaBiol(Praha), 2009, 55(4):126-31.
Study of synergistic effect of hyperlipoproteinemia and Aβ in processing of Alzheimer′s disease
HOU Jiang-qi1,2, ZHANG Xin2, LONG Qin2, CHU Shi-feng3,4, GUO Lei2,HE Wen-bin2,3, ZHANG Jun-long1,2,CHEN Nai-hong3,4
(1.ShandongUniversityofChineseMedicine,JiNanShandong250355,China; 2.ShanxiUniversityofChineseMedicine,TaiYuanShanxi030619,China; 3.ChineseAcademyofMedicalScienceandPekingUnionMedicalCollege,Beijing100500,Chinas; 4.CollegeofPharmacy,HunanUniversityofChineseMedicine,ChangshaHunan410208,China)
Aim To research the synergistic effect of hyperlipoproteinemia and Aβ in the processing of Alzheimer′s disease.Methods Seventy SD rats were randomly divided into seven groups, and dealt with D-gal (hypodermic injection), hyperlipemia diet, microinjection into both side of CA1 section in hippocampus, independently. Morris water maze(MWM) test was used to evaluate the spatial memory impairments. Tau and tau(pThr181) pathology in the hippocampus were detected using Western blot and immunohistochemistry. Nissl′s staining was used to detect cell apoptosis.Results Aβ25-35-treated rats showed significant impairments of spatial memory in MWM test, especially in the group of D-gal+Aβ25-35+HLD(P<0.01). Furthermore, these rats treated with Aβ25-35, D-gal, and hyperlipemia diet, exhibited significantly increased phosphorylation of tau, particularly in the Thr181 site.Conclusion Hyperlipoproteinemia is the risk factor for older person, which could strengthen the toxic effect of Aβ, and promote phosphorylation of tau.
hyperlipoproteinemia; Aβ; Alzheimer′s disease; tau; hyperphosphorylation; aging
时间:2017-3-13 8:38
http://kns.cnki.net/kcms/detail/34.1086.R.20170324.1247.022.html
2016-10-18,
2016-12-09
国家自然科学基金资助项目(No 81573853,81273629);中国医学科学院医学与健康科技创新工程重大协同创新项目(创新团队项目)(No 2016I2M1004);山西省回国留学人员科研资助项目(No 2013-134);湖南省重点研发计划项目(No 2015SK2029-1)
侯江淇(1988-),女,博士生,研究方向:《内经》理论及应用,E-mail:houjiangqi123@163.com; 陈乃宏(1961-),男,博士,研究员,通讯作者,E-mail:chennh@imm.ac.cn
10.3969/j.issn.1001-1978.2017.04.011
A
1001-1978(2017)04-0498-09
R-332;R322.81;R341;R339.38;R589.2;R745.7

