二烯丙基二硫上调RORα抑制人胃癌细胞Wnt/β-catenin通路靶基因
苏 坚,赵晓红,向姝霖,刘 芳,夏 红,苏 波,凌 晖,曾 希,苏 琦
(南华大学 1. 附属第二医院病理科; 2.肿瘤研究所,湖南省胃癌研究中心,湖南省高校肿瘤细胞与分子病理学重点实验室,湖南 衡阳 421001;3. 海南省妇幼保健院,海南 海口 570206)
二烯丙基二硫上调RORα抑制人胃癌细胞Wnt/β-catenin通路靶基因
苏 坚1,2,赵晓红2,3,向姝霖2,刘 芳2,夏 红2,苏 波2,凌 晖2,曾 希2,苏 琦2
(南华大学 1. 附属第二医院病理科; 2.肿瘤研究所,湖南省胃癌研究中心,湖南省高校肿瘤细胞与分子病理学重点实验室,湖南 衡阳 421001;3. 海南省妇幼保健院,海南 海口 570206)
目的 观察DADS上调RORα对人胃癌MGC803细胞Wnt/β-catenin通路相关分子与靶基因表达的影响。方法 RT-PCR、Western blot与免疫共沉淀检测Wnt/β-catenin通路相关分子与靶基因表达。荧光素酶报告基因检测c-Myc基因启动子活性。结果 RT-PCR 与Western blot显示,DADS处理后各组RORα mRNA与蛋白表达上调(P<0.05),而沉默RORα较对照组明显下调(P<0.05)。DADS处理后各组Wnt1 mRNA与蛋白表达下调(P<0.05)。沉默RORα较对照组Wnt1 mRNA与蛋白明显上调(P<0.05)。DADS处理前后各组β-catenin mRNA与蛋白表达差异无显著性(P>0.05)。免疫共沉淀显示,DADS处理组RORα与β-catenin结合明显增加,而沉默组与β-catenin结合明显减少(P<0.05)。DADS可明显下调核内β-catenin与p-β-catenin(P<0.05),而沉默RORα可明显上调β-catenin与p-β-catenin(P<0.05)。同时,DADS可明显下调TCF-4表达(P<0.05),而沉默RORα可明显上调TCF-4(P<0.05)。DADS可明显下调Axin、c-Myc、c-Jun mRNA与蛋白表达(P<0.05),而沉默RORα作用相反(P<0.05)。荧光素酶报告基因检测显示,DADS处理后,各组c-Myc启动子活性明显低于处理前(P<0.05)。沉默组c-Myc启动子活性明显高于对照组(P<0.05)。结论 DADS可上调RORα抑制Wnt/β-catenin通路相关分子与靶基因表达。
二烯丙基二硫;人胃癌细胞;RORα;Wnt/β-catenin信号通路;相关分子;靶基因;启动子活性
RORα(retinoid acid receptor related Orphan Receptor α)是核受体超家族成员之一,可调节多种正常组织细胞的发育和分化、生物代谢、机体稳态维持及高级神经功能等。并且,RORα在肿瘤表达下调,与肿瘤发生密切相关,可能是肿瘤治疗的靶点[1-2]。
研究显示[3],二烯丙基二硫(diallyl disulfide, DADS)对多种肿瘤均有明显的抑制作用,在抑制DNA加合物形成、阻滞细胞周期、诱导肿瘤细胞分化和凋亡、组蛋白修饰、抑制迁移侵袭等方面发挥重要作用,是一种很有开发潜力的抗肿瘤药物。近来,我们在鉴定DADS抑制人胃癌细胞的差异蛋白质中,发现RORα表达明显上调[4]。本研究探讨DADS上调RORα对胃癌细胞Wnt/β-catenin通路靶基因影响。
1 材料与方法
1.1 细胞培养 人胃癌MGC803细胞由本实验室保存,稳定低表达RORα人胃癌MGC803细胞由本实验室构建[5],置于含10%小牛血清的RPMI 1640培养基中,37℃,5% CO2、饱和湿度的培养箱内传代培养。取对数生长期的细胞用于实验。
1.2 主要试剂 DADS:Fluka公司产品[4]。RNA提取试剂盒购自OMEGA公司;逆转录试剂盒与BCA蛋白定量试剂盒为Promega公司产品;RORα与β-actin抗体购自Abcam公司;β-catenin、p-β-catenin、wnt-1、TCF-4、Axin、c-Jun、c-Myc抗体与ECL发光试剂盒购自Santa Cruz公司;新生牛血清购自杭州四季青生物工程公司;引物用Primer Premier 5.0软件设计,由上海生工公司合成;c-Myc-pGL-3萤光素酶报告质粒为广州赛业生物公司惠赠。
1.3 RT-PCR分析 Total RNA Kit 提取细胞总RNA,AMV 酶作用下逆转录合成 cDNA。设计并合成PCR引物序列:RORα:F 5′-GTCAGCAGCTTCTACCTGGAC-3′,R 5′-CA GTTGGGGAAGTCTCGCCG-3′,产物长度151 bp;β-catenin:F 5′-GTTGTACCGG AGCCCTTCAC-3′,R 5′- TCCCACCCTACCAACCAAGT-3′,产物长度729 bp;Wnt1:F 5′-TGCACGCA CACGCGCGTACTGCAC-3′,R 5′-CAGGATGGCAAGA GGGTTCAT-G-3′,产物长度400 bp;Axin:R 5′-AGC CGTGTCGGACATG GA-3′,F 5′-CCTCAAACACCAC CCCACAG-3′,产物长度254 bp;c-Myc:R 5′-CGT CTCCACACATCAGCACAA-3′,F 5′-CTGCTTGGACG GACAGGATG-3′,产物长度323 bp;c-Jun:R 5′-CGC ACCGGTTGTTGAACTTG-3′,F 5′-ATGCCTCCCGCAC TCTTACT-3′,产物长度292 bp;β-actin:F 5′-TCTA CAATGAGCTGCGTGTGG-3′,R 5′-GGAACCGCTCAT TGCCAATG-3′,产物长度498 bp。PCR反应条件:94℃,5 min;94℃,40 s,各基因Tm,45 s,72℃ 1 min 20 s,28个循环;72℃ 10 min。5 μL的PCR产物经1%的琼脂糖电泳,嗅化乙啶染色,通过IS1000图像分析软件读取条带灰度值,相对值以目的基因与β-actin灰度值之比表示。
1.4 Western blot检测 收集细胞,提取细胞总蛋白,BCA法测定蛋白浓度,每组取等量样本进行SDS-PAGE凝胶电泳,电泳后转膜,封闭1 h,加一抗,4 ℃过夜,TBST洗膜,加二抗孵育1 h,洗膜,ECL发光,X片曝光、显影、定影。
1.5 免疫共沉淀 按照Seize Classic Mammalian Immunoprecipitation试剂盒说明进行。将瓶中细胞培养液吸去,加入M-PER裂解液,收集细胞,离心13 000×g, 5 min。将抗RORα抗体加入细胞裂解物,4℃过夜,然后将其加入含蛋白G的旋转柱上,孵育30 min,离心2 000g×3 min,弃去滤过液,PBS洗3次,加入洗脱液洗脱2次,得到抗体复合物,加入上样缓冲液,SDS-PAGE电泳,进行Western blot。
1.6 荧光素酶报告基因分析 制备单细胞悬液,细胞计数,以3×104/cm2的细胞数量种入24孔板。细胞贴壁后,脂质体Lipofectamine 2000转染c-Myc-pGL-3萤光素酶报告质粒入细胞。24 h后,每孔加入100 μL裂解液,室温裂解30 min。将裂解液移入离心管中,取上清20 μL,加入50 μL荧光素酶底物,小心混匀。液体闪烁仪检测荧光值。每次每个样品设立复孔,实验重复3次。
2 结果
2.1 DADS上调MGC803细胞RORα表达 RT-PCR与Western blot检测显示,沉默RORα较对照组与空载体组RORα mRNA与蛋白表达明显下调(P<0.05)。30 mg·L-1DADS处理后,对照组与空载体组较处理前RORα mRNA与蛋白表达上调(P<0.05),沉默组较未处理沉默组RORα mRNA与蛋白表达上调(P<0.05),但是,表达水平仍低于对照组与空载体组(P<0.05)(Fig 1)。
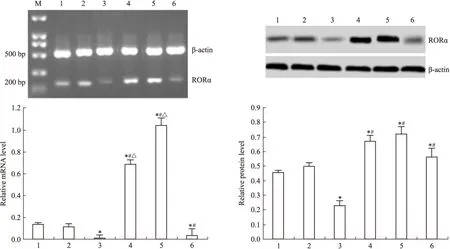
Fig 1 Effect of DADS and silence RORα on expression of RORα
1:MGC803; 2: Vector; 3: miR-RORα; 4: DADS; 5: Vector+DADS; 6: miR-RORα+DADS*P<0.05vsMGC803 and vector;#P<0.05vsmiR-RORα;△P<0.05vsmiR-RORα+DADS
2.2 DADS抑制Wnt/β-catenin通路信号分子 Fig 2~6显示,沉默RORα较对照组与空载体组Wnt1 mRNA与蛋白明显上调(P<0.05)。30 mg·L-1DADS处理后,对照组、空载体组与沉默组较处理前Wnt1 mRNA与蛋白表达下调(P<0.05),而沉默组表达水平仍高于对照组与空载体组(P<0.05)。但是,DADS处理前后,各组β-catenin mRNA与蛋白表达差异无显著性(P>0.05)。免疫共沉淀显示,用Anti-RORα抗体沉淀MGC803细胞的裂解蛋白中,可见β-catenin存在,并且,DADS处理组RORα与β-catenin结合明显增加(P<0.05),而沉默组与β-catenin结合明显减少(P<0.05)。核内蛋白检测结果显示,DADS可明显下调β-catenin与p-β-catenin(P<0.05),而沉默RORα可明显上调β-catenin与p-β-catenin(P<0.05)。同时,DADS可明显下调TCF-4,而沉默RORα可明显上调TCF-4(P<0.05)。表明DADS可下调Wnt1,并上调RORα抑制β-catenin入核和活化,继而下调TCF-4表达。而沉默RORα作用相反。
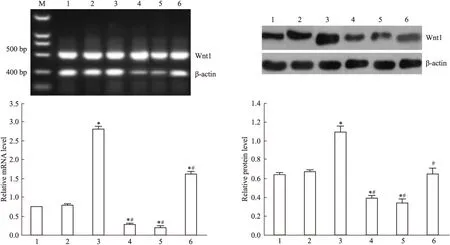
Fig 2 Effect of DADS and silence RORα on expression of Wnt1
1:MGC803;2:Vector;3:miR-RORα;4:DADS;5:Vector+DADS;6:miR-RORα+DADS.*P<0.05vsMGC803 and vector;#P<0.05vsmiR-RORα
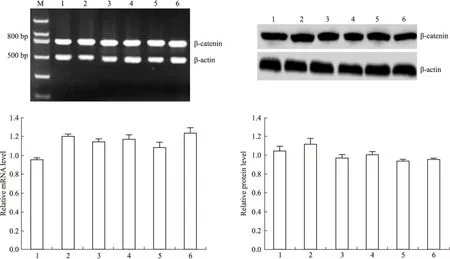
Fig 3 Effect of DADS and silence RORα on expression of β-catenin
1:MGC803;2:miR/MGC803;3:miR-RORα/MGC803;4:MGC803+DADS;5:miR/MGC803+DADS;6:miR-RORα+DADS
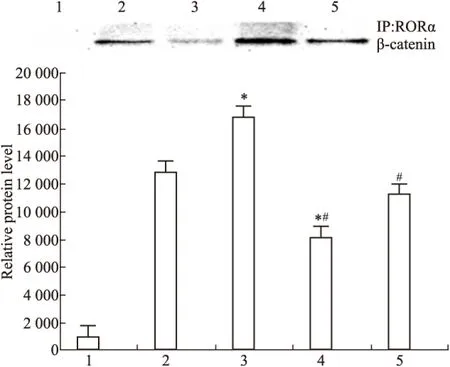
Fig 4 RORα bind to β-catenin detected by co-immunoprecipitation in DADS and silence RORα
1:IgG;2:MGC803;3:miR-RORα;4:DADS;5:miR-RORα+DADS.*P<0.05vsMGC803;#P<0.05vsmiR-RORα
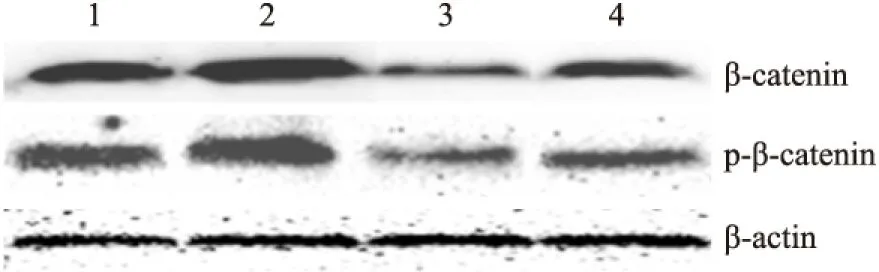
Fig 5 Effect of DADS and silence RORα on expression of intranuclear β-catenin and p-β-catenin
1:MGC803;2:miR-RORα;3:MGC803+DADS;4:miR-RORα+DADS.
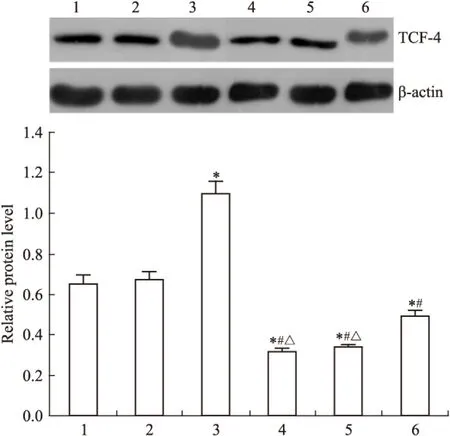
Fig 6 Effect of DADS and silence RORα on expression of TCF-4 protein
1:MGC803;2:Vector;3:miR-RORα;4:DADS;5:Vector+DADS;6:miR-RORα+DADS.*P<0.05vsMGC803 and vector;#P<0.05vsmiR-RORα;△P<0.05vsmiR-RORα+DADS
2.3 DADS抑制Wnt/β-catenin通路靶基因表达 Fig 7显示,DADS可明显下调靶基因Axin、c-Myc、c-Jun mRNA与蛋白表达(P<0.05),而沉默RORα可明显上调Axin、c-Myc、c-Jun mRNA与蛋白表达,减弱DADS抑制Wnt/β-catenin通路靶基因作用(P<0.05)。提示DADS可通过上调RORα抑制Wnt/β-catenin通路靶基因表达。
2.4 DADS对c-Myc启动子活性的影响 荧光素酶报告基因检测显示,RORα沉默组c-Myc启动子活性明显高于MGC803组与空载体组(P<0.05)。30 mg·L-1DADS处理后,MGC803组、空载体组与沉默组明显低于处理前(P<0.05)。表明DADS与RORα可抑制c-Myc启动子活性,而沉默RORα可增强c-Myc启动子活性。
3 讨论
据最新统计,胃癌在我国每年约新发67.9万和死亡49.8万人,发生率与死亡率均位于第二。由于患者就诊时大多已发生侵袭转移,5年生存率低于10%[6-7]。因此,研究胃癌侵袭转移机制,寻找靶点具有重要的意义。
我们前期工作证明,DADS可MGC803细胞上调组蛋白乙酰化与p21 WAF1,调节ATR/Chk1/Cdc25C/cyclin B1,阻滞G2/M,并且,可通过Rac1-Pak1/Rock1通路下调LIMK1抑制人胃癌细胞增殖、EMT与侵袭[8-11]。但是,其作用靶点尚不十分清楚。近来,我们采用蛋白质组学技术筛选DADS抑制人胃癌细胞的24个差异蛋白质中,发现RORα表达明显上调[4]。
研究证明[12],Wnt/β-catenin信号通路在肿瘤发生与侵袭转移中起着重要作用,可能成为药物干预治疗肿瘤靶点。Wnt/β-catenin信号通路由细胞外的Wnt蛋白、膜受体Frizzled、胞质内的β-catenin以及下游的靶基因组成,其中β-catenin起着关键作用。当Wnt蛋白增加时,Wnt与Frizzled结合,激活Dsh/Dvl蛋白,进而抑制GSK3Bβ/APC/Axin复合物对β-catenin的磷酸化,导致细胞内的β-catenin增多,增多的β-catenin进入细胞核,与转录因子Tcf/Lef结合,引起c-Myc、Cyclin D1、survivin、c-jun、Fra等靶基因的转录,导致肿瘤发生[13]。
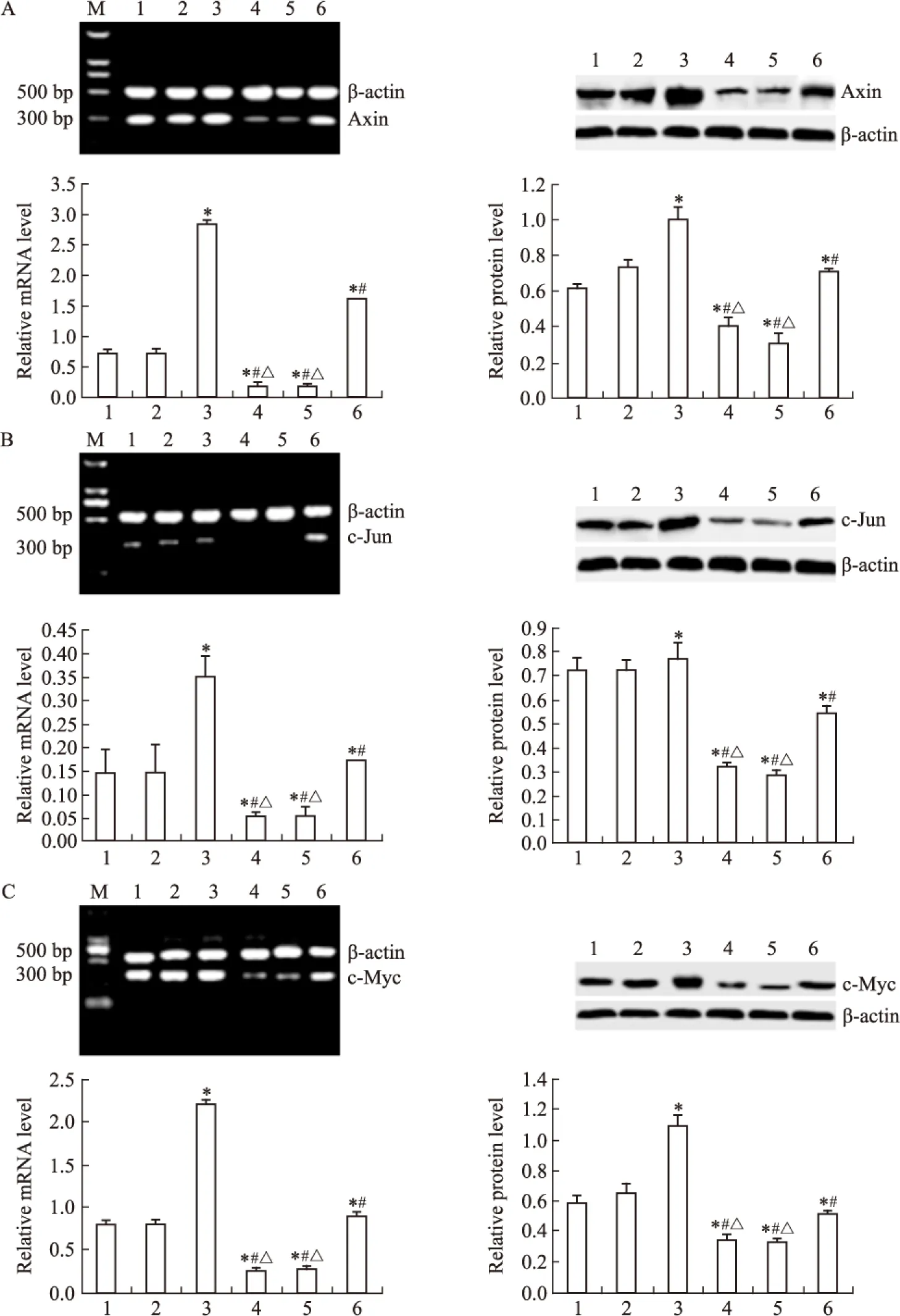
Fig 7 Effect of DADS and silence RORα on expression of target genes in Wnt/β-catenin pathway
A:Axin;B:c-Myc;C:c-Jun.1:MGC803;2:Vector;3:miR-RORα;4:DADS;5: Vector+DADS;6:miR-RORα+DADS.*P<0.05vsMGC803 and vector;#P<0.05vsmiR-RORα;△P<0.05vsmiR-RORα+DADS
研究认为,RORα在肿瘤起着抑癌基因的作用。RORα在结肠癌、食管癌、胰腺癌、肝癌、乳腺癌、子宫颈癌、卵巢癌、前列腺癌、膀胱癌、头颈部癌、白血病等多种肿瘤中表达下调。恢复RORα表达可体内外抑制乳腺癌细胞增殖与侵袭等恶性表型。RORα可通过经典的Wnt/β-Catenin与 非经典的Wnt5a/PKC、p53-dependent、Hypoxia/Angiogenesis、NF-κB 等多种信号途径调控肿瘤细胞增殖、凋亡与侵袭等功能。RORα与β-catenin 结合抑制Wnt/β-catenin 靶基因转录。提示RORα可能是肿瘤治疗靶点,进一步研发活化RORα的药物或激动剂成为新的治疗肿瘤的策略[2]。Lee等[13]报告,RORα通过Wnt5a与PKC依赖方式负调控Wnt/β-catenin通路,抑制β-catenin介导激活Wnt/β-catenin靶基因转录。RORα可通过丝氨酸35残基磷酸化,竞争结合β-catenin,抑制Wnt/β-catenin靶基因cyclin D1、c-myc、Axin,从而调控细胞增殖与肿瘤进展。并且,RORα可依赖PGE2/PKCα途径磷酸化减弱结肠癌细胞Wnt靶基因表达。表明RORα是肿瘤细胞增殖的关键调控因子[14]。

Fig 8 Effect of DADS and silence RORα on activity of c-Myc promotor
1:MGC803;2:Vector;3:miR-RORα;4:DADS;5: Vector+DADS;6:miR-RORα+DADS.*P<0.05vsMGC803 and vector;#P<0.05vsmiR-RORα;△P<0.05vsmiR-RORα+DADS
近年来[5],研发促进RORα表达的有效药物为治疗肿瘤开拓了新的途径。有人从12 000种植物提出物发现,neoruscogenin是与RORα高亲和力的激动剂,其可体内外活化RORα及影响其靶基因的表达[15]。RORα 激动剂SR1078处理肿瘤细胞可稳定p53蛋白表达与诱导凋亡[16]。
本研究在前期工作基础上,进一步观察DADS上调RORα对Wnt/β-catenin通路靶基因的作用。结果表明,DADS可上调RORα mRNA与蛋白表达,下调Wnt1 mRNA与蛋白表达,抑制人胃癌细胞增殖。尽管DADS处理前后各组β-catenin mRNA与蛋白表达差异无显著性。但是,免疫共沉淀显示,DADS可明显增加RORα与β-catenin结合,明显下调核内β-catenin与p-β-catenin。同时,DADS可明显下调TCF-4。检测Wnt/β-catenin通路靶基因的作用显示,DADS可明显下调Axin、c-Myc、c-Jun mRNA与蛋白表达。荧光素酶报告基因检测显示,DADS处理后,各组c-Myc启动子活性明显低于处理前。然而,沉默RORα在上述作用中效果相反。
综上所述,DADS可通过上调RORα与下调Wnt1表达,减少β-catenin入核和降低其活性,下调TCF-4,抑制Wnt/β-catenin通路靶基因表达。提示DADS可能是RORα的新型激动剂,对治疗胃癌具有良好前景。然而,DADS上调RORα是否通过Wnt/β-catenin途径抑制人胃癌细胞EMT与侵袭尚待深入研究。
[1] 赵晓红, 苏 琦. 维甲酸相关孤核受体α与Wn1t信号途径及肿瘤的关系[J]. 临床与病理学杂志, 2011, 31(3): 234-7.
[1] Zhao X H, Su Q. Retinoid acid receptor related orphan receptor α and Wnt signaling pathway and tumor[J].JClinPatholRes, 2011,31(3): 234-7.
[2] Du J,Xu R. RORα, a potential tumor suppressor and therapeutic target of breast cancer[J].IntJMolSci,2012,13(12):15755-66.
[3] Yi L, Su Q. Molecular mechanisms for the anti-cancer effects of diallyl disulfide[J].FoodChemToxicol, 2013, 57:362-70.
[4] Su B,Su J,He H,et al. Identification of potential targets for diallyl disulfide in human gastric cancer MGC-803 cells using proteomics approaches[J].OncolRep, 2015, 33(5): 2484-94.
[5] 凌 晖, 陈真伟, 曾铁兵, 等. RORα miRNA真核表达载体构建及对人胃癌细胞增殖的影响[J]. 中国现代医药杂志, 2011, 13(2):1-4.
[5] Ling H, Chen Z W, Zeng T B, et al. Construction of human ROR alpha miRNA eukaryotic expression vector and its effects on proliferation in gastric cancer cells[J].ModMedJChina, 2011, 13(2):1-4.
[6] Orditura M,Galizia G,Sforza V,et al. Treatment of gastric cancer[J].WorldJGastroenterol, 2014, 20(7):1635-49.
[7] Chen W,Zheng R,Baade P D,et al. Cancer statistics in China, 2015[J].CACancerJClin,2016, 66(2):115-32.
[8] Su B, Xiang S L,Su J, et al. Diallyl disulfide increased histone acetylation and p21WAF1 expression in human gastric cancer cellsinvivoandinvitro[J].BiochemPharmacol, 2012, 1(7): 1-10.
[9] Ling H, Lu L F, He J, et al. Diallyl disulfide selectively causes Checkpoint kinase-1 mediated G2/M arrest in human MGC803 gastric cancer cell line[J].OncolRep,2014,32(5): 2274-82.
[10]夏 红, 向姝霖, 曾 颖, 等. DADS对Chk1/2基因高表达人胃癌MGC803细胞G2/M期的影响[J]. 中国药理学通报, 2016, 32(2):199-204.
[10]Xia H, Xiang S L, Zeng Y, et al. Overexpression of chk1/2 gene to affect the G2/M arrest in MGC803 Cells induced by diallyl disulfide[J].ChinPharmacolBull, 2016, 32(2):199-204.
[11]Su B, Su J, Zeng Y, et al. Diallyl disulfide suppresses epithelial-mesenchymal transition, invasion and proliferation by downregulation of LIMK1 in gastric cancer[J].Oncotarget, 2016, 7(9):10498-512.
[12]Mook RA Jr, Chen M, Lu J, et al. Small molecule modulators of Wnt/β-catenin signaling[J].BioorgMedChemLett, 2013, 23(7):2187-91.
[13]Lee J M,Kim I S,Kim H,et al. RORalpha attenuates Wnt/beta-catenin signaling by PKCalpha-dependent phosphorylation in colon?cancer[J].MolCell,2010,37(2): 83-195.
[14]Shin D,Kim I S,Lee J M,et al. The hidden switches underlying RORα-mediated circuits that critically regulate uncontrolled cell proliferation[J].JMolCellBiol, 2014, 6(4):338-48.
[15]Helleboid S,Haug C,Lamottke K,et al. The identification of naturally occurring neoruscogenin as a bioavailable, potent, and high-affinity agonist of the nuclear receptor RORα(NR1F1)[J].JBiomolScreen,2014,19(3):399-406.
[16]Wang Y,Solt L A,Kojetin D J,et al. Regulation of p53 stability and apoptosis by a ROR agonist[J].PLoSOne,2012, 7(4):e34921.
Upregulation of RORα suppresses target genes of Wnt/β-catenin pathway in human gastric MGC803 cells by DADS
SU Jian1,2, ZHAO Xiao-hong2,3, XIANG Shu-lin2,LIU Fang2, XIA Hong2, SU Bo2, LING Hui2, ZENG Xi2, SU Qi2
(1.Deptofpathology,theSecondAffiliatedHospital,UniversityofSouthChina,HengyangHunan421001,China;2.CancerResearchInstitute,CenterforGastricCancerResearchofHunanProvince,KeyLaboratoryofCancerCellularandMolecularPathologyofHunanProvincialUniversity,UniversityofSouthChina,Hengyang421001,China;3.TheHainanMaternalandChildHealthHospital,Haikou570206,China)
Aim In ground of prophase work, to investigate the upregulation of RORα suppresses target genes of Wnt/β-catenin pathway in human gastric MGC803 cells by DADS.Methods The expressions of correlated molecules and target genes in Wnt/β-catenin pathway were tested by RT-PCR, Western blot and co-immunoprecipitation. Luciferase assay was used to assess the promoter activity of c-Myc.Results Soft agar colony formation showed that the proliferation in silence group of RORα was significantly strengthened compared with in control group, and the proliferation was notably decreased in all groups by DADS(P<0.05). RT-PCR and Western blot showed that the expressions of mRNA and protein of RORα and Wnt1 were respectively downregulated and up-regulated in silence group, and the expressions of RORα and Wnt1 were respectively upregulated and downregulated in all groups by DADS(P<0.05). The expressions of β-catenin mRNA and protein in all groups in circa treated by DADS had no significant deviation(P>0.05). Co-immunoprecipitation exhibited that RORα bind to β-catenin had significant increase after treated by DADS, but RORα bind to β-catenin showed significant decrease in silence group(P<0.05). The expressions of intranuclear β-catenin and p-β-catenin were markedly downregulated by DADS, however, the expressions were evidently up-regulated in silence group(P<0.05). At the same time, the expression of TCF-4 was downregulated by DADS, yet the expression of TCF-4 was up-regulated in silence group(P<0.05). RT-PCR and Western blot showed that DADS decreased the expressions of mRNA and proteins of target genes of Wnt/β-catenin pathway, such as Axin, c-Myc and c-Jun, and inhibited the promoter activity of c-Myc by DADS.Conclusion The upregulation of RORα could suppress the expression of target genes of Wnt/β-catenin pathway, and then inhibit the proliferation in MGC803 cells by DADS.
diallyl disulfide; human gastric cancer cells; RORα; Wnt/β-catenin signaling pathway; correlated molecules; target genes; promoter activity
时间:2017-3-13 8:38
http://kns.cnki.net/kcms/detail/34.1086.R.20170324.1247.030.html
2016-06-08;
2016-12-15
国家自然科学基金资助项目(No 81374013, 81102854); 湖南省卫计委科研课题(No B2015-182)
苏 坚(1975-),男,硕士,副主任医师,研究方向:消化系统肿瘤发生与防治分子机制,E-mail: sj5929@163.com; 赵晓红(1978-),女,硕士,主治医师,研究方向:胃癌发生与防治分子机制,并列第一作者,E-mail: zhaoxiaohx@163.com; 苏 琦(1945-),男,教授,博士生导师,研究方向:胃癌发生与防治分子机制,通讯作者,E-mail: suqi1945@163.com
10.3969/j.issn.1001-1978.2017.04.015
A
1001-1978(2017)04-0522-07
R329.25;R392.11;R394.2;R735.2;R916.4

