油茶籽粕蛋白功能特性及其酶解产物抗氧化活性研究
刘 静 李 旭 向春蓉 刘 露 冯士令 丁春邦
(四川农业大学生命科学学院,雅安 625014)
油茶籽粕蛋白功能特性及其酶解产物抗氧化活性研究
刘 静 李 旭 向春蓉 刘 露 冯士令 丁春邦
(四川农业大学生命科学学院,雅安 625014)
采用碱溶酸沉法提取油茶籽粕中的蛋白质,运用正交试验优化提取的最佳条件,并分析油茶籽粕蛋白功能特性及其木瓜蛋白酶水解物的抗氧化活性。结果表明,在pH 10、料液比1∶30(m/V)、提取时间3 h、提取温度50℃的最佳条件下,油茶籽粕蛋白的得率为4.99%。油茶籽粕蛋白等电点在pH 5左右。乳化能力、乳化稳定性和起泡能力随pH增加呈先降后升的趋势,与蛋白溶解度密切相关。木瓜蛋白酶能有效提高油茶籽粕蛋白溶解性,其蛋白水解物对DPPH·自由基和羟基自由基均具有很好的清除能力(清除率>85%),对铜离子的螯合能力大于对铁离子的螯合能力。
油茶籽粕蛋白 蛋白水解物 水解度 功能特性 抗氧化活性
油茶(Camellia oleifera Abel.)为山茶科山茶属(Camellia)常绿小乔木,是我国特有的一种优良的多年生木本油料植物。油茶籽粕作为油茶种子榨油后的主要副产物,目前主要用作燃料、有机肥或动物饲料,甚至被当作垃圾丢弃,造成资源的极大浪费[1]。因此,充分开发和利用油茶籽粕具有一定的实际意义。
油茶籽粕含有丰富的蛋白质、多糖和皂苷等多种生物活性成分,其粗蛋白质量分数达15%~20%,有17种氨基酸,其中8种是人体必需氨基酸,可用于生产蛋白饮料、冲调食品和食品添加剂[2-3]。用蛋白酶水解油茶籽粕蛋白制备小分子多肽,易被人体消化吸收,不仅能提供人体生长发育所需的营养物质,还具有很强的抗氧化、降血脂、免疫调节和降血压等生理保健功能[4-5]。目前,多种油料种子饼粕如大豆、油菜、花生和棉籽等,因其含有高品质植物蛋白,广泛应用于食品工业[6-8]。
本试验以油茶籽粕为原料,通过正交试验优化最佳蛋白提取条件,探讨油茶籽粕蛋白的溶解性、乳化性和起泡性等功能特性;同时用木瓜蛋白酶水解油茶籽粕蛋白,分析蛋白水解物的抗氧化活性,为开发利用油茶籽粕蛋白提供参考。
1 材料与方法
1.1 材料、试剂与仪器
油茶籽粕:雅安太时生物科技有限公司,经干燥、粉碎,过60目筛,备用。2,2-二苯基-1-苦味基肼(DPPH)、1,10-菲啰啉和菲洛嗪:美国Sigma公司;邻苯二酚紫和三硝基苯磺酸(TNBS):Kayon生物科技公司。
紫外分光光度计UV-1750:日本岛津公司;pH-4C酸度计:成都世纪方舟科技有限公司;FW135高速万能粉碎机、DZF真空干燥箱:北京永光明医疗仪器厂;RE-2000B旋转蒸发仪:上海亚荣生化有限公司;SHZ-D循环水式真空泵:巩义予华仪器有限公司;离心机:德国Thermo公司。
1.2 油茶籽粕蛋白的提取及正交优化
油茶籽粕粉末用正己烷浸提24 h以除去残余油脂,经75%乙醇浸提5次,每次1 h,以除去皂苷、多酚等物质,干燥备用。在单因素试验基础上,选取合适的因素水平进行正交优化(表1)。称取100 g处理过的油茶籽粕粉末,按试验设计所给的条件提取蛋白,过滤、离心。上清液用1 mol/L HCl调至pH 4.5,于6 000 r/min离心20 min,得沉淀,经80%乙醇洗涤2次,真空干燥,即得油茶籽粕蛋白并称重。蛋白质得率=提取的蛋白质的质量/油茶籽粕粉末质量× 100%。

表1 因素水平表
1.3 油茶籽粕蛋白功能特性测定
1.3.1 蛋白溶解性测定
蛋白溶解度测定方法参照Li等[9]的方法,稍有修改。100 mg样品溶于10 mL双蒸水。在相应温度下,水浴振荡30 min后,于8 000 r/min离心10 min,取上清,蛋白含量用Lowery法测定[10]。
1.3.2 蛋白乳化性测定
蛋白乳化性测定方法参照Li等[9]的方法,略有修改。一定浓度的样品溶液用1 mol/L NaOH/HCl调节至一系列的pH值(3~9)。取6 mL蛋白溶液,加入2 mL大豆油,于匀浆机5 000 r/min下搅拌2 min。分别在静止10 s和10 min后,取下层乳状液,用0.1%SDS溶液稀释100倍,充分混匀,于500 nm下测定吸光度,以SDS溶液为空白对照。乳化能力和乳化稳定性计算公式:
乳化能力/m2/g=(2×2.303A)×100/φC
乳化稳定性=A0×10/(A0-A10)×100%
式中:A0为静止10 s时的吸光度;A10为静止10 min时的吸光度;C为蛋白浓度;φ为油的体积分数。
1.3.3 蛋白起泡性测定
蛋白起泡性测定方法参照Li等[9]的方法,略有修改。一定浓度的样品溶液用1 mol/L NaOH/HCl调节至一系列的pH值(3~9),定容至20 mL,于5 000 r/min下搅拌2 min。分别在0和30 min后,测定总体积。起泡能力和泡沫稳定性计算公式:
起泡能力=(A0min-B)/B×100%
泡沫稳定性=(A30min-B)/(A0min-B)×100%
式中:A0min、A30min分别为搅拌后静止0、30 min时的总体积;B为搅拌前的体积。
1.4 油茶籽粕蛋白水解物制备及水解度测定
准确称取油茶籽粕蛋白样品1.703 g,用适量蒸馏水溶解,加入木瓜蛋白酶54.7 mg,充分溶解混匀,调节pH在6~7范围内,并定容到80 mL。取7只10 mL EP管编号1~7,分别准确量取10 mL溶液,置于55℃水浴下保温。保温时间分别为0.5、1、1.5、2、3、4、5 h。按时间取出,于沸水中煮2 min,室温放置,备用。
水解度的测定采用Benjakul等[11]的方法,基于α-氨基基团与三硝基苯磺酸(TNBS)反应。1 mL样品溶于2.0 mL 0.2 mol/L PBS(pH 8.2)和1 mL 0.01%TNBS,黑暗下,于50℃放置30 min;用2.0 mL 0.1 mol/L亚硫酸钠终止反应,冷却至室温,15 min后,于420 nm测定吸光度。水解度计算公式:
水解度=(As-A0)/(Amax-A0)×100%
式中:As为酶水解蛋白样品的吸光度;A0为未水解蛋白的吸光度;Amax为经酸完全水解蛋白后(经6 mol/L HCl,100℃水解24 h)的吸光度。
1.5 油茶籽粕蛋白水解物的抗氧化研究
以对DPPH·和羟基自由基清除能力和金属离子螯合能力作为测定油茶籽粕蛋白水解物体外抗氧化能力的指标。
1.5.1 DPPH·自由基清除活性
采用Li等[9]的分光光度法测定。1.0 mL样品加入3.0 mL 0.15 mmol/L的DPPH自由基溶液(95%乙醇),摇匀,黑暗室温反应30 min,517 nm处测定吸光度。DPPH·清除能力参照公式计算:
DPPH·自由基清除率=[A0-(As-Ah)]/A0× 100%
式中:A0为双蒸水代替样品时的吸光度;Ah为双蒸水代替DPPH溶液的吸光度;As为样品的吸光度。
1.5.2 羟基自由基清除活性
采用Zhou等[12]的方法测定。0.4 mL样品加入到1.5 mL 0.75 mmol/L邻二氮菲,1.5 mL 0.75 mmol/L FeSO4和0.4 mL 0.1%H2O2,摇匀,于37℃水浴60 min,536 nm处测定吸光度。
羟基自由基清除率=(As-A0)/(A-A0)×100%
式中:A为双蒸水替代样品和H2O2溶液时的吸光度;A0为双蒸水替代样品时的吸光度;As为样品的吸光度。
1.5.3 铁离子螯合能力
采用Li等[9]的方法测定。1 mL样品加入3.7 mL双蒸水和0.1 mL 2mmol/L FeCl2,摇匀,加入0.2 mL 5 mmol/L菲洛嗪,室温反应20 min后,于562 nm处测定吸光度。
铁离子螯合能力=(A0-As)/A0×100%
式中:A0为双蒸水代替样品时的吸光度;As为样品的吸光度。
1.5.4 铜离子螯合能力
采用Li等[9]的方法测定。1 mL样品加入2 mL 0.1%CuSO4溶液和0.5 mL 4 mmol/L邻苯二酚紫溶液,室温反应20 min后,于632 nm处测定吸光度。计算公式与铁离子螯合能力计算公式一致。
1.6 数据统计分析
所有试验均重复3次,用Origin pro 8.0和SPSS 19.0软件进行数据统计与分析。
2 结果与分析
2.1 油茶籽粕蛋白提取工艺优化
在单因素试验基础上,以pH值(A)、料液比(B)、提取时间(C)、提取温度(D)为自变量,以油茶籽粕蛋白得率(Y)为因变量,进行四因素三水平正交试验设计,试验结果与分析见表2。由R值分析得出,各因素对油茶籽粕蛋白提取率的影响大小为B>A>D>C,即料液比的影响最大,其次是碱液pH值、提取温度和提取时间。通过K值可判断出最佳的提取条件是A2B2C2D2,即pH 10、料液比1∶30(m/V)、提取时间3 h、提取温度50℃。在此条件下,经验证蛋白得率为4.99%。碱溶酸沉法是工业生产中常用的种子饼粕蛋白的提取方法,丁丹华等、熊拯等先后用碱溶酸沉法提取了油茶籽粕蛋白,分别得到57.8%和48.59%的提取率[13-14],本试验优化后得到4.99%的得率,因为供试材料原因(样品的粗蛋白质量分数为10.75%),换算为提取率略低于前二者的研究,但其提取率也达到46.42%。

表2 L9(34)正交试验设计及结果
2.2 油茶籽粕蛋白功能特性分析
2.2.1 蛋白溶解性
蛋白质的溶解性是蛋白质固有的性质,对其应用有着重要的影响。在控制加工温度的条件下,蛋白质的溶解性与pH值有着密切的关系。
如图1所示,油茶籽粕蛋白的溶解性随pH值的变化而变化。在pH 5左右,蛋白溶解度最低,表明油茶籽粕蛋白的等电点在pH 5左右,在偏离等电点的环境中,蛋白均有较高的溶解度。50℃时的蛋白溶解度在pH 3~12下均高于30和70℃时的溶解度,且碱性条件下的溶解度高于酸性条件下的溶解度,在pH 12时的溶解度达82%。一般地,低温不利于蛋白分子与水分子的相互作用,而高温则会破坏蛋白分子的空间结构,减弱蛋白分子的稳定性,致使蛋白溶解度降低。在酸性条件下,70℃时的蛋白溶解度与30℃时的溶解度无明显差异,而碱性条件下低于30℃时的溶解度,表明碱性条件下油茶籽粕蛋白更易受高温影响。
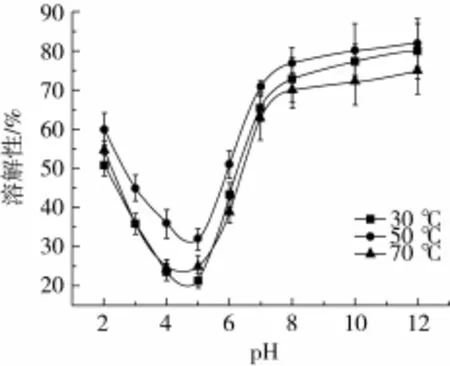
图1 不同温度对油茶籽粕蛋白溶解性的影响
2.2.2 蛋白乳化性与乳化稳定性
乳化性指蛋白质将油水结合在一起形成乳状液的性能,乳化稳定性是指油水乳状液保持稳定的能力。蛋白乳化性和乳化稳定性与蛋白质分子的亲水和亲油基团在分子表面的分布有关,蛋白质变性不同,蛋白质内部疏水基团的暴露程度不同,因此,其乳化性和乳化稳定性也不同[15]。通常,影响蛋白产品乳化性与乳化稳定性的因素有蛋白颗粒的大小、蛋白质的浓度、溶液的pH值、温度等。
图2a、图2b为室温条件下pH值和蛋白浓度对乳化性和乳化稳定性的影响。图2c、图2d为蛋白浓度为1.5 mg/mL时pH值和温度对乳化性和乳化稳定性的影响。
从图2a、图2b可以看出,油茶籽粕蛋白的乳化能力随pH值的增加呈先降后升的趋势,接近蛋白的等电点(pH 5左右)时,蛋白的溶解性最低,乳化性质也低。蛋白的乳化活性与它的溶解度的关系密切,偏离等电点时,pH增加可以提高蛋白的溶解性,分子中的疏水基团暴露,促进了乳化形成。蛋白浓度和温度对乳化能力也有影响,高质量浓度蛋白(1.5 mg/mL)对油茶籽粕蛋白的乳化能力有一定的抑制作用,蛋白浓度为1.0 mg/mL、pH 9时有最好的乳化能力(371.5 m2/g)(图2a)。在pH 5时,油茶籽粕蛋白在70℃时乳化能力最差,在50℃时乳化能力最高;在远离pH 5环境中,50和70℃时均具有良好的乳化能力,温度为50℃、pH 9时乳化能力达到248.5 m2/g(图2c)。
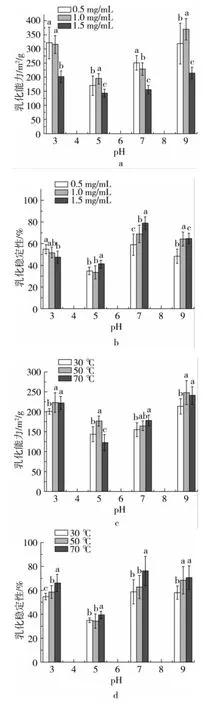
图2 油茶籽粕蛋白乳化性能
图2b、图2d显示,随着pH值的增加,油茶籽粕蛋白的乳化稳定性呈先降后升再略有下降的趋势,在蛋白的等电点(pH 5左右)时乳化稳定性最差,在pH 7时最好,当pH大于7时,乳化稳定性降低,可能是由于溶解度增加,疏水基团暴露,蛋白的黏度降低导致。pH影响蛋白分子弱酸、弱碱性基团从而影响蛋白分子的构象及理化性质,使浓度和温度对蛋白乳化性能的影响因酸碱环境的不同而异[16]。在pH 3时乳化稳定性随浓度增加而减小,而在pH 7时则随浓度增加而增加,在pH≥5时高浓度蛋白比低浓度表现出更强的乳化稳定性(图2b)。从图2d可以看出,油茶籽粕蛋白乳化稳定性随温度升高而升高,在70℃、pH 7时,乳化稳定性达77.6%。
2.2.3 蛋白起泡性
起泡性是蛋白质搅打起泡的能力,蛋白质泡沫是蛋白质在一定条件下与水分、空气形成的一种特殊形态的混合物。泡沫稳定性是指泡沫保持稳定的能力。蛋白质的起泡性和泡沫稳定性与蛋白质浓度、pH、溶解度、温度等有密切关系。
图3a、图3b为室温条件下pH值和蛋白浓度对起泡性和泡沫稳定性的影响。图3c、图3d为蛋白浓度为1.5 mg/mL时pH值和温度对起泡性和泡沫稳定性的影响。
如图3所示,油茶籽粕蛋白的起泡能力随pH值的增加呈先降后升的趋势,在等电点附近蛋白溶解度最低,蛋白起泡能力也最低,而泡沫稳定性则随pH值的增加呈先升后降的趋势,在pH为7时泡沫稳定性最好,与菜籽蛋白、牡丹籽蛋白等油料蛋白的研究结果相似,表明中性环境有利于蛋白的泡沫稳定性[17-18]。
图3a显示,油茶籽粕蛋白起泡能力随蛋白浓度的增加而增加。在pH≥5环境中,高质量浓度(≥1.0 mg/mL)的蛋白起泡能力增加不明显(P>0.05),并抑制泡沫稳定性,而低浓度的蛋白则具有良好的泡沫稳定性。质量浓度为0.5 mg/mL、pH 7时,泡沫稳定性最好,达82.3%(图3b)。盛彩虹等[19]对紫苏蛋白的起泡性和泡沫稳定性分析认为紫苏蛋白的起泡性和泡沫稳定性都随蛋白质浓度的增大而增大,而本试验显示仅起泡性随蛋白质浓度的增大而增大,这可能与蛋白质种类和性质不同有关。
图3c显示,弱酸(pH 5)和中性环境中,温度对蛋白起泡能力的影响不显著,但在强酸强碱性(pH 3或pH 9)环境中,蛋白起泡性随温度增加而增加。图3d显示,低温(30℃)、中性环境(pH 7)时蛋白泡沫稳定性最高,高温(70℃)或强酸强碱性(pH 3或pH 9)均显著抑制蛋白泡沫稳定性,因为泡沫稳定性受蛋白变性程度的影响[20]。结果显示,低质量浓度(0.5 mg/mL)、低温(30℃)、中性环境(pH 7)时油茶籽粕蛋白的起泡能力和泡沫稳定性综合表现优良。

图3 油茶籽粕蛋白起泡性能
2.3 油茶籽粕蛋白水解度及溶解性分析
利用木瓜蛋白酶水解油茶籽粕蛋白,由图4显示,蛋白水解度和溶解性均随水解时间延长而增加,在开始水解1.5 h内增长迅速,水解度从0.5 h的9.1%迅速增加到1.5 h的15.9%,蛋白溶解度从71.6%迅速增加至82.1%,而后,溶解度增加减缓,到水解结束时(5 h),其水解度为22.8%,溶解度为88.6%(图4)。随着水解时间的延长,酶解反应充分,水解度增加,因产生更多的多肽片段,增加了蛋白溶解性。

图4 水解时间对油茶籽粕蛋白水解度及溶解性的影响
2.4 油茶籽粕蛋白水解物抗氧化活性分析
自由基具有细胞毒性,能破坏细胞膜,损伤蛋白质,导致DNA突变,修饰低密度脂蛋白,还能氧化油脂导致食品变质和营养流失[5,9]。由图5所示,油茶籽粕蛋白水解物对DPPH·自由基和羟基自由基均有较好的清除能力,其清除率均>85%。随水解时间增加,DPPH·自由基清除活性增加,从0.5 h的86.8%增加至水解结束时的97.2%,而羟基自由基清除活性则呈先增加后减少的趋势,在2 h时的清除率最高(92.9%)。

图5 油茶籽粕蛋白酶解产物自由基清除活性与金属螯合能力
过渡金属离子如铁离子、铜离子等能催化自由基的产生导致氧化加速,因而螯合过渡金属离子能够延缓自由基的产生,延迟氧化[9,12]。由图5所示,随水解时间增加,油茶籽粕蛋白水解物对铁离子螯合能力呈先降后升趋势,而对铜离子螯合能力无显著影响,维持在45%左右,表明不同水解时间水解出的肽类不同,对金属离子的螯合能力不同。对铁离子的螯合能力在水解2 h时最低(12.6%),在5 h时最高(42.2%),均低于对铜离子的螯合能力。
3 结论
3.1 经正交试验优化出了油茶籽粕蛋白的最佳提取条件:pH 10、料液比1∶30(m/V)、提取时间3 h、提取温度50℃,此条件下的蛋白得率为4.99%。
3.2 油茶籽粕蛋白的等电点在pH 5左右,其蛋白溶解度最低;50℃时的蛋白溶解性较高,且碱性条件下的溶解度更高,在pH 12时溶解度达82%。浓度和温度对蛋白功能特性的影响因pH值的不同而不同,乳化能力和起泡能力在pH 9时最好,乳化稳定性和泡沫稳定性在pH 7时最好。高浓度(1.5 mg/mL)对蛋白的乳化能力和泡沫稳定性起抑制作用。高温(70℃)增加了乳化稳定性,抑制了泡沫稳定性。
3.3 木瓜蛋白酶水解油茶籽粕蛋白能有效提高蛋白溶解性,其蛋白水解物对DPPH·自由基和羟基自由基均具有很好的清除能力(清除率>85%),对金属离子螯合能力受水解时间和离子类型的影响,对铜离子的螯合能力大于对铁离子的螯合能力。
[1]罗晓岚,朱文鑫.油茶籽油加工和油茶资源综合利用[J].中国油脂,2010,35(9):13-17 Luo X L,Zhu W X.Processing technology of oil-tea camellia seed oil and comprehensive utilization of camellia eifera resources[J].China Oils and Fats,2010,35(9):13-17
[2]钟旭美,张百刚,朱杰.我国油茶籽的综合利用[J].粮油食品科技,2007,15(2):34-36 Zhong X M,Zhang B G,Zhu J.The comprehensive utilization of camellia oleifera seed[J].Science and Technology of Cereals,Oils and Foods,2007,15(2):34-36
[3]丁丹华,彭光华,何东平.HPLC法测定油茶籽多肽相对分子质量分布及氨基酸组成[J].中国油脂,2010,35(11):68-71 Ding D H,Peng G H,He D P.Determination of relative molecular weight distribution and amino acids composition of oil -tea camellia seed peptides by high performance liquid chromatography[J].China Oils and Fats,2010,35(11):68-71
[4]龚吉军,李忠海,钟海雁,等.茶籽多肽的制备及抗氧化活性研究[J].食品研究与开发,2007,28(10):59-61 Gong J J,Li Z H,Zhong H Y,et al.Study on preparation and antioxidant activity of tea-seed peptide[J].Food Research and Development,2007,28(10):59-61
[5]Sarmadi B H,Ismail A.Antioxidant peptides from food proteins:a review[J].Peptides,2010,31(10):1949-1956
[6]高海燕,赵镭,尹京苑,等.棉籽分离蛋白功能性质的研究[J].食品科学,2008,29(11):72-76 Gao H Y,Zhao L,Yin J Y,et al.Study on functional properties of cotton seed protein isolate[J].Food Science,2008,29(11):72-76
[7]黄明亮,王雪莹,孙颖,等.菜籽蛋白功能性质及抗氧化的研究进展[J].食品工业科技,2012,33(12):405-413 Huang M L,Wang X Y,Sun Y,et al.Review on functional properties and antioxidant of rapeseed protein[J].Science and Technology of Food Industry,2012,33(12):405-413
[8]Moure A,Sineiro J,Dominguez H,et al.Functionality of oilseed protein products:A review[J].Food Research International,2006,39(9):945-963
[9]Li X,Shen S,Deng J,et al.Antioxidant activities and functional properties of tea seed protein hydrolysates(Camellia oleifera Abel.)influenced by the degree of enzymatic hydrolysis[J].Food Science and Biotechnology,2014,23(6):2075-2082
[10]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the Folin phenol reagent[J].The Joural of Biological Chemistry,1951,193(1):265-275
[11]Benjakul S,Morrissey M T.Protein hydrolysates from Pacific whiting solid wastes[J].Journal of Agricultural and Food Chemistry,1997,45(9):3423-3430
[12]Zhou D Y,Zhu B W,Qiao L,et al.In vitro antioxidant activity of enzymatic hydrolysates prepared from abalone(Haliotis discus hannai Ino)viscera[J].Food and Bioproducts Processing,2012,90(2):148-154
[13]丁丹华,彭光华,夏辉,等.油茶籽粕蛋白提取工艺研究[J].食品科学,2010,31(8):102-105 Ding D H,Peng G H,Xia H,et al.Orthogonal array design for extraction optimization of protein from Camellia oleifera seed meal[J].Food Science,2010,31(8):102-105
[14]熊拯,陈敏娥,张炳亮.油茶籽粕蛋白质提取工艺及功能特性研究[J].粮油食品科技,2013,21(1):27-30 Xiong Z,Chen M E,Zhang B L.Research on extraction of protein from camellia oleifera seed meal and the functional properties[J].Science and Technology of Cereals,Oils and Foods,2013,21(1):27-30
[15]Hung S C,Zayas J F.Emulsifying capacity and emulsionstability of milk proteins and corn gem protein flour[J]. Journal of Food Science,2006,56(5):1216-1219
[16]Chobert J M,Bertrand H C,Nicolas M G.Solubility and emulsifying properties of caseins and whey proteins modified enzymically by trypsin[J].Journal of Agricultural and Food Chemistry,1988,36(5):883-892
[17]黄明亮,王雪莹,孙颖,等.菜籽蛋白功能性质及抗氧化的研究进展[J].食品工业科技,2012,33(12):405-408 Huang M L,Wang X Y,Sun Y,et al.Review on functional properties and antioxidant of rapeseed protein[J].Science and Technology of Food Industry,2012,33(12):405-408
[18]庞雪风,何东平,胡传荣,等.牡丹籽蛋白功能特性的研究[J].中国粮油学报,2014,29(7):45-48 Pang X F,He D P,Hu C R,et al.Functional characteristics of peony seed protein[J].Journal of the Chinese Cereals and Oils Association,2014,29(7):45-48
[19]盛彩虹,刘晔,刘大川,等.紫苏分离蛋白功能性研究[J].食品科学,2011,32(17):137-140 Sheng C H,Liu Y,Liu D C,et al.Functional properties of perilla seed protein isolate[J].Food Science,2011,32(17):137-140
[20]Kumar K S,Ganesan K,Selvara J K,et al.Studies on the functional properties of protein concentrate of Kappaphycus alvarezii(Doty)Doty-An edible seaweed[J].Food Chemistry,2014,153(1):353-360.
Functional Properties of Camellia Oleifera Seed-Cake Protein and Antioxidant Activity of Its Enzymatic Hydrolysate
Liu Jing Li Xu Xiang Chunrong Liu Lu Feng Shiling Ding Chunbang
(College of Life and Science,Sichuan Agricultural University,Yaan 625014)
The extraction of protein from Camellia oleifera seed-cake by alkali-soluble acid precipitation was used in order to optimize extraction conditions of C.oleifera seed-cake protein(SCP)by orthogonal experimental design.Meanwhile,the functional properties of SCP and antioxidant activity of its hydrolysate prepared by papain were evaluated.Results showed that the optimum extraction conditions were pH 10,material-liquid ratio 1∶30(m/V),temperature 50℃ and time 3 h,based on which SCP yield was 4.99%.SCP isoelectric point was at around pH 5. As pH increased,emulsifying capacity and stability and foaming capacity of SCP presented an initial drop and subsequent rise,positively correlating with protein solubility.Papain treatment improved the protein solubility effectively. Papain-treated hydrolysate possessed excellent DPPH and hydroxyl radical scavenging activity both with above 85%,and copper chelating capacity was stronger than iron chelating capacity.
Camellia oleifera seed-cake protein,protein hydrolysate,hydrolysis degree,functional properties,antioxidant activity
TQ936.2
A
1003-0174(2017)01-0040-07
四川省科技厅科技支撑计划(2013NZ0047)
2015-05-25
刘静,女,1978年出生,博士,植物资源保护与利用
丁春邦,女,1966年出生,教授,植物资源评价与利用

