葡萄糖代谢与利用对奶牛生产的影响
王 炳 汪 悦 蒋林树* 刘建新
(1.奶牛营养学北京市重点实验室,北京农学院动物科学技术学院,北京102206;2.浙江大学动物科学学院奶业科学研究所,杭州310058)
葡萄糖代谢与利用对奶牛生产的影响
王 炳1,2汪 悦1蒋林树1*刘建新2*
(1.奶牛营养学北京市重点实验室,北京农学院动物科学技术学院,北京102206;2.浙江大学动物科学学院奶业科学研究所,杭州310058)
葡萄糖是脑细胞等中枢神经系统和胚胎的主要供能物质,也是泌乳奶牛合成乳糖的前体物质,并且与乳脂、乳蛋白合成密切相关,对泌乳奶牛具有重要的营养生理功能。为了提高奶牛泌乳性能以及生理健康,有必要深入研究奶牛葡萄糖的营养与生理功能。本文从葡萄糖的生成、乳腺中葡萄糖代谢与调节、葡萄糖代谢对奶牛生产影响等几个方面对泌乳奶牛葡萄糖的代谢与利用进行综述,为进一步揭示奶牛葡萄糖的代谢机制、提高奶牛对葡萄糖利用、促进奶牛生产提供参考依据。
奶牛;葡萄糖;糖异生;乳腺;调节
在哺乳动物中,葡萄糖是乳糖的主要前体物,并且是乳腺(腺泡)上皮分泌细胞乳蛋白及脂肪合成的底物。在哺乳期间,乳糖由乳腺腺泡上皮分泌细胞的高尔基体、囊泡合成。乳腺由于缺乏葡萄糖-6-磷酸酶(G6Pase),因此不能从其他前体合成葡萄糖[1-2],它必须依赖于供血以满足其对葡萄糖的需求。在8~10月龄荷斯坦后备奶牛饲粮营养需要中,饲粮代谢葡萄糖水平为113.59 g/kg时能满足0.8~1.0 kg/d日增重的需要[3],饲粮代谢葡萄糖水平为99.27 g/kg时可显著提高奶牛产奶量和采食量[4]。对于平均产奶量为40 kg/d的奶牛来说,每天最多要从乳腺的血液中摄取3 kg的葡萄糖[5-6]。而乳腺对血液中葡萄糖的摄取是一种被动和易化转运过程[7],这个过程通过葡萄糖转运载体(glucose transporter,GLUT)所介导。通过乳腺摄取的葡萄糖再进入血液的总葡萄糖中可以占到多达60%~85%[6]。乳糖可以维持牛奶的渗透压,乳糖合成的速率是产奶量的主要控制因素[8],因此,乳腺摄取葡萄糖被认为是乳汁生成的限速步骤[5,9]。因此,本文将围绕奶牛机体葡萄糖代谢规律与机制(瘤胃丙酸生成、肝脏糖异生、乳腺葡萄糖代谢)以及其与奶牛生产的关系进行阐述。
1 葡萄糖来源
葡萄糖是动物生命与生产活动中不可缺少的营养物质,它在机体内直接参与新陈代谢过程,是重要的营养单糖。同时,葡萄糖也是能量代谢以及所有哺乳动物细胞合成途径中的基本的燃料[10],需要在血流中不断维持在足够的水平。动物体内葡萄糖来源主要有3种途径:1)饲粮碳水化合物消化产生葡萄糖。饲粮中的碳水化合物经过动物消化道内消化酶的消化分解形成葡萄糖,经消化道上皮吸收进入血流,然后进入全身组织代谢过程。2)肝脏糖异生作用产生葡萄糖。饲粮中的碳水化合物在动物消化道内消化分解为丙酸或乳酸等,随后吸收进入肝脏后进行糖异生作用产生葡萄糖。3)生糖氨基酸转化产生葡萄糖。饲粮中的蛋白质或动物消化道内微生物蛋白质,可消化为生糖氨基酸,生糖氨基酸经糖异生作用形成葡萄糖。通常第1种途径来源的葡萄糖为外源葡萄糖,后2种途径来源的葡萄糖统称为内源葡萄糖。在反刍动物中,内源葡萄糖生成过程主要由瘤胃丙酸(葡萄糖前体物)生成和肝脏糖异生2个途径组成。
1.1 瘤胃丙酸生成
在反刍动物中,丙酸主要由瘤胃微生物发酵产生,是肝脏糖异生的主要前体物[11]。丙酸的供应量对糖异生有重要影响[12]。提高丙酸的供给可以增加肝脏糖异生活动[13]。Lemosquet等[14]研究了瘤胃灌注丙酸对泌乳奶牛葡萄糖代谢及乳腺能量代谢的影响,结果表明,丙酸可以影响机体葡萄糖周转,增强糖异生能力,维持乳糖、乳蛋白及产奶量的稳定。也有报道表明,瘤胃内灌注丁酸同样可以降低血液中葡萄糖浓度进而降低乳糖合成[15]。Wang等[16]研究发现,饲喂稻草饲粮奶牛瘤胃丙酸浓度和血液中葡萄糖浓度显著低于饲喂苜蓿饲粮奶牛,因此饲喂稻草的奶牛可能由于缺少丙酸的供应,因此降低了葡萄糖的合成。植物挥发油如辣椒油可调控瘤胃发酵类型,使瘤胃维持丙酸型发酵[17]。而围产期奶牛机体代谢具有特殊性和复杂性,其瘤胃发酵类型调控相关研究还较少。因此,建立围产期瘤胃发酵调控模型,通过体内试验研究其发酵模式和调控手段,可为促进肝脏糖异生和葡萄糖高效利用提供科学支撑。
1.2 肝脏糖异生
反刍动物体内葡萄糖的生成主要来源于肝脏的糖异生作用,糖异生即将血液通过门静脉循环系统运输至肝脏的丙酸,在各种酶的作用下合成葡萄糖的过程[18]。糖异生过程中,几个重要的限速酶为葡萄糖-6-磷酸酶、磷酸烯醇式丙酮酸激酶(PEPCK)和丙酮酸羧化酶(PC),糖异生途径限速酶活性大小反映了机体葡萄糖异生作用的程度。有报道称糖异生关键酶的mRNA表达丰度可以反映出其酶的活性[19]。奶牛分娩前肝脏糖原含量较高,分娩后显著降低,随后逐渐增加,具体表现为PEPCK的mRNA表达丰度在奶牛围产期随着生糖作用增强而显著提高[19-21],泌乳中期奶牛的PCmRNA表达丰度在限饲条件下出现负反馈调节而表现出显著升高[22]。营养物质底物、酶和激素等可以共同调控反刍动物肝脏糖异生活动,增加底物、提高酶的活性或者注射外源激素均可促进葡萄糖的生成,进而维持机体葡萄糖的代谢稳衡。White等[23]研究发现,用甘油替代玉米可以提高奶牛肝脏中PEPCK的表达,表明饲粮不同能量来源可以调控肝脏基因表达。有研究利用体外肝脏细胞模型发现丙酸可以通过调节肝脏线粒体中PEPCK启动子来促进PEPCK的基因表达[24],也有研究发现在奶牛围产后期通过提高PC的启动子1来调控PC的表达[25]。王炳[26]研究发现,饲喂稻草饲粮奶牛肝脏细胞线粒体的PEPCK和PC的mRNA表达丰度相比较于饲喂苜蓿饲粮的奶牛显著降低,这可能意味着正是由于奶牛饲喂稻草饲粮后,肝脏糖异生活动减弱,因此导致葡萄糖的供应不足。饲粮蛋白质水平可通过影响机体氨基酸代谢和提高生糖氨基酸水平而促进这些酶的分泌[19]。也有报道称饲粮添加丙二醇后,提高了奶牛分娩后第7、21和35天肝糖原含量和糖异生限速酶活性[21]。Rhoads等[27]研究了外源生长激素对奶牛肝脏葡萄糖代谢的影响,结果发现,生长激素可促进肝脏糖异生,增加了动物可利用葡萄糖的供应量。
2 葡萄糖转运
作为一个极性的亲水性分子,葡萄糖不能通过简单扩散穿过细胞质膜的疏水脂双层[28],葡萄糖跨膜转运是葡萄糖高效利用的限速步骤。葡萄糖通过生物膜转运需要特定的机制和转运蛋白。在哺乳动物细胞中,葡萄糖通过2个独立的机制进行摄取,这一过程由钠依赖性葡萄糖转运体(sodium depedent glucose transporter,SGLT)和GLUT共同完成[29]。1)钠离子(Na+)-依赖性转运:葡萄糖通过肠上皮细胞顶侧膜、脉络丛和肾近曲小管进行转运,依赖于Na+连接的次级主动转运机制,并由Na+/葡萄糖协同转运,蛋白质符号SGLT,基因符号SLC5[30-32]。该SLC5家族目前有12个结构相关的成员(SGLT1~6、SMIT1、NIS、SMVT、CH1、SMCT1和SMCT2)[32]。这些转运体有不同的组织分布和底物特异性。这些转运体中,SGLT1(SLC5A1)、SGLT2(SLC5A2)、SGLT3(SLC5A4)、SGLT4(SLC5A9)、SGLT5(SLC5A10)和SMIT1(SLC5A3)已显示对葡萄糖具有转运活性。SGLT1主要表达于小肠成熟上皮细胞的刷状缘膜,并在吸收葡萄糖和半乳糖起着主要作用[31]。2)易化转运:存在于肠上皮细胞基底外侧膜、脉络丛和肾近曲小管膜,以及几乎所有其他细胞质膜,由促进葡萄糖转运体所介导,蛋白质符号GLUT,基因符号SLC2。易化扩散中,葡萄糖沿其浓度梯度双向运输而不需要能量。GLUT家族属于2个最大的膜转运家族之一,在哺乳动物中,有14种GLUT,命名为GLUT1~12和14以及HMIT[33]。GLUT1是GLUT的主要异构体,米氏常数(Km值)为10 mmol/L。GLUT1在许多组织和细胞中普遍表达,在细胞和组织中,GLUT1在葡萄糖摄取以及葡萄糖穿过组织-血液屏障运输中起着重要作用[34-35]。GLUT1除了主要在质膜上存在,也在乳腺上皮细胞的高尔基体膜上表达,并很可能在乳糖合成的位点参与葡萄糖和半乳糖的吸收。因为乳糖合成影响产奶量,因此对葡萄糖转运蛋白表达和运输的机制研究对奶牛生产起到关键作用。
乳腺主要表达GLUT1及GLUT8[36]。乳腺葡萄糖转运活性从非泌乳状态到哺乳状态急剧增加,GLUT表达也随之增加。GLUT1在不同发育时期的奶牛乳腺中均有表达,在泌乳期间表达较高,泌乳140 d时达到最高峰值[37]。Zhao等[38]使用人cDNA探针,通过RNA印迹分析研究泌乳牛乳腺GLUT1~5的表达,结果发现哺乳期乳腺只表达大量GLUT1和少量GLUT3~5。有趣的是,在非哺乳期乳腺中还检测到一种38 ku的不同大小的GLUT1[39]。在新的GLUT被发现后,也检测到在哺乳期牛乳腺有明显的中等或低水平的GLUT8和GLUT12的mRNA[40]。另外在牛乳腺中也检测到低水平的SGLT2的mRNA[41],但是SGLT2在乳腺的生理作用仍需研究。
调控GLUT的数量和活性,增强葡萄糖转运能力,也是保证奶牛乳腺能量供应和维持代谢平衡的重要方式。胰岛素和胰高血糖素是维持机体血糖平衡,调控糖类代谢的关键激素,其对葡萄糖代谢的调控也必然伴随着GLUT的时空表达变化。胰岛素水平高低可影响GLUT4的表达及其转运[42]。赵珂[43]研究发现,高剂量催乳素可显著降低GLUT8基因表达,胰岛素可促进GLUT8基因表达,随着氢化可的松浓度增加,GLUT1和GLUT8基因表达均呈现先升高后降低的趋势。并发现胰岛素和氢化可的松有明显的交互作用,氢化可的松可拮抗胰岛素提高GLUT8基因表达的作用。王炳[26]研究发现,不同质量粗饲料饲粮对乳腺GLUT1、GLUT3和GLUT8的mRNA表达丰度均无显著影响。
3 乳腺中葡萄糖代谢与利用
3.1 乳腺对葡萄糖的摄取
乳腺葡萄糖摄取受许多因素影响,包括乳腺发育阶段、营养水平和乳腺代谢。在山羊中,从怀孕到哺乳期高峰,乳腺葡萄糖摄取量增加超过20倍,然后随着产奶量的减少逐渐下降[44]。Cant等[45]利用同位素标记葡萄糖进行灌注试验,结果显示,在哺乳期的荷斯坦奶牛中,乳腺对葡萄糖的摄取约为300 mmol/h时可以满足0.6 kg/h的产奶量。此发现与一个较早的观察接近,即牛乳腺摄取72 g葡萄糖以产生1 kg的牛奶[5]。泌乳反刍动物乳腺的葡萄糖摄取量可以占进入血液循环的总葡萄糖的60%~85%[6,46]。增加挤奶间隔时间会通过降低乳腺血流量和提取率而减少乳腺对葡萄糖的摄取[47]。有研究报道,奶牛乳腺葡萄糖摄取在一定程度上依赖于乳腺对乙酸盐摄取[48],表明了这2种营养素在牛乳腺中的相互作用。然而,乳腺葡萄糖摄取几乎没有受到氨基酸的影响,因为向奶牛皱胃灌注氨基酸对乳腺葡萄糖摄取无明显改变[49-50]。乳腺对葡萄糖的摄取可受到生长激素和甲状腺素刺激[51],但胰岛素并不刺激乳腺葡萄糖的摄取[44]。
乳腺对葡萄糖的摄取取决于乳腺葡萄糖供应和跨膜葡萄糖转运。前者是由动脉葡萄糖浓度和乳腺血流量确定。在哺乳动物中,动脉葡萄糖浓度由胰岛素和其他内分泌激素调节并保持在一个小范围内。在各种试验条件下对牛、羊的研究中无法找到乳腺动静脉葡萄糖差异和动脉葡萄糖浓度之间明显的关系[44-45,48],表明动脉葡萄糖浓度在正常的生理条件下可能不是影响乳腺葡萄糖摄取的主要因素。乳腺血流量在调节乳腺的营养供应中起重要作用[9,52]。一般来说,乳腺血流量和产奶量之间有着密切的关系[47]。Wang等[52]饲喂奶牛不同质量粗饲料源饲粮研究发现,优质苜蓿饲粮和秸秆饲粮相比显著提高了奶牛乳腺血流量,但不影响乳腺转运载体mRNA的丰度[26],因此,乳腺血流量可能是影响奶牛乳腺葡萄糖摄取的关键因素。
3.2 乳腺葡萄糖代谢途径与转运调节
3.2.1 代谢途径
葡萄糖进入乳腺后主要通过以下过程进行合成或分解代谢(图1)[36]:1)乳糖合成;2)进入三羧酸循环(TCA)产能;3)磷酸戊糖途径产生还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH);4)乳脂合成;5)非必需氨基酸合成;6)核苷酸合成。在乳糖合成过程中,葡萄糖首先不可逆地磷酸化为葡萄糖-6-磷酸,然后在细胞质中转化为半乳糖。葡萄糖和半乳糖都被高尔基体囊泡摄取并用于高尔基体膜上的乳糖合成酶合成乳糖。乳糖合成酶包括2个多肽亚基:α-乳清蛋白(α-LA)和β-1,4-半乳糖基转移酶(β-4Gal-T1)[53]。另外,葡萄糖-6-磷酸也可以进入糖酵解途径和戊糖磷酸途径。糖酵解期间,葡萄糖-6-磷酸被转换为磷酸丙糖,然后变为丙酮酸。磷酸丙糖也是一个合成α-甘油-磷酸盐的底物,它为甘油三酯的生物合成提供了一个骨架。丙酮酸被线粒体大量摄取以产生乙酰辅酶A(CoA),后者进入TCA产生ATP。柠檬酸作为TCA循环的底物可以离开线粒体,并通过在细胞质中的ATP柠檬酸裂解酶转化为乙酰CoA。细胞质中的乙酰CoA参与脂肪酸的合成。此外,丙酮酸和TCA循环底物可用于产生乳蛋白合成所需的非必需氨基酸。磷酸戊糖途径产生NADPH和核糖。前者为脂肪酸的生物合成提供还原能,而后者是RNA的合成底物。
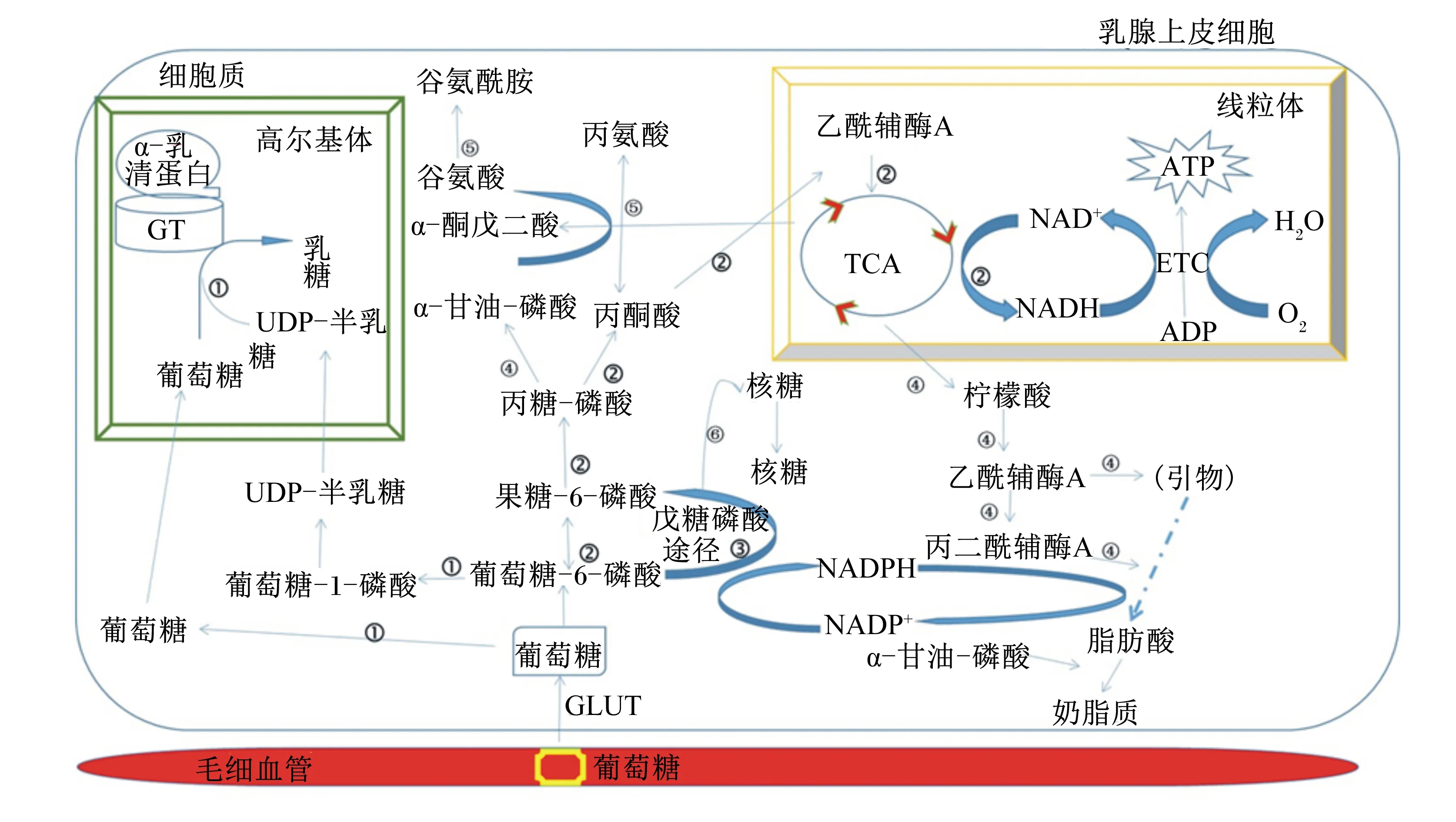
图1 乳腺腺泡上皮细胞中葡萄糖代谢利用通路图
3.2.2 转运调节
从细菌到哺乳动物,葡萄糖稳态的调节是所有生命的一个基本的调节功能[54-55]。而在哺乳期的动物中,提供葡萄糖到乳腺进行乳合成是确保物种生存的一种优先代谢活动[56]。即使以破坏体内平衡为代价,这个优先代谢活动也要协调维持。乳腺中的葡萄糖转运调节在满足这一优先级中起着关键作用。乳腺中葡萄糖转运的调节主要包括内分泌调节、缺氧调节、发育调节、空腹效应调节以及其他调节。
血浆葡萄糖依赖性促胰岛素多肽浓度与乳中能量产量显著正相关(r=0.67),与呼吸熵显著负相关(r=-0.72),表明血浆葡萄糖依赖性促胰岛素多肽可以调控奶牛能量代谢以及可能调控葡萄糖转运[57]。催乳素被发现可刺激乳腺外植体对2-脱氧葡萄糖的摄取[58]。注射外源性生长激素会增加乳腺对葡萄糖的摄取,而不会影响乳牛血浆葡萄糖浓度[51]。这些观察表明生长激素可能会刺激乳腺中的葡萄糖转运。然而,对泌乳牛使用外源性生长激素63 d的试验并没有改变乳腺GLUT1的mRNA和蛋白质的表达[39]。因此,外源性生长激素增加乳腺葡萄糖摄取可能是因为流向乳腺的血流量增加[59],而非诱导了乳腺上皮细胞的GLUT表达。最近有研究发现乳腺组织和乳腺上皮细胞中GLUT表达对催乳素不敏感[60]。另外,动物机体或者组织内的氧气供应缺乏会造成缺氧状态,这是一种正常的生理或病理状态,在缺氧状况下,许多组织和细胞会发生一系列的生理变化,包括葡萄糖摄取的增加和无氧代谢增强,以保护自己免受氧气供应不足的伤害。新假说主要基于2个方面的证据。从怀孕到哺乳,乳腺代谢率增加以支持乳腺生长、生乳和泌乳。乳腺对氧气的吸收在妊娠后期稳步增长,并在泌乳早期达到其最高水平[47]。这些结果支持缺氧条件在乳腺发育、GLUT1表达和泌乳中起到一定作用。另外,葡萄糖转运体可被糖基化,以此来对葡萄糖转运进行调节[36]。
4 饲粮营养对葡萄糖代谢和乳糖合成的影响
4.1 粗饲料种类与质量
王炳[26]研究发现,稻草饲粮的瘤胃丙酸浓度显著低于苜蓿饲粮;反映肝脏糖原异生作用的丙酮酸羧激酶mRNA表达丰度表现为稻草饲粮显著低于苜蓿饲粮和玉米秸饲粮,而线粒体磷酸烯醇式丙酮酸羧激酶、胰岛素样生长因子1受体、磷酸果糖激酶(肝源、肌源及胰源)等酶的mRNA表达丰度则以稻草饲粮组显著低于苜蓿饲粮。饲喂玉米秸饲粮和稻草饲粮奶牛的乳腺葡萄糖摄取量显著低于苜蓿饲粮。稻草饲粮组奶牛乳中钾离子(K+)浓度显著高于苜蓿饲粮和玉米秸饲粮。这些结果显示,饲喂稻草饲粮奶牛丙酸生产较低,引起肝脏糖异生作用合成葡萄糖较少,供应于乳腺的葡萄糖摄取量低下,最终导致乳糖合成不足。
乳糖在维持牛奶渗透压方面起着主要作用,大约贡献50%的牛奶渗透压[61]。因此,乳糖的合成量决定着奶产量。另外,牛奶中Na+、K+、氯离子(Cl-)浓度也起到维持渗透压作用[62]。稻草饲粮组显著降低奶牛乳糖含量,除了低于苜蓿饲粮组奶牛外,同样低于和其泌乳性能相近的玉米秸秆饲粮组奶牛,因此,除了葡萄糖供应不足这一原因外,离子等其他因素所贡献的渗透压应该也有所差异,以维持总体牛奶渗透压的平衡。检测牛奶中离子浓度发现,饲喂稻草组的牛奶K+浓度显著高于其他2组,这就解释了乳糖含量产生变化的原因。并且,有报道乳糖含量与牛奶中Na+、K+和Cl-的浓度呈负相关[62]。Peaker[63]也报道称牛奶Na+和K+浓度之和与乳糖含量的变化相反。饲喂稻草导致了乳糖含量降低,除了乳腺动脉血中葡萄糖供应量不足外,由于稻草饲粮中含有较多的K+,乳中K+浓度升高和乳糖一起共同维持了渗透压平衡[26]。
4.2 过瘤胃淀粉供应
淀粉是葡萄糖的一种高聚物,其在反刍动物瘤胃和小肠中的主要降解产物分别是丙酸和葡萄糖。适量过瘤胃淀粉可为奶牛提供大量外源性葡萄糖,降低糖异生途径合成葡萄糖的能量损失,节约生糖氨基酸,提高动物生产性能[64]。过瘤胃淀粉水平越高,血浆胰岛素水平越高,而胰高血糖素水平越低[65],这表明适当增加饲粮过瘤胃淀粉水平可促进葡萄糖吸收,促进葡萄糖的高效利用。过瘤胃淀粉水平决定小肠可吸收葡萄糖水平,进而改变机体能量供应模式,影响氮素利用和能氮平衡[66]。胰腺α-淀粉酶分泌不足限制过瘤胃淀粉的小肠消化率,不仅造成能量浪费,还会造成后肠道酸中毒[67]。因此,通过调控技术促进α-淀粉酶分泌理论上可促进过瘤胃淀粉的小肠消化率,增加葡萄糖供应量,满足机体葡萄糖需要。Xu等[68]研究发现,过瘤胃淀粉水平能影响胰腺α-淀粉酶分泌。胆囊收缩素可调控动物胰腺相关酶的分泌表达[69]。Mikua等[70]研究饲粮用玉米(高过瘤胃淀粉)替代黑小麦(低过瘤胃淀粉)对围产期奶牛机体代谢、泌乳性能和繁殖性能的影响,结果表明,玉米淀粉更适宜作为围产期奶牛的能量来源。综上所述,适宜的过瘤胃淀粉水平以及提高胰腺α-淀粉酶的分泌,可以促进过瘤胃淀粉消化,提高饲料能量利用率,保证奶牛泌乳时的能量供应。
5 奶牛围产期葡萄糖代谢
与泌乳期相比,奶牛围产后期干物质采食量急剧下降,引起奶牛能量负平衡及低血糖症,而提高小肠葡萄是解决这一问题最有效的策略。通过增加干物质采食量来解决能量负平衡及低血糖症等问题在理论上可行,但实际生产中提高围产后期的干物质采食量难度很大,短期内不易实现。因此,提高饲粮能量供应以及代谢葡萄糖水平至关重要。葡萄糖在围产期奶牛中缺乏较大,容易导致奶牛自身能量负平衡出现,导致体脂动员,易产生酮病[71]。另外,围产期奶牛营养物质摄入不足,能量代谢加快,内分泌激素急剧变化,氧化应激严重,机体免疫和抗炎症能力降低,易发生乳房炎、乳房水肿、胎衣不下等疾病[72]。作为奶牛的重要能量来源,葡萄糖在维持乳腺发育、泌乳和物质周转过程中发挥重要作用。因此,充足的葡萄糖供应是保证围产期奶牛能量平衡和减少疾病发生的有效手段。研究表明,产后奶牛饲粮中补充过瘤胃葡萄糖能有效地提髙奶牛泌乳量和升高血液中葡萄糖浓度,降低酮体水平,改善能量负平衡[73]。Pieper等[74]研究发现,德国荷斯坦公牛对静脉葡萄糖耐受性具有较高的可遗传性,这为我们选取高葡萄糖耐受性的荷斯坦奶牛提供了可能,也可以解决围产期奶牛能量负平衡所引起的各种代谢疾病。
干奶期奶牛能量摄入过多对围产期葡萄糖代谢和能量平衡状态都有一定负面作用,并影响奶牛平稳过度到泌乳前期。在整个干奶期或者临产前期,能量过多摄入不会影响葡萄糖耐受性,但是奶牛在干奶期能量摄入高低与血液中葡萄糖浓度以及产后血液中胰岛素、胰高血糖素、非酯化脂肪酸和β-羟丁酸浓度密切相关[75]。干奶期时间长短可以影响产犊前后奶牛能量代谢状况以及后续奶产量的高低。奶牛产犊后肝糖原降低以及肝脏脂肪含量升高,干奶90 d的奶牛肝脏PC的mRNA丰度有上调的趋势。干奶时间缩短可以使奶牛的葡萄糖代谢趋于更加平衡的状态[76]。Galindo等[50]研究发现,产后奶牛皱胃灌注氨基酸可以提高机体全身葡萄糖的生产速率,这主要是由于门静脉回流肝脏中释放多的葡萄糖,奶牛在泌乳早期对氨基酸的需要量非常大,即使提高了氨基酸供应,依然无法满足需求,并且奶牛机体代谢活动倾向于氨基酸的需要而不是肝脏糖异生活动。
6 小 结
奶牛机体葡萄糖代谢规律对奶牛能量需要以及奶牛泌乳有着密切的关系,从瘤胃内葡萄糖前体物丙酸的生成到肝脏中糖异生,再到乳腺后,从血液中对葡萄糖进行转运以及在乳腺上皮细胞中进行合成与分解代谢等一系列活动,都对奶牛泌乳起着关键的作用。葡萄糖作为奶合成的一种必需和关键的底物和燃料,而乳糖在奶牛泌乳中具有重要的渗透压平衡作用,因此葡萄糖代谢在调控奶牛泌乳量方面作用重要,但目前在机制解析方面仍不明晰。因此,了解乳腺潜在的葡萄糖摄取的分子机制至关重要。到目前为止,关于葡萄糖转运体的研究已有较大进展,已经清楚认识到多个葡萄糖转运体都参与了这一过程,但有关乳腺组织中每个葡萄糖转运体的生理和病理作用、细胞和亚细胞定位还有调控(基因表达、亚细胞运输和动力学)仍然存在较大的认知空洞。另外葡萄糖代谢与奶牛疾病发生以及围产期葡萄糖代谢等问题还需要更多研究去揭示并找出解决办法。而分子生物学技术的发展,特别是组学技术,例如,基因组学技术有效帮助我们选育葡萄糖利用高效率奶牛,代谢组学技术将有效解决围产期奶牛能量代谢紊乱与奶牛健康和泌乳期产奶量的内在分子代谢机制。总之,需要更多的研究来探究奶牛生产与葡萄糖代谢的关系,最终为实现奶牛健康养殖、高效生产提供理论支持。
[1] SCOTT R,BAUMAN D E,CLARK J H.Cellular gluconeogenesis by lactating bovine mammary tissue[J].Journal of Dairy Science,1976,59(1):50-56.
[2] THREADGOLD L C,KUHN N J.Glucose-6-phosphate hydrolysis by lactating rat mammary gland[J].International Journal of Biochemistry,1979,10(8):683-685.
[3] 付聪,王洪荣,王梦芝,等.不同代谢葡萄糖水平饲粮对8~10月龄后备奶牛生长发育、营养物质消化率和血清生化指标的影响[J].动物营养学报,2014,26(9):2615-2622.
[4] 宋良荣,薛白,闫方权,等.饲粮代谢葡萄糖水平对热应激奶牛生产性能和生理指标的影响[J].动物营养学报,2014,26(6):1477-1485.
[5] KRONFELD D S.Major metabolic determinants of milk volume,mammary efficiency,and spontaneous ketosis in dairy cows[J].Journal of Dairy Science,1982,65(11):2204-2212.
[6] RIGOUT S,LEMOSQUET S,VAN EYS J,et al.Duodenal glucose increases glucose fluxes and lactose synthesis in grass silage-fed dairy cows[J].Journal of Dairy Science,2002,85(3):595-606.
[7] XIAO C T,QUINTON V M,CANT J P.Description of glucose transport in isolated bovine mammary epithelial cells by a three-compartment model[J].American Journal of Physiology:Cell Physiology,2004,286(4):C792-C797.
[8] STACEY A,SCHNIEKE A,KERR M,et al.Lactation is disrupted by alpha-lactalbumin deficiency and can be restored by human alpha-lactalbumin gene replacement in mice[J].Proceedings of the National Academy of Sciences of the United States of America,1995,92(7):2835-2839.
[9] DAVIS S R,COLLIER R J.Mammary blood flow and regulation of substrate supply for milk synthesis[J].Journal of Dairy Science,1985,68(4):1041-1058.
[11] ARMSTRONG D G,BLAXTER K L.Effects of acetic and propionic acids on energy retention and milk secretion in goats[C]//Proceedings of the 3rd Symposium on Energy Metabolism.London:Animal Production Publishing,59-68.
[12] 徐明,姚军虎.泌乳牛葡萄糖营养研究进展[J].动物营养学报,2005,17(3):1-5.
[13] OBA M,ALLEN M S.Extent of hypophagia caused by propionate infusion is related to plasma glucose concentration in lactating dairy cows[J].The Journal of Nutrition,2003,133(4):1105-1112.
[14] LEMOSQUET S,RAGGIO G,LOBLEY G E,et al.Whole-body glucose metabolism and mammary energetic nutrient metabolism in lactating dairy cows receiving digestive infusions of casein and propionic acid[J].Journal of Dairy Science,2009,92(12):6068-6082.
[15] MIETTINEN H,HUHTANEN P.Effects of the ratio of ruminal propionate to butyrate on milk yield and blood metabolites in dairy cows[J].Journal of Dairy Science,1996,79(5):851-861.
[16] WANG B,MAO S Y,YANG H J,et al.Effects of alfalfa and cereal straw as a forage source on nutrient digestibility and lactation performance in lactating dairy cows[J].Journal of Dairy Science,2014,97(12):7706-7715.
[18] ARMENTANO L E.Ruminant hepatic metabolism of volatile fatty acids,lactate and pyruvate[J].The Journal of Nutrition,1992,122(3S):8386-842.
[19] GREENFIELD R B,CECAVA M J,DONKIN S S.Changes in mRNA expression for gluconeogenic enzymes in liver of dairy cattle during the transition to lactation[J].Journal of Dairy Science,2000,83(6):1228-1236.
[20] RUKKWAMSUK T,WENSING T,GEELEN M J H.Effect of fatty liver on hepatic gluconeogenesis in periparturient dairy cows[J].Journal of Dairy Science,1999,82(3):500-505.
[21] 王聪,刘强,张延利,等.丙二醇对奶牛围产期血浆激素和肝脏糖异生限速酶的影响[J].核农学报,2013,27(1):132-137.
[22] VELEZ J C,DONKIN S S.Feed restriction induces pyruvate carboxylase but not phosphoenolpyruvate carboxykinase in dairy cows[J].Journal of Dairy Science,2005,88(8):2938-2948.
[23] WHITE H M,CARVALHO E R,KOSER S L,et al.Shortcommunication:regulation of hepatic gluconeogenic enzymes by dietary glycerol in transition dairy cows[J].Journal of Dairy Science,2016,99(1):812-817.
[24] ZHANG Q,KOSER S L,DONKIN S S.Propionate induces the bovine cytosolic phosphoenolpyruvate carboxykinase promoter activity[J].Journal of Dairy Science,2016,99(8):6654-6664.
[25] WALKER C G,CROOKENDEN M A,HENTY K M,et al.Epigenetic regulation of pyruvate carboxylase gene expression in the postpartum liver[J].Journal of Dairy Science,2016,99(7):5820-5827.
[26] 王炳.饲喂秸秆日粮奶牛泌乳性能低下的消化吸收与代谢机制研究[D].博士学位论文.杭州:浙江大学,2016.
[27] RHOADS R P,LA NOCE A J,WHEELOCK J B,et al.Shortcommunication:alterations in expression of gluconeogenic genes during heat stress and exogenous bovine somatotropin administration[J].Journal of Dairy Science,2011,94(4):1917-1921.
[28] BANGHAM A D,DE GIER J,GREVILLE G D.Osmotic properties and water permeability of phospholipid liquid crystals[J].Chemistry and Physics of Lipids,1967,1(3):225-246.
[29] WIDDAS W F.The glucose transporter of human erythrocytes-working hypothesis for its functional mechanism[J].Experimental Physiology,1998,83(2):186-194.
[30] ZHAO F Q,KEATING A F.Functional properties and genomics of glucose transporters[J].Current Genomics,2007,8(2):113-128.
[31] WRIGHT E M,LOO D D F,HIRAYAMA B A.Biology of human sodium glucose transporters[J].Physiological Reviews,2011,91(2):733-794.
[32] WRIGHT E M.Glucose transport families SLC5 and SLC50[J].Molecular Aspects of Medicine,2013,34(2/3):183-196.
[33] MUECKLER M,THORENS B.The SLC2 (GLUT) family of membrane transporters[J].Molecular Aspects of Medicine,2013,34(2/3):121-138.
[34] ILLSLEY N P.Current topic:glucose transporters in the human placenta[J].Placenta,2000,21(1):14-22.
[35] KLEPPER J,VOIT T.Facilitated glucose transporter protein type 1 (GLUT1) deficiency syndrome:impaired glucose transport into brain-a review[J].European Journal of Pediatrics,2002,161(6):295-304.
[36] ZHAO F Q.Biology of glucose transport in the mammary gland[J].Journal of Mammary Gland Biology and Neoplasia,2014,19(1):3-17.
[37] 宗灿华,李庆章.不同发育时期奶牛乳腺葡萄糖转运蛋白1的表达与定位[J].黑龙江畜牧兽医,2013(11):11-13,188.
[38] ZHAO F Q,GLIMM D R,KENNELLY J J.Distribution of mammalian facilitative glucose transporter messenger RNA in bovine tissues[J].International Journal of Biochemistry,1993,25(12):1897-1903.
[39] ZHAO F Q,DIXON W T,KENNELLY J J.Localization and gene expression of glucose transporters in bovine mammary gland[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1996,115(1):127-134.
[40] MILLER P J,FINUCANE K A,HUGHES M,et al.Cloning and expression of bovine glucose transporter GLUT12[J].Mammalian Genome,2005,16(11):873-883.
[41] ZHAO F Q,MCFADDEN T B,WALL E H,et al.Cloning and expression of bovine sodium/glucose cotransporter SGLT2[J].Journal of Dairy Science,2005,88(8):2738-2748.
[42] KOMATSU T,ITOH F,KUSHIBIKI S,et al.Changes in gene expression of glucose transporters in lactating and nonlactating cows[J].Journal of Animal Science,2005,83(3):557-564.
[43] 赵珂.奶牛乳腺上皮细胞葡萄糖摄取的调控及其对乳成分合成的影响研究[D].博士学位论文.杭州:浙江大学,2011.
[44] NIELSEN M O,MADSEN T G,HEDEBOE A M.Regulation of mammary glucose uptake in goats:role of mammary gland supply,insulin,IGF-1 and synthetic capacity[J].The Journal of Dairy Research,2001,68(3):337-349.
[45] CANT J P,TROUT D R,QIAO F,et al.Milk synthetic response of the bovine mammary gland to an increase in the local concentration of arterial glucose[J].Journal of Dairy Science,2002,85(3):494-503.
[46] ANNISON E F,LINZELL J L.The oxidation and utilization of glucose and acetate by the mammary gland of the goat in relation to their over-all metabolism and to milk formation[J].The Journal of Physiology,1964,175(3):372-385.
[47] DELAMAIRE E,GUINARD-FLAMENT J.Increasing milking intervals decreases the mammary blood flow and mammary uptake of nutrients in dairy cows[J].Journal of Dairy Science,2006,89(9):3439-3446.
[48] MILLER P S,REIS B L,CALVERT C C,et al.Patterns of nutrient uptake by the mammary glands of lactating dairy cows[J].Journal of Dairy Science,1991,74(11):3791-3799.
[49] DOEPEL L,LAPIERRE H.Changes in production and mammary metabolism of dairy cows in response to essential and nonessential amino acid infusions[J].Journal of Dairy Science,2010,93(7):3264-3274.
[50] LARSEN M,GALINDO C,OUELLET D R,et al.Abomasal amino acid infusion in postpartum dairy cows:effect on whole-body,splanchnic,and mammary amino acid metabolism[J].Journal of Dairy Science,2015,98(11):7944-7961.
[51] DAVIS S R,COLLIER R J,MCNAMARA J P,et al.Effects of thyroxine and growth hormone treatment of dairy cows on mammary uptake of glucose,oxygen and other milk fat precursors[J].Journal of Animal Science,1988,66(1):80-89.
[52] WANG B,SUN H Z,XU N N,et al.Amino acid utilization of lactating dairy cows when diets are changed from an alfalfa-based diet to cereal straw-based diets[J].Animal Feed Science and Technology,2016,217:56-66.
[53] RAMAKRISHNAN B,QASBA P K.Crystal structure of lactose synthase reveals a large conformational change in its catalytic component,the β1,4-galactosyltransferase-Ⅰ[J].Journal of Molecular Biology,2001,310(1):205-218.
[54] JAHREIS K,PIMENTEL-SCHMITT E F,BRÜCKNER R,et al.Ins and outs of glucose transport systems in eubacteria[J].FEMS Microbiology Reviews,2008,32(6):891-907.
[55] POLAKOF S,MOMMSEN T P,SOENGAS J L.Glucosensing and glucose homeostasis:from fish to mammals[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2011,160(4):123-149.
[56] BAUMAN D E,CURRIE W B.Partitioning of nutrients during pregnancy and lactation:a review of mechanisms involving homeostasis and homeorhesis[J].Journal of Dairy Science,1980,63(9):1514-1529.
[57] RELLING A E,CROMPTON L A,LOERCH S C,et al.Shortcommunication:plasma concentration of glucose-dependent insulinotropic polypeptide may regulate milk energy production in lactating dairy cows[J].Journal of Dairy Science,2014,97(4):2440-2443.
[58] PETERS B J,RILLEMA J A.Effect of prolactin on 2-deoxyglucose uptake in mouse mammary gland explants[J].The American Journal of Physiology:Endocrinology and Metabolism,1992,262(5):E627-E630.
[59] TANWATTANA P,CHANPONGSANG S,CHAIYABUTR N.Effects of exogenous bovine somatotropin on mammary function of late lactating crossbred Holstein cows[J].Asian Australasian Journal of Animal Sciences,2003,16(1):88-95.
[60] SHAO Y,WALL E H,MCFADDEN T B,et al.Lactogenic hormones stimulate expression of lipogenic genes but not glucose transporters in bovine mammary gland[J].Domestic Animal Endocrinology,2013,44(2):57-69.
[62] OSHIMA M,FUSE H,ISHII T.Decrease in electrolyte concentration and changes in lactose and solids content of cows milk after treatment with thyroxine[J].Japanese Journal of Zootechnical Science,1980,51(11):772-778.
[63] PEAKER M.Ion and Water Transport in the Mammary Gland[M]//LARSON B L.The mammary gland/human lactation/milk Synthesis.New York:Aademic Press,1978:437-462.
[64] LARSEN M,LUND P,WEISBJERG M R,et al.Digestion site of starch from cereals and legumes in lactating dairy cows[J].Animal Feed Science and Technology,2009,153(3/4):236-248.
[65] GARNSWORTHY P C,FOULADI-NASHTA A A,MANN G E,et al.Effect of dietary-induced changes in plasma insulin concentrations during the early post partum period on pregnancy rate in dairy cows[J].Reproduction,2009,137(4):759-768.
[67] HARMON D L.Understanding starch utilization in the small intestine of cattle[J]. Asian-Australasian Journal of Animal Sciences,2009,22(7):915-922.
[68] XU M,DU S,WANG J,et al.Influence of rumen escape starch on pancreatic exocrine secretion of goats[J].Journal of Animal Physiology and Animal Nutrition,2009,93(1):122-129.
[69] CROZIER S J,SANS M D,LANG C H,et al.CCK-induced pancreatic growth is not limited by mitogenic capacity in mice[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2008,294(5):G1148-G1157.
[71] 孙菲菲,曹阳春,姚军虎.奶牛围产期葡萄糖营养平衡及其调控研究进展[J].饲料工业,2013,34(15):46-50.
[72] SORDILLO L M,CONTRERAS G A,AITKEN S L.Metabolic factors affecting the inflammatory response of periparturient dairy cows[J].Animal Health Research Reviews,2009,10(1):53-63.
[73] 李妍,薛倩,高艳霞,等.瘤胃保护葡萄糖对围产后期荷斯坦奶牛生产性能及血清生化指标的影响[J].畜牧兽医学报,2016,47(1):113-119.
[74] PIEPER L,STAUFENBIEL R,CHRIST J,et al.Heritability of metabolic response to the intravenous glucose tolerance test in German Holstein Friesian bulls[J].Journal of Dairy Science,2016,99(9):7240-7246.
[75] MANN S,YEPES F A L,DUPLESSIS M,et al.Dry period plane of energy:effects on glucose tolerance in transition dairy cows[J].Journal of Dairy Science,2016,99(1):701-717.
[76] WEBER C,SCHFF C T,KAUTZSCH U,et al.Insulin-dependent glucose metabolism in dairy cows with variable fat mobilization around calving[J].Journal of Dairy Science,2016,99(8):6665-6679.
*Corresponding authors: JIANG Linshu, professor, E-mail: kjxnb@vip.sina.com; LIU Jianxin, professor, E-mail: liujx@zju.edu.cn
(责任编辑 武海龙)
Effects of Glucose Metabolism and Utilization on Dairy Cows Production
WANG Bing1,2WANG Yue1JIANG Linshu1*LIU Jianxin2*
(1.KeyLaboratoryforDairyCowNutrition,CollegeofAnimalScienceandTechnology,BeijingUniversityofAgriculture,Beijing102206,China; 2.KeyLaboratoryofMolecularAnimalNutritionofMinistryofEducation,InstituteofDairyScience,ZhejiangUniversity,Hangzhou310058,China)
Glucose is not only the main energy substrate for brain cells of central nervous system and embryo in dairy cows, but also the lactose precursor and closely related to milk fat and milk protein synthesis, thus it has key nutritional physiological functions in lactating dairy cows. In order to improve milk performance and physiological health in lactating cows, it is necessary to study its physiological functions and metabolism in dairy cows. Therefore, the generation of glucose, glucose metabolism and utilization in the mammary gland, and the effects of glucose metabolism on dairy cows production were reviewed in order to further reveal the mechanism of glucose metabolic pathways across the whole body, promote the utilization of glucose and afford basic knowledge and references for dairy cow feeding.[ChineseJournalofAnimalNutrition, 2017, 29(3):729-738]
dairy cows; glucose; gluconeogenesis; mammary gland; regulation
10.3969/j.issn.1006-267x.2017.03.001
2016-10-01
“十三五”国家重大科技专项(2016YFDO700201);北京市农业局北京市现代农业产业技术体系奶牛创新团队
王 炳(1989—),男,河南南阳人,博士,研究方向为奶牛营养。E-mail: wbwz0810@126.com
*通信作者:蒋林树,教授,硕士生导师,E-mail: kjxnb@vip.sina.com;刘建新,教授,博士生导师,E-mail: liujx@zju.edu.cn
S852.2
A
1006-267X(2017)03-0729-10

