围手术期严重过敏反应病因诊断一例
张伟义,刘光跃,周 莉,孟 娟
(四川大学华西医院耳鼻咽喉头颈外科过敏性疾病诊治中心,成都 610041)
围手术期严重过敏反应发生率低,但可危及生命,我国目前尚缺少有关数据。本文报道1例围手术期严重过敏反应病例。
临床资料
患者女,25岁,因“左乳包块:纤维腺瘤?叶状肿瘤?”入院行左乳包块切除术。麻醉前给予抗胆碱药长托宁0.5 mg肌内注射。全麻诱导期给予地塞米松10 mg、咪达唑仑2 mg、丙泊酚100 mg、舒芬太尼17.5 μg、顺阿曲库铵8 mg静脉推注。麻醉诱导5 min后患者出现室性心动过速,立即予以甲强龙80 mg静脉推注。随即出现心室颤动,血压60/20 mmHg(1 mmHg=0.133 kPa),全身斑丘疹(根据麻醉抢救记录描述),立即行心肺复苏,给予1∶1 000肾上腺素0.2 mg静脉推注,气管插管。6 min后心电图转为窦性心动过速(心率137次/min)。2 min后再次出现心室颤动,立即再行心肺复苏,再次给予1∶1 000肾上腺素0.2 mg静脉推注。2 min后再次转为窦性心动过速,予以1∶1 000肾上腺素静脉泵注(按血压进行调整)。5 min后循环稳定,停用肾上腺素,手术暂停。
14周后,患者进行围手术期严重过敏反应病因诊断。根据麻醉记录,选用可疑致敏药物丙泊酚、咪达唑仑、舒芬太尼、顺阿曲库铵、地塞米松、长托宁进行皮肤试验。先进行皮肤点刺试验,操作方法为:将前臂曲侧皮肤用75%酒精消毒,待皮肤干燥后,将检测药物(药物浓度见表1)、阴性对照(生理盐水)及阳性对照(组胺10 mg/ml)按照2 cm间隔滴在前臂曲侧皮肤上,用点刺针刺破表皮,但不引发出血。15 min后判读结果。风团直径较阴性对照(生理盐水)≥3 mm为阳性反应,合并有红斑或痒感更支持阳性反应[1]。若皮肤点刺试验阴性或可疑阳性,再进行皮内试验。皮内试验操作方法为:将0.02~0.03 ml检测药品稀释液(药物浓度见表1)注入前臂屈侧皮下形成直径≤4 mm的皮丘,15 min后判读结果,若皮丘直径较之前扩大3 mm及以上,伴有红斑和痒感,为阳性反应[2]。
结果顺阿曲库铵在皮内试验浓度为0.02 mg/ml(1∶100)时出现强阳性反应(图1)。使用罗库溴铵以及维库溴铵进行肌松类药物交叉敏感性试验(皮肤试验浓度见表1),结果均为阴性。长托宁在皮内试验浓度为0.1 mg/ml(1∶1)时出现阳性反应,但长托宁皮肤试验的灵敏度及特异度缺乏相关文献支持,在最高浓度(原液)下的反应可能为皮肤的非特异性刺激反应。其他药物检测结果均为阴性(表1),因此诊断患者对顺阿曲库铵过敏,可选用罗库溴铵或者维库溴铵替代;同时建议术中不使用长托宁。
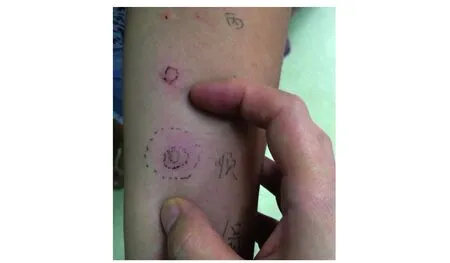
图1顺阿曲库铵皮内试验阳性反应(浓度1∶100)最内圈为皮内试验注射时形成的皮丘,中间圈为皮内试验15 min后扩大的皮丘,最外圈为皮内试验15 min后红斑范围
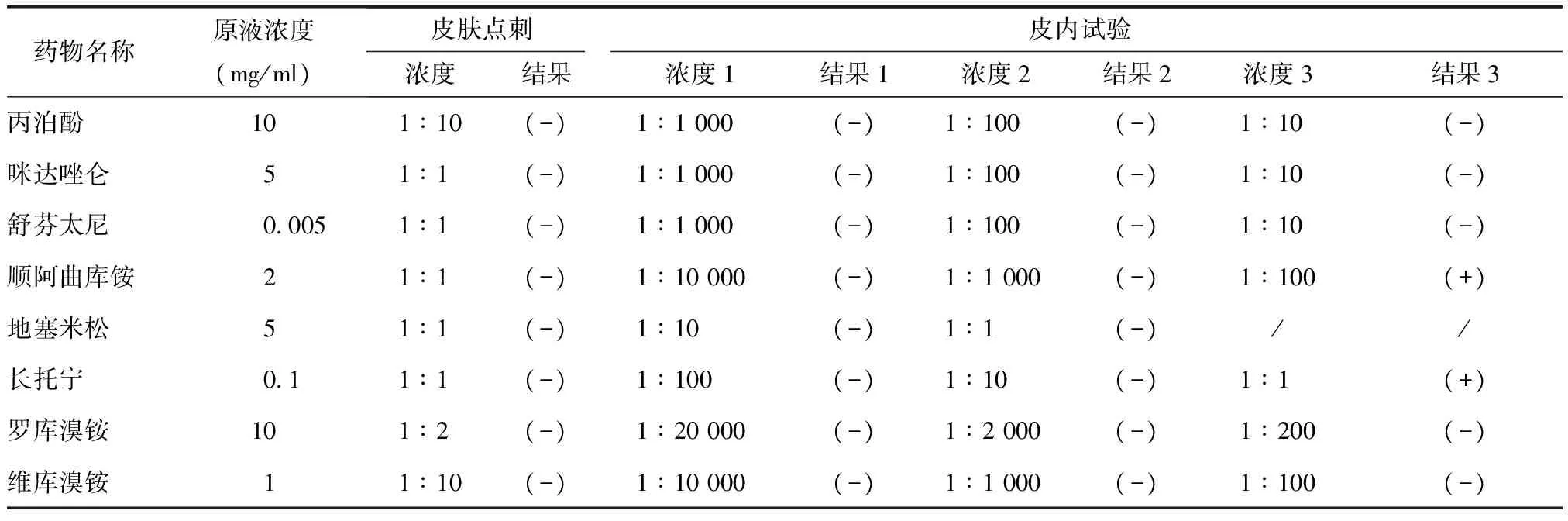
表1 皮肤试验药物浓度及结果
在第二次手术中,使用维库溴铵替代顺阿曲库铵,未再使用长托宁,患者手术顺利。
讨 论
目前我国仍缺乏关于围手术期严重过敏反应的流行病学数据,根据国外的流行病学调查数据,发生率大约为1∶20 000~1∶10 000[3- 5]。虽然发生率不高,但可威胁患者的生命,据以往报道致死性反应占围手术期严重过敏反应的3%~6%[4],最近的研究显示,该比例下降为0~1.4%,可能的原因为制定了围手术期严重过敏反应处理指南以及加强了相关培训,尤其是对于严重过敏反应早期诊断、早期处理的培训[6]。
围手术期严重过敏反应常见临床表现包括:皮肤黏膜表现(潮红、风团、水肿等)、气道表现(支气管痉挛、通气障碍)及心血管系统表现(心率下降、心率加快、血压下降,心律失常)[5]。在严重过敏反应中,皮肤症状往往是最常见且最早出现的,但对于围手术期严重过敏反应,由于患者处于无意识或镇静状态中,全身覆盖于手术铺巾下,皮肤表现往往不易被发现,因此支气管痉挛及循环衰竭常常成为首先被发现的症状、体征。此患者首先发现症状即为室性心动过速。
根据症状的严重程度,过敏反应可分为四级(表2),仅有皮肤症状(Ⅰ级)不能诊断为严重过敏反应。严重过敏反应可以发生在围手术期的任何阶段,但90%以上发生在全麻诱导期。该患者严重过敏反应即出现在全麻诱导期,临床表现有皮肤黏膜系统表现、室性心动过速及心室颤动、低血压表现,应为严重过敏反应Ⅲ级。
丹麦进行的一项研究对比严重过敏反应发生后,麻醉科医师推测的变应原和变态反应科医师经过检测确认的变应原,发现二者仅有7%相吻合[8],因此进行详细、准确的变应原检测明确诱发因素,对于避免以后麻醉中再次使用致敏药物或试剂诱发严重过敏反应具有重要临床意义。
对该患者在第一次全麻诱导期中使用的药物进行皮肤试验,顺阿曲库铵皮内试验为阳性。2011年,欧洲药物过敏协作组总结了自1980年以来所有英文和法文文献数据,得出常见的引起围手术期严重过敏反应的药物及试剂依次为:神经肌肉松弛剂(63%)、乳胶(14%)、镇静催眠药(7%)、抗生素(6%)、

表2 速发型过敏反应严重程度分级标准[7]
血浆代用品(3%)及阿片类(2%)[7],因此神经肌肉松弛剂(肌松剂)是最常见的引起围手术期严重过敏反应的诱因。此类药物可介导两类超敏反应,一类是IgE介导的Ⅰ型变态反应,其分子结构中的季铵盐结构是主要的抗原表位,所有的肌松类药物均可以介导此类反应;第二类是非免疫反应介导的,由于非特异性刺激肥大细胞脱颗粒导致,见于苄基异喹啉类肌松剂,常见于美维库铵和阿曲库铵。但这两类超敏反应中,以IgE介导的更为常见。法国1996年报道,肌松剂类药物导致的、由IgE介导的严重过敏反应发生率为1∶6 500[3],而非免疫介导的过敏反应发生概率低,且严重程度较IgE介导型的低,主要表现为皮肤反应。顺阿曲库铵是一个相对较新的非极性肌松剂,自从1995年起应用于临床。早期研究认为该阿曲库铵的异构体基本没有非特异性刺激肥大细胞脱颗粒的作用,导致IgE介导的变态反应反应的机率也低于其他肌松剂[9]。但随着临床应用的增多,由顺阿曲库铵引起的严重过敏反应报道逐渐增多[10- 12]。
IgE介导的I型变态反应的机制为: 首次及早期暴露于变应原后,刺激机体产生特异性IgE结合于肥大细胞、嗜碱粒细胞膜上(致敏),当再接触此变应原后,抗原与细胞膜上的两个IgE结合产生桥连反应,导致肥大细胞、嗜碱粒细胞活化、脱颗粒,释放炎症介质(诱发症状)。但在肌松剂诱发的IgE介导严重过敏反应病例中,仅有15%的患者以前曾有同类药物的暴露史[13],本例患者即为首次接触肌松剂。有研究认为致敏的途径可能为接触环境中含有铵盐基团的物质(比如化妆品、消毒剂、工业材料等),或者使用其他含有铵盐基团的药物(如抗精神病药、抗胆碱酯酶药、局麻药及某些抗生素等)[14]。
由于均具有铵盐基团,因此不同的肌松剂之间具有交叉反应性。当全麻中使用的肌松剂皮肤试验为阳性时,需要对其他所有肌松剂类药物进行皮肤试验,以明确交叉反应性,为患者选择可以安全使用的肌松剂提供依据。研究表明:在皮肤试验中肌松剂之间交叉反应可高达65%[15]。由于此类药物药效学的特殊性,不能进行药物激发试验,所以皮肤试验所表现出来的交叉反应性是否具有临床意义无从证实,但从安全性角度考虑,具有交叉反应性的同类药物在今后的全麻过程中应该避免使用[16]。由于本院除顺阿曲库铵外,常用肌松类药物包括罗库溴铵及维库溴铵,使用这两种药物进一步行交叉反应试验,结果为阴性,因此患者可以使用罗库溴铵以及维库溴铵作为替代。
长托宁(盐酸戊乙奎醚)为国产新型选择性抗胆碱药物,可麻醉前给药以抑制唾液腺和气道腺体分泌。此药物目前尚无相关过敏反应的报道,亦缺乏皮肤试验对过敏反应诊断的灵敏度及特异度相关文献资料。我们尝试对患者用原液进行皮肤点刺试验,1∶100和1∶10稀释液、原液进行皮内试验,在原液浓度皮内试验时出现了阳性反应。但在高药物浓度下得到的阳性反应很可能为非特异性皮肤刺激反应。经沟通,尝试对患者家属进行了长托宁的皮肤试验,在原液浓度下进行皮内试验亦出现了阳性反应(图2),因此进一步证实了患者皮肤试验所得到的阳性结果很可能为假阳性反应。经与麻醉科沟通,鉴于长托宁不是在麻醉过程中必须使用的药物,从安全性角度考虑,建议再次手术中避免使用长托宁。
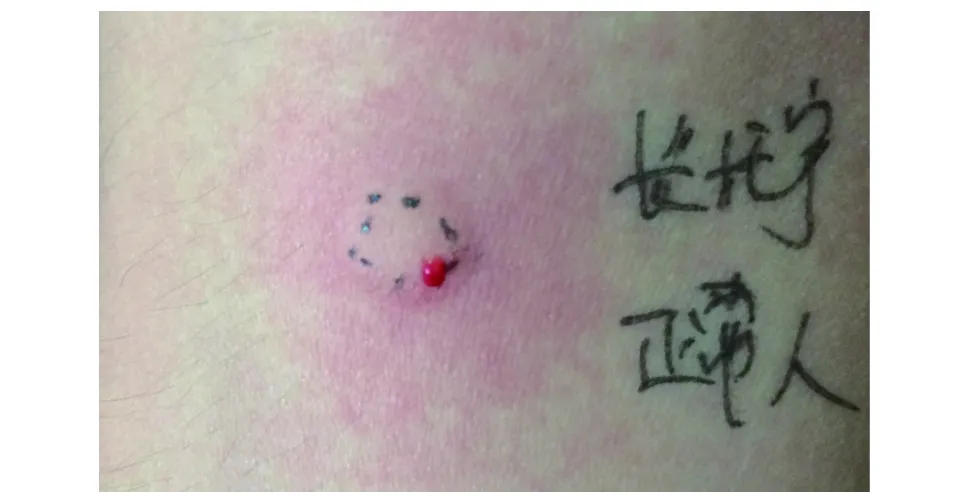
图2 正常人长托宁原液浓度皮内试验阳性反应(非特异性刺激反应)
另外,围手术期严重过敏反应的病因诊断最好在反应发生4~6周后进行,以免在严重过敏反应后不应期内,体内特异性IgE大量消耗,使得皮肤试验出现假阴性结果[16]。该患者病因诊断在反应发生后的14周进行,避免了假阴性结果的可能。若临床中病情需要,诊断也可在6周之内进行,结果阳性有意义,结果阴性需在6周后复查[16]。
围手术期严重过敏反应虽然发生概率低,但可危及生命。在我国建立围手术期严重过敏反应的报告系统,完善流行病学统计数据,加强变态反应科与麻醉科的合作,建立围手术期严重过敏反应的诊断流程,对于保证围手术期医疗安全具有重要意义。
[1]Brockow K, Romano A, Blanca M, et al. General considerations for skin test procedures in the diagnosis of drug hypersensitivity[J]. Allergy,2002,57: 45- 51.
[2]Mirakian R, Leech SC, Krishna MT, et al. Management of allergy to penicillins and other beta-lactams[J]. Clin Exp Allergy,2015,45: 300- 327.
[3]Laxenaire MC. Epidemiology of anesthetic anaphylactoid reactions. Fourth multicenter survey(July 1994-December 1996)[J]. Ann Fr Anesth Reanim,1999,18: 796- 809.
[4]Fisher M, Baldo BA. Anaphylaxis during anaesthesia: current aspects of diagnosis and prevention[J]. Eur J Anaesthesiol,1994,11: 263- 284.
[5]Fisher MM, Baldo BA. The incidence and clinical features of anaphylactic reactions during anesthesia in Australia[J]. Ann Fr Anesth Reanim,1993,12: 97- 104.
[6]Gibbs NM, Sadleir PH, Clarke RC, et al. Survival from perioperative anaphylaxis in Western Australia 2000-2009[J]. Br J Anaesth,2013,111: 589- 593.
[7]Mertes PM, Malinovsky JM, Jouffroy L, et al. Reducing the risk of anaphylaxis during anesthesia: 2011 updated guidelines for clinical practice[J]. J Investig Allergol Clin Immunol,2011,21: 442- 453.
[8]Kroigaard M, Garvey LH, Menne T, et al. Allergic reactions in anaesthesia: are suspected causes confirmed on subsequent testing?[J]. Br J Anaesth,2005,95: 468- 471.
[9]Wastila WB, Maehr RB, Turner GL, et al. Comparative pharmacology of cisatracurium(51W89), atracurium, and five isomers in cats[J]. Anesthesiology,1996,85: 169- 177.
[10] Toh KW, Deacock SJ, Fawcett WJ. Severe anaphylactic reaction to cisatracurium[J]. Anesth Analg,1999,88: 462- 464.
[11] Legros CB, Orliaguet GA, Mayer MN, et al. Severe anaphylactic reaction to cisatracurium in a child[J]. Anesth Analg,2001,92: 648- 649.
[12] Briassoulis G, Hatzis T, Mammi P, et al. Persistent anaphylactic reaction after induction with thiopentone and cisatracurium[J]. Paediatr Anaesth,2000,10: 429- 434.
[13] Fisher MM, Munro I. Life-threatening anaphylactoid reactions to muscle relaxants[J]. Anesth Analg,1983,62: 559- 564.
[14] Baldo BA, Fisher MM, Pham NH. On the origin and specificity of antibodies to neuromuscular blocking(muscle relaxant) drugs: an immunochemical perspective[J]. Clin Exp Allergy,2009,39: 325- 344.
[15] Ebo DG, Fisher MM, Hagendorens MM, et al. Anaphylaxis during anaesthesia: diagnostic approach[J]. Allergy,2007,62: 471- 487.
[16] Ewan PW, Dugue P, Mirakian R, et al. BSACI guidelines for the investigation of suspected anaphylaxis during general anaesthesia[J]. Clin Exp Allergy,2010,40: 15- 31.