生物制剂联合甲氨蝶呤和柳氮磺胺吡啶治疗强直性脊柱炎伴髋关节炎的临床疗效
韩 青,梁 强,吴振彪,冷 南,朱 平
(第四军医大学 西京医院临床免疫科 国家分子医学转化科学中心-临床分子医学研究所,西安710032)
ChinJAllergyClinImmunol,2017,11(4):322- 326
髋关节炎是导致强直性脊柱炎(ankylosing spondylitis,AS)致残的主要原因[1- 2],研究显示发病率达19%~47%[3- 4],疾病晚期患者失去自理能力,严重影响生存质量。髋关节损害的患者早期症状并不典型;X线骨盆平片检查主要是疾病晚期出现骨结构的改变,这至少需要数年的时间才能得到放射学证据,容易造成误诊[5- 6]。传统药物治疗髋关节病变效果有限,国际AS评估工作组认为柳氮磺胺吡啶(sulfasalazine,SSZ)等对累及中轴关节的AS患者无效,可以用来治疗外周关节炎[7- 8]。生物制剂治疗AS有良好的临床治疗效果[9- 10],但对并发髋关节病变的患者尚缺乏更多的临床数据。本研究回顾性分析生物制剂联合甲氨蝶呤(methotrexate,MTX)和SSZ治疗178例AS伴髋关节炎患者,并评价其临床治疗效果。
资料与方法
一般资料
收集2010年12月至2016年12月在第四军医大学西京医院临床免疫科门诊或病房治疗的AS伴髋关节炎患者178例,均为男性,年龄18~45岁,平均(24.8±4.12)岁;病程0.7~10年,平均(5.5±1.9)年。所有AS患者均符合1984年修订的AS纽约标准[11],入组标准:(1)年龄18~65岁;(2)AS疾病活动评分(ankylosing spondylitis disease activity score,ASDAS)>3.5;(3)Harris评分<70分;(4)既往使用一种非甾体抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)、改善病情的抗风湿药(dis-ease-modifying antirheumatic drugs,DMARDs)联合治疗3个月效果不佳;(5)X线证实符合髋关节炎患者;(6)参加试验前至少4周未使用激素;(7)3个月内未使用过生物制剂。排除标准:结核等感染、恶性肿瘤、妊娠期。将患者分为对照组(n=52)和观察组(n=126),观察组患者在口服MTX和SSZ的基础上联合应用生物制剂;对照组患者口服MTX和SSZ。两组患者在年龄、病程、ASDAS、Bath强直性脊柱炎功能指数(Bath ankylosing spondylitis functional index,BASFI)、Harris评分,C反应蛋白(C reaction protein,CRP)和红细胞沉降率(erythrocyte sedimentation rate,ESR)等方面差异无统计学意义(P>0.05);其中,观察组中118例为HLA-B27阳性,阳性率为93.7%,对照组47例为HLA-B27阳性,阳性率为90.4%,两组比较差异无统计学意义(χ2=0.004,P>0.05)。所有入组患者自愿签署知情同意书并自愿接受本次临床观察研究,本研究已通过第四军医大学西京医院伦理委员会的批准。
治疗方案及分组
观察组(n=126):(1)依那西普(三生国健药业股份有限公司/辉瑞制药有限公司)(ETA)(n=65),每周50 mg,皮下注射;(2)或英夫利昔单克隆抗体(西安杨森制药有限公司)(IFN) (n=22),3~5 mg/kg,于0、2、6周,间隔6~8周,静脉滴注;(3)或阿达木单克隆抗体(上海艾伯维医药有限公司)(ADA)(n=39),每2周40 mg,皮下注射;(4)和SSZ结肠溶胶囊(潮州市强基制药厂)0.75 g,3次/d;(5)和MTX(上海信谊制药厂)每周10 mg。
对照组(n=52):(1)SSZ结肠溶胶囊(潮州市强基制药厂)0.75 g,3次/d;(2)和MTX(上海信谊制药厂)每周10 mg。
以上两个治疗组均联合口服醋氯芬酸片0.1 g,2次/d,所有入组患者均定期监测不良反应,第12、24周进行临床参数、实验室指标的检测。
评价指标
疗效评价指标为AS疗效评价标准20%反应(ASAS20)缓解标准;AS疗效评价标准40%反应(ASAS40)缓解标准,AS疗效评价标准部分缓解标准。
临床观察指标:ASDAS、BASFI、Harris评分、CRP和ESR。
统计学处理

结 果
两组患者基线比较
基线期两组患者在年龄、性别、病程、疾病活动评分、Harris评分上差异无统计学意义(P>0.05),两组患者具有可比性(表1)。
疗效评估
治疗后24周生物制剂观察组与对照组临床缓解率:ASAS20缓解标准(51.7%vs. 38.6%,P=0.134)、ASAS40缓解标准(40.0%vs. 22.9%,P=0.035)、ASAS部分缓解标准(33.3%vs. 12.8%,P=0.005)差异均具有统计学意义(图1)。

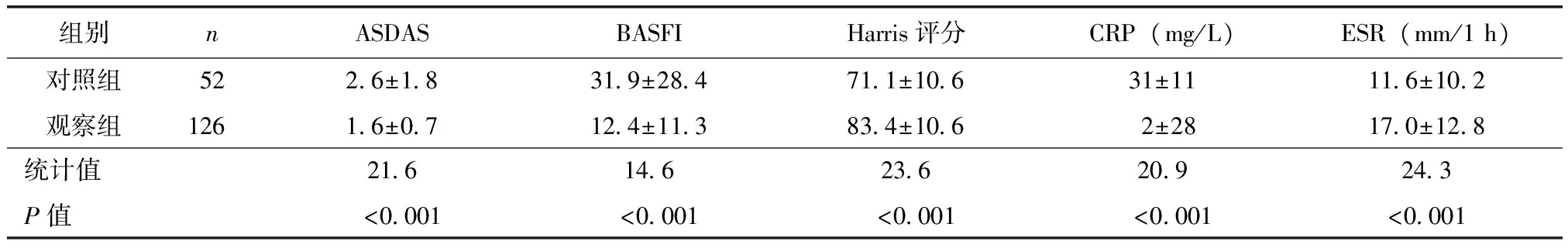
表1 两组患者基线比较Table 1 Baseline condition of the two groups
HLA-B27:人白细胞抗原-B27;ASDAS:AS疾病活动评分:BASFI:Bath AS功能指数;CRP:C反应蛋白(正常值<8 mg/L);ESR:红细胞沉降率(正常值:女性<20 mm/1 h,男性<15 mm/1 h)

图1 观察组和对照组第 24周临床缓解率比较Fig 1 Comparation of curative efficacy between the observation group and the control group in the 24th week
临床指标分析
观察组与对照组临床平均参数组间比较:两组治疗24周后,平均ASDAS(1.6vs. 2.6,P<0.001)、BASFI (12.4vs. 32.0,P<0.001)、Harris评分(83.4vs. 71.1,P<0.001)、CRP(2 mg/Lvs. 31 mg/L,P<0.001)、ESR (17.0 mm/1 hvs. 11.6 mm/1 h,P<0.001)差异有统计学意义,观察组临床改善优于对照组(表2)。观察组组内比较:治疗24周后与基线相比,平均ASDAS(3.7vs. 1.6,P<0.01)、BASFI(49.1vs. 12.4,P<0.01)、Harris评分(61.3vs. 83.4,P<0.01)、CRP(49 mg/Lvs. 2 mg/L,P<0.05)、ESR(21.6 mm/1 hvs. 17.0 mm/1 h,P<0.05)差异有统计学意义;对照组虽较基线期有所缓解但无统计学差异(图2)。

组别nASDASBASFIHarris评分CRP(mg/L)ESR(mm/1h)对照组5226±18319±284711±10631±11116±102观察组12616±07124±113834±1062±28170±128统计值216146236209243P值<0001<0001<0001<0001<0001
ASDAS:强直性脊柱炎疾病活动评分;BASFI:Bath强直性脊柱炎功能指数;Harris评分:髋关节功能评分;CRP:C反应蛋白(正常值<0.8 mg/dl);ESR:红细胞沉降率(正常值:男性<15 mm/1 h,女性<20 mm/1 h)
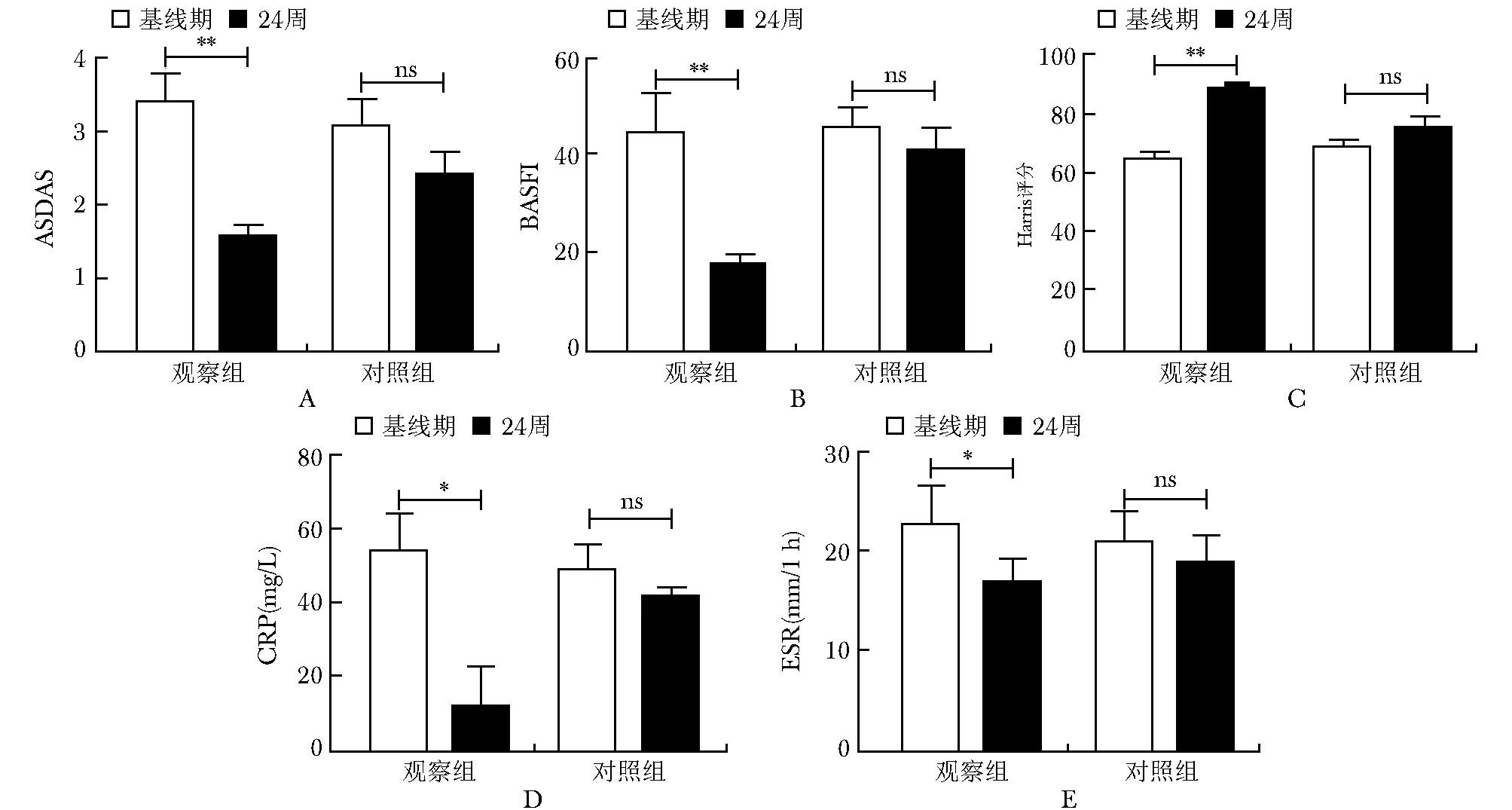
图2观察组和对照组组内临床疗效比较
Fig2Comparation of clinical efficacy between the observation group and the control group
ASDAS:强直性脊柱炎疾病活动评分;BASFI:Bath强直性脊柱炎功能指数;Harris评分:髋关节功能评分;CRP:C反应蛋白;ESR:红细胞沉降率;观察组治疗24周后与基线相比,A:ASDAS(P<0.01);B:BASFI(P<0.01);C:Harris评分(P<0.05);D:CRP(P<0.05);E:ESR(P<0.05);*P<0.05;**P<0.01;ns:无统计学意义
讨 论
AS伴髋关节炎主要以年轻男性为主,部分患者以单侧或双侧臀部、单侧或双侧髋关节疼痛为首发症状前来医院就诊[5],髋关节病变是导致AS致残的关键因素[12],误诊、误治往往导致患者失去生活自理能力[13- 14],主要表现为髋关节面的侵蚀性破坏、硬化、关节间隙变窄甚至骨性强直,导致不可逆性的骨结构的破坏[15- 16]。有学者认为患者的ASDAS评分可提示影像学改变对患者功能状态的影响以及髋关节受累情况,但不能反映外周关节炎症状况[17- 19]。本临床研究证实应用TNF-α抑制剂能更快减轻早期AS伴髋关节炎患者的临床症状,而传统药物在1~3个月开始发生药理作用。
本研究结果提示,观察组与对照组相比,生物制剂联合MTX和SSZ能提高AS伴髋关节炎患者的临床缓解率,治疗24周后在缓解症状,控制病情进展,改善实验室炎性指标方面疗效显著,且明显优于对照组,改善程度高于对照组,差异有统计学意义(均P<0.05)。
Harris评分是一个广泛应用的评价髋关节功能的方法,常常用来评价保髋和关节置换的效果。满分100分,90分以上为优良,80~89分为较好,70~79分为尚可,<70分为差。本研究证实观察组与对照组比较,能明显改善髋关节的功能(P<0.001)。
综上所述,生物制剂联合MTX和SSZ治疗AS伴髋关节炎可以有效地改善患者临床症状和体征,降低病情活动度,与对照组相比,临床见效快,未见明显不良反应,可作为AS伴髋关节炎的常规治疗方案,尤其对于年轻患者,临床更值得推广应用。由于本研究例数较少,观察时间较短,该方案长期应用的有效性和安全性,尤其是能否控制或延缓影像学进展,尚需进一步研究。
[1]张风肖,赵阳,宁晓然,等. 强直性脊柱炎伴髋关节病变患者的临床特征分析[J]. 中华全科医学, 2017, 15: 210- 212.
[2]陈福灵,邹文,唐跃先,等. 强直性脊柱炎的治疗进展[J]. 中国伤残医学, 2016, 24: 104- 106.
[3]Lin YC, Liang TH, Chen WS, et al. Differences bet-ween juvenile-onset nkylosing spondylitis and adult-onset ankylosing spondylitis[J]. J Chin Med Assoc, 2009, 72: 573- 580.
[4]Singh G, Lawrence A, Agarwal V, et al. Higher prevalence of extra-articular manifestations in ankylosing spondylitis with peripheral arthritis[J]. J Clin Rheumatol, 2008, 14: 264- 266.
[5]张晓刚,周友华,杨冰,等. 强直性脊柱炎伴髋关节炎的治疗[J].世界最新医学信息文摘(连续型电子期刊), 2016, 16: 125- 127.
[6]周俊飞,刘升云,杨璐,等. 脊柱关节炎进展为强直性脊柱炎的危险因素及其治疗新进展[J]. 中国实用医刊, 2016, 43: 125- 126.
[7]Schmidt WA, Wierth S, Milleck D, et al. Sulfasalazine in ankylosing spondylitis: a prospective, randomized, double-blind placebo-controlled study and comparison with other controlled studies[J]. Z Rheumatol, 2002, 61: 159- 167.
[8]朱平,韩青,李学义,等. MRI等综合评估、TNF-α抑制剂或沙利度胺治疗SpA/AS髋关节炎的临床研究-以单用SSZ为对照,评价TNF-α抑制剂或沙利度胺联合SSZ治疗326例SpA/AS髋关节炎患者的2年临床研究[C]. 北京:第十届全国免疫学学术大会, 2015- 11- 14.
[9]张鹰. 比较三种新型生物制剂治疗中重度活动性类风湿关节炎的疗效与安全性[J]. 当代医学, 2017, 23: 128- 129.
[10] 魏赣辉, 张敏明. TNF抑制剂治疗nr-axSpA和AS患者的临床特征和磁共振诊断结果[J]. 中国老年学杂志, 2016, 39: 2230- 2232.
[11] van der Linden S, Valkenburg HA, Cats A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York criteria[J]. Arthritis Rheum, 1984, 27: 361- 368.
[12] 曾勇, 袁菊莲, 樊冰, 等. 分阶段手术配合系统康复用于治疗强直性脊柱炎髋关节重度屈曲挛缩畸形的疗效观察[J]. 中国康复医学杂志, 2016, 31: 798- 800.
[13] 刘樱,许珂,张莉芸, 等. 大剂量甲泼尼龙冲击治疗强直性脊柱炎髋关节病变疗效观察[J]. 中国药物与临床, 2015, 10: 1464- 1466.
[14] 王伟. 人工髋关节置换治疗强直性脊柱炎髋关节病变患者的临床观察[J]. 中国民康医学, 2015, 7: 57- 58.
[15] Chen HA, Chen CH, Liao HT, et al. Factors associated with radiographic spinal involvement and hip involvement in ankylosing spondylitis[J]. Semin Arthritis Rheum, 2011, 40: 552- 558.
[16] 刘文锋. 强直性脊柱炎髋关节病变的影像对比分析[J]. 今日健康, 2015, 6: 449.
[17] 耿光辉. AS髋关节受累影像学表现与临床特点相关性探讨[D]. 石河子:石河子大学, 2015.
[18] 郑玮. 强直性脊柱炎骨化中SLPI的作用机制及髋关节受累的影响因素研究[D]. 上海: 第二军医大学, 2015.
[19] Baraliakos X, van der Heijde D, Braun J, et al. OMERACT magnetic resonance imaging initiative on structural and inflammatory lesions in ankylosing spondylitis—report of a special interest group at OMERACT 10 on sacroiliac joint and spine lesions[J]. J Rheumatol, 2011, 38: 2051- 2054.