北京市城区及农村儿童食物过敏患病率比较
邵明军,沙 莉,刘传合,朱雯靓,李 硕,罗雁青,李敬光,吴永宁,陈育智
(首都儿科研究所,北京 100020)
ChinJAllergyClinImmunol,2017,11(4):358- 364
食物过敏是由免疫反应介导的食物不良反应,其症状表现多样,且可累及多个器官、系统[1],患儿及家长需时刻注意食品标签,警惕避免摄入致敏食物。食物过敏在多个方面影响着患儿及其家庭的生活质量[2]。在过去的10~15年里,食物过敏患病率的增长被称为继哮喘、过敏性鼻炎后过敏性疾病的“第二次浪潮”[3]。在澳大利亚,婴儿食物过敏的患病率已达10%[4]。在英国,10岁以下儿童通过病史和食物激发诊断的食物过敏累计患病率为6.8%[5]。我国食物过敏患病率亦呈现迅速上升趋势[6- 7]。但目前我国关于儿童食物过敏患病情况的资料较少,缺乏包括不同年龄段儿童食物过敏的流行病学数据。本研究通过对北京市城区及农村0~14岁儿童进行现场问卷调查,了解北京城区和农村儿童食物过敏患病率及患病的异同,获得北京地区不同年龄段儿童常见过敏食物及食物过敏的特征。
对象与方法
研究对象
选择北京市城区和农村的0~14岁儿童作为本次调查的对象。本研究中的患儿家长均知情同意并签署知情同意书,同时研究获得首都儿科研究所伦理委员会批准。
调查方法
采用随机整群抽样,在北京市中心城区(原西城区)和较偏远农村(良乡西南、通州东南),根据各群体的大小和样本量要求,抽取所需数量的中、小学校、幼儿园、社区。
采用《儿童过敏性疾病筛查问卷》作为此次儿童食物过敏调查的初筛问卷[8],其内容包括被调查对象的人口学特征、食物过敏、喘息情况、其他过敏性疾病及家族过敏史等。初筛问卷由专门的调查员通过学校、幼儿园老师或社区医师向被抽取的儿童发放,由被调查儿童家长负责填写,填写完成后由学校或幼儿园卫生老师负责回收,交还调查员,调查员汇总并审核,回收率不低于95%。
随后,对初筛问卷中家长报告曾发生过食物过敏的儿童进行现场食物过敏问卷调查。问卷内容参照Europrevall食物过敏调查方案[8]设计而成,主要包括以下内容:(1)孩子是否在进食某种食物后出现以下症状:口唇口腔黏膜红肿、痒疼,皮疹、瘙痒,腹痛、呕吐、腹泻,喷嚏、流涕、鼻塞,眼部红痛、流泪,咳嗽、喘息、呼吸困难,休克,若是,什么食物;再次摄入,症状是否重复出现;避食该食物后,症状是否消失;第一次出现的年龄;(2)是否进行过敏原检测,结果提示哪些过敏原/食物过敏;(3)是否被医师诊断过食物过敏。问卷调查由调查员进行并填写,食物过敏的诊断由专业医师进行。
食物过敏的诊断
由参加现场调查的专业医师根据被调查对象的问卷结果,所携带病历中的就诊记录,体检,既往辅助检查结果及既往诊断情况综合判断,进行临床诊断。诊断原则为:(1)进食特定食物后出现症状;(2)再次摄入该食物时,症状重复出现;(3)避免摄入该食物后,症状消失或减轻。
质量控制
对参加调查的人员进行培训,以保证问卷填写符合要求。调查表完成后由调查负责人员复审,对存在问题的问卷及时进行纠正。问卷不能有空项,审核后发现漏项者,由调查员联系家长或通过卫生老师协调后补齐相关信息。问卷数据采取两人独立录入,比对校正。
统计学处理
使用EpiInfo建立数据库,使用SPSS 20.0软件包进行统计分析。计数资料以例数(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
结 果
被调查对象的人口特征
本次调查共有13 073名城区儿童(男性6 967名,女性6 106名)和7 113名农村儿童(男性3 685名,女性3 428名)接受初筛问卷调查。根据年龄将调查儿童分为婴幼儿组(0~2岁),学龄前儿童组(3~5岁)和学龄儿童组(6~14岁),除农村儿童婴幼儿年龄段数量略低外,城区和农村不同年龄段儿童数量的比例以及不同龄段儿童的性别构成基本均衡(表1)。
食物过敏患病率
共有837名城区儿童及279名农村儿童家长报告其曾有食物过敏症状。家长报告有食物过敏的儿童中,734名城区儿童和243名农村儿童进行了现场调查,应答率分别为87.7%和87.1%。通过专业医师现场调查,423名城区儿童和76名农村儿童被临床诊断现患有食物过敏或曾经发生过食物过敏反应,城区和农村儿童食物过敏临床诊断患病率分别为3.24%和1.07%,城区儿童显著高于农村儿童(χ2=89.743,P<0.001)。对两组儿童按性别及年龄进行分析,除婴幼儿组外,城区学龄儿童和学龄前儿童食物过敏患病率均高于农村儿童(表2)。

表1 被调查儿童的性别和年龄分布情况Table 1 Gender and age distribution of the investigated children (n)
无论在城区还是在农村,食物过敏患病率均为男性儿童高于女性儿童,城区男、女儿童患病率分别为3.55%和2.88%,差异具有统计学意义(χ2=4.567,P=0.033);农村男、女儿童患病率分别为1.30%和0.82%,差异具有统计学意义(χ2=3.965,P=0.046)。不同年龄段儿童,城区儿童食物过敏患病率以学龄前及学龄儿童较高,显著高于婴幼儿(χ2=26.321,P<0.001)。农村儿童亦以学龄前儿童患病最高,但不同年龄组间食物过敏患病率差异不存在统计学意义(χ2=2.782,P=0.249)。
常见过敏食物
在医师诊断为食物过敏的儿童中,引起食物过敏常见的食物在城区儿童和农村儿童较为一致,最常见的均为水果(芒果、桃、菠萝等),分别占46.81%和47.37%;其次为鱼虾,分别占33.57%和30.26%;牛奶/奶制品、鸡蛋亦为常见的过敏原,花生、坚果、豆类、谷类引起的食物过敏发生率较低(表3)。
食物过敏的临床特点
在本组资料中,城区和农村儿童食物过敏表现的临床症状均主要为皮疹、瘙痒等皮肤症状,分别为58.87%和50.00%,其次为口咽部症状,如口唇、口腔或咽喉部肿痛、有痒感或刺痛等。城区和农村儿童表现为腹痛、腹泻、呕吐等消化系统症状的比例接近。此次调查中,北京市儿童仅有4例曾有严重食物过敏反应病史,均来自城区儿童,分别由坚果、虾、香菇和芒果引起(表4)。

表2 北京城区和农村儿童食物过敏患病率Table 2 Prevalenc of food allergy in children between urban and rural areas in Beijing (%)
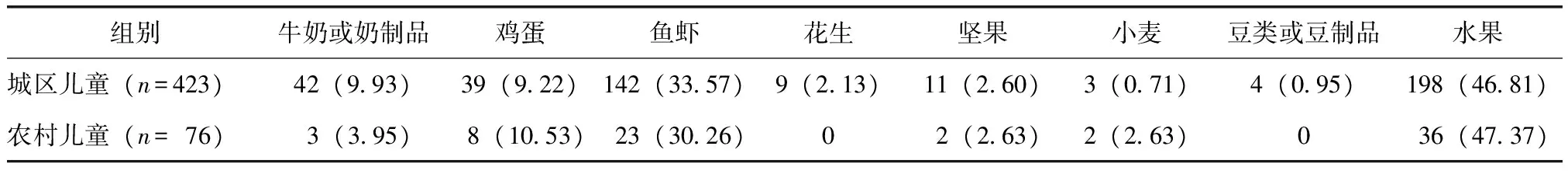
表3 北京城区与农村儿童食物过敏常见过敏食物aTable 3 Different food allergy in children among urban and rural areas in Beijing [n(%)]
a部分患儿对多种食物过敏,部分患儿对其他食物过敏

表4 北京城区及农村儿童食物过敏常见症状Table 4 Specific symptoms among children with food allergy between urban and rural areas in Beijing [n(%)]
讨 论
随着居民物质生活水平的提高,食品多样化,食物过敏和不良反应问题日渐突出。近30年,食物过敏的患病率在西方国家显著增加,美国在1997至2007年10年间,儿童食物过敏患病率增加了18.0%[9],2011年18岁以下儿童食物过敏患病率为8.0%[10]。在我国,1999年重庆地区报告0~24个月婴幼儿食物过敏检查率为3.5%~5.1%[11],2009年再次调查的结果显示婴幼儿食物过敏检出率为7.0%~9.2%[12],提示我国儿童食物过敏患病率亦呈上升趋势。
食物过敏不仅对儿童的生长发育和生活质量造成严重影响[13],其作为过敏进程的首发表现,可增加儿童后期呼吸道过敏性疾病的患病风险[14- 16]。从过敏原种类上来看,食物过敏通常发生最早,在婴儿早期即可出现,以鸡蛋、牛奶过敏最为常见,幼儿期以后,吸入性过敏原致敏逐渐出现。有关队列研究结果表明,鸡蛋、坚果过敏是发生哮喘的危险因素[17]。在我国儿童食物过敏的相关研究较少,且多限于婴幼儿或特定年龄段,本研究较为全面地了解了北京市城区与农村0~14岁儿童食物过敏的患病情况,并对其过敏的食物及临床特征进行了调查。
本次调查结果显示,北京中心城区儿童食物过敏患病率显著高于农村儿童,前者为后者的3倍,与国内既往报道结果类似[8]。美国2009至2010年进行的一项调查中,城区儿童食物过敏患病率(9.8%)显著高于郊区儿童食物过敏患病率(6.2%)[18]。Hooper等[19]对南非698名8~13岁城区和农村儿童开展的饮食和过敏性疾病关系的横断面研究结果显示,典型的城市化膳食与过敏性疾病的发生率增加密切相关。除了膳食结构的差异外,根据英国学者Strachan提出的“卫生假说”[20],城市公共卫生设施改善、环境卫生改进和家庭小型化也可能是城市食物过敏患病率较高的原因。
对食物过敏年龄的分布,通常认为食物过敏在婴儿期最常见,且以牛奶、鸡蛋过敏为主,在1岁左右达到高峰,3岁时开始下降[21],并认为这种现象与婴幼儿的生理特点或免疫系统发育发展规律有关。我国一项8城市的多中心研究报道,食物过敏自报率从4~6个月开始升高,在7~12个月和13~24个月达到高峰,而从25~36个月逐渐降低[22]。DARC队列研究中,1、3、6岁儿童的食物过敏患病率分别为1.3%、3.4%和1.2%[23];Venter等[24- 25]对英国6岁和1~3岁儿童食物过敏患病率的调查同样说明了这一流行病学趋势。本次调查包括14岁以下全部儿童,北京市城区不同年龄儿童食物过敏患病率随着年龄增加而升高,至学龄期儿童达最高,而农村儿童食物过敏则以学龄前期儿童最高,至学龄期有所下降。北京农村儿童食物过敏年龄分布特点与以上报道相同,但城区儿童食物过敏一直呈上升趋势,是否与北京中心城区儿童居住环境和膳食结构不同有关,尚需探索。调查中的部分年长儿童已对过敏食物形成免疫耐受,但因未再食用该食物,通过问卷调查很难将其排除,这可能是造成本研究中年长儿童食物过敏患病率较高的原因之一。另外,婴幼儿食物过敏的症状主要表现为湿疹、腹泻等,易被家长忽视。大多数关于食物过敏的流行病学研究并未发现有明显的性别分布差异,但在此次调查中,男性儿童显著高于女性儿童,城区和农村均如此,这一结果可能提示,与支气管哮喘类似,北京地区儿童食物过敏同样存在性别差异[26]。
虽然多种食物可导致过敏发生,但不同年龄段儿童过敏的食物种类并不相同。在婴幼儿,90%的食物过敏与牛奶、鸡蛋、大豆、小麦、花生、鱼、虾、坚果等8种食物有关[27]。婴幼儿期后,对牛奶、鸡蛋过敏逐渐减少,年长儿童对海鲜、水果过敏增加[28- 29],本次对14岁以下年龄段儿童的调查中,其常见的过敏食物主要为水果(芒果、菠萝等),其次为鱼虾,且农村与城区食物过敏原相似。以上结果可能与北京近年生活水平的提高,饮食结构改变,如食用水果、水产品的种类和数量增加,摄入年龄提前等有关。芒果、菠萝等水果常引起接触性皮炎,部分为食物过敏,部分则与水果所含刺激物有关,仅通过症状难以区分[30],另外,这种反应往往是速发性的,并且可以反复出现,更容易被家长发现。
食物过敏表现为一疾病群,可累及多个系统。本次调查显示,北京市城区和农村儿童食物过敏表现仍以皮肤症状和口腔黏膜部位症状为主,占食物过敏症状的绝大多数。呼吸道、眼部、严重过敏反应的发生比例很低,这与既往研究结果相同[31]。本次调查中,无论城区还是农村儿童,最常见过敏食物为水果,而植物蛋白过敏原不稳定,进食后易被消化液破坏,因此对这些植物蛋白过敏的表现往往发生在口腔周围皮肤和口腔黏膜部位[32]。此次北京市食物过敏患病调查中,有4例有严重食物过敏反应病史,分别由坚果、虾、香菇和芒果引起。国内食物致过敏性休克报道较少。北京协和医院等进行的严重过敏反应流行病学研究发现食物为最常见诱因,占77%,其中41%为谷物致敏[33],而在西方国家的一些研究中,最常引起过敏性休克的食物为坚果和花生[34- 35]。
在食物过敏患病率调查的研究中,因研究设计和诊断方法不同,儿童食物过敏患病率结果差别很大[36]。被调查者或家长倾向于对食物不良反应作出过度报告,其中一些反应与食物过敏并无关联。一项对土耳其3 500名6~9岁学龄儿童进行的调查中发现,食物过敏家长报告率(5.7%)显著高于经牛奶蛋白激发试验确定诊断的食物过敏患病率(0.8%)[37]。在本次北京地区的调查中,我们首先采用儿童家长自我报告的方式对过敏儿童进行初筛,在此基础上参考Europreval食物过敏问卷调查的形式进行,依据儿童既往就医诊断意见和辅助检查结果,采用了统一的诊断标准,由专业医师进行临床诊断,确定是否食物过敏,结果相较于家长报告率更为准确。但本研究大部分采用问卷调查的形式进行,虽然对调查者进行过统一培训,仍不能避免有一定的信息偏倚,且本次调查为回顾性调查,被调查家长对食物过敏的认知程度及对孩子的关注程度等可能存在较大差异,结果存在回忆偏倚难以避免。因此,本文研究结果只能在一定程度上反映北京市城区和农村14岁以下儿童食物过敏的总体结果和趋势。
一些研究为获得准确的儿童食物过敏患病率,通常借助客观的实验室检查对食物过敏进行诊断或排除。作为过敏检测常规技术,过敏原点刺检测在诊断食物方面具有较高特异性,通常被认为是排除IgE介导食物过敏的较好办法,对食物过敏的诊断有一定参考价值,但一些食物过敏原热不稳定,难以分离,缺乏理想的、标准的用于诊断的提取物,因此欧洲变态反应和临床免疫学会更推荐新鲜食物皮肤点刺试验(prick to prick)的原因[38],但对高度过敏患者检测存在很大风险。血清sIgE抗体测定在食物过敏的诊断上有其价值,特别是检测鸡蛋、牛奶、鱼和花生等过敏原的敏感性和特异性较高,同样存在儿童/家长不同意静脉取血的实际问题。双盲安慰剂对照食物激发试验是诊断食物过敏反应的金标准[39],能确定暴露于过敏食物与临床症状的因果关系,仅适用于特定年龄段的小样本量的研究,难以用于较大人群的调查,因此,问卷调查仍不失为一种易行、适用、相对可靠的食物过敏调查方法。
[1]Ree R, Poulsen LK, Wong G, 等. 食物过敏的定义、流行性、诊断及治疗[J]. 中华预防医学杂志, 2015, 49: 87- 92.
[2]Bilaver LA, Kester KM, Smith BM, et al. Socioeconomic disparities in the economic impact of childhood food allergy[J]. Pediatrics, 2016, 137: AB283-AB283.
[3]Prescott S, Allen KJ. Food allergy: Riding the second wave of the allergy epidemic[J]. Pediatr Allergy Immunol, 2011, 22:155- 160.
[4]Osborne NJ, Koplin JJ, Martin PE, et al. Prevalence of challenge-proven IgE-mediated food allergy using population-based sampling and predetermined challenge criteria in infants[J]. J Allergy Clin Immunol, 2011, 127: 668- 676.
[5]Venter C, Patil V, Grundy J, et al. Prevalence and cumulative incidence of food hypersensitivity in the first 10 years of life[J]. Pediatr Allergy Immunol, 2016, 27: 452- 458.
[6]Leung TF, Yung E, Wong YS, et al. Parent-reported adverse food reactions in Hong Kong Chinese preschoolers: epidemiology, clinical spectrum and risk factors[J]. Pediatr Allergy Immunol, 2009, 20: 339- 346.
[7]Hu Y, Chen J, Li H. Comparison of food allergy prevalence among Chinese infants in Chongqing, 2009 versus 1999[J]. Pediatr Int, 2010, 52: 820- 824.
[8]马煜, 方建龙, 罗雁青, 等. 儿童食物过敏的患病情况分析[J]. 中国医刊, 2009, 44: 60- 62.
[9]Branum AM, Lukacs SL. Food allergy among children in the United States[J]. Pediatrics, 2009, 124: 1549- 1555.
[10] Gupta RS, Springstong EE, Warrier MR, et al. The prevalence, severity, and distribution of childhood food allergy in the United States[J]. Pediatrics, 2011, 128: e9-e17.
[11] 胡燕, 黎海芪. 0~24个月儿童食物过敏的流行病学研究[J]. 中华儿科杂志, 2000, 38: 431- 434.
[12] 陈静, 廖艳, 张红忠, 等. 三城市两岁以下儿童食物过敏现状调查[J]. 中华儿科杂志, 2012, 50: 5- 9.
[13] Vieira MC, Morais MB, Spolidoro JVN, et al. A survey on clinical presentation and nutritional status of infants with suspected cow’ milk allergy[J]. BMC Pediatrics, 2010, 10: 25.
[14] Alduraywish SA, Lodge CJ, Campbell B, et al. The march from early life food sensitization to allergic disease: a systematic review and meta-analyses of birth cohort studies[J]. Allergy, 2015, 71:77- 89.
[15] Hill DA, Grudmeier RW, Ram G, et al. The epidemiologic characteristics of healthcare provider-diagnosed eczema, asthma, allergic rhinitis, and food allergy in children: a retrospective cohort study[J]. BMC Pediatrics, 2016, 16: 133.
[16] Henneman P, Petrus NCM, Venema A, et al. Genetic susceptibility for cow’s milk allergy in Dutch children: the start of the allergic march?[J]. Clin Transl Allergy, 2016, 6: 7.
[17] Gaffin JM, Sheehan WJ, Morrill J, et al. Tree nut allergy, egg allergy, and asthma in children[J]. Clin Pediatr (Phila), 2011, 50: 133- 139.
[18] Gupta RS, Springston EE, Smith B, et al. Geographic variability of childhood food allergy in the United States[J]. Clin Pediatr (Phila), 2012, 51: 856- 861.
[19] Hooper R, Calvert J, Thompson RL, et al. Urban/rural differences in diet and atopy in South Africa[J]. Allergy, 2008, 63: 425- 431.
[20] Strachan DP. Hay fever, hygiene, and household size[J]. BMJ, 1989, 299: 1259- 1260.
[21] Wood RA. The natural history of food allergy[J]. Pediatrics, 2003, 111: 1631- 1637.
[22] 刘芳丽, 宁一冰, 马德福, 等. 中国八城市0~36月龄婴幼儿自报过敏, 食物过敏与不耐受状况调查与影响因素分析[J]. 中华儿科杂志, 2013, 51: 801- 806.
[23] Eller E, Kjaer HF, Høst A, et al. Food allergy and food sensitization in early childhood: results from the DARC cohort[J]. Allergy, 2009, 64: 1023- 1029.
[24] Venter C, Pereira B, Grundy J, et al. Prevalence of sensitization reported and objectively assessed food hypersensitivity amongst six year old children: a population based study[J]. Pediatr Allergy Immunol, 2006, 17: 356- 363.
[25] Venter C, Pereira B, Voigt K, et al. Prevalence and cumulative incidence of food hypersensitivity in the first 3 years of life[J]. Allergy, 2008, 63: 354- 359.
[26] Zhu WJ, Liu CH, Ma HX, et al. Asthma in children in rural areas of Beijing: prevalence and treatment compared with Urban Areas[J]. Chin Med J, 2015, 128: 2273- 2277.
[27] 中华医学会儿科学分会儿童保健学组,《中华儿科杂志》编辑委员会. 婴幼儿食物过敏诊治建议[J]. 中华儿科杂志, 2011, 49: 344- 348.
[28] Ho MH, Lee SL, Wong WH, et al. Prevalence of self-reported food allergy in Hong Kong children and teens—a population survey[J]. Asian Pac J Allergy Immunol, 2012, 30: 275- 284.
[29] Strinnholm A, Winberg A, West C, et al. Food hypersensitivity is common in Swedish schoolchildren, especially oral reactions to fruit and gastrointestinal reactions to milk[J]. Acta Paediatrica, 2014, 103: 1290- 1296.
[30] 闵建强, 陆明, 王兵兵, 等. 水果致接触性皮炎103例临床分析[J]. 中国麻风皮肤病杂志, 2014, 30: 236- 237.
[31] Prescott SL, Ruby P, Allen KJ, et al. A global survey of changing patterns of food allergy burden in children[J]. World Allergy Organ J, 2013, 6: 1- 12.
[32] 王晓川. 食物过敏的免疫机制及其临床意义[J]. 中华实用儿科临床杂志, 2015, 30: 651- 652.
[33] Jiang NN, Yin J, Wen LP, et al. Characteristics of anaphylaxis in 907 Chinese patients referred to a tertiary allergy center: a retrospective study of 1 952 episodes[J]. Allergy Asthma Immunol Res, 2016, 8: 353- 361.
[34] Vetander M, Helander D, Flodström C, et al. Anaphylaxis and reactions to foods in children-a population based case study of emergency department visits[J]. Clin Exp Allergy, 2012, 42: 568- 577.
[35] Hompes S, Köhli A, Nemat K, et al. Provoking allergens and treatment of anaphylaxis in children and adolescents—data from the anaphylaxis registry of German-speaking countries[J]. Pediatr Allergy Immunol, 2011, 22: 568- 574.
[36] Gonçalves LC, Guimarãs TC, Silva RM, et al. Prevalence of food allergy in infants and pre-schoolers in Brazil[J]. Allergol Immunopathol (Madr), 2016, 44: 497- 503.
[37] Orhan F, Karakas T, Cakir M, et al. Prevalence of immunoglobulin E-mediated food allergy in 6-9 year old urban schoolchildren in the eastern Black Sea region of Turkey[J]. Clin Exp Allergy, 2009, 39: 1027- 1035.
[38] Bolhaar STHP, van de Weg WE, van Ree R, et al. In vivo assessment with prick-to-prick testing and double-blind, placebo-controlled food challenge of allergenicity of apple cultivars[J]. J Allergy Clin Immunol, 2005, 116: 1080- 1086.
[39] Sampson HA, Gerth van Wijk R, Bindslev-Jensen C, et al. Standardizing double-blind, placebo-controlled oral food challenges: American Academy of Allergy, Asthma & Immunology-European Academy of Allergy and Clini-cal Immunology PRACTALL consensus report[J]. J Allergy Clin Immunol, 2012, 130: 1260- 1274.